RESUMEN
Introducción y objetivos: La regurgitación mitral es una de las valvulopatías cardiacas más comunes. La cirugía de reemplazo valvular es una opción recomendada por las guías clínicas. Sin embargo, en un porcentaje significativo de pacientes, esta opción no es viable. En estos casos, la reparación mitral percutánea de borde a borde (M-TEER) es una posible alternativa terapéutica. No obs- tante, los resultados de los ensayos clínicos aleatorizados han mostrado resultados divergentes. Recientemente se han publicado los resultados del estudio RESHAPE-HF2, que aportan información adicional sobre este tema. El objetivo de este trabajo fue evaluar si existen diferencias entre realizar M-TEER o mantener a los pacientes bajo tratamiento médico según las guías clínicas (TMSG).
Métodos: Se realizó un metanálisis siguiendo las guías PRISMA. Se buscaron estudios en las bases de datos PubMed, Embase y Cochrane hasta febrero de 2025. Se establecieron los siguientes criterios de inclusión: pacientes con insuficiencia mitral secundaria, estudios que comparaban M-TEER más TMSG frente a solo TMSG, y que indicaran hospitalización por insuficiencia cardiaca o mortalidad.
Resultados: Tres ensayos clínicos aleatorizados cumplieron los criterios de inclusión, con un total de 1.423 pacientes, de los que 704 se trataron con M-TEER y 719 recibieron solo TMSG. La M-TEER se asoció con una reducción del riesgo de hospitalización por insuficiencia cardiaca con una razón de riesgo de 0,71 (IC95%, 0,56-0,90; p = 0,004). No se encontraron diferencias en cuanto a muerte por cualquier causa, con una razón de riesgo de 0,80 (IC95%, 0,63-1,02; p = 0,07).
Conclusiones: En este metanálisis, la M-TEER, en combinación con el TMSG, mostró una reducción del riesgo de hospitalización por insuficiencia cardiaca en comparación con el TMSG solo. No se hallaron diferencias en el riesgo de muerte por cualquier causa (muerte de causa cardiovascular o infarto agudo de miocardio).
Registrado en PROSPERO: CRD42025645047.
Palabras clave: Regurgitación mitral. Reparación percutánea de borde a borde. Insuficiencia cardiaca. M-TEER.
ABSTRACT
Introduction and objectives: Mitral regurgitation is one of the most common heart valve diseases. Valve replacement surgery is a guideline-recommended option; however, in a significant proportion of patients, this option is not feasible. In such cases, mitral transcatheter edge-to-edge repair (M-TEER) is a potential therapeutic alternative. Nevertheless, the results of a randomized clinical trial have shown divergent results. Recently, the results of the RESHAPE-HF2 trial were published, providing additional insights. The objective of this work is to evaluate whether there are any differences between performing M-TEER and keeping patients under guideline-directed medical therapy (GDMT).
Methods: We conducted a meta-analysis following the PRISMA guidelines. We searched for studies across the PubMed, Embase, and Cochrane databases until February 2025. We establish the following inclusion criteria: patients with secondary mitral regurgitation, studies comparing M-TEER plus GDMT vs GDMT alone, and who reported hospitalization due to heart failure (HF) or mortality.
Results: A total of 3 randomized clinical trials meet the inclusion criteria, including a total of 1423 patients: 704 received M-TEER and 719, GDMT alone. M-TEER was associated with a reduced risk of HF-related hospitalization with a risk ratio (RR) of 0.71 (95%CI, 0.56-0.90; P = .004). We did not find any differences in all-cause mortality with a RR of 0.80 (95%CI, 0.63-1.02; P = .07).
Conclusions: In this meta-analysis, M-TEER plus GDMT shows a lower risk of HF-related hospitalization vs GDMT alone. We did not find any differences in the risk of all-cause mortality or cardiac death.
Registered at PROSPERO: CRD42025645047.
Keywords: Mitral regurgitation. Mitral transcatheter edge-to-edge repair. Heart failure. M-TEER.
Abreviaturas
IC: insuficiencia cardiaca. IM: insuficiencia mitral. M-TEER: reparación mitral percutánea de borde a borde. NYHA: New York Heart Association. TMSG: tratamiento médico según las guías clínicas.
INTRODUCCIÓN
La insuficiencia mitral (IM) es una valvulopatía frecuente asociada a una morbimortalidad significativa, especialmente en pacientes con insuficiencia cardiaca (IC)1. Las estrategias tradicionales para el manejo de esta entidad son el tratamiento médico óptimo para controlar los síntomas y la cirugía para su corrección definitiva2. No obstante, en la actualidad, las guías de práctica clínica solo avalan la reparación mitral cuando el paciente vaya a ser reintervenido, como por ejemplo, si va a ser tratado mediante cirugía de revascularización coronaria o sustitución valvular aórtica; no obstante, muchos pacientes presentan un riesgo quirúrgico elevado debido a sus comorbilidades, razón por la cual, se hace necesarias otras opciones terapéuticas3.
La reparación mitral percutánea de borde a borde (M-TEER) se ha convertido en una opción mínimamente invasiva para pacientes con insuficiencia mitral sintomática que no son aptos para cirugía4. Aunque la M-TEER ha mostrado resultados prometedores, comparada con el tratamiento médico según las guías clínicas (TMSG), su eficacia sigue siendo objeto de debate5.
El presente metanálisis tiene como objetivo valorar el impacto de M-TEER + TMSG frente a, solo, TMSG sobre los principales resultados clínicos en pacientes con IM secundaria. El objetivo primario del estudio fue la hospitalización por IC. Los objetivos secundarios fueron la mortalidad por cualquier causa, la mortalidad cardiovascular, la mejoría experimentada en la clase funcional (CF) según la New York Heart Association (NYHA) y la incidencia de eventos como el accidente cerebrovascular y el infarto de miocardio. Estos objetivos fueron seleccionados tanto por su relevancia clínica como su potencial para guiar la toma de decisiones terapéuticas en esta población de alto riesgo.
MÉTODOS
Se realizó el presente metanálisis de conformidad con las recomendaciones establecidas en la declaración PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses) para revisiones sistemáticas y metanálisis6. Todas las fases del estudio se llevaron a cabo de conformidad con el Cochrane Handbook for Systematic Reviews of Interventions, versión 6.37. El protocolo fue registrado prospectivamente en PROSPERO el 10 de febrero de 2025 con el ID CRD42025645047.
Estrategia de búsqueda
Se realizó una búsqueda sistemática en 3 bases de datos electrónicas (PubMed, EMBASE y COCHRANE) desde el principio hasta febrero de 2025. Los términos de búsqueda incluyeron combinaciones de las siguientes palabras clave: “percutáneo”, “secundario”, “válvula mitral”, “reemplazo”, “regurgitación” e “insuficiencia”. Estas palabras clave se combinaron con los operadores booleanos O e Y. También se revisaron las listas de referencias de los estudios elegibles y revisiones previas a fin de identificar artículos adicionales relevantes.
Criterios de los estudios incluidos
Los estudios se consideraron aptos para ser incluidos atendiendo a los siguientes criterios: a) ensayos clínicos aleatorizados (ECA) o estudios de cohorte observacionales en español o inglés que b) compararan el reemplazo valvular mitral percutáneo y el tratamiento médico óptimo en adultos con insuficiencia mitral secundaria y c) que comunicaran resultados clínicos de interés tales como la primera hospitalización por IC, los reingresos por IC, la mortalidad cardiovascular o la mortalidad por cualquier causa.
Se excluyeron todos los estudios no originales, tales como revisiones sistemáticas, cartas, resúmenes, metanálisis, casos clínicos o series de casos. También se excluyeron todos aquellos estudios en los que la insuficiencia mitral fuese primaria o si se hubiesen realizado reparaciones quirúrgicas previa.
Aunque los estudios de cohorte observacionales eran elegibles, solo se identificó una única cohorte que no cumplió los criterios de inclusión durante la lectura a texto completo. Como resultado, en el metanálisis solo ser incluyeron ECA.
Obtención de datos
A efectos de asegurar la precisión, se utilizó Zotero para eliminar duplicados. Cada artículo fue evaluado inicialmente por título y resumen y, después, por una lectura completa del texto. Dos autores (D.A. Navarro Martínez y D. Paulino-González) realizaron la selección de forma independiente, resolviendo las discrepancias con la ayuda de un tercer autor (A.L. García Loera). Además, las bibliografías de los estudios incluidos fueron revisadas y añadidas siempre y cuando cumpliesen nuestros criterios de elegibilidad. Los datos obtenidos se almacenaron en hojas de cálculo Excel y se recopiló la siguiente información: a) características basales de la población objeto del estudio (tratamiento basal, parámetros ecocardiográficos y comorbilidades); b) resumen de las características de los estudios incluidos; c) medidas de los resultados y d) dominios de evaluación de calidad.
Objetivos primarios y secundarios
Los objetivos primarios del presente metanálisis fueron: a) la mortalidad por cualquier causa (hazard ratio [HR]), definida como mortalidad por cualquier causa evaluada mediante análisis de tiempo a evento8 y b) la hospitalización por IC, definida como todo aquel ingreso hospitalario por un empeoramiento de la IC tras la intervención (M-TEER o inicio del tratamiento médico óptimo)9.
Los objetivos secundarios fueron: a) el accidente cerebrovascular, definido como un episodio de disfunción neurológica provocado por un infarto cerebral, espinal o retiniano10 y b) el infarto de miocardio, definido según la Cuarta Definición Universal11.
Todos los objetivos se evaluaron como variables categóricas dicotómicas y se expresaron como porcentajes. También se calculó el riesgo relativo (RR) con su intervalo de confianza del 95% (IC95%).
Valoración de la heterogeneidad
La heterogeneidad se evaluó mediante la Q de Cochran con un nivel de significación de p < 0,05. También se empleó el estadístico I2 para cuantificar la proporción de variabilidad atribuible a heterogeneidad y los valores > 50% se consideraron indicadores significativos de heterogeneidad12.
Análisis estadísticos
Para los datos dicotómicos se evaluaron las frecuencias de eventos y los totales de cada grupo para calcular el RR y su IC95%. También se obtuvieron el HR y el IC95% para calcular el error estándar (EE).
Las variables analizadas se basaron en datos comunicados según el principio de intención de tratar. Se aplicó un modelo de efectos aleatorios utilizando el método de DerSimonian-Laird13 para la comparación entre estudios. Teniendo en cuenta las limitaciones y fortalezas de este método, se realizó un análisis de sensibilidad mediante el método de Hartung-Knapp-Sidik-Jonkman. Los resultados clínicos se plasmaron gráficamente en diagramas de bosque.
Dada la heterogeneidad de las poblaciones incluidas en los ensayos clínicos, se realizó un análisis exploratorio adicional de los ensayos RESHAPE-HF214 y COAPT15 (salvo el MITRA-FR16 que se eliminó del análisis) para los objetivos primarios.
Todos los análisis estadísticos, incluido el cálculo del RR y del EE, se realizaron con el software RevMan v.5.4.1.
RESULTADOS
La búsqueda inicial en la base de datos identificó 164 artículos potencialmente relevantes. Tras eliminar duplicados, quedaron un total de 129 artículos para evaluación por título y resumen. Tras esta primera revisión, se identificaron 8 artículos como potencialmente aptos para lectura a texto completo. Por último, tras una evaluación detalladas de los textos completos según los criterios predefinidos de inclusión y exclusión, 3 estudios fueron excluidos. El resumen del proceso de selección se muestra en el diagrama de flujo PRISMA (figura 1).
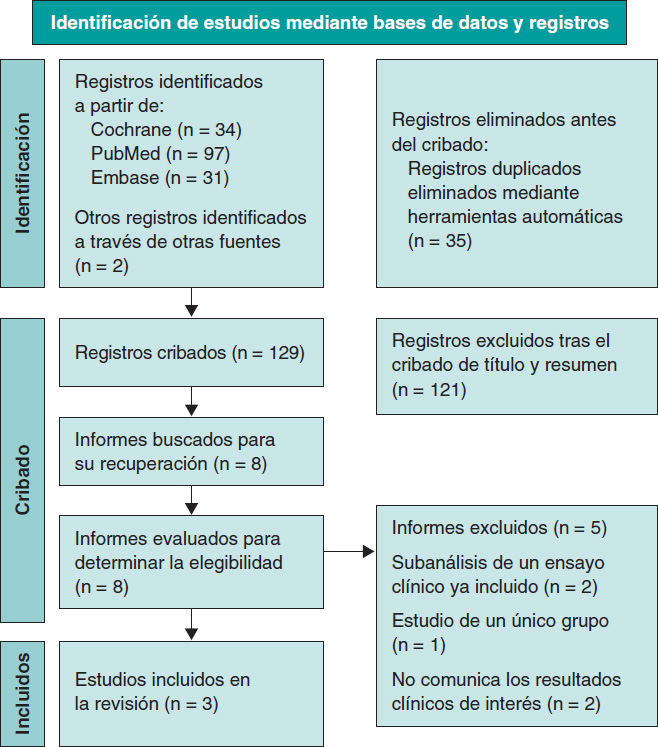
Figura 1. Diagrama de flujo PRISMA 2020 para nuevas revisiones sistemáticas que incluyeron únicamente búsquedas en bases de datos y registros.
Nuestro análisis incluyó 3 ECA14-16. Se consultó el informe ampliado de los resultados a 2 años del ensayo MITRA-FR17 y un artículo adicional del RESHAPE-HF2 para la obtención de datos adicionales sobre hospitalizaciones18. Todos los estudios incluidos compararon M-TEER + TMSG frente a, solo, el TMSG. Para estandarizar los resultados, el seguimiento mediano se fijó en 24 meses; solo la CF según la NYHA se evaluó con resultados a 1 año. Los 3 estudios incluidos emplearon el dispositivo MitraClip (Abbot, Estados Unidos).
Características clínicas basales de los pacientes
La población total analizada incluyó 1.423 pacientes, 704 de los cuales recibieron M-TEER y 719, solo TMSG. En el ensayo RESHAPE- HF214, el grupo con el dispositivo mostró las siguientes características: la media de edad fue de 70 años; la fracción de eyección del ventrículo izquierdo (FEVI), 32%; el volumen telediastólico del ventrículo izquierdo (VTDVI), 200 ml; la mediana del área del orificio regurgitante efectivo (AORE), 0,23 cm2 y la mediana del péptido natriurético tipo B N-terminal (NT-proBNP) y péptido natriurético cerebral (BNP), 2.651 y 556 pg/ml, respectivamente. En el ensayo COAPT15, la edad mediana fue de 71 años; la FEVI, 31%; el VTDVI, 194 ml; la mediana del AORE, 0,41 cm2 y la mediana del NT-proBNP y el BNP de 5.174 de 1.014 pg/ml, respectivamente. Por último, en el ensayo MITRA-FR16, la media de edad fue 71 años; la FEVI, 33%; el VTDVI, 136,2 ml; la mediana del AORE, 0,31 cm2 y la mediana del NT-proBNP y el BNP de 3.407 y 765 pg/ml, respectivamente. En cuanto a la etiología, todos los ensayos incluyeron poblaciones mixtas de origen isquémico y no isquémico. Las características basales de pacientes y estudios, inclu idas comorbilidades, tratamientos y datos ecocardiográficos, se muestran en la tabla 1, tabla 2 y tabla 3.
Tabla 1. Características basales de los pacientes
| Referencia | Grupo | N | Edad | FA o aleteo | Diabetes | IM previo | Etiología no isquémica | Etiología isquémica | Prueba de marcha de 6 min | Bloquea- dores beta | IECA | BRA | ARNI | iSGLT2 | ARM | Diuréticos | Anticoa- gulantes orales | BNP | NT-proBNP | EuroSCORE II |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| RESHAPE-HF214 | M-TEER | 250 | 70,0 ± 10,4 | 118 (47,2) | 91 (36,4) | 144 (57,6) | 88 (35,2) | – | 300 (220-382) | 238 (95,2) | 142 (56,8) | 51 (20,4) | 40 (16,0) | 24 (9,6) | 200 (80,0) | 239 (95,6) | 163 (65,2) | 556 (312-1.018) | 2.651 (1.630-4.918) | 5,3 (2,7-8,9) |
| Tratamiento médico óptimo | 255 | 69,4 ± 10,7 | 125 (49,0) | 85 (33,3) | 135 (52,9) | 88 (34,5) | – | 310 (200-378) | 246 (96,5) | 142 (55,7) | 45 (17,6) | 28 (11,0) | 22 (8,6) | 215 (84,3) | 243 (95,3) | 152 (59,6) | 406 (231-874) | 2.816 (1.306-5.496) | 5,3 (2,9-9,0) | |
| COAPT15 | M-TEER | 302 | 71,7 ± 11,8 | 173 (57,3) | 106 (35,1) | 156 (51,7) | 118 (39,1) | 184 (60,9) | 261,3 ± 125,3 | 275 (91,1) | 138 (45,7) | 66 (21,9) | 13 (4,3) | NR | 153 (50,7) | 270 (89,4) | 140 (46,4) | 1.014,8 ± 1.086,0 | 5.174,3 ± 6.566,6 | NR |
| Tratamiento médico óptimo | 312 | 72,8 ± 10,5 | 166 (53,2) | 123 (39,4) | 160 (51,3) | 123 (39,4) | 189 (60,6) | 246,4 ± 127,1 | 280 (89,7) | 115 (36,9) | 72 (23,1) | 9 (2,9) | NR | 155 (49,7) | 277 (88,8) | 125 (40,1) | 1.017,1 ± 1.212,8 | 5.943,9 ± 8.437,6 | NR | |
| MITRA-FR16 | M-TEER | 152 | 70,1 ± 10,1 | 49/142 (34,5) | 50 (32,9) | 75 (49,3) | 57 (37,5) | 95 (62,5) | 307 (212-387) | 134 (88,2) | 111 (73,0) | 111 (73,0) | 14/140 (10) | NR | 86 (56,6) | 151 (99,3) | 93 (61,2) | NR | NR | 7,33 ± 6,29 |
| Tratamiento médico óptimo | 152 | 70,6 ± 9,9 | 48/147 (32,7) | 39 (25,7) | 52 (34,2) | 66 (43,7) | 85 (56,3) | 335 (210-410) | 138 (90,8) | 113 (74,3) | 113 (74,3) | 17/140 (12,1) | NR | 80 (53,0) | 149 (98,0) | 93 (61,2) | NR | NR | 6,57 ± 5,24 | |
|
ARM: antagonistas del receptor mineralocorticoide; ARNI: inhibidores del receptor de angiotensina–neprilisina; BNP: péptido natriurético tipo B; BRA: bloqueadores del receptor de angiotensina II; FA: fibrilación auricular; IECA: inhibidores de la enzima convertidora de angiotensina; IM: infarto de miocardio; iSGLT2: inhibidores del cotransportador sodio-glucosa tipo 2; M-TEER: reparación mitral percutánea de borde a borde; ND: no disponible; NT-proBNP: fracción N-terminal del pro-BNP. |
||||||||||||||||||||
Tabla 2. Resumen de los estudios incluidos
| Autores y Año | Diseño del estudio | Dispositivo | Tamaño poblacional | Intervenciones comparadas | Seguimiento medio | Principales hallazgos |
|---|---|---|---|---|---|---|
| Anker et al. RESHAPE-HF2 202414 | ECA | MitraClip | 505 | M-TEER Tratamiento médico óptimo | 24 meses |
|
| Stone et al. COAP 201815 | ECA | MitraClip | 614 | M-TEER Tratamiento médico óptimo | 24 meses |
|
| Obadia et al. MITRA-FR 201816 | ECA | MitraClip | 304 | M-TEER Tratamiento médico óptimo | 24 meses |
|
|
IC: insuficiencia cardiaca; IC95%; intervalo de confianza del 95%; HR: hazard ratio; OR: odds ratio; M-TEER: reparación mitral percutánea de borde a borde. |
||||||
Tabla 3. Características ecocardiográficas basales
| Características basales | RESHAPE-HF214 | COAPT15 | MITRA-FR16 | |||
|---|---|---|---|---|---|---|
| Grupo con el dispositivo | Grupo de control | Grupo con el dispositivo | Grupo de control | Grupo con el dispositivo | Grupo de control | |
| Gravedad de la IM Grado 3+, n, % (n) | 141 (56,4%) (250) | 141 (55,3%) (255) | 148 (49,0%) (302) | 172 (55,3%) (312) | – | – |
| Gravedad de la IM Grado 4+, n, % (n) | 109 (43,6%) (250) | 114 (44,7%) (255) | 154 (51,0%) (302) | 139 (44,7%) (312) | – | – |
| FEVI, % (n) | 32 (26-37) (250) | 31 (25-37) (255) | 31,3 ± 9,1 (302) | 31,3 ± 9,6 (312) | 33,3 ± 6,5 | 32,9 ± 6,7 |
| VTDVI, ml (n) | 137 (100-173) (250) | 140 (104-176) (255) | 135,5 ± 56,1 (302) | 134,3 ± 60,3 (312) | – | – |
| VTDVI, ml (n) | 200 (153-249) (250) | 206 (158-250) (255) | 194,4 ± 69,2 (302) | 191,0 ± 72,9 (312) | 136,2 ± 37,4 | 134,5 ± 33,1 |
| DTSVI, cm (n) | 5,8 (5,3-6,5) (250) | 5,9 (5,3-6,4) (255) | 5,3 ± 0,9 (302) | 5,3 ± 0,9 (312) | – | – |
| DTDVI, cm (n) | 6,9 (6,3-7,6) (250) | 6,8 (6,4-7,5) (255) | 6,2 ± 0,7 | 6,2 ± 0,8 | – | – |
| AORE, cm2 (n) | 0,23 (0,20-0,30) (250) | 0,23 (0,19-0,29) (255) | 0,41 ± 0,15 | 0,40 ± 0,15 | 0,31 ± 10* | 0,31 ± 11* |
| Volumen regurgitante, ml (n) | 35,4 (28,9-43,9) (250) | 35,6 (28,2-42,5) (255) | – | – | 45 ± 13 | 45 ± 14 |
|
AORE: área del orificio regurgitante efectivo; LV: ventrículo izquierdo; VTDVI: volumen telediastólico del ventrículo izquierdo; DTDVI: dimensión telediastólica del ventrículo izquierdo; FEVI: DTDVI: dimensión telesistólica del ventrículo izquierdo; fracción de eyección del ventrículo izquierdo; IM: insuficiencia mitral. Los datos del RESHAPE-HF2 expresan mediana e IQR en el estudio COAPT. Los datos del MITRA-FR, mediana ± desviación estándar. * Este valor originalmente estaba expresado en mm2 y se convirtió en una medición estandarizada. |
||||||
Valoración del riesgo de sesgo
Para evaluar la calidad de los ECA incluidos, utilizamos la herramienta Risk of Bias 2 (RoB2) del Cochrane Handbook for Systematic Reviews of Interventions, versión 6.37. Esta metodología permitió evaluar de forma sistemática la calidad metodológica de cada estudio, lo cual fortaleció la validez de nuestros resultados.
Uno de los 3 estudios tuvo un riesgo de sesgo bajo14 y los otros 2 fueron preocupantes15-16 principalmente por cuestiones relaciona- das con la metodología al tratarse de estudios de etiqueta abierta (figura 2).
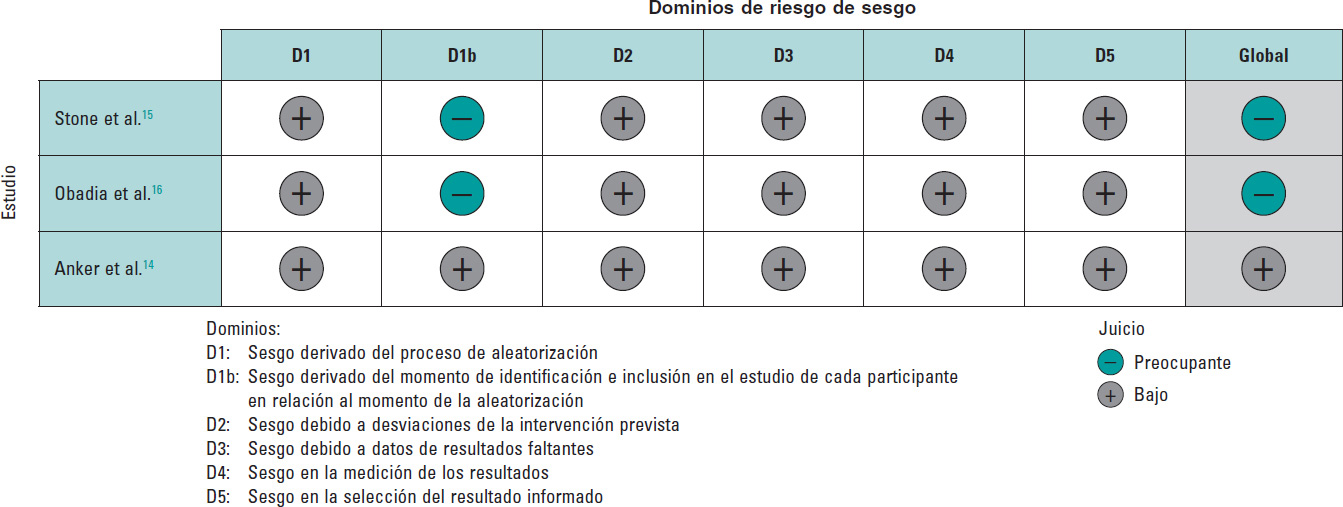
Figura 2. Riesgo de sesgo de cada ensayo clínico aleatorizado incluido. Las referencias bibliográficas citadas en esta figura corresponden a Stone et al.14, Obadia et al.15 y Anker et al.16.
Resultados clínicos
Hospitalización por IC
El análisis de este resultado mostró un descenso significativo, con un RR de 0,71 (IC95%, 0,56-0,90; p = 0,004). No obstante, se observó una heterogeneidad significativa (I2 = 79%). Teniendo en cuenta las diferencias poblaciones del MITRA-FR, se realizó un análisis exploratorio sin el citado ensayo. Los resultados siguieron mostrando un descenso significativo del riesgo de hospitalización, con un RR de 0,63 (IC95%, 0,55-0,72; p < 0,00001) y una mejora sustancial de la heterogeneidad (I2 = 0%). Como este hallazgo es meramente exploratorio se debe interpretar con cautela.
Tanto el análisis como todos los estudios incluidos se muestran en la figura 3A; por su parte, los análisis exploratorios se muestran en la figura 3B. También se analizó el HR para el objetivo primario de hospitalización por HC y, teniendo en cuenta el número limitado de estudios, se realizó un análisis de sensibilidad mediante el método Hartung-Knapp-Sidik-Jonkman (HKSJ); todos estos análisis se encuentran en el material adicional (figuras S1-S4).
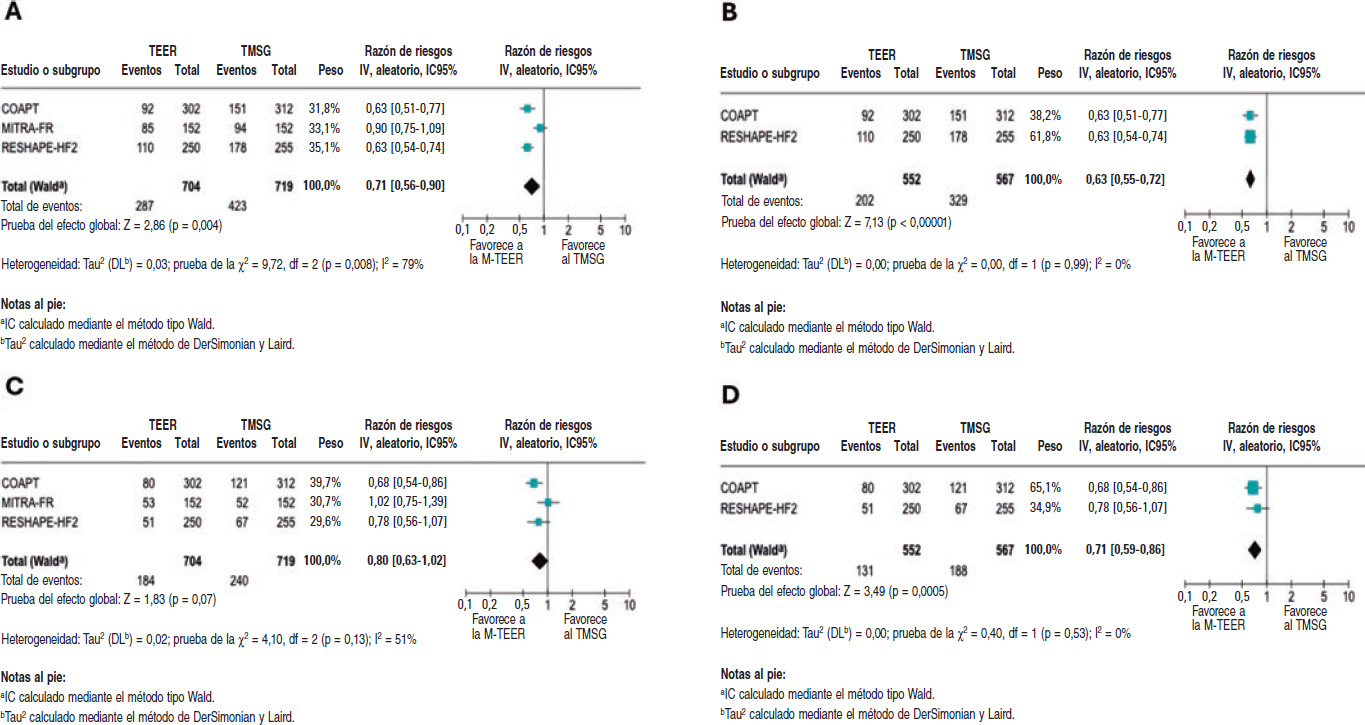
Figura 3. Diagrama de bosque de los riesgos relativos (RR). Las líneas indican los intervalos de confianza del 95% (IC95%) de cada ensayo. A: diagrama de bosque del RR para las hospitalizaciones por IC. B: diagrama de bosque del RR exploratorio para las hospitalizaciones por IC. C: diagrama de bosque del RR para la mortalidad por cualquier causa. D: diagrama de bosque del RR exploratorio para la mortalidad por cualquier causa. M-TEER: reparación mitral percutánea de borde a borde; TMSG: tratamiento médico según las guías clínicas. Las referencias bibliográficas citadas en esta figura corresponden a Stone et al.14, Obadia et al.15 y Anker et al.16.
Mortalidad por cualquier causa
El RR para la mortalidad por cualquier causa fue de 0,80 (IC95%, 0,63-1,02; p = 0,07). No obstante, se observó una heterogeneidad moderada en todos los estudios (I2 = 56%). En el análisis exploratorio se halló un descenso significativo de la mortalidad, con un RR de 0,71(IC95%, 0,59-0,86; p = 0,0005) sin heterogeneidad entre los distintos estudios (I2 = 0%). Todos los análisis y estudios incluidos se muestran en la figura 3C y el análisis exploratorio en la figura 3D.
Los resultados del HR y el análisis sensibilidad se hallan en el material adicional (figuras S5-S8).
Mortalidad cardiovascular
El RR para la mortalidad cardiovascular fue de 0,81 (IC95%, 0,62-1,06; p = 0,12), con una heterogeneidad entre baja y moderada (I2 = 48%). En el análisis exploratorio se observó un descenso significativo de la mortalidad cardiovascular, con un RR de 0,74 (IC95%, 0,55-1,00; p = 0,05) y una baja heterogeneidad (I2 = 41%). Los análisis y estudios incluidos se muestran en la figura 4A y el análisis exploratorio en la figura 4B. Los resultados del HR y el análisis sensibilidad se hallan en el material adicional (figuras S9-S12).
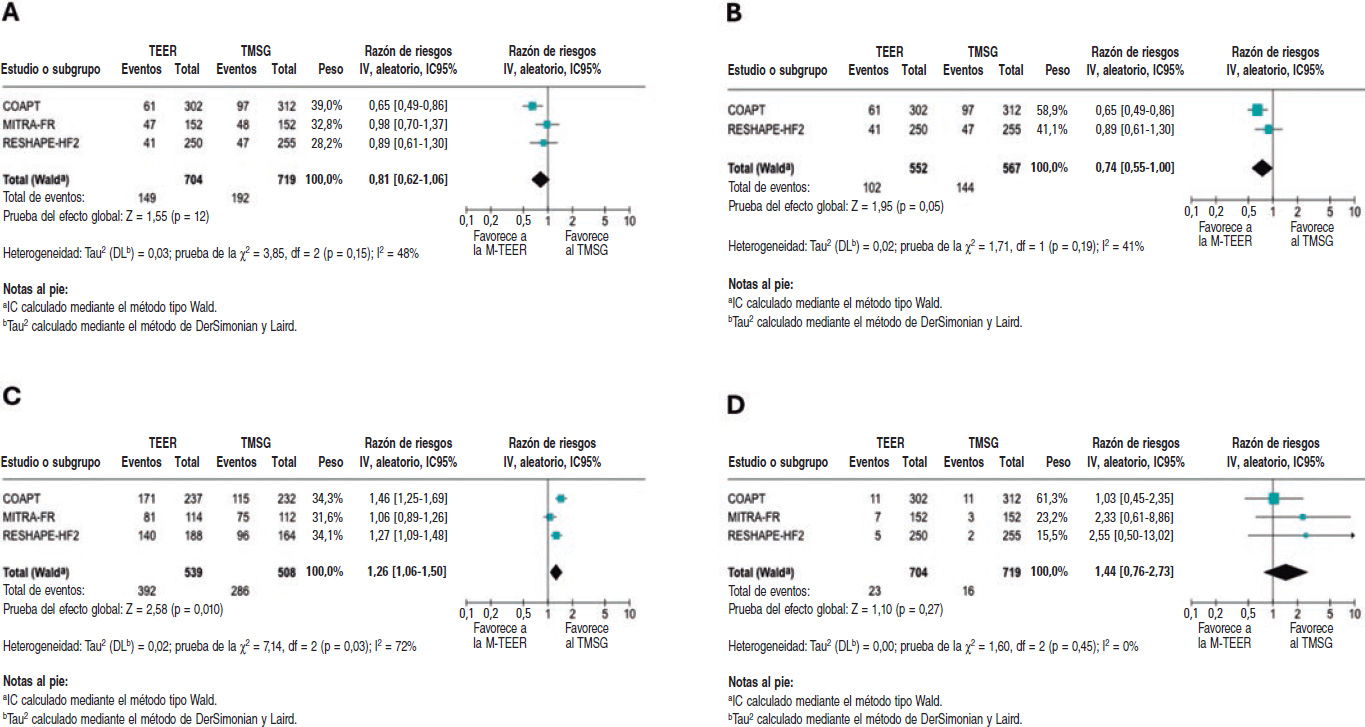
Figura 4. Diagrama de bosque del riesgo relativo (RR). A: diagrama de bosque del RR para la mortalidad cardiovascular. B: diagrama de bosque del RR exploratorio para la mortalidad cardiovascular. C: diagrama de bosque del RR para la CF I/II según la NYHA a 1 año. D: diagrama de bosque del RR para el accidente cerebrovascular. IC95%: intervalo de confianza del 95%; M-TEER: reparación mitral percutánea de borde a borde; TMSG: tratamiento médico según las guías clínicas. Las referencias bibliográficas citadas en esta figura corresponden a Stone et al.14, Obadia et al.15 y Anker et al16. Las líneas indican los IC95% de cada ensayo.
CF según la NYHA
En el análisis de la CF según la NYHA se observó que los pacientes tratados de M-TEER eran más propensos a presentar una CF I/II según la NYHA a los 12 meses, con un RR de 1,26 (IC95%, 1,06-1,50; p = 0,010). No obstante, la heterogeneidad fue alta (I2 = 72%). También se debe tener en cuenta que como la clasificación NYHA es subjetiva, estos resultados (que se detallan en la figura 4C) se deben interpretar con cautela.
Accidente cerebrovascular
No hubo ninguna diferencia significativa entre la M-TEER y el tratamiento médico óptimo en lo referente al riesgo de accidente cerebrovascular, con un RR de 1,44 (IC95%, 0,76-2,73; p = 0,27) y sin heterogeneidad entre los diferentes estudios (I2 = 0%). Estos resultados se muestran en el en la figura 4D.
Infarto de miocardio
En lo referente al infarto de miocardio, nuestro análisis no mostró diferencias significativas entre los diferentes grupos (RR = 0,83; IC95%, 0,43-1,61; p = 0,58), ni heterogeneidad entre los distintos estudios (I2 = 0%); este hallazgo se halla en el material adicional (figura S13).
Análisis exploratorio según la gravedad
Se realizó un análisis estratificado atendiendo al grado basal de insuficiencia mitral. Los datos del objetivo compuesto de mortalidad por cualquier causa u hospitalización por IC estuvieron disponibles según el grado de IM. Para pacientes con IM 3+, el RR fue de 0,75 (IC95%, 0,56-1,00; p = 0,05; I2 = 12%). Los datos de los pacientes con IM 4+ se obtuvieron, únicamente, de los estudios RESHAPE-HF2 y COAPT (RR = 0,55; IC95%, 0,42-0,73; p = 0,0001; I2 = 0%). Este hallazgo se halla en el material adicional (figuras S14-S15).
DISCUSIÓN
Nuestro metanálisis ofrece una evaluación de 3 ECA de gran relevancia: el COAPT15, el MITRA-FR16 y el RESHAPE-HF214, que analizan la M-TEER + TMSG frente a, solo, el TMSG en pacientes con IM secundaria. En pacientes con síntomas persistentes pese a un TMSG adecuado y que no cumplen los criterios marcados para el reemplazo quirúrgico definitivo, la M-TEER se ha convertido en una alternativa prometedora. En este metanálisis actualizado, no se encontró un efecto estadísticamente significativo sobre la mortalidad por cualquier causa; no obstante, la marcada heterogeneidad entre los estudios sugiere que la M-TEER aporta un beneficio clínico significativo cuando se utiliza en pacientes debidamente seleccionados.
Nuestro estudio demostró que la heterogeneidad de los resultados se vio condicionada, principalmente, por el estudio MITRA-FR. Los estudios COAPT y RESHAPE-HF2 presentan muchas diferencias similares frente al MITRA-FR, tal y como se evidencia en las características basales de las cohortes, los métodos y la dirección de los resultados clínicos. Esto se ilustra mejor a través de un análisis exploratorio que compara los resultados del COAPT y el RESHAPE-HF2, con descensos del 37% y 32% en el riesgo de hospitalización por IC e incidencia de la mortalidad cardiovascular, respectivamente (figura 3). La tasa global neutra de mortalidad resultante de nuestro estudio podría deberse más a la heterogeneidad entre ensayos que a una falta de beneficio terapéutico per se.
Una de las principales diferencias entre los ensayos es que MITRA-FR incluyó más ampliamente a pacientes con insuficiencia tricuspídea, remodelado avanzado del VI, mayor dilatación y un AORE más pequeña que los otros 2 ensayos. Otra importante fuente de heterogeneidad fue la gravedad basal de la IM. Los estudios COAPT y RESHAPE-HF2 incluyeron principalmente pacientes con IM grado 3+ y 4+ y el MITRA-FR a pacientes con IM grado 4+, lo cual podría contribuir a las diferencias observadas en los resultados clínicos. En nuestro análisis exploratorio según el grado de IM, los datos mostraron tendencias consistentes a favor de la M-TEER; no obstante, estos hallazgos deben interpretarse con cautela dada la escasa información por subgrupos.
Tal y como propusieron Paul et al.19, una estrategia para valorar la IM secundaria es tener en cuenta la proporción entre el AORE y el VTDVI. En el ensayo MITRA-FR, muchos pacientes presentaban un AORE pequeña con ventrículos muy dilatados, un fenotipo en el que el TMSG podría tener un mayor efecto que la intervención valvular. En los ensayos COAPT y RESHAPE-HF2, una mayor proporción de pacientes presentaba un AORE grande en relación con el VTDVI20, lo que convierte a la insuficiencia mitral en un determinante primario de los síntomas y los resultados y, en consecuencia, en una situación con potencial para un mayor beneficio derivado de la M-TEER.
En los análisis por subgrupo de cada ensayo, los estudios COAPT15 y RESHAPE-HF214 no comunicaron una interacción significativa entre la asignación al tratamiento y la etiología isquémica frente a no isquémica, lo cual indica una cierta consistencia del beneficio entre las distintas etiologías entre los diferentes grupos. El estudio MITRA-FR16 tampoco identificó heterogeneidad significativa en relación con la etiología en sus subgrupos preespecificados. Esto sugiere que la etiología isquémica frente a no isquémica no debería emplearse para optar por una u otra alterativa en el tratamiento de la IM secundaria. En cambio, las decisiones clínicas sí deben priorizar la gravedad de la IM, el grado de disfunción del VI, la carga sintomática y la respuesta al tratamiento médico óptimo21.
Además, las diferencias entre ensayos en lo referente al éxito de la intervención son notables, definido como alcanzar IM ≤ 2+. Este éxito fue mucho menor en el estudio MITRA-FR (75,6%; IM ≤ 2+ al alta) que en el COAPT (94,8%; IM ≤ 2+ a los 12 meses) y en el RESHAPE-HF2 (90,4%; IM ≤ 2+ a los 12 meses). Diversos factores podrían haber contribuido a estas diferencias; por ejemplo, el requisito de la experiencia operatoria previa exigido por el estudio MITRA-FR (haber realizado, como mínimo 5 o más casos con MitraClip) frente a los centros de alto volumen y mayor experiencia exigidos por los otros ensayos. Asimismo, los datos obtenidos tras la aprobación del registro estadounidense STS/ACC TVT22 revelaron descensos de la IM a ≤ 2+ en > 90% de los casos y tasas de supervivencia coincidentes con los ensayos clínicos, lo cual pone de manifiesto la reproducibilidad del beneficio clínico en centros experimentados. La tecnología del dispositivo también es un factor clave a tener en cuenta en estas diferencias: desde los clips de 1ª generación del MITRA-FR, pasando por los de 2ª generación del COAPT, hasta los de 4ª generación del RESHAPE- HF2, con captura independiente de las valvas y brazos más anchos, lo que explicaría los resultados clínicos discrepantes en lo referente a la durabilidad de la IM y los resultados clínicos. Por último, el TMSG se implementó de manera distinta entre los diferentes estudios. El ensayo MITRA-FR se realizó antes del uso generalizado de ARNI e inhibidores de SGLT2; el COAPT, antes de la adopción de los inhibidores de SGLT2 y el RESHAPE-HF2 refleja el uso contemporáneo de una terapia cuádruple.
A pesar de las diferencias de fenotipo entre los pacientes, en muchos países en vías de desarrollo el acceso a intervenciones valvulares percutáneas sigue siendo restringido, principalmente debido a su alto costo y la necesidad de contar con infraestructuras especializadas23,24. Las marcadas disparidades en el acceso a tecnologías de vanguardia, sumadas a la centralización de estas intervenciones en unos cuantos centros urbanos u hospitales de alta especialidad (un fenómeno observado incluso en países con alto poder adquisitivo como Estados Unidos) dejan a una gran parte de la población sin opciones terapéuticas viables25. En este sentido, la intervención con mayor relevancia clínica y aplicabilidad en estas regiones sigue siendo la optimización rigurosa del TMSG y la formación de los profesionales sanitarios. No obstante, sigue siendo necesario fenotipar a los pacientes para identificar a aquellos que podrían beneficiarse en mayor medida de una futura derivación a tratamiento con M-TEER.
Al integrar las características poblacionales de los ensayos con los resultados clínicos, nuestro estudio contribuye a reducir la brecha entre los hallazgos de cada ensayo y la selección de pacientes en la práctica real y ofrece un marco potencial para futuros estudios prospectivos y para refinar los criterios de las guías. Aunque los resultados de nuestro estudio se deben interpretar con cautela, aportan evidencia generadora de hipótesis que avala la idea de que la selección de pacientes, en especial teniendo en cuenta el equilibrio entre el AORE, el VTDVI y la optimización del TMSG, puede ser de vital importancia para maximizar el beneficio de la M-TEER en el tratamiento de la IM secundaria. Este abordaje va más allá de la mera aplicación de las recomendaciones actuales de las guías de práctice clínica y apunta hacia una estrategia más individualizada basada en parámetros anatómicos y funcionales.
Limitaciones
La principal limitación de este estudio reside en la heterogeneidad de las poblaciones incluidas en los ensayos clínicos aleatorizados, tal y como evidencia el I2 observado en los análisis, lo cual podría influir en los resultados globales. En segundo lugar, las diferencias observadas en la gravedad de la IM entre ensayos son otra limitación importante. Mientras los estudios COAPT y RESHAPE-HF2 incluyeron principalmente a pacientes con IM grado 3+ o 4+, el MITRA-FR incorporó un grado más grave de IM, lo cual podría explicar, al menos, en parte, los resultados contradictorios. Por último, no se pudo realizar un metanálisis individualizado de cada paciente por la falta de datos; este tipo de análisis aumentaría el potencial estadístico, especialmente en análisis por subgrupos y mejoraría tanto la solidez como la extrapolación de los hallazgos.
CONCLUSIONES
En este metanálisis, M-TEER + TMSG acarrean un menor riesgo de hospitalización por IC que, solo, el TMSG. No se encontraron diferencias en el riesgo de mortalidad por cualquier causa, mortalidad cardiovascular, accidente cerebrovascular ni infarto de miocardio.
FINANCIACIÓN
Ninguna.
CONSIDERACIONES ÉTICAS
El presente metanálisis se realizó utilizando datos de estudios previamente publicados. Al estar basado enteramente en datos secundarios, no se recopiló información nueva de participantes humanos ni animales; por otra parte, el uso de las guías SAGER no fue de aplicación. Todos los estudios incluidos contaron con la aprobación correspondiente de los comités de ética. Los autores confirman que todos los datos utilizados fueron de acceso público y que no se empleó información confidencial sin la debida autorización.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
Durante la preparación de este trabajo, los autores utilizaron ChatGPT 4o para revisar la sintaxis y gramática del documento. Tras hacer uso de esta herramienta, los autores revisaron y editaron el contenido cuando fue necesario y se hacen plenamente responsables del contenido del artículo publicado.
CONTRIBUCIÓN DE LOS AUTORES
D. Paulino-González: conceptualización; análisis formal; redacción, revisión y edición. A.L. García-Loera: metodología, investigación, redacción, revisión y edición. D.A. Navarro-Martínez: metodología, análisis formal. M.A. Pardiño-Vega: redacción, revisión, edición y supervisión. K.P. Zúñiga-Montaño: investigación, redacción, revisión y edición.
CONFLICTO DE INTERESES
Ninguno.
¿QUÉ SE SABE DEL TEMA?
- La insuficiencia mitral es una patología prevalente que influye negativamente en la calidad de vida de los pacientes. La M-TEER se ha consolidado como una opción terapéutica alternativa para pacientes no aptos para cirugía. No obstante, su beneficio sigue siendo incierto frente al TMSG, ya que los ensayos clínicos que evalúan esta intervención han comunicado resultados discrepantes, con beneficio en los objetivos primarios observados en el ensayo COAPT y en el recién publicado RESHAPE-HF2, pero no en el MITRA-FR; una discrepancia que se debe seguir investigando.
¿QUÉ APORTA DE NUEVO?
- Este metanálisis ofrece una valoración integral de la evidencia que compara M-TEER + TMSG frente a, solo, el TMSG en el tratamiento de la IM secundaria. Nuestros hallazgos confirman que la M-TEER acarrea menos hospitalizaciones por IC. Se debe mencionar que, al examinar detalladamente las poblaciones de los ensayos, se evidencia que la selección de pacientes influye en los resultados clínicos: en los estudios que incluyeron a pacientes con menos dilatación ventricular y niveles más bajos de biomarcadores de congestión (como el COAPT y el RESHAPE-HF2), la M-TEER se asoció a más beneficios tanto en la mortalidad cardiovascular como por cualquier causa. Estos resultados revelan el posible papel que juegan parámetros anatómicos y funcionales tales como el equilibrio entre el AORE y el VTDVI, para identificar a aquellos pacientes más propensos a beneficiarse de esta intervención conjunta.
BIBLIOGRAFÍA
1. Chehab O, Roberts-Thomson R, Ng Yin Ling C, et al. Secondary mitral regurgitation:pathophysiology, proportionality and prognosis. Heart. 2020;106:716-723.
2. Sengodan P, Younes A, Shah N, Maraey A, Chitwood WR Jr, Movahed A. Contemporary review of the evolution of various treatment modalities for mitral regurgitation. Expert Rev Cardiovasc Ther. 2024;22:639-651.
3. Nishimura RA, Otto CM, Bonow RO, et al. 2017 AHA/ACC Focused Update of the 2014 AHA/ACC Guideline for the Management of Patients With Valvular Heart Disease:A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation. 2017;135:e1159-e1195.
4. Itabashi Y, Kobayashi S, Mizutani Y, Torikai K, Taguchi I. Treatment of secondary mitral regurgitation by transcatheter edge-to-edge repair using MitraClip. J Med Ultrason (2001). 2022;49:389-403.
5. Barnes C, Sharma H, Gamble J, Dawkins S. Management of secondary mitral regurgitation:from drugs to devices. Heart. 2024;110:1099-1106.
6. Page MJ, McKenzie JE, Bossuyt PM, et al. The PRISMA 2020 statement:an updated guideline for reporting systematic reviews. BMJ. 2021;372:n71.
7. Sterne JAC, Savovic´J, Page MJ, et al. RoB 2:a revised tool for assessing risk of bias in randomised trials. BMJ. 2019;366:l4898.
8. Heidenreich PA, Bozkurt B, Aguilar D, et al. 2022 AHA/ACC/HFSA Guideline for the Management of Heart Failure:A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines [published correction appears in Circulation. 2022;145:e1033.] [published correction appears in Circulation. 2022;146:e185.] [published correction appears in Circulation. 2023;147:e674]. Circulation. 2022;145:e895-e1032.
9. Abraham WT, Psotka MA, Fiuzat M, et al. Standardized Definitions for Evaluation of Heart Failure Therapies:Scientific Expert Panel From the Heart Failure Collaboratory and Academic Research Consortium. JACC Heart Fail. 2020;8:961-972.
10. Sacco RL, Kasner SE, Broderick JP, et al. An updated definition of stroke for the 21st century:a statement for healthcare professionals from the American Heart Association/American Stroke Association [published correction appears in Stroke. 2019;50:e239]. Stroke. 2013;44:2064-2089.
11. Thygesen K, Alpert JS, Jaffe AS, et al. Fourth Universal Definition of Myocardial Infarction (2018). Glob Heart. 2018;13:305-338.
12. Higgins JP, Thompson SG, Deeks JJ, Altman DG. Measuring inconsistency in meta-analyses. BMJ. 2003;327:557-560.
13. DerSimonian R, Laird N. Meta-analysis in clinical trials. Control Clin Trials. 1986;7:177-188.
14. Anker SD, Friede T, von Bardeleben RS, et al. Transcatheter Valve Repair in Heart Failure with Moderate to Severe Mitral Regurgitation. N Engl J Med. 2024;391:1799-1809.
15. Stone GW, Lindenfeld J, Abraham WT, et al. Transcatheter Mitral-Valve Repair in Patients with Heart Failure. N Engl J Med. 2018;379:2307-2318.
16. Obadia JF, Messika-Zeitoun D, Leurent G, et al. Percutaneous Repair or Medical Treatment for Secondary Mitral Regurgitation. N Engl J Med. 2018;379:2297-2306.
17. Iung B, Armoiry X, Vahanian A, et al. Percutaneous repair or medical treatment for secondary mitral regurgitation:outcomes at 2 years. Eur J Heart Fail. 2019;21:1619-1627.
18. Ponikowski P, Friede T, von Bardeleben RS, et al. Hospitalization of Symptomatic Patients With Heart Failure and Moderate to Severe Functional Mitral Regurgitation Treated With MitraClip:Insights From RESHAPE-HF2. J Am Coll Cardiol. 2024;84:2347-2363.
19. Grayburn PA, Sannino A, Packer M. Proportionate and Disproportionate Functional Mitral Regurgitation:A New Conceptual Framework That Reconciles the Results of the MITRA-FR and COAPT Trials. JACC Cardiovasc Imaging. 2019;12:353-362.
20. Anker SD, Friede T, von Bardeleben RS. Percutaneous repair of moderate-to-severe or severe functional mitral regurgitation in patients with symptomatic heart failure:Baseline characteristics of patients in the RESHAPE-HF2 trial and comparison to COAPT and MITRA-FR trials. Eur J Heart Fail. 2024;26:1608-1615.
21. Nappi F, Singh SSA, Bellomo F.Exploring the Operative Strategy for Secondary Mitral Regurgitation:A Systematic Review. Biomed Res Int. 2021;2021:3466813.
22. American College of Cardiology. STS/ACC TVT Registry Analysis Finds TMVr Safe and Effective in Real-World Setting. ACC. 2023 Mar 5. Disponible en:https://www.acc.org/Latest-in-Cardiology/Articles/2023/03/01/22/45/Sun-1215pm-sts-acc-tvt-acc-2023. Consultado 1 Jul 2025.
23. Bernardi FLM, Ribeiro HB, Nombela-Franco L, et al. Recent Developments and Current Status of Transcatheter Aortic Valve Replacement Practice in Latin America - the WRITTEN LATAM Study. Arq Bras Cardiol. 2022;118:1085-1096.
24. Bana A. TAVR-present, future, and challenges in developing countries. Indian J Thorac Cardiovasc Surg. 2019;35:473-484.
25. Steitieh D, Zaidi A, Xu S, et al. Racial Disparities in Access to High-Volume Mitral Valve Transcatheter Edge-to-Edge Repair Centers. J Soc Cardiovasc Angiogr Interv. 2022;1:100398.


