RESUMEN
Todo cardiólogo debe realizar un viaje atrás en la historia para entender el estado actual de su especialidad. El stent coronario es uno de los logros más importantes de la investigación y de la ingeniería biomédica del último siglo. Su tecnología ha ido evolucionando e incorporando mejoras sustanciales que hoy en día hacen de este dispositivo un estándar de gran calidad para el tratamiento de la enfermedad coronaria. En este artículo se resume la historia del stent coronario desde su génesis hasta el presente. Se repasan los hitos históricos y científicos más remarcables que contribuyeron a hacer de la angioplastia percutánea un procedimiento seguro y altamente efectivo gracias al stent coronario. La evolución del stent ha ido de la mano del crecimiento y la maduración de la cardiología intervencionista.
Palabras clave: Stent. Stent liberador de fármaco. Angioplastia coronaria transluminal percutánea.
ABSTRACT
All cardiologists should delve into history to understand the current state of the art of their specialty. In the last century, the coronary stent was a pivotal achievement of research and biotechnological engineering. Since then, technology has advanced, and substantial improvements have been incorporated into this device, which has become the gold standard for treating coronary artery disease. This article summarizes the history of the coronary stent from its inception to the present day. The document reviews key historical and scientific milestones that have contributed to making percutaneous angioplasty a safe and highly effective procedure due to coronary stents. The evolution of the stent has been closely linked to the growth and maturation of interventional cardiology to date.
Keywords: Stent. Drug-eluting stent. Percutaneous transluminal coronary angioplasty.
CONCEPCIÓN Y DESARROLLO DE LA ANGIOPLASTIA CORONARIA (DÉCADAS DE 1970 Y 1980)
La cardiología intervencionista ha experimentado una espectacular evolución en las últimas décadas, que ha ido siempre al compás de la biotecnología. El desarrollo de los stents coronarios ha desempeñado un papel fundamental al haber permitido el asentamiento y la expansión de la angioplastia percutánea con fiabilidad. Los stents surgieron para resolver los problemas de la angioplastia coronaria percutánea con balón, que se evidenciaron durante los primeros pasos de esta. Por ello, conviene recordar cómo comenzó todo (tabla 1)1.
Tabla 1. Hitos en el desarrollo de la cardiología intervencionista
| Año | Hito |
|---|---|
| 1929 | Werner Forssmann realiza el primer cateterismo cardiaco transluminal |
| 1953 | Sven Seldinger emplea el acceso percutáneo |
| 1958 | Mason Sones realiza la primera angiografía coronaria (acceso braquial quirúrgico) |
| 1963 | Charles Dotter realiza la primera angioplastia arterial periférica |
| 1968 | Eberhard Zeitler expande la angioplastia periférica en Europa |
| 1968 | Melvin Judkins desarrolla la técnica de la coronariografía percutánea |
| 1977 | Andreas Grüntzig realiza la primera angioplastia coronaria percutánea con balón |
| 1979 | Geoffrey Hartzler realiza la primera angioplastia coronaria en infarto agudo de miocardio |
| 1986 | Jacques Puel implanta el primer stent coronario (Wallstent) |
| 1991 | Cannon y Roubin reportan el primer implante de stent en infarto agudo de miocardio |
| 1994 | Aprobación regulatoria del primer stent con base científica (Palmaz-Schatz) |
En los inicios de los años 1970, el tratamiento de la enfermedad coronaria se limitaba al uso de nitroglicerina y propranolol, escasas pruebas diagnósticas y muy pobre evidencia científica. Hasta entonces, eso sí, se habían producido algunos hitos importantes que sirvieron de precedente para dar el gran paso del tratamiento percutáneo1. Las coronariografías eran raramente indicadas, tan solo a pacientes con muchos síntomas y en vistas a un posible tratamiento con cirugía de puentes coronarios, que era la única modalidad de revascularización. Andreas Roland Grüntzig, radiólogo y cardiólogo alemán que desarrolló su carrera en Zúrich y luego en Atlanta, fue un personaje con una genialidad y un tesón particulares que le llevaron a desarrollar la técnica de la angioplastia con balón, superando el escepticismo y la oposición reinantes en su entorno. Habiendo recibido el legado de la angioplastia periférica de Charles Dotter a través de Eberhard Zeitler, se embarcó en el desarrollo del balón de angioplastia, aplicándolo primero a la enfermedad periférica en 1974 y luego dando el osado salto al árbol coronario en los humanos el 16 de septiembre de 19772.
Tras el éxito clínico inicial, se comenzaron a evidenciar las limitaciones de la técnica, en especial a medida que esta se expandió a diferentes escenarios clínicos y anatómicos. Preocupaban la oclusión aguda por la retracción elástica, la disección y la trombosis. Esto se traducía en infartos periprocedimiento, o en necesidad de cirugía cardiaca o de nueva angioplastia durante el seguimiento3. La restenosis era un fenómeno más tardío, pero su gran incidencia (20-40%) hacía que también supusiera un problema importante4. Para prevenir la retracción elástica y las disecciones oclusivas, se precisaba el mantenimiento de la fuerza radial ejercida por el balón de angioplastia, lo cual podría hacerlo una estructura protésica intraluminal.
LLEGADA Y APROBACIÓN DEL STENT CORONARIO (1980-1994)
El término stent es un anglicismo reconocido por la Real Academia Española5. Tiene un origen incierto, pero lo más aceptado es que se trata del epónimo del dentista británico Charles Thomas Stent (1807-1885), quien en 1856 patentó un material termoplástico para realizar impresiones dentarias, que denominó «pasta de Stent»6. Más adelante, cuando la patentada pasta de Stent dejó de emplearse, el término continuó aplicándose para el material protésico que podía suplir tejido biológico. Su uso se fue extendiendo para denominar también a las prótesis tubulares empleadas en cirugía hepatobiliar y en urología6. Charles Dotter, pionero también en esto, reporta en 1969 su experiencia al insertar unas espirales metálicas en arterias de perros con la finalidad de demostrar que sería posible implantar un dispositivo de contención intraluminal7. No obstante, no fue hasta los años 1980, tras evidenciar las limitaciones de la angioplastia con balón, cuando se expandió la denominación de stent y se desarrolló con énfasis la tecnología de los dispositivos que conocemos hoy en día.
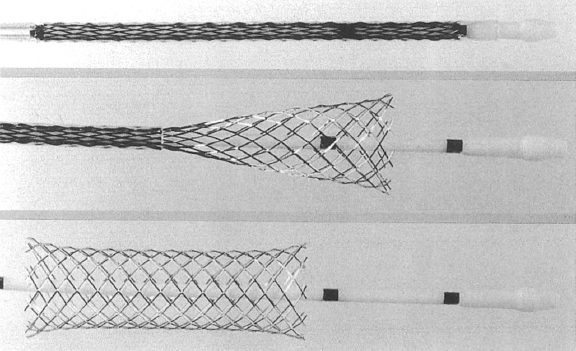
En 1980, el encuentro en Suiza entre dos suecos expatriados, Ake Senning, cirujano cardiotorácico que había sido valedor de Andreas Grüntzig, y el ingeniero Hans Wallsten, marcó el inicio de un proyecto exitoso que, con la colaboración del ingeniero francés Christian Imbert, acabaría dando a luz al primer stent para uso en arterias coronarias: el Wallstent. El término no era un epónimo del ingeniero, sino que derivaba de aplicar una próstesis (stent) sobre la pared de un vaso (wall)1. Se trataba de un mallado de filamentos de acero inoxidable con capacidad autoexpandible al ser liberado por un sistema (figura 1). Fundaron la compañía MedInvent (luego adquirida por Schneider, Suiza), buscaron investigadores para las pruebas del dispositivo y contactaron con Ulrich Sigwart (Lausanne) y Jacques Puel (Toulouse)1.
Figura 1. Stent autoexpandible Wallstent. Se muestra, de arriba abajo, el proceso de despliegue del dispositivo con el importante acortamiento longitudinal que se producía.
El protocolo de experimentación para el Wallstent comprendía primeramente su uso en animales, a continuación en arterias periféricas en humanos y finalmente en arterias coronarias de pacientes. El centro de Toulouse encontró menos dificultades para iniciar la experimentación animal y llegó antes a la prueba en humanos. Así, en diciembre de 1985, Hervé Rousseau y Francis Joffre, radiólogos del departamento de Jacques Puel en Toulouse, implantaron la primera endoprótesis periférica. Por su parte, Jacques Puel, en marzo de 1986, implantó la primera endoprótesis coronaria en un paciente que había presentado restenosis tras una angioplastia con balón en la descendente anterior1. En junio de ese mismo año, Ulrich Sigwart implantó la primera endoprótesis coronaria para el tratamiento de una disección aguda oclusiva en una descendente anterior proximal tras una angioplastia con balón; fue la primera vez que un paciente evitó la cirugía urgente por esta complicación1,8.
Más adelante, Sigwart se erigió como portavoz en la escena pública y en las publicaciones, quizás ayudado por su mejor dominio de la lengua inglesa1. En marzo de 1987 se publicó la primera descripción de la experiencia conjunta en The New England Journal of Medicine9. El trabajo reportó el implante de 24 stents coronarios en 19 pacientes para tratamiento de restenosis (n = 17), oclusión aguda tras angioplastia con balón (n = 4) o deterioro de bypass coronario (n = 3). Sigwart contó años después que la revista le solicitó no emplear el verbo stenting, pero sí el sustantivo stent para denominar al nuevo dispositivo10. Las experiencias multicéntricas iniciales con el Wallstent fueron lideradas por los centros de Toulouse, Laussane y Rotterdam. En 1991, Serruys et al.11 describieron el seguimiento de los primeros 105 pacientes tratados: la mortalidad fue del 7,6%, la incidencia de oclusión fue del 24% (mayoritariamente en las primeras 2 semanas) y la restenosis fue del 14-32% (según la definición considerada).
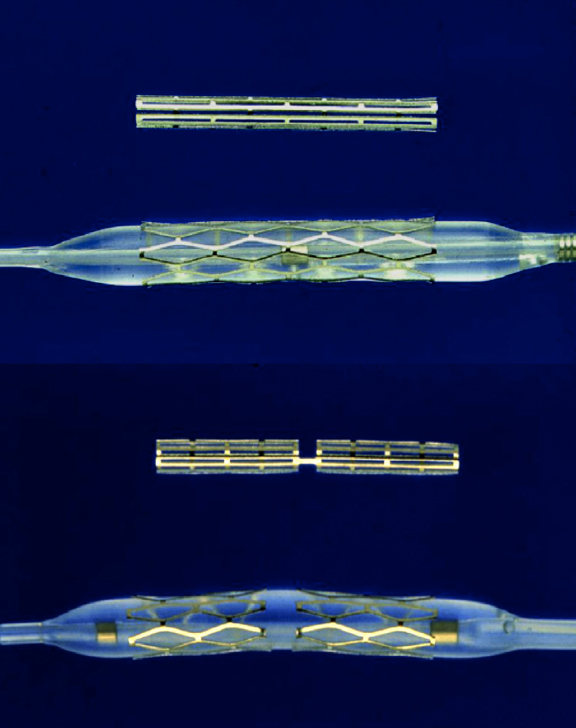
Paralelamente, al otro lado del océano, Julio Palmaz, un radiólogo intervencionista argentino afincado en los Estados Unidos, en 1977 asistía a las sesiones en vivo de Grüntzig y, al presenciar las complicaciones de la angioplastia, vio la oportunidad de desarrollar un dispositivo para prevenirlas. Diseñó su primer prototipo en la cocina de su casa con una pistola soldadora y alambre de cobre. Luego empleó acero inoxidable e inventó el primer stent expandible con balón, que implantó en aortas de perros1,12. Más adelante se trasladó a San Antonio (Tejas, Estados Unidos), donde pudo mejorar el dispositivo empleando máquinas de corte sobre tubos de acero13. Conoció a Richard Schatz, cardiólogo militar que le ayudó a adaptar el modelo para uso en arterias coronarias uniendo dos stents pequeños por un puente, mejorando así su flexibilidad y navegabilidad (figura 2). Tras reunir la inversión necesaria, iniciaron la compañía Expandable Grafts Partnership (después adquirida por Johnson & Johnson, Estados Unidos) para producir los prototipos y financiar la investigación12.
Figura 2. Stent expandible con balón Palmaz-Schatz (arriba) y PS 153 series (abajo), que consistía en 2 stents más cortos unidos por un puente con la finalidad de mejorar su flexibilidad y navegación.
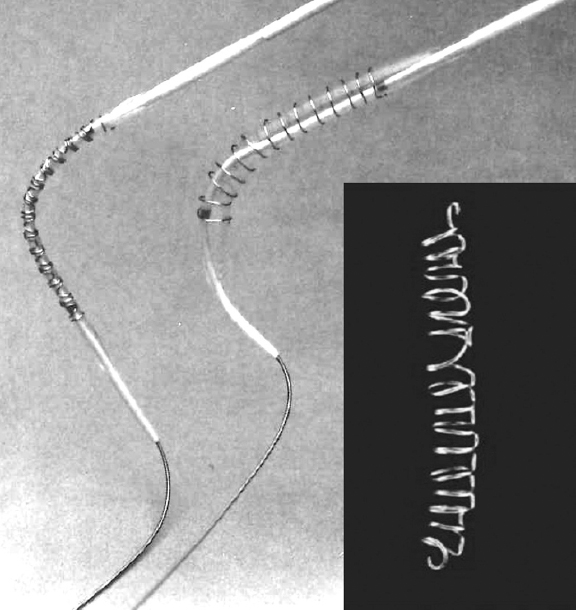
Debido a las restricciones en el progreso de las investigaciones en los Estados Unidos, las primeras pruebas en humanos se realizaron en el extranjero1,12. En octubre de 1987, Julio Palmaz y Goetz Richter implantaron el primer stent Palmaz-Schatz en arterias periféricas en Freiburg, Alemania. A finales de ese mismo año, Palmaz, Schatz y Eduardo Sousa implantaron el primer stent Palmaz-Schatz en arterias coronarias en Sao Paulo, Brasil (21 meses después del primer Wallstent coronario). Lamentablemente para Julio Palmaz, el hito del primer implante de stent expandible con balón lo habían logrado 3 meses antes Gary Roubin y Spencer King III en Emory, Atlanta. Se trataba de una estructura de filamento metálico enrollado sobre un balón (figura 3), inventada por el radiólogo italiano Cesare Gianturco, que previamente había trabajado con Grüntzig. La Food and Drug Administration de los Estados Unidos aprobó el stent Gianturco-Roubin (Cook Medical Inc., Estados Unidos) en 1993, pero no el Palmaz-Schatz, al cual se le exigió la realización de dos ensayos clínicos aleatorizados, que se completaron y publicaron en 1994, y entonces logró la aprobación de la agencia1,12,14,15. Aquí repasamos estos dos importantes estudios que validaron científicamente el uso del stent en cardiología.
Figura 3. Stent expansible con balón Gianturco-Roubin, con formación espiroidea.
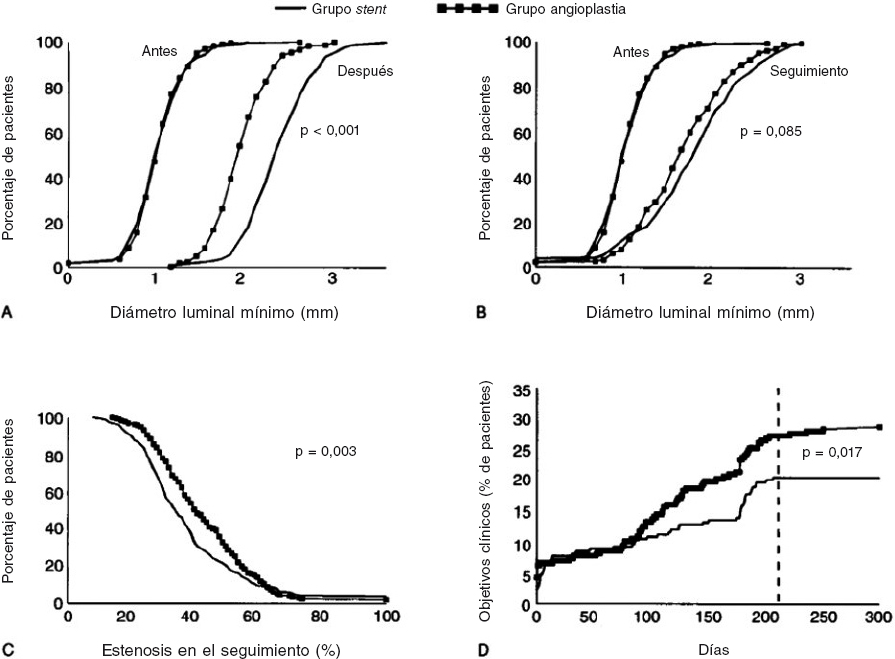
En el ensayo BENESTENT (Belgian Netherlands Stent), presentado por Serruys et al.15 en 1994, se aleatorizó a 520 pacientes con angina estable y enfermedad coronaria de 1 vaso para recibir tratamiento con angioplastia simple con balón o implante de un stent Palmaz-Schatz. Participaron 28 centros, en su gran mayoría europeos. Todos los pacientes recibieron ácido acetilsalicílico durante 6 meses, y si se les colocaba stent se añadía warfarina durante 3 meses. A los 7 meses, el tratamiento con stent redujo un 32% el combinado de eventos adversos, fundamentalmente a expensas de una menor incidencia de revascularización repetida. La restenosis binaria (≥ 50%) fue del 22% en el grupo de stent y del 32% en el grupo de balón (figura 4). La trombosis del stent sucedió en un 3,5% de los pacientes. Las complicaciones vasculares o hemorrágicas y la duración de la estancia hospitalaria fueron mayores en los pacientes tratados con stent. En el seguimiento a 1 año se mantuvo la reducción relativa del evento combinado en un 26% a favor del stent, con una incidencia de angioplastia repetida del 10 frente al 21% en el grupo de balón16.
Figura 4. Gráficas del estudio BENESTENT que muestran ganancia luminal aguda (A) y en el seguimiento (B). Se muestran también la distribución de frecuencias de restenosis (C) y la acumulación de eventos clínicos (D). (Reproducida con permiso de Serruys et al.15).
En el estudio STRESS (Stent Restenosis Study), reportado por Fischman et al.14 el mismo año, se aleatorizó a 410 pacientes procedentes de 20 centros, en su mayoría norteamericanos. El régimen antitrombótico incluía ácido acetilsalicílico indefinido para todos los pacientes y anticoagulación con warfarina durante 1 mes para aquellos que recibían el stent Palmaz-Schatz. A los 6 meses, la incidencia del combinado de eventos adversos fue similar (19,5% en el grupo de stent frente a 23,8% en el grupo de balón; p = 0,16), pero se observó una tendencia hacia una menor necesidad de revascularización repetida en el grupo de stent (10,2 frente a 15,4%; p = 0,06). La restenosis binaria también fue menor en los pacientes tratados con stent (32 frente a 42%; p < 0,05). La trombosis del stent ocurrió en el 3,4% (7/205) de los casos tratados por protocolo y en el 21,4% (3/14) de aquellos en los que el stent se empleó como rescate de la angioplastia (crossover). Nuevamente, las complicaciones vasculares o hemorrágicas, así como la duración de la estancia hospitalaria, fueron mayores en los pacientes tratados con stent. En el seguimiento cercano a 1 año se mantuvieron las diferencias numéricas a favor del stent, aunque sin significación estadística (revascularización no planeada: 12 frente a 17%; p = 0,09)17.
Finalmente, pese a los impedimentos y retrasos, el stent Palmaz-Schatz se acabó imponiendo como estándar de referencia durante un tiempo gracias a la evidencia que lo respaldaba, a su mayor seguridad y a su facilidad de uso. Los otros stents, a pesar de su importante expansión inicial, carecían del respaldo de estudios y preocupaba la incidencia de trombosis y restenosis. El stent Gianturco- Roubin se mostró inferior en estos aspectos frente al stent Palmaz-Schatz18, y el Wallstent tenía el problema del acortamiento longitudinal, la imprecisión en el implante y el compromiso de ramas laterales por su pequeño tamaño de celda. Todo esto influyó en que estos stents fueran siendo desplazados y gradualmente desaparecieran del mercado.
A partir de 1994, gracias a los estudios BENESTENT y STRESS, el uso del stent se expandió, pero aún existían dudas sobre si los costes generados por esta nueva intervención se traducirían en un beneficio significativo. Los estudios subsiguientes convencieron de la superioridad del stent frente a la angioplastia simple con balón en distintos escenarios. Hubo dos estudios importantes que mostraron el claro beneficio en términos de restenosis: en oclusiones crónicas (32 frente a 74%; p > 0,001) en 199619 y en enfermedad aislada de arteria descendente anterior proximal (19 frente a 40% a 12 meses; p = 0,02) en 199720. Por otro lado, se comparó la estrategia de angioplastia con stent frente a angioplastia con balón con posibilidad de rescate con stent, resultando favorecida la estrategia de empleo de stent en primera línea por beneficio clínico y balance de costes21. En el infarto agudo, el estudio Stent-PAMI sentó la indicación del uso de stent frente a la angioplastia con balón22.
PROGRESOS Y MODERNIZACIÓN DE LAS PLATAFORMAS (DÉCADA DE 1990)
Durante la década de 1990 se produjeron algunos avances importantes que repercutieron en la efectividad y la seguridad del stent (tabla 2)1, desde el uso de ultrasonido intravascular para optimizar el implante hasta los progresos en hemostasia y la expansión del acceso radial, que junto con el abandono de la anticoagulación en favor de la doble antiagregación disminuyeron las complicaciones hemorrágicas, tan evidentes en los ensayos BENESTENT y STRESS14,15. Por último, y no menos importante, las mejoras tecnológicas en la plataforma del stent fueron clave para generalizar este tratamiento.
Tabla 2. Avances de la angioplastia en la década de 1990
| Años | Avances | Resultados |
|---|---|---|
| 1989-1993 | Acceso radial para coronariografía y angioplastia coronaria | Inicios de la nueva era en acceso arterial mínimamente invasivo |
| 1993-1994 | Reducción del calibre de acceso a 6 Fr Cierres hemostáticos femorales | Reducción de la hospitalización y de las complicaciones hemorrágicas |
| 1994 | Publicación de los estudios BENESTENT15 y STRESS14 | El stent demuestra su efectividad en la angioplastia |
| El stent Palmaz-Schatz se consolida como referencia | ||
| Empleo de ecografía intravascular para la optimización del implante del stent | La expansión adecuada, gracias a una presión de implante elevada, conducía a mínima trombosis y menor restenosis | |
| 1995-1998 | Estudios con terapia antiplaquetaria doble | Minimización de la trombosis |
| Abandono de la anticoagulación oral | ||
| Reducción de las hemorragias | ||
| 1994-2000 | Mejoras del Palmaz-Schatz (Cordis) y aparición de nuevas plataformas modernas: Micro Stent (Arterial Vascular Engineering), Multi-Link (Advanced Cardiovascular Systems), etc. | Expansión de la indicación de la angioplastia con stent |
| Se impone el stent tubular o modular frente a los autoexpandibles y helicoidales |
Los stents iniciales tenían carencias técnicas evidentes que requerían ser resueltas para poder ampliar este tratamiento a distintos escenarios anatómicos (tortuosidades, bifurcaciones y lesiones calcificadas). Por iniciativa de los propios intervencionistas, se propuso la posibilidad de cortar el stent de Palmaz-Schatz por el puente articulado con el fin de disponer de un stent corto («Palmaz desarticulado» o «hemi-Palmaz») para lesiones cortas y que tuvieran un acceso anatómico más difícil23. Sin embargo, fue la incorporación de la tecnología de corte láser lo que trajo la innovación en el diseño de los stents. Cordis, compañía de Johnson & Johnson (Estados Unidos), mejoró la plataforma del Palmaz-Schatz creando el Spiral y luego el Crown24 (figura 5). Posteriormente evolucionaría hacia el Bx Velocity, un stent también de diseño tubular (tubo cortado a láser), pero con anillos en zigzag y conectores ondulados que permitían una mayor flexibilidad, aunque seguía manteniendo el diseño de celda cerrada (conectores en todos los ángulos de infle- xión de los anillos) que limitaba su navegación en curvas (figura 5). A partir de la plataforma del Bx Velocity, Cordis lanzó el primer stent farmacoactivo de la historia: el Cypher12.
Figura 5. Stents de Cordis: evolución de la plataforma del Palmaz-Schatz, desde el articulado PS 153 series (arriba), pasando por el Crown (centro), hasta la plataforma Bx Velocity (abajo).
En 1990, Medtronic Inc. (Estados Unidos) creó el Wiktor, un stent de filamento en espiral expandible con balón similar al Gianturco-Roubin, pero hecho de tántalo, más radiopaco (figura 6). Sin embargo, su fragilidad y su débil fuerza radial hicieron que fuera superado por las nuevas plataformas y finalmente fue retirado24. En torno a 1994, la compañía Arterial Vascular Engineering (AVE; Estados Unidos) lanzó el Micro Stent, un stent con un diseño modular consistente en un filamento redondo de acero que se curvaba con ángulos suavizados conformando anillos que luego se unían con soldaduras en vértices alternos formando celdas abiertas; todo ello mejoraba su flexibilidad y navegación, sin perder fuerza radial24. AVE fue adquirida por Medtronic en 1998. En las sucesivas iteraciones del Micro Stent (GFX, GFX2, S670, S7) se fue disminuyendo el grosor del strut (filamento que compone la malla del stent) y en 2002 se cambió el acero inoxidable por una aleación de cobalto y níquel en el stent Driver (figura 6). Ya bien entrado el siglo XXI, Medtronic empleó la plataforma del Driver para crear el stent farmacoactivo Endeavor. En 2010, la transición a la plataforma Integrity supuso usar un filamento continuo con forma sinusoidal, esta vez soldado con láser en múltiples puntos para proteger su integridad.
Figura 6. Stents de Medtronic y AVE: stent helicoidal Wiktor (A) y micro-stent modular AVE (B), con sus versiones GFX2 (C) y Driver (D). El diagrama muestra el cambio del strut con las sucesivas plataformas. Se muestra la plataforma Integrity (E) con la tecnología de filamento continuo soldado con láser.
Por otro lado, Advanced Cardiovascular Systems (Estados Unidos), una compañía adquirida previamente por la división de dispositivos de Eli Lilly (Estados Unidos), luego Guidant, creó el stent Multi-Link, aprobado para su uso en Europa en 1995 y en los Estados Unidos en 1997. Se trataba de un stent de acero de diseño tubular con celda abierta. En este caso el strut era plano y con ángulos romos en los anillos24. Este diseño más moderno lo hizo muy competitivo y fue dominando el mercado junto al stent de AVE12. Guidant continuó mejorando la plataforma Multi-Link al adelgazar el strut, emplear conectores curvos y pasar a usar la aleación de cromo-cobalto en el modelo Vision (figura 7). El Multi-Link Rx (strut de 50 μm) demostró superioridad frente al stent Bx Velocity (strut de 140 μm) en términos de restenosis a 12 meses en el estudio ISAR-STEREO-2 (18 frente a 31%; p < 0,001)25, lo cual demostró la importancia del grosor del strut en el daño de la pared del vaso y la aparición de restenosis. La plataforma Multi-Link de cromo-cobalto sirvió posteriormente de base para los stents farmacoactivos Xience V (Abbott Vascular, Estados Unidos) y Promus (Boston Scientific, Estados Unidos).
Figura 7. Stents de ACS-Guidant. Plataforma Multi-link en sus sucesivas versiones con modificaciones en la celda y en los conectores.
El stent NIR, de Medinol (Israel), distribuido por Boston Scientific, era un stent de acero inoxidable de celda cerrada con un diseño que permitía flexibilidad en la navegación, pero que una vez expandido su geometría de celda le confería gran rigidez y, por lo tanto, fuerza radial24 (figura 8). Esta plataforma sirvió para el primer stent farmacoactivo de paclitaxel, el Taxus, lanzado por Boston Scientific en 2003. A finales de los años 1990, Boston Scientific, que había distribuido el Wallstent y el NIR, desarrolló y comercializó sus propios stents, el Express y el Veriflex/Liberté, que también servirían para las siguientes versiones del Taxus (figura 8).
Figura 8. Plataformas empleadas por Boston para desarrollar el Taxus. Arriba se muestra el stent NIR de Medinol; abajo a la izquierda, la plataforma Express; y abajo a la derecha, la plataforma Veriflex que sirvió para el Taxus Liberté.
Muchos stents lanzados durante los años 1990 fueron comparados de acuerdo con sus características técnicas y mediante estudios de comparación directa, que en general ofrecieron datos equivalentes26. Tras esta revolución tecnológica vivida a finales de siglo, se podía concluir que los stents expandibles con balón de diseño tubular (Palmaz-Schatz y Multi-Link) y modular (Micro Stent) se habían impuesto frente a los autoexpandibles y a los helicoidales. Los avances de la angioplastia en esos años (tabla 2) posicionaron al stent como estándar de tratamiento percutáneo de la enfermedad coronaria. No obstante, la restenosis seguía siendo un inconveniente para el stent y para la angioplastia en general. La incidencia de restenosis había disminuido de un 30-40% con la angioplastia con balón a un 20-30% en los primeros estudios del stent Palmaz-Schatz14,15. Tras las sucesivas mejoras en las plataformas y las técnicas de implante, la restenosis se redujo, pero seguía cercana al 20% al año del implante27. Además, la ampliación del uso del stent a escenarios más complejos (injertos de safena, vaso pequeño, lesiones largas, etc.) hacía prever una incidencia de restenosis aún mayor. Afrontar este problema era el objetivo prioritario, lo que dio lugar a la siguiente revolución de la cardiología intervencionista con la llegada del siglo XXI.
DESAFIANDO LA RESTENOSIS EN EL SIGLO XXI: LA ERA DEL STENT FARMACOACTIVO
Una vez que el stent se generalizó, la restenosis y la trombosis fueron las complicaciones que había que comprender y tratar. Inicialmente se idearon los recubrimientos heparínicos para los stents en aras de evitar ambos procesos; mientras que parecían tener un efecto protector sobre la trombosis, su efecto sobre la restenosis era dudoso. El stent coronario supuso un avance claro para la angioplastia, pero la reacción vascular que producía llevaba a procesos inflamatorios sostenidos con crecimiento de tejido y pérdida luminal tardía28. Tras comprender que la restenosis ocurría principalmente por un mecanismo proliferativo de las células del músculo liso vascular29, los esfuerzos se centraron entonces en frenar ese proceso. La braquiterapia (administración transcatéter de radiación ionizante sobre la lesión) surgió precisamente para frenar esta respuesta proliferativa. Sin embargo, la dificultad de aplicación de esta terapia, junto con la aparición de trombosis muy tardía, en probable relación con la inhibición de la endotelización y la restenosis en los bordes del segmento radiado, frenaron su éxito30. Con todo esto, la atención se fue centrando en el desarrollo de fármacos antiproliferativos.
El sirolimus (rapamicina) es un agente antimicótico que se aisló por primera vez en 1965 en una bacteria hallada en Isla de Pascua (Chile)31. Es un inhibidor de la proteína mTOR (mammalian Target Of Rapamycin) con efecto antiproliferativo e inmunosupresor que había sido empleado en terapia oncológica y como tratamiento después del trasplante de órganos. Esta molécula fue seleccionada por el equipo investigador de Cordis para crear el primer stent farmacoactivo, el Cypher. El sirolimus se introdujo en un transportador (polímero) que recubría la superficie metálica del stent y permitía su liberación modulada al endotelio. Por otro lado, el paclitaxel, un antimitótico proveniente de la corteza del tejo, fue aislado por primera vez en 196732. Tiene un efecto citotóxico bloqueando el desensamblaje de los microtúbulos, interfiriendo en el ciclo celular y la mitosis. La compañía Boston Scientific lo seleccionó para crear la primera generación del stent Taxus, también con el fármaco embebido en un polímero transportador. Paralelamente, el paclitaxel se estaba empleando en el desarrollo de un balón liberador de fármaco por el grupo de Bruno Scheller y Ulrich Speck en Alemania, también con el objetivo de solucionar el problema de la restenosis33.
El primer implante de un stent farmacoactivo fue de un Cypher y tuvo lugar en diciembre de 1999 en Sao Paulo, Brasil. En el equipo se encontraban Eduardo Sousa y Patrick Serruys. La experiencia con los primeros 30 pacientes y su seguimiento al año, sin ningún caso de restenosis, marcó el inicio de una nueva era34. A esto le siguió el ensayo clínico RAVEL, en el que se aleatorizaron 238 pacientes para recibir Bx Velocity o Cypher. A los 6 meses, la pérdida luminal fue de 0,80 ± 0,53 mm con Bx Velocity y de –0,01 ± 0,33 mm con Cypher (p < 0,001), mientras que la restenosis binaria fue del 26,6% y del 0%, respectivamente (p < 0,001)35. Por otro lado, el estudio TAXUS II aleatorizó a 536 pacientes para recibir NIR o Taxus en dos formas distintas de liberación del paclitaxel (lenta o intermedia). A los 6 meses, la pérdida luminal por ultrasonografía intravascular fue > 20% con NIR y < 8% con Taxus. La restenosis se redujo del 19% al 2,3% con el Taxus de liberación lenta y al 4,7% con el de liberación intermedia (p < 0,001), y al cabo de 1 año los eventos se redujeron a la mitad, similar a lo observado en el estudio RAVEL36.
Pasados unos años de expansión del uso de los stents farmacoactivos, surgieron algunos datos que moderaron la euforia inicial. Comenzaron a reportarse fenómenos de trombosis tardías (más allá del primer mes) y ello hizo saltar las alarmas37. Los fármacos antiproliferativos producían una endotelización retardada y se reportaron algunos casos de reacción inflamatoria local, presumiblemente por el polímero38. Se asumía que esto podía explicar los casos de trombosis tardía observados. Más adelante, los estudios de patología demostraron el desarrollo de neoateroesclerosis de manera más frecuente y temprana con los stents farmacoactivos en comparación con los convencionales sin fármaco39. Los metanálisis comprobaron que el aumento del riesgo de trombosis era globalmente muy leve y sin diferencias en mortalidad, mientras que se confirmaba la sorprendente efectividad de los nuevos stents40.
Tras el éxito de la primera generación de Cypher y Taxus, fueron apareciendo nuevos stents mejorados en cuanto al fármaco empleado, el polímero y la plataforma metálica41 (tabla 3). Además, las mejoras en los sistemas de liberación permitieron alcanzar lesiones más complejas. La plataforma de acero inoxidable fue dando paso a aleaciones de cromo-cobalto y cromo-platino, que permitieron adelgazar el strut, minimizando el daño vascular y mejorando la navegación sin perder fuerza radial. La geometría de celda abierta con menos conectores se generalizó, con pequeñas variaciones entre marcas. Las compañías apostaron por análogos del sirolimus y emplearon nuevos polímeros más biocompatibles y de menor espesor en la superficie del strut. Se llevaron a cabo numerosos ensayos clínicos aleatorizados de comparación directa entre los stents farmacoactivos de segunda generación, los de primera generación y los metálicos convencionales42. Mientras que la superioridad de los stents farmacoactivos sobre los convencionales era poco discutible en la mayoría de los escenarios, las supuestas ventajas de las nuevas generaciones eran más difíciles de demostrar. A partir de 2008 se realizaron numerosos estudios de evaluación de la respuesta vascular a los distintos stents mediante tomografía de coherencia óptica. Esto también fue reproducido en estudios de anatomía patológica, que además mostraron mayor respuesta inflamatoria y acúmulo de fibrina con los stents de primera generación43. Hubo una renovación generacional: mientras Cypher y Taxus se fueron retirando, Xience (Abbott Vascular, Estados Unidos), por sus resultados más favorables, pasó a ser el stent de referencia (best-in-class) para las comparaciones posteriores.
Tabla 3. Stents farmacoactivos de primera y segunda generación (polímero y struts finos)
| Nombre | Compañía | Plataforma | Metal | Grosor del strut | Fármaco | Grosor del polímero |
|---|---|---|---|---|---|---|
| Cypher | Cordis (J&J) | Bx Velocity | Acero inoxidable | 140 μm | Sirolimus | 12,6 μm |
| Taxus Express | Boston Scientific | Express | Acero inoxidable | 132 μm | Paclitaxel | 16 μm |
| Taxus Liberté | Boston Scientific | Veriflex | Acero inoxidable | 97 μm | Paclitaxel | 16 μm |
| Endeavor | Medtronic | Driver | Cromo-cobalto | 91 μm | Zotarolimus | 4,1 μm |
| Resolute Onyx | Medtronic | Integrity | Níquel-cromo + platino-iridio | 81-91 μm | Zotarolimus | 4,1 μm |
| Xience V/Promus | Abbott/Boston Scientific | Multi-link | Cromo-cobalto | 81 μm | Everolimus | 7,6 μm |
| Promus Element | Boston Scientific | Omega | Cromo-platino | 81 μm | Everolimus | 6,0 μm |
ÚLTIMOS AVANCES Y STENT BIOABSORBIBLE
El stent farmacoactivo (1999) fue una de las grandes revoluciones en la cardiología intervencionista tras la del balón de angioplastia (1977) y la del stent convencional (1986). A partir de la segunda generación, el stent farmacoactivo se consolida como estándar por su seguridad y efectividad. Las siguientes generaciones de stents incorporan polímeros biodegradables, prescinden del polímero o cuentan con recubrimientos especiales para favorecer la endotelización y la biocompatibilidad (tabla 4). Además, se logró adelgazar aún más el strut. Los avances en el tipo de recubrimiento del stent no han logrado demostrar un beneficio de forma consistente44. Sin embargo, algunos datos indican que la evolución hacia el strut ultrafino sí puede suponer una ventaja en términos de menor incidencia de revascularizaciones repetidas en la lesión diana a largo plazo44,45. Hoy en día, los stents farmacoactivos disponibles en el mercado navegan muy satisfactoriamente y son muy efectivos. Las diferencias entre los distintos modelos son sutiles y las supuestas ventajas resultan difíciles de demostrar. La generalización de los estudios de comparación directa con diseño de no inferioridad reflejan esta especie de estancamiento en el progreso46. Pese a ello, el desarrollo tecnológico continúa en busca de mejoras41.
Tabla 4. Stents farmacoactivos con polímero biodegradable o sin polímero
| Nombre | Compañía | Metal | Grosor del strut | Polímero | Fármaco |
|---|---|---|---|---|---|
| Biomatrix Flex | Biosensors | Acero inoxidable | 112 μm | Sí | Biolimus A9 |
| Biomatrix Alfa | Biosensors | Cromo-cobalto | 84-88 μm | Sí | Biolimus A9 |
| Nobori | Terumo | Acero inoxidable | 112 μm | Sí | Biolimus A9 |
| Ultimaster | Terumo | Cromo-cobalto | 80 μm | Sí | Sirolimus |
| Synergy | Boston Scientific | Cromo-platino | 74-81 μm | Sí | Everolimus |
| Orsiro | Biotronik | Cromo-cobalto | 60-80 μm | Sí | Sirolimus |
| Biomime | Meril | Cromo-cobalto | 65 μm | Sí | Sirolimus |
| Supraflex Cruz | SMT | Cromo-cobalto | 60 μm | Sí | Sirolimus |
| Coroflex ISAR Neo | Braun | Cromo-cobalto | 55-65 μm | No | Sirolimus + probucol |
| Biofreedom | Biosensors | Acero inoxidable | 112 μm | No | Biolimus A9 |
| Biofreedom Ultra | Biosensors | Cromo-cobalto | 84-88 μm | No | Biolimus A9 |
| Cre8 | Alvimedica | Cromo-cobalto | 70-80 μm | No | Sirolimus + ácido graso |
Mención aparte merece la idea del stent reabsorbible, que podría evitar los inconvenientes de dejar una malla metálica permanente en una arteria coronaria. En los años 1990, el ingeniero japonés Keiji Igaki y el intervencionista Hideo Tamai idearon una plataforma compuesta de polímero de ácido poliláctico con strut de 170 μm y sin fármaco, que debía calentarse para expandirse en el implante (se hacía con contraste calentado a 80 °C). Teóricamente, el polímero comenzaría a degradarse al cabo de 6 meses y duraría hasta 2 años, perdiendo su fuerza radial de manera progresiva. El primer stent reabsorbible de la historia (stent Igaki-Tamai, Kyoto Medical) lo implantó Hideo Tamai en 1998, en Japón. Se publicaron los resultados de los primeros 15 pacientes tratados, con un seguimiento de 6 meses, que mostraron una incidencia de restenosis del 10,5% por lesión tratada47. Sin embargo, el seguimiento de 50 pacientes a 10 años reveló una incidencia de revascularización por vaso del 28% y de trombosis del 2,4%48.
En 2006, John Ormiston implantó el primer stent bioabsorbible farmacoactivo, el Absorb Bioresorbable Vascular Scaffold (Abbott Vascular, Estados Unidos), con everolimus embebido en una matriz polimérica de ácido poliláctico con strut de 150 μm1. Tras datos favorables en los estudios piloto se inició el estudio ABSORB II, que aleatorizó a 501 pacientes para recibir Absorb BVS o Xience, con el objetivo de superioridad en cuanto a respuesta vasomotora del segmento tratado (teórica ventaja de una plataforma reabsorbible) y de no inferioridad en términos de pérdida luminal tardía. Lamentablemente, el análisis a 3 años, presentado en 2016, mostró la no consecución de ambos objetivos, con el añadido de un aumento de los casos de trombosis subaguda (2,8 frente a 0%; p = 0,03) y de infarto del vaso diana (7,1 frente a 1,2%; p = 0,006)49. A esto siguieron los resultados desfavorables a largo plazo de otros ensayos clínicos aleatorizados y metanálisis50, que llevaron a Abbott a retirar su dispositivo del mercado.
El primer stent farmacoactivo bioabsorbible había fallado en las comparaciones con el estándar de referencia Xience, que demostró su gran fiabilidad. No obstante, se habían aprendido algunas lecciones importantes para el futuro progreso51. Absorb era un dispositivo de strut grueso (150 μm frente a 81 μm de Xience) que condicionaba una navegabilidad más limitada, mayor compromiso de ramas laterales, peor endotelización y mayor trombogenicidad; se debía mejorar este aspecto para resultar más competitivo. Por otro lado, la fuerza radial de Absorb era limitada frente a la de los stents metálicos, lo cual hacía fundamental una técnica de implante óptima mediante la correcta preparación de la placa, la medición fina del vaso empleando imagen intracoronaria y la posdilatación a alta presión52. La realización de estudios poscomercialización pragmáticos hizo evidentes estas carencias. Este proyecto encalló debido en parte a la temprana (tal vez prematura) expansión de un dispositivo de primera generación hacia escenarios de mayor complejidad anatómica, como lesiones largas, vaso pequeño, bifurcaciones e incluso oclusiones crónicas53, lo que sin duda contribuyó a mostrar sus desventajas frente al stent estándar de comparación del momento.
Otras compañías desarrollaron plataformas poliméricas reabsorbibles51, pero al no poder mejorar los aspectos limitantes del Absorb se frenó la carrera de experimentación clínica en espera de mejoras en la tecnología. Además, las guías de práctica clínica desaconsejaron su uso fuera de protocolos de investigación54. Por otra parte, el stent bioabsorbible de magnesio liberador de sirolimus DREAMS (Biotronik AG, Suiza) parece tener una mejor perspectiva, con una nueva generación en la que se ha logrado disminuir el grosor radial del strut e incrementar su fuerza radial modificando la composición. Los datos del primer estudio en humanos, en el ensayo BIOMAG-I, son también prometedores55, pero habrá que esperar pacientemente a disponer de más datos de seguridad antes de poder emplearlo fuera de protocolo. La combinación del desarrollo tecnológico y la puesta en práctica de las lecciones aprendidas con Absorb traerán con seguridad nuevas oportunidades para poder contar con esta tecnología en nuestros laboratorios de intervencionismo51.
CONCLUSIONES Y PERSPECTIVAS FUTURAS
La invención del stent ha supuesto uno de los mayores avances en la historia de la cardiología y de la medicina en general. Este artículo relata el éxito de la colaboración entre genios innovadores e industria biomédica que invirtió lo necesario para el desarrollo de una terapia requerida por la población (figura 9). Esta hazaña trajo además importantes aprendizajes para la investigación en cardiología intervencionista. La necesidad de evaluar la seguridad y la efectividad de los sucesivos avances hizo madurar rápidamente la metodología de investigación y se crearon grandes redes de colaboración. La coordinación de los protocolos, la recogida y la auditoría de datos, y su análisis posterior, pudieron llevarse a cabo gracias al duro trabajo de investigadores dedicados y a la importante financiación por parte de las compañías y de las instituciones académicas. Como resultado, la cardiología intervencionista dispone hoy de una valiosa sistemática de trabajo y de la infraestructura necesaria para seguir innovando.
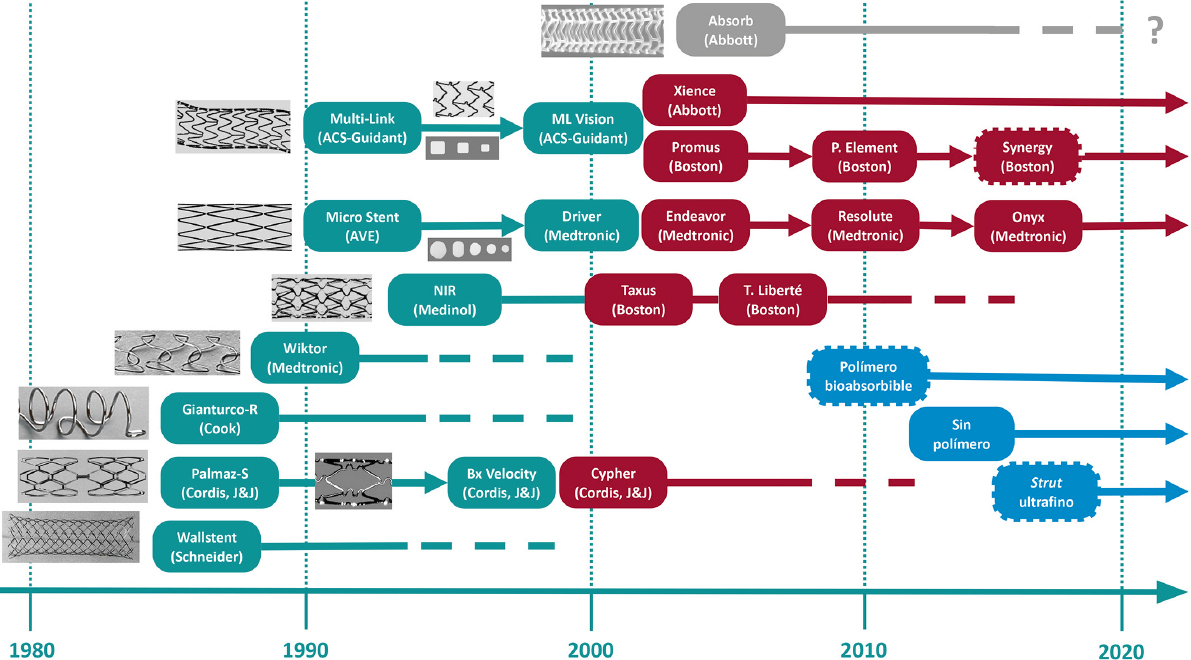
Figura 9. Stents coronarios que han marcado los hitos más importantes en la historia y su evolución en la línea del tiempo. En verde se señalan los stents metálicos convencionales; en rojo, los farmacoactivos; en gris, el polimérico bioabsorbible; y en azul, los nuevos stents farmacoactivos. El borde discontinuo indica polímero reabsorbible. ACS: Advanced Cardiovascular Systems; AVE: Arterial Vascular Engineering; J&J: Johnson & Johnson.
La práctica de la angioplastia es muy segura y efectiva, en gran parte gracias a los modernos stents que cuentan con todas las mejoras incorporadas durante su historia. En la actualidad, la incidencia de trombosis del stent es menor del 1% en las fases aguda, tardía y muy tardía56. Incluso, gracias a la seguridad de los dispositivos y las mejoras en la técnica, se está logrando acortar el tratamiento antitrombótico potente al mínimo41. La incidencia de restenosis del stent con necesidad de revascularización se presenta con una frecuencia anual del 1-2% tras el implante57. Aunque estas cifras son muy bajas, dado que se implantan millones de stents anualmente en el mundo, puede considerarse un problema de salud relevante desde el punto de vista epidemiológico. Sigue habiendo problemas que requieren la atención de la investigación: los pacientes con propensión a la restenosis recurrente, las lesiones calcificadas que impiden resultados óptimos, y el efecto deletéreo de los fármacos antiproliferativos sobre la función endotelial con el consecuente desarrollo de neoateroesclerosis41. Todo ello ofrece oportunidades para la innovación en la industria del stent. Además, la perspectiva de poder realizar angioplastias efectivas sin dejar un dispositivo permanente sigue abierta con la línea del stent bioabsorbible, aunque también con la posible expansión del uso del balón recubierto de fármaco a distintos escenarios clínico-anatómicos en los que el stent permanente pudiera presentar inconvenientes58.
FINANCIACIÓN
Los autores declaran la ausencia de fuentes de financiación para la elaboración de este artículo.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se ha empleado inteligencia artificial en este trabajo.
CONTRIBUCIÓN DE LOS AUTORES
F. Macaya-Ten: concepción y diseño, y redacción de la primera versión del manuscrito. N. Gonzalo: revisión crítica del manuscrito. J. Escaned: revisión crítica del manuscrito. C. Macaya: concepción y diseño, y revisión crítica del manuscrito.
CONFLICTO DE INTERESES
Se declara la ausencia de conflictos de intereses en relación con este trabajo.
AGRADECIMIENTOS
Los autores agradecen el apoyo con material visual y documentación bibliográfica proporcionado por diversas compañías citadas en este artículo.
BIBLIOGRAFÍA
1. Gaspard P, Whitin H. The History of Coronary Angioplasty. Toulouse:Europa Digital &Publishing/Europa Group;2017.
2. Gruentzig A, Myler R, Hanna E, Turina M. Coronary transluminal angioplasty (abstract). Circulation. 1977;56:84.
3. Gruentzig A. Results from coronary angioplasty and implications for the future. Am Heart J. 1982;103:779-783.
4. Gruentzig AR, King SB, Schlumpf M, Siegenthaler W. Long-term follow-up after percutaneous transluminal coronary angioplasty. The early Zurich experience. N Engl J Med.1987;316:1127-1132.
5. Navarro FA. Stent. Rev Esp Cardiol. 2018;71:694.
6. Roguin A. Stent:The Man and Word Behind the Coronary Metal Prosthesis. Circ Cardiovasc Interv.2011;4:206-209.
7. Dotter CT. Transluminally-placed coilspring endarterial tube grafts. Long-term patency in canine popliteal artery. Invest Radiol. 1969;4:329-332.
8. Sigwart U, Urban P, Golf S, et al. Emergency stenting for acute occlusion after coronary balloon angioplasty. Circulation. 1988;78:1121-1127.
9. Sigwart U, Puel J, Mirkovitch V, Joffre F, Kappenberger L. Intravascular stents to prevent occlusion and restenosis after transluminal angioplasty. N Engl J Med. 1987;316:701-706.
10. Sigwart U. What is a stent and where can you get one?Am J Cardiol. 1997;80:1122.
11. Serruys PW, Strauss BH, Beatt KJ, et al. Angiographic follow-up after placement of a self-expanding coronary-artery stent. N Engl J Med.1991;324:13-17.
12. Tan C, Schatz RA. The History of Coronary Stenting. Interv Cardiol Clin. 2016;5:271-280.
13. Palmaz JC, Sibbitt RR, Reuter SR, Tio FO, Rice WJ. Expandable intraluminal graft:a preliminary study. Work in progress. Radiology. 1985;156:73-77.
14. Fischman DL, Leon MB, Baim DS, et al. A randomized comparison of coronary-stent placement and balloon angioplasty in the treatment of coronary artery disease. Stent Restenosis Study Investigators. N Engl J Med. 1994;331:496-501.
15. Serruys PW, de Jaegere P, Kiemeneij F, et al. A comparison of balloon-expandable-stent implantation with balloon angioplasty in patients with coronary artery disease. Benestent Study Group. N Engl J Med. 1994;331:489-495.
16. Macaya C, Serruys PW, Ruygrok P, et al. Continued benefit of coronary stenting versus balloon angioplasty:one-year clinical follow-up of Benestent trial. Benestent Study Group. J Am Coll Cardiol. 1996;27:255-261.
17. George CJ, Baim DS, Brinker JA, et al. One-year follow-up of the Stent Restenosis (STRESS I) Study. Am J Cardiol. 1998;81:860-865.
18. Lansky AJ, Roubin GS, O'Shaughnessy CD, et al. Randomized comparison of GR-II stent and Palmaz-Schatz stent for elective treatment of coronary stenoses. Circulation. 2000;102:1364-1368.
19. Sirnes PA, Golf S, Myreng Y, et al. Stenting in Chronic Coronary Occlusion (SICCO):a randomized, controlled trial of adding stent implantation after successful angioplasty. J Am Coll Cardiol. 1996;28:1444-1451.
20. Versaci F, Gaspardone A, Tomai F, Crea F, Chiariello L, GioffrèPA. A comparison of coronary-artery stenting with angioplasty for isolated stenosis of the proximal left anterior descending coronary artery. N Engl J Med.1997;336:817-822.
21. Serruys PW, de Bruyne B, Carlier S, et al. Randomized comparison of primary stenting and provisional balloon angioplasty guided by flow velocity measurement. Doppler Endpoints Balloon Angioplasty Trial Europe (DEBATE) II Study Group. Circulation. 2000;102:2930-2937.
22. Grines CL, Cox DA, Stone GW, et al. Coronary angioplasty with or without stent implantation for acute myocardial infarction. Stent Primary Angioplasty in Myocardial Infarction Study Group. N Engl J Med. 1999;341:1949-1956.
23. Colombo A, Hall P, Thomas J, Almagor Y, Finci L. Initial experience with the disarticulated (one-half) Palmaz-Schatz stent:a technical report. Cathet Cardiovasc Diagn. 1992;25:304-308.
24. Serruys PW, Rensing BJ. Handbook of Coronary Stents, Fourth Edition. Kentucky, USA:Taylor &Francis;2002.
25. Pache J, Kastrati A, Mehilli J, et al. Intracoronary stenting and angiographic results:strut thickness effect on restenosis outcome (ISAR-STEREO-2) trial. J Am Coll Cardiol. 2003;41:1283-1288.
26. Colombo A, Stankovic G, Moses JW. Selection of coronary stents. J Am Coll Cardiol. 2002;40:1021-1033.
27. Serruys PW, Unger F, Sousa JE, et al. Comparison of coronary-artery bypass surgery and stenting for the treatment of multivessel disease. N Engl J Med.2001;344:1117-1124.
28. Gaspardone A, Versaci F. Coronary stenting and inflammation. Am J Cardiol. 2005;96:65L-70L.
29. Kearney M, Pieczek A, Haley L, et al. Histopathology of in-stent restenosis in patients with peripheral artery disease. Circulation. 1997;95:1998-2002.
30. SabatéM, Pimentel G, Prieto C, et al. Intracoronary brachytherapy after stenting de novo lesions in diabetic patients:results of a randomized intravascular ultrasound study. J Am Coll Cardiol. 2004;44:520-527.
31. Hobby G, Clark R, Woywodt A. A treasure from a barren island:the discovery of rapamycin. Clin Kidney J. 2022;15:1971-1972.
32. Weaver BA. How Taxol/paclitaxel kills cancer cells. Mol Biol Cell. 2014;25:2677-2681.
33. Scheller B, Speck U, Abramjuk C, Bernhardt U, Böhm M, Nickenig G. Paclitaxel balloon coating, a novel method for prevention and therapy of restenosis. Circulation. 2004;11:810-814.
34. Sousa JE, Costa MA, Abizaid AC, et al. Sustained suppression of neointimal proliferation by sirolimus-eluting stents:one-year angiographic and intravascular ultrasound follow-up. Circulation. 2001;104:2007-2011.
35. Morice MC, Serruys PW, Sousa JE, et al. A randomized comparison of a sirolimus-eluting stent with a standard stent for coronary revascularization. N Engl J Med. 2002;346:1773-1780.
36. Colombo A, Drzewiecki J, Banning A, et al. Randomized study to assess the effectiveness of slow- and moderate-release polymer-based paclitaxel-eluting stents for coronary artery lesions. Circulation. 2003;108:788-794.
37. Pfisterer M, Brunner-La Rocca HP, Buser PT, et al. Late clinical events after clopidogrel discontinuation may limit the benefit of drug-eluting stents:an observational study of drug-eluting versus bare-metal stents. J Am Coll Cardiol. 2006;48:2584-2591.
38. Joner M, Finn AV, Farb A, et al. Pathology of drug-eluting stents in humans:delayed healing and late thrombotic risk. J Am Coll Cardiol.2006;48:193-202.
39. Otsuka F, Byrne RA, Yahagi K, et al. Neoatherosclerosis:overview of histopathologic findings and implications for intravascular imaging assessment. Eur Heart J. 2015;36:2147-2159.
40. Stone GW, Moses JW, Ellis SG, et al. Safety and efficacy of sirolimus- and paclitaxel-eluting coronary stents. N Engl J Med. 2007;356:998-1008.
41. Torii S, Jinnouchi H, Sakamoto A, et al. Drug-eluting coronary stents:insights from preclinical and pathology studies. Nat Rev Cardiol. 2020;17:37-51.
42. Garg S, Serruys PW. Coronary Stents:Current Status. J Am Coll Cardiol. 2010;56:S1-S42.
43. Otsuka F, Vorpahl M, Nakano M, et al. Pathology of second-generation everolimus-eluting stents versus first-generation sirolimus- and paclitaxel-eluting stents in humans. Circulation.2014;129:211-223.
44. Taglieri N, Bruno AG, Ghetti G, et al. Target Lesion Failure With Current Drug-Eluting Stents:Evidence From a Comprehensive Network Meta-Analysis. JACC Cardiovasc Interv. 2020;13:2868-2878.
45. Madhavan MV, Howard JP, Naqvi A, et al. Long-term follow-up after ultrathin vs. 2nd-generation drug-eluting stents:a systematic review and meta-analysis of randomized controlled trials. Eur Heart J. 2021;42:2643-2654.
46. Macaya F, Ryan N, Salinas P, Pocock SJ. Challenges in the Design and Interpretation of Noninferiority Trials. J Am Coll Cardiol. 2017;70:894-903.
47. Tamai H, Igaki K, Kyo E, et al. Initial and 6-month results of biodegradable poly-l-lactic acid coronary stents in humans. Circulation. 2000;102:399-404.
48. Nishio S, Kosuga K, Igaki K, et al. Long-term (>10 years) clinical outcomes of first-in-human biodegradable poly-l-lactic acid coronary stents:Igaki-Tamai stents. Circulation. 2012;125:2343-2353.
49. Serruys PW, Chevalier B, Sotomi Y, et al. Comparison of an everolimus-eluting bioresorbable scaffold with an everolimus-eluting metallic stent for the treatment of coronary artery stenosis (ABSORB II):a 3 year, randomised, controlled, single-blind, multicentre clinical trial. Lancet. 2016;388:2479-2491.
50. Ali ZA, Serruys PW, Kimura T, et al. 2-year outcomes with the Absorb bioresorbable scaffold for treatment of coronary artery disease:a systematic review and meta-analysis of seven randomised trials with an individual patient data substudy. Lancet. 2017;390:760-772.
51. Katagiri Y, Serruys PW, Asano T, et al. How does the failure of Absorb apply to the other bioresorbable scaffolds?An expert review of first-in-man and pivotal trials. EuroIntervention J. 2019;15:116-123.
52. Stone GW, Abizaid A, Onuma Y, et al. Effect of Technique on Outcomes Following Bioresorbable Vascular Scaffold Implantation:Analysis From the ABSORB Trials. J Am Coll Cardiol. 2017;70:2863-2874.
53. Smits PC, Chang CC, Chevalier B, et al. Bioresorbable vascular scaffold versus metallic drug-eluting stent in patients at high risk of restenosis:the COMPARE-ABSORB randomised clinical trial. EuroIntervention. 2020;16:645-653.
54. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
55. Haude M, Wlodarczak A, van der Schaaf RJ, et al. Safety and performance of the third-generation drug-eluting resorbable coronary magnesium scaffold system in the treatment of subjects with de novo coronary artery lesions:6-month results of the prospective, multicenter BIOMAG-I first-in-human study. EClinicalMedicine. 2023;59:101940.
56. Gori T, Polimeni A, Indolfi C, Räber L, Adriaenssens T, Münzel T. Predictors of stent thrombosis and their implications for clinical practice. Nat Rev Cardiol. 2019;16:243-256.
57. Giustino G, Colombo A, Camaj A, et al. Coronary In-Stent Restenosis:JACC State-of-the-Art Review. J Am Coll Cardiol. 2022;80:348-372.
58. Jeger RV, Eccleshall S, Wan AWA, et al. Drug-Coated Balloons for Coronary Artery Disease. JACC Cardiovasc Interv. 2020;13:1391-1402.