RESUMEN
La insuficiencia tricuspídea se asocia de manera independiente con un aumento de la mortalidad. Investigaciones recientes demuestran que la cirugía aislada de la válvula tricúspide presenta la mortalidad quirúrgica más alta dentro de los procedimientos valvulares. Las terapias percutáneas han surgido como una alternativa a la cirugía en pacientes seleccionados de alto riesgo quirúrgico. El dispositivo MitraClip en posición tricuspídea ha sido el más empleado. El propósito de este artículo es revisar los diferentes dispositivos transcatéter para el tratamiento de la insuficiencia tricuspídea, con especial énfasis en el MitraClip. Se describirán las vistas básicas de la exploración por imagen y el procedimiento paso a paso para la inserción del clip. Este documento pretende ser una guía para la sistematización de la evaluación de la válvula tricúspide y los pasos del implante del dispositivo para asegurar el éxito del procedimiento.
Palabras clave: Insuficiencia tricuspídea. Ecocardiograma transesofágico. Reparación tricuspídea transcatéter.
ABSTRACT
Severe tricuspid regurgitation is independently associated with an increased mortality. Recent studies show that surgery for isolated tricuspid valve (TV) is still associated with the highest surgical risk of all valve procedures. Percutaneous treatments for the management of tricuspid regurgitation have become an alternative to surgery in select patients of high surgical risk. To this day, the most widely used device is MitraClip in the tricuspid position. We reviewed the different devices used today for transcatheter treatments paying special attention to MitraClip. We describe the basic standpoints on transesophageal echocardiography screening and step-by-step procedure for the implantation of the clip. This document stands as a guide to systematize tricuspid valve assessments and the steps involved in device implantation to achieve successful procedures.
Keywords: Tricuspid regurgitatio. Transesophageal echocardiography. Transcatheter tricuspid valve repair.
INTRODUCCIÓN
Pese a que clásicamente la valvulopatía tricuspídea se ha considerado como de menor gravedad que la patología valvular izquierda, se considera que casi 2 millones de pacientes en los Estados Unidos presentan insuficiencia tricuspídea (IT) de grado al menos moderado. Sin embargo, menos de 10.000 se someten a cirugía cada año. La IT funcional representa más del 90% de los casos de IT y se debe típicamente a la dilatación anular de la válvula tricúspide (VT) (principalmente en el diámetro anteroposterior) y a la dilatación del ventrículo derecho (VD) secundaria a la enfermedad cardiaca izquierda progresiva1. La VT se ha considerado durante años como la «válvula olvidada». Este problema puede explicarse por el hecho de que se creía que la IT era bien tolerada y que disminuía después de tratar la enfermedad valvular izquierda. Sin embargo, los pacientes con IT significativa e insuficiencia cardiaca tienden a estar muy sintomáticos2. La presencia de IT moderada o grave se asocia con un aumento de la mortalidad independientemente de otras variables, como la fracción de eyección o las presiones pulmonares, y la tasa de mortalidad es mayor del 25% anual3-5.
Los datos actuales apoyan que la reparación de la VT en el momento de la cirugía de las cavidades izquierdas es segura, mientras que la reintervención por IT persistente se relaciona con unas altas tasas de morbilidad y mortalidad6. Publicaciones recientes demuestran que la cirugía de la VT aislada sigue siendo la cirugía valvular que se asocia con mayor riesgo quirúrgico, con una tasa de mortalidad entre el 8,8 y el 9,7%7. Así, las terapias percutáneas para el tratamiento de la IT surgen como una alternativa a la cirugía convencional para aquellos pacientes en quienes hasta ahora solo era posible realizar tratamiento médico conservador por presentar alto riesgo quirúrgico.
Teniendo en cuenta el objetivo anatómico de la reparación, los dispositivos pueden dividirse en dispositivos de coaptación, de anuloplastia y de remplazo valvular (sea en posición ortotópico o heterotópica). La técnica más utilizada es la reparación borde a borde con dispositivo MitraClip (Abbott Vascular, Santa Clara, EE.UU.) en posición tricuspídea. En el registro TriValve8 se han incluido más de 650 procedimientos con el dispositivo MitraClip (el 66% de todos los procedimientos percutáneos realizados sobre la VT). El propósito de este artículo es doble: primero, proponer un protocolo para la evaluación ecocardiográfica de la VT en pacientes con IT con vistas a decidir la idoneidad y la factibilidad de la realización de una reparación tricuspídea con este sistema, así como para guiar el procedimiento paso a paso; y segundo, realizar una breve descripción de otros dispositivos percutáneos transcatéter que pueden utilizarse hoy en día y que ya han alcanzado cierta relevancia clínica.
IMAGEN DE LA VÁLVULA TRICÚSPIDE PARA INTERVENCIONISMO
Todos los candidatos a intervenciones percutáneas tricuspídeas deben someterse inicialmente a un ecocardiograma transtorácico (ETT) y, si la válvula puede ser reparada borde a borde, se procederá a una evaluación más avanzada con un ecocardiograma transesofágico (ETE).
No se considerarían favorables por ETT aquellas VT en las que hay una clara interferencia con un cable de marcapasos o de desfibrilador implantable, perforación de los velos, restricción grave o engrosamiento significativo de estos. Los planos habituales para la evaluación de la VT mediante ETT son el paraesternal en el eje largo modificado de la VT, el eje corto, el plano apical de 4 cámaras modificado y el plano subcostal en el eje corto.
La evaluación mediante ETE es fundamental para decidir si un procedimiento con este dispositivo es factible. La anatomía debe ser adecuada, pero también debe haber una calidad de imagen suficiente para poder guiar el procedimiento; en ocasiones, variantes anatómicas o la presencia de material protésico intracardiaco pueden hacer inviable la intervención. Las guías actuales de ETE de la American Society of Echocardiography incluyen imágenes adicionales para la valoración de la VT9. Es importante rotar en múltiples planos y emplear el multiplano para identificar correctamente los velos, así como las estructuras adyacentes que sirven de referencia10.
EVALUACIÓN DE LA VÁLVULA TRICÚSPIDE A PARTIR DEL ECOCARDIOGRAMA TRANSESOFÁGICO
Las vistas esenciales para una evaluación detallada de la VT para las intervenciones transcatéter son las siguientes:
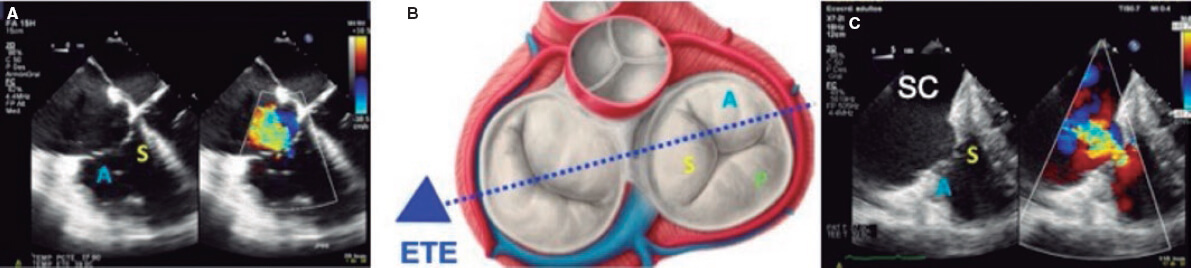
1. Vista medioesofágica de cuatro cámaras a 0°. Pueden observarse el velo septal (adyacente a la aorta) y el velo anterior (adyacente a la pared libre del VD) si la sonda está en anteflexión (figura 1), y el velo posterior si se hace retroflexión.
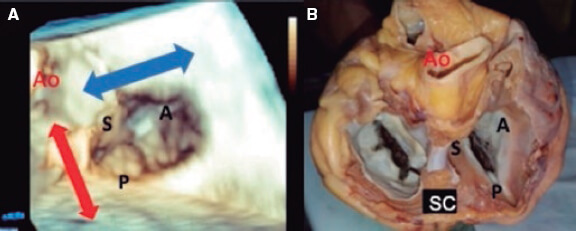
Figura 1. A: vista medioesofágica de 4 cámaras que permite la visualización del velo septal y del velo anterior. B: plano imaginario en la vista de 4 cámaras. C: vista transesofágica profunda. A: anterior; ETE: ecocardiograma transesofágico; S: septal; SC: seno coronario.
Para optimizar la imagen de las estructuras cardiacas derechas debe girarse la sonda en sentido horario. Los artefactos del septum y de prótesis aórticas o mitrales pueden dificultar la visualización del velo septal. El anillo tricuspídeo se mide en este plano con las valvas abiertas al final de la diástole.
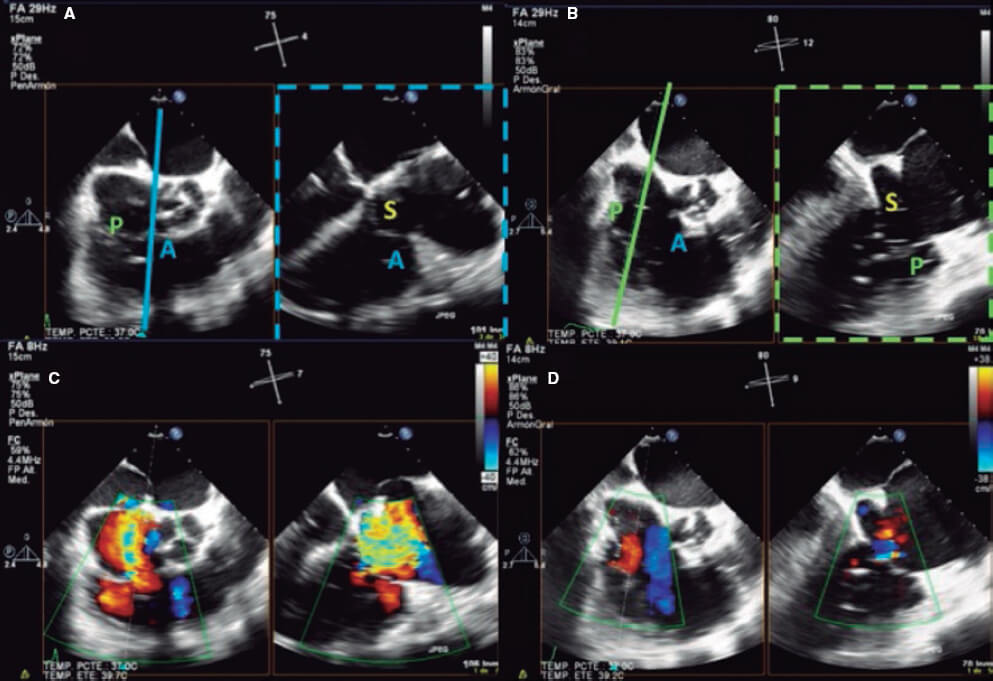
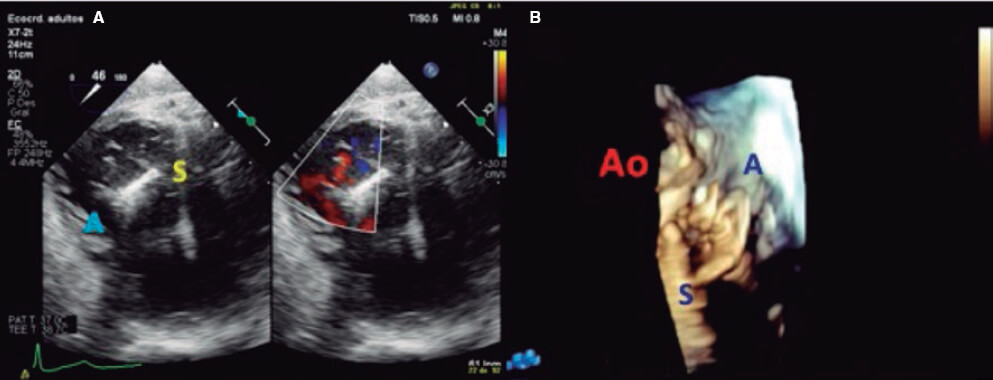
2. Vista medioesofágica de tracto de entrada y salida del VD (plano tricuspídeo intercomisural) entre 60° y 90°. Muestra la línea imaginaria desde la comisura anteroseptal (A-S) hasta la comisura posteroseptal (P-S). Se visualiza el velo anterior cerca de la aorta y el posterior en el lado lateral (vídeo 1 del material adicional). Este es el plano de referencia para obtener imágenes biplano para evaluar el velo septal. Si se coloca el cursor cerca de la aorta (herramienta X-plano), el plano ortogonal muestra la coaptación A-S y los velos anterior y septal. Alejando el cursor de la aorta hacia lateral, se obtiene el plano que muestra la coaptación P-S y los velos posterior y septal. Las mismas vistas deben adquirirse con Doppler color (figura 2) para visualizar si el origen del chorro de regurgitación es de predominio anterolateral o P-S.
Figura 2. Vista medioesofágica intercomisural. A: si el cursor se coloca cerca de la aorta, el plano ortogonal muestra la línea de coaptación anteroseptal. B: moviendo el cursor hacia la zona más lateral se obtiene el plano ortogonal que muestra la línea de coaptación posteroseptal. C y D: imagen biplana con color, para visualizar el origen del chorro de regurgitación. A: anterior; P: posterior; S: septal.
Además, estas vistas son útiles para medir la longitud de los velos, ver los defectos de coaptación, evaluar el movimiento de los velos y observar la presencia de cuerdas que puedan dificultar el procedimiento. Hay que tener en cuenta que la presencia de una restricción grave del movimiento del velo septal va a ser una de las limitaciones para la realización del procedimiento con el dispositivo actual.
3. Vista esofágica profunda de 4 cámaras en 0°. Debido a que el borde inferior derecho del corazón está cerca del diafragma, la inserción más profunda de la sonda de ETE la sitúa en el esófago distal, cerca de la unión gastroesofágica; es posible que en este plano solo se vean la aurícula derecha y el seno coronario, sin tener imágenes de la aurícula izquierda (figura 1), con lo que se evitan artefactos causados porlas estructuras del corazón izquierdo, como el material protésico mitral que puede generar sombra acústica sobre el velo septal. Esta vista es ideal para adquirir volúmenes tridimensionales (3D).
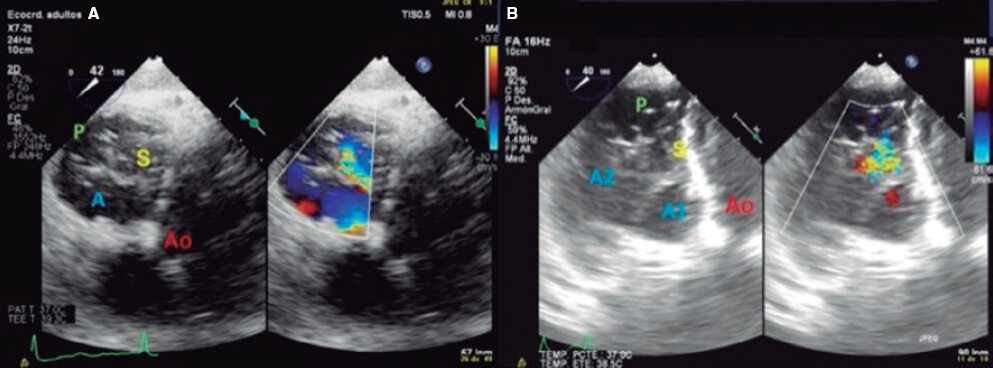
4. Vista transgástrica. Las vistas transgástricas se obtienen avanzando la sonda hacia el estómago. Si se parte del eje corto basal transgástrico y se rota la sonda entre 20° y 40°, realizando pequeños giros en sentido horario y con anteversión, se obtiene el plano óptimo en el que pueden visualizarse los 3 velos tricuspídeos (eje corto de la VT). Este es el único plano bidimensional (2D) que permite la visualización simultánea de las 3 valvas y comisuras, con el velo posterior en el campo cercano, el anterior en el campo lejano y el septal adyacente al tabique (figura 3 y vídeo 2 del material adicional). Deben optimizarse las imágenes para asegurarse de permanecer en la punta de los velos y en paralelo al plano valvular. Para ello, puede partirse de un plano transgástrico de 2 cámaras de VD en torno a 90-110°, y si se coloca mediante la herramienta X-plano el cursor en la punta de los velos se obtendrá el plano ortogonal, que será el eje corto de la VT. Este plano proporciona gran información sobre la VT:
Figura 3. Plano transgástrico. A: vista en el eje corto transgástrico de una válvula tricúspide con 3 cúspides. B: vista en el eje corto transgástrico de una variante anatómica con 2 festones en el velo anterior. A: anterior; A1: festón 1 del velo anterior; A2: festón 2 del velo anterior; Ao: aorta; P: posterior; S: septal.
- Número de velos: generalmente existen 3, pero es posible encontrar válvulas con varios festones e incluso con 4 cúspides hasta en un 40% de los pacientes11.
- Porción de la válvula que ocupa cada velo: resulta muy útil representar de forma gráfica qué parte de la circunferencia ocupa cada velo.
- Localización del origen del chorro de regurgitación: hay que aproximarse al extremo distal de los velos para una correcta visualización del defecto de coaptación en el eje corto.
El impacto de las imágenes 3D es menos claro en el intervencionismo sobre la VT que en la válvula mitral. Lang et al.12 sugieren una visualización de imágenes estandarizada para la vista frontal de la VT, colocando el velo septal en posición inferior (a las 6:00 h). Estas recomendaciones fueron establecidas al final de la pasada década, cuando no existían las intervenciones transcatéter y se intentaba replicar la vista quirúrgica. Actualmente se prefiere rotar 90° la imagen con la válvula aórtica a las 11:00 h. De esta manera mejorará la comprensión de la anatomía de la VT al crear un lenguaje común entre especialistas en imagen cardiaca e intervencionistas.
El análisis cuantitativo de los velos y del anillo se realiza mediante reconstrucciones multiplanares de planos 3D13. Colocando los planos ortogonales al anillo tricuspídeo en el punto de inserción de los velos se obtiene el eje corto de la VT, y tras un ajuste preciso pueden obtenerse las medidas de los diámetros a nivel del anillo, así como la del área (figura 1 del material adicional).
La nueva clasificación de la IT con los nuevos grados de gravedad masiva y torrencial puede ser de vital importancia tanto para clasificar adecuadamente a los pacientes como para evaluar el resultado final tras el intervencionismo14.
VISTAS ESENCIALES POR ECOCARDIOGRAMA TRANSESOFÁGICO PARA EL PROCEDIMIENTO DE REPARACIÓN TRICUSPÍDEA CON CLIP
Existen 4 vistas esenciales de ETE para guiar el implante del clip en la VT: de 4 cámaras, bicomisural, transgástrica y plano de grasping (captura de los velos tricuspídeos dentro del dispositivo). Las primeras ya han sido descritas; ahora se profundizará en la última.
Plano de grasping
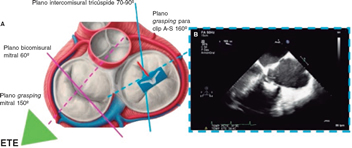
Este plano es aquel que muestre con más claridad los velos que deben tratarse y el clip con los brazos completamente abiertos. Encontrar el mejor plano de grasping para el implante de un clip en posición tricuspídea es uno de los pasos más complejos e importantes durante el procedimiento. La primera limitación para encontrarlo es que, al contrario de lo que sucede en la válvula mitral, no existen claras referencias anatómicas que permitan asegurar la perpendicularidad del clip respecto a los velos, por lo que la correcta alineación a nivel transgástrico es crítica. Tras encontrar esta alineación, se retira la sonda para buscar el plano de grasping a nivel medioesofágico.
La estrategia más común es posicionar un clip entre los velos A y S hacia la zona más central de la VT. Para obtener el plano de grasping en el cual visualizar los velos A y S se parte del plano intercomisural y mediante el multiplano se encuentra en general el plano de grasping en torno a 160° (figura 4). Otra opción es barrer con la sonda de ETE de 0° a 180° hasta encontrar una vista de plano de grasping directo en la que se vean claramente los velos y los brazos de clip abiertos. En todo caso, debe individualizarse en cada paciente ya que la VT presenta más variaciones anatómicas que la válvula mitral, y el ángulo entre el plano intercomisural y la línea de coaptación de los velos A y S puede ser menor de 90° y llevar a error las asunciones con el multiplano. La ETE 3D en tiempo real puede ser útil para la orientación del clip, aunque en menor medida que en el intervencionismo mitral.
Figura 4. Búsqueda del plano de grasping para clip en posición anteroseptal (A-S) respecto al centro de la válvula tricúspide. A: plano de grasping para clip A-S (línea azul discontinua). B: ecocardiograma transesofágico (ETE) a 160° que muestra el clip con los brazos abiertos y los velos anterior y septal reposando sobre ellos.
PROCEDIMIENTO PASO A PASO
El implante de MitraClip en posición tricuspídea se lleva a cabo en la mayoría de los casos por vía femoral y bajo anestesia general. Se realiza control con fluoroscopia y ETE; su combinación es esencial para lograr un resultado óptimo. A continuación se describe el procedimiento paso a paso con los datos clave que deben ser valorados por imagen:
1. El acceso percutáneo a la vena femoral derecha se obtiene con la técnica de Seldinger. A través de un introductor de 7 Fr se inserta una guía de alto soporte hasta la vena cava superior (VCS) y, después de la predilatación del acceso, el catéter guía (CG) se avanza hacia la aurícula derecha.
2. El CG se inserta de manera similar a como se hace en el procedimiento para la mitral, con el mando ± girado aproximadamente 180° en la dirección (−) y girando también el propio CG 180° en sentido antihorario para orientarse hacia la zona anterior. Una vez en la aurícula derecha, el dilatador y la guía se retiran mientras el catéter se aspira suavemente para evitar la embolia aérea. Asimismo, se libera el giro (−).
3. En este punto, el procedimiento puede realizarse de 2 maneras diferentes. En la primera se utiliza el mando (+) para aumentar la curva del CG y que apunte directamente a la VT. En este caso, el catéter del clip se inserta normalmente en el CG (línea azul con línea azul) y es el CG el que garantizará el posicionamiento correcto del dispositivo para realizar el grasping de los velos. En la segunda, que es la más utilizada, se realiza la inserción del catéter del clip de forma desalineada (90° en sentido antihorario o 180°; los autores de este artículo preferimos la desalineación de 180°). Esta técnica permitirá el straddling (acabalgamiento de marcas radioopacas del clip sobre la del CG) del catéter del clip sobre el CG (esto debe hacerse hacia la VCS para evitar daños en las estructuras circundantes). Después de alcanzar la posición de straddling, la rueda A o M (dependiendo de la anatomía del paciente) permitirá la desviación de la punta del clip hacia el punto deseado de la VT. Esta técnica permite un rango de movimiento más versátil con el dispositivo para superar los problemas con la orientación o con la distancia entre la punta del CG y la zona objetivo de la VT. En los próximos pasos se describirá la técnica con desalineación CG-catéter clip. Desde el punto de vista ecocardiográfico, la monitorización de estos pasos se realiza en plano bicava 90-110° con biplano, procurando en todo momento no dañar ninguna estructura anatómica.
4. Una vez alcanzada la posición de straddling se activa la rueda A o M (o una combinación de ambas) para desviar el clip hacia la VT. La rueda seleccionada dependerá de la trayectoria del clip. El objetivo es lograr la trayectoria más perpendicular posible a la VT, evitando la posición del catéter demasiado cerca del septo interauricular (septal hugging) tanto como sea posible (esta circunstancia hará que el clip apunte a la parte lateral de la VT). Para guiar el movimiento del clip se utiliza fluoroscopia en la proyección oblicua anterior izquierda a 45° para ver la punta del clip moviéndose hacia la izquierda de la pantalla (alejándose del tabique) y apuntando hacia el operador (figura 2 del material adicional). La monitorización ecocardiográfica pasará del plano bicava al plano intercomisural.
5. Cuando el clip se encuentra perpendicular sobre la VT, la rotación del CG en sentido horario moverá el clip hacia la posición septal y en sentido antihorario hacia la parte lateral. El avance del estabilizador aproximará el clip a la comisura A-S y, al retraerlo, el clip pasará a la comisura P-S. Esto permitirá un rango completo de movimientos para asegurar la ubicación correcta de los graspings (figura 5).
Figura 5. A: ecocardiograma transesofágico en modo zoom tridimensional, vista frontal durante el intervencionismo. El catéter guía puede moverse en la aurícula derecha hacia la válvula aórtica mediante el avance del sistema completo (flecha roja), o hacia el velo posterior mediante retracción del sistema; el movimiento hacia el septo (flecha azul) se consigue rotando el catéter guía en sentido horario, y hacia la pared libre del ventrículo derecho rotando en sentido antihorario. B: corazón explantado, vista anatómica. A: anterior; Ao: aorta; P: posterior; S: septal; SC: seno coronario.
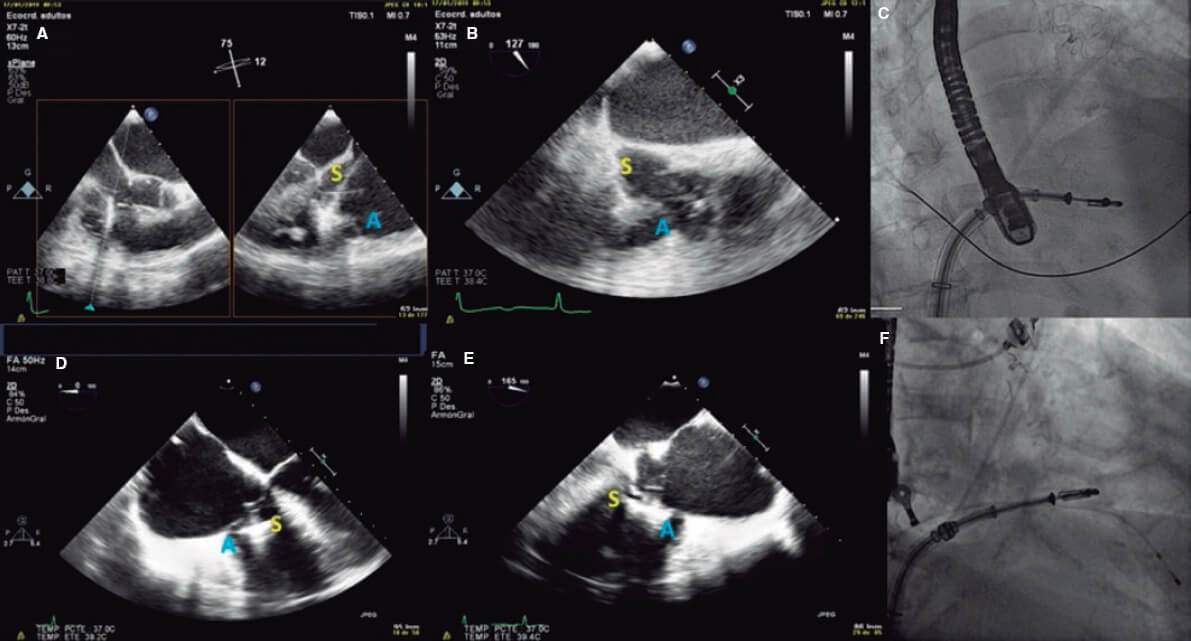
6. Cuando se consigue la posición deseada, el clip se abre y se evalúa la perpendicularidad. Esto debe hacerse mediante ETE 2D en el eje corto transgástrico o mediante zoom 3D en vista auricular. Hay que rotar con suavidad el clip para que sea completamente perpendicular al punto de grasping deseado (figura 1 y vídeo 3 del material adicional).
Figura 6. Con el clip sobre el anillo tricuspídeo debe emplearse el eje corto transgástrico (A) o zoom tridimensional (B) para orientar el clip. A: anterior; Ao: aorta; S: septal.
7. Posteriormente, el clip se cierra a 60° y se avanza lentamente hacia el VD justo debajo de los velos para evitar la interferencia con cuerdas o estructuras del VD. Es recomendable realizar esta maniobra con guía fluoroscópica en una proyección oblicua anterior derecha a 30° (eje largo del VD). Esta vista fluoroscópica confirmará que el clip describe una trayectoria recta y que se mantiene la perpendicularidad. El ajuste fino de la rotación del clip puede hacerse durante el avance al VD, pero idealmente no debajo de los velos (para evitar la interferencia con las cuerdas). Luego, el clip se abre lentamente a 120° y se retrae para asegurar la captura de los velos (figura 3 del material adicional y vídeo 4 del material adicional).
8. De nuevo ya en el VD, hay que comprobar la perpendicularidad del clip respecto a la línea de coaptación a tratar en el plano del eje corto transgástrico. A continuación se busca el plano de grasping, es decir, aquel que muestre con más claridad los velos que deben ser tratados y el clip con los brazos completamente abiertos. Es esencial tener una buena imagen ecográfica durante el grasping para asegurar la correcta inserción de los velos y la perpendicularidad de los brazos del clip. Se evitarán las capturas subóptimas repetidas de velos para no producirles un daño excesivo (los velos de la VT son más delgados y más frágiles que los de la válvula mitral) (figura 7).
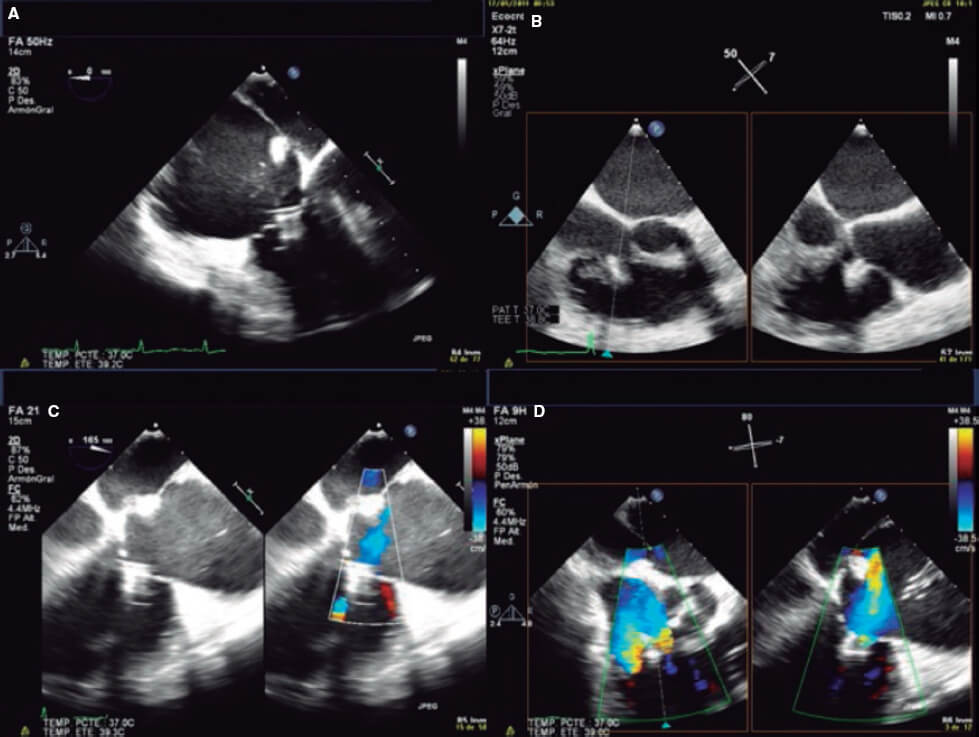
Figura 7. Ejemplos de plano de grasping. A y D: paciente 1, grasping desde el plano intercomisural a 75° y desde el plano de grasping directo a 125°. B y E: paciente 2, plano de grasping directo obtenido en 0° y en 160°. C y F: proyección oblicua anterior derecha para guiar el movimiento del clip. A: anterior; S: septal.
9. Una vez capturados los velos debe confirmarse su inserción en múltiples vistas por ETE 2D y asegurar la presencia de puentes de tejido por 3D. El multiplano es muy útil para la evaluación, y en casos en los que puedan quedar dudas de la inserción de los velos puede ser útil la realización de un ETT, e incluso el eco intracardiaco. Debe medirse el gradiente medio de la VT para descartar estenosis; en general, no se recomienda un gradiente medio de más de 3 mmHg (figura 8).
Figura 8. A-D: evaluación del grasping en múltiples vistas para evaluar la inserción de los velos y la reducción de la insuficiencia tricuspídea.
10. El clip se libera de manera estándar. Después de su liberación completa hay que evaluar el grado de IT residual y su localización, así como la necesidad de implantar un nuevo clip. La posición de los próximos clips depende de la localización y de la cantidad de los chorros de IT residuales.
Desde la introducción del MitraClip XTR, la mayoría de los procedimientos se han realizado con este dispositivo. Permite una captura más fácil, incluso cuando existen defectos de coaptación entre los velos. El procedimiento paso a paso aquí descrito se refiere al dispositivo MitraClip estándar que se usa en la actualidad para los procedimientos mitrales. Próximamente estará disponible una modificación del Mitraclip (en el CG) para facilitar la dirección y el posicionamiento del clip (evaluada en el ensayo TRILUMINATE a 30 días con excelentes resultados15). Esta nueva versión reemplazará la versión mitral del dispositivo y los pasos se modificarán ligeramente. Asimismo, se espera una nueva iteración del sistema en los próximos meses (TriClip).
Existen varias posibilidades técnicas para el implante de clips en la VT; la estrategia puede variar según la superficie ocupada por cada velo y la ubicación del chorro de regurgitación. Para el tratamiento de los defectos de coaptación A-S, el implante del clip lo más cercano posible al centro de la válvula maximiza la reducción de la IT. En pacientes con grandes defectos de coaptación, la estrategia más común es tratar la línea de coaptación A-S con varios clips, intentando así crear una bicuspidación de la VT (vídeo 5 del material adicional). Como alternativa, puede implantarse un primer clip entre las valvas anterior y septal, y un segundo clip entre los velos posterior y septal, creando una VT de «triple orificio» (figura 4 del material adicional). En este sentido, el «triple orificio» puede ser superior a la técnica de bicuspidación A-S, ya que logra una reducción directa de los defectos de coaptación y, al mismo tiempo, contrarresta la dilatación anular al ejercer fuerzas de tracción en la zona anterior y posterior del anillo. Sin embargo, un análisis de ambas estrategias no ha encontrado diferencias entre ellas en cuanto a la reducción de la IT o la mejoría clínica16.
La selección de pacientes para la reparación tricuspídea debe incluir una combinación de características clínicas, hemodinámicas y anatómicas. En la tabla 1 se indican los criterios que definen al candidato óptimo para la reparación de la IT con MitraClip17. Es importante destacar que todos los pacientes deben tener una IT sintomática a pesar de recibir un tratamiento médico óptimo, un alto riesgo quirúrgico y una IT grave.
Tabla 1. Criterios para identificar a los candidatos ideales para reparación tricúspide con MitraClip
| Óptimo | Posible | Excepcional |
|---|---|---|
| IT secundaria con velos normales | IT secundaria con apariencia normal de los velos o IT primaria con prolapso valvular | Engrosamiento significativo de los velos (reumática) o acortamiento o destrucción o prolapso valvular grave |
| Defecto de coaptación pequeño (< 3-4 mm) y buena movilidad de los velos | Defecto moderado de coaptación (4-7,2 mm), movilidad de los velos reducida | Defecto de coaptación grande (> 7,2 mm) o restricción grave de los velos |
| Buena ventana ETE | Suficiente ventana ecocardiográfica para visualizar los velos | Insuficiente ventana ecocardiográfica para visualizar los velos |
| Sin cables de MCP o DAI | Presencia de cable de MCP o DAI, sin interacción significativa de los velos y sin interacción con el clip | IT inducida por cable de MCP o DAI |
| Función del VD normal-moderadamente deprimida VD de tamaño normal o moderadamente dilatado | Función del VD moderadamente reducida, dilatación moderada del VD | Función del VD gravemente reducida o dilatación grave del VD |
| Presión sistólica pulmonar normal | < 60-65 mmHg y resistencias pulmonares < 4 UW | > 60-65 mmHg o resistencias pulmonares < 4 UW |
|
DAI: desfibrilador automático implantable; ETE: ecocardiograma transesofágico; IT: insuficiencia tricuspídea; MCP: marcapasos; UW: unidades Wood; VD: ventrículo derecho. Reproducida con permiso de Hausleiter et al.17. |
||
Recientemente se han publicado los predictores ecocardiográficos de éxito durante la reparación de la IT con MitraClip, y son la ubicación del chorro en la línea de coaptación A-S o zona central y el defecto de coaptación entre los velos < 7,2 mm los mejores predictores con el dispositivo NTR17. El éxito del procedimiento es primordial, ya que es una variable independiente asociada con mejor pronóstico8,18.
OTROS DISPOSITIVOS TRANSCATÉTER PARA EL TRATAMIENTO DE LA INSUFICIENCIA TRICUSPÍDEA
En la tabla 2 y la tabla 3 se resumen otros dispositivos transcatéter para el tratamiento de la IT.
Tabla 2. Dispositivos de reparación percutánea tricúspide transcatéter
| Características | Fortalezas | Desafíos | |
|---|---|---|---|
| Dispositivos de coaptación | |||
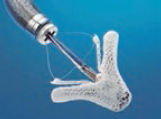 MitraClip MitraClip |
Bicuspidación o triple orificio VT Primeras series publicadas |
Amplia experiencia en válvula mitral Fácil de usar por los operadores |
Ruta de acceso vascular Técnica de implante modificada Configuración de la válvula con 3 velos No dirigido a dilatación anular |
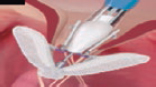 Pascal Pascal |
Similar a TriClip Bicuspidación o triple orificio VT Ventaja del espaciador para el grasping |
Probablemente fácil de usar por los operadores Similar a TriClip |
Técnica de implante modificada Configuración de la válvula con 3 velos No dirigido a dilatación anular |
| Dispositivos de anuloplastia | |||
 Trialign Trialign |
Bicuspidación de la VT (comisura posterior) Primeras series reportadas Pendiente estudio para marca CE |
Antecedentes quirúrgicos Alto perfil de seguridad |
Riesgo de daño de los velos o de la coronaria derecha Técnicamente demandante Guía por ETE Propiedades del tejido de la válvula |
 Cardioband Cardioband |
Anillo de anuloplastia flexible Primeros casos comunicados en humanos |
Antecedentes quirúrgicos | Poca experiencia en válvula mitral Riesgo de lesión de la coronaria derecha |
 TriCinch TriCinch |
Anuloplastia indirecta simple Pendiente de estudio para marca CE |
Antecedentes quirúrgicos Alto perfil de seguridad Totalmente recuperable antes de la colocación del stent |
Riesgo de lesión de la coronaria derecha Dilatación de la vena cava inferior |
|
CE: Conformidad Europea; ETE: ecocardiograma transesofágico; VT: válvula tricúspide. |
|||
Tabla 3. Dispositivos percutáneos de reemplazo valvular tricuspídeo transcatéter
| Dispositivos | Características | Fortalezas | Desafíos |
|---|---|---|---|
 GATE GATE |
Válvula ortotópica autoexpandible de nitinol Captura de los velos y expansión anular |
Abolición de la IT Similar a la experiencia quirúrgica Sistema de la válvula basado en catéter, sencillo para los operadores |
Ruta de acceso vascular Planificación preprocedimiento Dispositivo voluminoso Defecto en el sistema de conducción |
 TricValve TricValve |
Previene el flujo retrogrado de la IT en las cavas Válvula autoexpandible de nitinol con diseño especial para VCS y VCI |
Fácil de implantar Mejoría sintomática |
Ruta de acceso vascular Planificación preprocedimiento No antecedentes quirúrgicos Restricciones anatómicas Efecto a largo plazo de ventricularización de la aurícula |
 Tricento Tricento |
Previene el flujo retrogrado de la IT en las cavas Stent autoexpandible desde la VCS a la vena cava Válvula biológica bicúspide hacia la aurícula derecha que impide el flujo hacia las cavas |
Fácil de implantar Mejoría sintomática |
Ruta de acceso vascular Planificación preprocedimiento No antecedentes quirúrgicos Restricciones anatómicas Diseño individual Efecto a largo plazo de ventricularización de la aurícula |
|
IT: insuficiencia tricuspídea; VCI: vena cava inferior; VCS: vena cava superior. |
|||
Dispositivos de reparación borde a borde
Pascal
Se trata de un dispositivo que realiza una reparación borde a borde mediante la captura de los velos de la VT. Este dispositivo tiene clasps (palas metálicas que capturan los velos) y paddles (brazos en los que se insertan los velos) que permiten capturar los velos contra un espaciador. Los clasps se mueven de manera independiente para asegurar una mejor captura de los velos en el dispositivo, y el espaciador ayuda a aumentar la superficie de coaptación y a disminuir el estrés en los velos. El sistema completo es 22 Fr y el dispositivo puede ser elongado por completo, lo cual favorece la interacción con el aparato subvalvular. El procedimiento se lleva a cabo por vía transfemoral bajo anestesia general y guiado por ETE. Bajo control con ETE y guía fluoroscópica, el dispositivo se dirige a la VT y se implanta de manera similar al MitraClip. En una reciente comunicación se presentó la experiencia inicial con Pascal en la reparación de la IT. Doce pacientes fueron tratados con una reducción de al menos un grado de IT en el 92% y todos los pacientes mejoraron la clase funcional a los 30 días de seguimiento19. Esta experiencia inicial es alentadora, pero se necesitan más datos antes de extender el uso de este dispositivo a una comunidad más amplia.
Dispositivos de anuloplastia
Trialign
El dispositivo Trialign (Mitralign Inc., Tewksbury, Massachusetts) es un sistema de anuloplastia transyugular basado en sutura que reduce el diámetro anular tricuspídeo mediante la plicatura de tejido de los velos. Durante el procedimiento se liberan un par de suturas de poliéster en el anillo tricuspídeo, cerca de las comisuras anteroposterior y P-S. A continuación se cincha mediante una sutura de poliéster para obliterar el velo posterior tricuspídeo, y se fija en el lado auricular. Ya se han publicado los resultados del estudio SCOUT20, en el que se implantó con éxito un solo par de suturas en 14 de 16 pacientes (87,5%), con una reducción promedio tras el procedimiento del 37% en el anillo tricuspídeo y del 59% en el área del orificio regurgitante. Pueden implantarse un par de suturas en el anillo anterior para optimizar el resultado final. No hubo mortalidad durante el procedimiento y se demostró una mejoría en los test de calidad de vida a 1 mes de seguimiento.
Cardioband
El sistema Cardioband (Edwards LifeSciences, CA, EE.UU.) es un dispositivo de anuloplastia directa percutánea que repara la VT. Se implanta en el anillo tricuspídeo mediante anclajes a través del anillo en el miocardio basal del VD y sigue la forma natural del anillo, respetando la zona septal, donde se encuentra el nodo auriculoventricular. Después se cincha mediante guía con ETE y se reduce el diámetro septolateral del anillo.
Se han presentado datos del estudio TRI-REPAIR a 6 meses21, que incluyó 30 pacientes y el éxito técnico del procedimiento fue del 100%. A los 6 meses se observó una reducción del diámetro anular septolateral del 9% y del PISA (proximal isovelocity surface area) del 50%. El 88% de los pacientes estaban en grado funcional I-II de la New York Heart Association, con mejoría en los test de calidad de vida.
TriCinch
TriCinch (4Tech Cardio, Galway, Irlanda) es un dispositivo de anuloplastia formado por un catéter deflectable que presenta en su porción distal un sistema de bobina para anclarse al anillo tricuspídeo. Este anclaje permite generar tracción de todo el anillo a través de una banda que va conectada al mismo. El implante del anclaje se realiza en el espacio pericárdico, para evitar desprendimientos en el seguimiento. El lugar de fijación es en la parte media del anillo tricuspídeo anterior bajo guía fluoroscópica y ecocardiográfica. Posteriormente, el catéter se tensa para cinchar el anillo tricuspídeo, y así se reduce la dimensión A-S de este y se mejora la coaptación de los velos. Por último, se coloca un stent de nitinol autoexpandible en la vena cava inferior (VCI) para asegurar el sistema y mantener la tensión aplicada. La implantación de TriCinch conserva la anatomía nativa, lo que permite posibles opciones de tratamiento en el futuro. La experiencia en animales ha demostrado la seguridad y la eficacia del dispositivo22.
Dispositivos de reemplazo valvular
El reemplazo de la VT transcatéter puede ser ortotópico o heterotópico. Las primeras experiencias con esta técnica se han desarrollado utilizando prótesis valvulares aórticas para implante percutáneo colocadas en posición tricuspídea. Más común es la implantación de una prótesis valvular aórtica percutánea en forma de «válvula en válvula» o «válvula en anillo» en posición tricuspídea. Se han comunicado resultados aceptables a medio plazo con estos procedimientos23. Sin embargo, más interesante es el desarrollo de sistemas de reemplazo valvular tricuspídeo transcatéter en VT nativa.
GATE
La bioprótesis GATE (NaviGATE Cardiac Structures, Lake Forest, CA, EE.UU.) es el único dispositivo disponible actualmente con experiencia clínica en humanos como uso compasivo, y es el único que permite el reemplazo valvular tricuspídeo transcatéter completamente ortotópico. Se trata de una bioprótesis de velos de xenopericardio insertados sobre un armazón autoexpandible de nitinol. El stent de nitinol es más ancho en la zona ventricular, lo que le confiere una morfología tronco-cónica que permite a la prótesis reducir el gradiente transvalvular y minimizar la obstrucción del tracto de salida (al protruir poco material en el ventrículo). Actualmente puede ser implantada por vía yugular o por acceso por la aurícula derecha mediante minitoracotomía; el acceso femoral está en desarrollo. El tamaño necesario para el acceso yugular es ≥ 14 mm, ya que la vaina introductora es de 42 Fr. En ambos casos, se requieren al menos 7 cm desde el punto de entrada al anillo para dirigir el dispositivo (el cual debe angularse 70°) para que sea perfectamente coaxial al plano anular.
La prótesis está disponible en 5 medidas (36, 40, 44, 48 y 52 mm). Solo se recomienda un ligero sobredimensionamiento (5-10%) con respecto a las medidas del anillo. Para la selección del tamaño del dispositivo es obligatoria la medida del anillo mediante una combinación de ETE y tomografía computarizada. En la tomografía computarizada, la distancia desde el anillo hasta la arteria coronaria derecha es una característica clave para evitar cualquier daño y para tener una guía durante el procedimiento. La proyección radiológica del implante también se deriva del análisis de la tomografía computarizada.
Se han realizado pocos implantes hasta ahora en todo el mundo y siempre como uso compasivo. Recientemente, se ha publicado la experiencia de la Universidad de Columbia con 5 procedimientos consecutivos24. El éxito del procedimiento fue del 100% y la ruta de acceso fue minitoracotomía en todos los casos. Solo 1 paciente falleció en los primeros 30 días después del procedimiento. El implante exitoso se asoció con mejoría del remodelado del VD, aumento del gasto cardiaco y mejoría en la clase funcional de la New York Heart Association en la mayoría de los pacientes.
CAVI
El propósito de la CAVI (caval valve implantation) es evitar el flujo de retorno de la IT a las cavas. Esto significa que los dispositivos en sí no eliminan la IT, sino que mejoran la congestión venosa sistémica. El procedimiento se realiza mediante la implantación de válvulas (en la experiencia inicial, válvulas expandibles con balón no dedicadas) en el origen de la VCI y la VCS. El implante puede ser simple (solo VCI) o doble, dependiendo de las características anatómicas del drenaje del sistema venoso en la aurícula derecha. También existe un dispositivo especializado CAVI autoexpandible, el TricValve (P&F Products Features Vertriebs, Viena, Austria), que consiste en un stent de nitinol especialmente diseñado para la circulación a baja presión. Los tamaños máximos disponibles son 38 y 43 mm para la VCS y la VCI, respectivamente, lo que significa que los diámetros de la zona de anclaje deberían ser idealmente ≤ 35 mm (de 28 a 43 mm).
Ambas válvulas se despliegan mediante un abordaje transfemoral en un catéter dedicado de 27 Fr. El dispositivo de la VCI se despliega con la porción cubierta dentro de la aurícula derecha y la cintura en el hiato del diafragma para permitir el drenaje del sistema venoso hepático. Aunque ha sido el primer dispositivo transcatéter utilizado, tiene varios inconvenientes, ya que no corrige la IT. El impacto a largo plazo de la ventricularización de la aurícula derecha, la sobrecarga persistente de la aurícula derecha y del VD, el estado persistente de bajo gasto cardiaco y el efecto en la función del VD han impedido un uso más amplio de esta técnica. Del mismo modo, las consecuencias de las complicaciones trombóticas son desconocidas.
Tricento
El dispositivo Tricento (NVT AG, Muri, Suiza) es una sofisticación del concepto CAVI. Está compuesto por un stent cubierto con anclaje a ambas cavas, con un elemento de válvula bicúspide lateral hecho de pericardio porcino que requiere solo una baja presión de cierre. El stent es de nitinol y presenta marcadores radioopacos que permiten un posicionamiento y una orientación precisos durante su implantación. Mediante acceso transfemoral, el dispositivo se libera a través de un catéter 24 Fr. El Tricento es totalmente reposicionable y recuperable hasta su despliegue final. Dado que existe una gran variabilidad anatómica entre pacientes, el stent debe hacerse a medida. La idea es nuevamente evitar el flujo de retorno de la IT hacia las cavas, pero todos los inconvenientes principales del concepto CAVI se aplican a este dispositivo.
CONCLUSIÓN
Existen diversas terapias transcatéter en desarrollo para el tratamiento de la IT. Este artículo pretende estandarizar las vistas ecocardiográficas básicas para la selección de los pacientes, así como ser una guía para el implante en la VT del MitraClip, que es el dispositivo más empleado en el momento actual. Teniendo en cuenta la continua evolución de los dispositivos y de la imagen cardiaca, los distintos protocolos de imagen y de intervencionismo se irán desarrollando de manera conjunta.
CONFLICTO DE INTERESES
No existe conflicto de intereses por parte de los autores con respecto a este manuscrito.
MATERIAL ADICIONAL
Vídeo 1. Moñivas Palomero V. DOI: 10.24875/RECIC.M19000078
Vídeo 2. Moñivas Palomero V. DOI: 10.24875/RECIC.M19000078
Vídeo 3. Moñivas Palomero V. DOI: 10.24875/RECIC.M19000078
Vídeo 4. Moñivas Palomero V. DOI: 10.24875/RECIC.M19000078
Vídeo 5. Moñivas Palomero V. DOI: 10.24875/RECIC.M19000078
BIBLIOGRAFÍA
1. Dreyfus GD, Martin RP, Chan KM, Dulguerov F, Alexandrescu C. Functional tricuspid regurgitation:a need to revise our understanding. J Am Coll Cardiol. 2015;65:2331-2336.
2. Taramasso M, Vanermen H, Maisano F, Guidotti A, La Canna G, Alfieri O. The growing clinical importance of secondary tricuspid regurgitation. J Am Coll Cardiol. 2012;59:703-710.
3. Nath J, Foster E, Heidenreich PA. Impact of tricuspid regurgitation on long-term survival. J Am Coll Cardiol. 2004;43:405-409.
4. Topilsky Y, Nkomo VT, Vatury O, et al. Clinical outcome of isolated tricuspid regurgitation. JACC Cardiovasc Imaging. 2014;7:1185-1194.
5. Topilsky Y, Inojosa JM, Benfari G, et al. Clinical presentation and outcome of tricuspid regurgitation in patients with systolic dysfunction. Eur Heart J. 2018;39:3584-3592.
6. Dreyfus GD, Corbi PJ, Chan KM, Bahrami T. Secondary tricuspid regur?gitation or dilatation:which should be the criteria for surgical repair?Ann Thorac Surg. 2005;79:127-132.
7. Zack CJ, Fender EA, Chandrashekar P, et al. National Trends and Outcomes in Isolated Tricuspid Valve Surgery. J Am Coll Cardiol. 2017;70:2953-2960.
8. Taramasso M, Alessandrini H, Latib A, et al. Outcomes After Current Transcatheter Tricuspid Valve Intervention:Mid-Term Results From the International TriValve Registry. JACC Cardiovasc Interv. 2019;12:155-165.
9. Hahn RT, Abraham T, Adams MS, et al. Guidelines for performing a comprehensive transesophageal echocardiographic examination:recommendations from the American Society of Echocardiography and the Society of Cardiovascular Anesthesiologists. J Am Soc Echocardiogr. 2013;26:921-964.
10. Hahn RT. State-of-the-art review of echocardiographic imaging in the evaluation and treatment of functional tricuspid regurgitation. Circ Cardiovasc Imaging. 2016;9:e005332.
11. Holda MK, Zhingre Sanchez JD, Bateman MD, Iaizo PA. Right Atrioventricular Valve Leaflet Morphology Redefined:Implications for Transcatheter Repair Procedures. JACC Cardiovasc Interv. 2019;12:169-178.
12. Lang RM, Badano LP, Tsang W, et al. American Society of Echocardiography;European Association of Echocardiography. EAE/ASE recommendations for image acquisition and display using three-dimensional echocardiography. Eur Heart J Cardiovasc Imaging. 2012;13:1-46.
13. Muraru D, Hanh RT, Soliman OI, et al. 3-Dimensional Echocardiography in Imaging the Tricuspid Valve. JACC Cardiovasc Imaging. 2019;12 500-515.
14. Santoro C, Del Castillo AM, Gonzalez-Gomez A, et al. Mid-term outcome of severe tricuspid regurgitation:are there any differences according to mechanism and severity?Eur Heart J Cardiovasc Imaging. 2019;20:1-8.
15. Nickenig G, Hausleiter J, Hahn R, et al. Percutaneous Edge-to-Edge Repair for Tricuspid Regurgitation:Primary Outcomes from the TRILUMINATE clinical trial. En:EuroPCR;2019 May 21;Paris. Disponible en:https://abstractbook.pcronline.com/export/pdf/id/110069.
16. Braun D, Orban M, Orban M, et al. Transcatheter Edge-to-Edge Repair for Severe Tricuspid Regurgitation Using the Triple-Orifice Technique Versus the Bicuspidalization Technique. JACC Cardiov Interv. 2018;11:1790-1792.
17. Hausleiter J, Braun D, Orban M, et al. Patient selection, echocardiographic screening and treatment strategies for interventional tricuspid repair using the edge-to-edge repair technique. EuroIntervention. 2018;14:645-653.
18. Besler C, Orban M, Rommel KP, et al. Predictors of Procedural and Clinical Outcomes in Patients With Symptomatic Tricuspid Regurgitation Undergoing Transcatheter Edge-to-Edge Repair. JACC Cardiov Interv. 2018;11:1119-1128.
19. Fam NP. Pascal tricuspid:early experience technology and clinical updates. En:Transcatheter Cardiovascular Therapeutics 2018;2018 Sept 23;San Diego. Disponible en:https://www.tctmd.com/slide/pascal-tricuspidearly-experience-technology-and-clinical-updates.
20. Hahn RT, Meduri CU, Davidson CJ, et al. Early Feasibility Study of a Transcatheter Tricuspid Valve Annuloplasty:SCOUT Trial 30-Day Results. J Am Coll Cardiol. 2017;69:1795-1806.
21. Nickenig G, Weber M, Schueler R, et al. 6-Month Outcomes of Tricuspid Valve Reconstruction for Patients With Severe Tricuspid Regurgitation. J Am Coll Cardiol. 2019;73:1905-1915.
22. Taramasso M, Latib A, Denti P, et al. Percutaneous repair of the tricuspid valve using a novel cinching device:acute and chronic experience in a preclinical large animal model. EuroIntervention. 2016;12:918-925.
23. McElhinney DB, Cabalka AK, Aboulhosn JA, et al. Transcatheter Tricuspid Valve-in-Valve Implantation for the Treatment of Dysfunctional Surgical Bioprosthetic Valves:An International, Multicenter Registry Study. Circulation. 2016;133:1582-1593.
24. Hahn RT, George I, Kodali SK, et al. Early Single-Site Experience With Transcatheter Tricuspid Valve Replacement. JACC Cardiovasc Imaging. 2019;12:416-429.