RESUMEN
Introducción y objetivos: Conocer el beneficio clínico del cierre percutáneo de la orejuela izquierda (OI) en nuestro medio; en concreto, la reducción de eventos tromboembólicos y hemorrágicos, que permitiría un mejor posicionamiento de esta intervención.
Métodos: Estudio retrospectivo que recoge la actividad del cierre de OI en un centro durante 9 años. Se registraron la tasa de éxito del dispositivo y del procedimiento, así como las tasas de eventos tromboembólicos y de hemorragia mayor.
Resultados: Se evaluaron 260 procedimientos de cierre de OI en una población con fibrilación auricular no valvular y puntuación en las escalas CHA2DS2-VASc de 4,3 ± 1,6 y HAS-BLED de 3,7 ± 1,2. El éxito del procedimiento fue del 98,8%, y la tasa de eventos adversos graves en los primeros 7 días fue del 2,3%. Con un seguimiento medio de 2,5 ± 1,9 años y una población de 637,9 pacientes-año, la tasa de eventos tromboembólicos fue de 1,4 por 100 pacientes-año (75,5% de reducción del riesgo) y la de hemorragia mayor fue de 3,0 por 100 pacientes-año (58,5% de reducción del riesgo), ambas significativamente menores que las predichas. Las tasas de eventos por 100 pacientes-año en los pacientes con seguimiento muy largo (más de 4 años) mostraron tendencia a ser menores que en el resto de la población (0,7 frente a 2,0, con p = 0,17, para evento tromboembólico, y 1,7 frente a 4,0, con p = 0,09, para hemorragia mayor).
Conclusiones: En nuestra población, el cierre de la OI mostró un elevado éxito del procedimiento y una baja tasa de eventos inmediatos. El cierre de la OI indujo una significativa reducción en la tasa prevista de eventos tromboembólicos y hemorrágicos, y dicha reducción se mantuvo a muy largo plazo.
Palabras clave: Cierre percutáneo. Embolia arterial. Isquemia cerebral.
Abstract
Introduction and objectives: A better positioning of left atrial appendage closure (LAAC) requires assessment of its clinical benefits to reduce thromboembolic and bleeding events in a real-word population.
Methods: Single-center retrospective study of our consecutive LAAC activity for 9 years. Both the device success and procedural success were registered as well as the reduction of the expected rates of thromboembolic and major bleeding events.
Results: A total of 260 LAAC procedures were performed in a population with nonvalvular atrial fibrillation with CHA2DS2-VASc and HAS-BLED scores of 4.3 ± 1.6 and 3.7 ± 1.2, respectively. Procedural success was 98.8%, and the rate of serious adverse events within the first 7 days was 2.3%. At a median follow-up of 2.5 ± 1.9 years and an estimated population of 637.9 patients-year, the thromboembolic event rate was 1.4 per 100 patients-year (75.5% risk reduction) and the rate of major bleeding was 3.0 per 100 patients-year (58.5% risk reduction), which was significantly lower than anticipated. The thromboembolic and major bleeding events per 100 patients-year showed a lower tendency for patients with very long follow-up (over 4 years) compared to the remaining of the population (0.7 vs 2.0 with P = .17, and 1.7 vs 4.0 with P = .09, respectively).
Conclusions: In our population, the LAAC showed high procedural success and a low rate of periprocedural adverse events. LAAC induced a significant reduction in the rate of predicted thromboembolic and hemorrhagic events, and this reduction was maintained even at very long follow-up.
Keywords: Percutaneous closure. Arterial embolism. Cerebral ischemia.
INTRODUCCIÓN
El procedimiento de cierre de la orejuela izquierda (OI) por vía percutánea tiene tras de sí un amplio programa de estudios clínicos. A pesar de los excelentes resultados sobre eficacia y seguridad del cierre de la OI procedentes de los estudios aleatorizados1, estos presentan la limitación de tener un diseño no aplicable a nuestra realidad asistencial; quizá por ello el programa de cierre de OI en nuestro medio está todavía alejado de su pleno potencial2. Sin menoscabar la influencia del actual bajo grado de recomendación clínica del cierre de la OI3, la comunidad médica solo ganará confianza en este procedimiento cuando se le presenten estudios que evalúen su rendimiento en nuestro quehacer habitual.
El cierre de OI es un procedimiento estructural maduro, que en España se sitúa en el segundo puesto en número de casos tras el implante transcatéter de válvula aórtica4. El crecimiento en la experiencia con el cierre de la OI ha trasladado el foco de atención de los aspectos iniciales de éxito y seguridad hacia otras cuestiones todavía no bien contestadas, como cuál es el rendimiento del cierre de la OI en la reducción de eventos cardiovasculares a largo plazo y si este beneficio se mantiene con el tiempo.
Hasta el momento actual son escasos los trabajos dedicados a recoger la experiencia a largo plazo del cierre de OI, con un tiempo medio de seguimiento superior a los 2,5 años1,5-9. Únicamente desde esta perspectiva de largo plazo podremos entender el valor de una intervención basada en gran parte en la profilaxis de las complicaciones tromboembólicas a lo largo de la vida del paciente.
El objetivo de este trabajo fue presentar nuestra experiencia en el seguimiento de la población tratada con cierre de OI desde el inicio del procedimiento, con la finalidad de evaluar su rendimiento total y, especialmente, en la reducción de eventos tromboembólicos y de hemorragias a largo y muy largo plazo.
MÉTODOS
Nuestro estudio consiste en un análisis retrospectivo de la actividad de cierre de la OI realizada de manera consecutiva en un centro universitario desde marzo de 2011 hasta febrero de 2020. Se indicó el procedimiento desde diferentes servicios del hospital, entre los que destacan por volumen de intervención los servicios de medicina interna, neurología y cardiología. Nuestra unidad ha asumido el cierre de OI como un programa estratégico en su actividad estructural.
El procedimiento del cierre de OI: modo de intervención y dispositivo implantado
Todos los procedimientos se realizaron en un entorno idéntico de trabajo (instalaciones y personal). Sin embargo, se siguieron 3 modos de intervención diferentes: por un lado, anestesia general y sedación consciente, ambas con ecografía transesofágica, y una tercera modalidad con guía exclusivamente por fluoroscopia, con el paciente despierto.
Aunque en el inicio de nuestra experiencia se comenzó solo con anestesia general, trascurridos 2 años y medio se añadió la posibilidad de la sedación consciente, realizada por nuestro personal; el criterio para la elección entre anestesia general o sedación consciente fue logístico, debido a la discrecionalidad de la participación del servicio de anestesia en los procedimientos estructurales. En ambas modalidades, el tipo de sonda para la ecografía transesofágica fue el mismo.
El protocolo de sedación consciente consistió en una sedoanalgesia mediante la administración intravenosa de 50 mg de petidina, seguidos de 0,5 mg/kg de propofol en bolo con infusión lenta en 3 minutos, con monitorización continua de saturación y hemodinámica. Tras la introducción de la sonda transesofágica se administraban bolos de 10 mg de propofol intravenoso a demanda, en caso de incomodidad o de rechazo del paciente a la sonda.
El procedimiento guiado de forma exclusiva por fluoroscopia se reservó para aquellos casos con contraindicación absoluta o relativa de la ecografía transesofágica (en nuestro servicio no se dispone de ecografía intracavitaria), y para aquellos pacientes considerados muy frágiles para la inducción anestésica; se comenzó a realizar transcurridos algo más de 4 años del inicio de nuestra experiencia. En estos pacientes se recomendó la realización de una angiotomografía cardiaca para evaluar la orejuela y descartar la presencia de un trombo en su interior; en cualquier caso, tras el acceso transeptal se realizó una angiografía a través de un catéter pigtail desde el ostium de la orejuela izquierda, sin canularla selectivamente, con el fin de descartar un trombo. Una vez canulada la orejuela se realizó una adquisición rotacional de 180° mediante inyección de contraste a un flujo de 8 ml/s, con un total de 48 ml; de este modo se genera una imagen tridimensional de la orejuela (software i-Pilot, Siemens, Alemania) que se fusiona con la fluoroscopia real.
En los procedimientos se emplearon los 2 principales dispositivos del mercado: WATCHMAN (en sus versiones WATCHMAN 2,5 y WATCHMAN Flex; Boston Scientific, EE.UU.) y AMPLATZER ACP/Amulet (Abbott, EE.UU.); el dispositivo LAmbre (Lifetech Scientific, China) se implantó de forma anecdótica. La selección de uno u otro dispositivo no se debió a ningún criterio clínico o anatómico, y se tendió a un equilibrio en el volumen de utilización de cada uno de ellos. Únicamente en los procedimientos guiados por fluoroscopia fue preferente el dispositivo AMPLATZER Amulet, ya que sus criterios de liberación son básicamente fluoroscópicos.
El rendimiento del cierre de OI éxito y seguimiento
Las definiciones se basaron en el documento de consenso de Múnich sobre el cierre de la OI10. Se registró el éxito del procedimiento de cierre de OI como éxito del dispositivo (implante con éxito del primer dispositivo seleccionado) y éxito del procedimiento (implante final con éxito, sin eventos en las primeras 24 horas). La liberación del dispositivo se realizó tras comprobar la idoneidad de los parámetros ecográficos y fluoroscópicos. En los casos realizados mediante fluoroscopia, se valoraron la posición y la estabilidad sobre la imagen de fusión, así como la ausencia de lóbulos no cubiertos en la angiografía.
En cuanto al tratamiento tras el implante, no hubo criterio preestablecido y se ajustó al riesgo hemorrágico del paciente. Todos los pacientes fueron evaluados por ecografía transtorácica dentro de las primeras 24 horas, previamente al alta. El cumplimiento del control por ecografía transesofágica al mes y medio del procedimiento fue muy irregular.
El seguimiento se realizó en febrero de 2020 mediante revisión de la historia clínica digital única de Andalucía (Diraya). Se registraron la aparición y la fecha de los siguientes eventos: fallecimiento y su causa; ictus isquémico/embolia sistémica; hemorragia mayor (hemorragia incapacitante y mayor); y tratamiento médico en el momento del seguimiento. Se definió la futilidad del cierre de la OI como la tasa de muertes de causa no cardiovascular durante el primer año.
El rendimiento del cierre de OI en el seguimiento se evaluó mediante la tasa de reducción del riesgo de eventos tromboembólicos (ictus isquémico/embolia sistémica) o hemorrágicos (hemorragia mayor), teniendo en cuenta las tasas estimadas del riesgo procedentes de las puntuaciones CHA2DS2-VASc11 y HAS-BLED12, respectivamente.
Se ha querido establecer 4 años de seguimiento como límite a partir del cual se considera «muy larga evolución», dado que en el estudio Protect AF1 fue este el seguimiento que marcó la superioridad en cuanto a mortalidad del cierre de la OI frente a la anticoagulación.
Análisis estadístico
Los cálculos se realizaron mediante los programas IBM SPSS v26.0 y Epidat 4.2, y consistieron inicialmente en un análisis descriptivo de los datos, generando medias y desviaciones estándar de las variables numéricas, y distribuciones de frecuencia y porcentajes de las cualitativas.
La comparación entre variables cuantitativas demográficas y clínicas se realizó con el test de ANOVA, tras verificar las hipótesis de normalidad con el test de Shapiro Wilks; en caso de obtener una diferencia significativa se realizaron comparaciones múltiples mediante el test de Bonferroni.
La comparación de las variables cualitativas se hizo mediante tablas de contingencia y se aplicó el test de χ2.
La comparación entre las tasas de incidencia de eventos se realizó mediante el test de Rothman, y se calcularon los intervalos de confianza del 95% (IC95%) con el método Rosner.
Por último, se generaron curvas de Kaplan-Meier, comparadas mediante test de log rank.
RESULTADOS
Población
La población analizada consistió en 260 pacientes con fibrilación auricular no valvular, con edades entre 42 y 92 años. Las características clínicas de la población se muestran en la tabla 1.
Tabla 1. Características clínicas de la población
| Edad (años) | 74,8 ± 8,1 |
| Varones | 160 (61,5%) |
| Factores de riesgo | |
| Hipertensión arterial | 238 (91,5%) |
| Diabetes (tipos 1 y 2) | 118 (45,4%) |
| Tabaquismo | 93 (35,8%) |
| Dislipemia | 130 (50%) |
| Insuficiencia renal | 64 (24,6%) |
| Cardiopatía isquémica | 89 (34,2%) |
| Ictus previo | |
| Ictus isquémico | 38 (14,6%) |
| Ictus hemorrágico | 57 (21,9%) |
| CHA2DS2-VASc | 4,3 ± 1,6 |
| CHA2DS2-VASc ≥ 4 | 176 (67,7%) |
| HAS-BLED | 3,7 ± 1,2 |
| HAS-BLED ≥ 3 | 222 (85,4%) |
|
Los datos expresan n (%) o media ± desviación estándar. |
|
La indicación mayoritaria para el procedimiento de cierre de OI fue la contraindicación absoluta para el tratamiento anticoagulante por evento hemorrágico en 229 casos (88,1%) o por alto riesgo (2 pacientes con tumor cerebral y 1 con disección de aorta; 1,1%). En 28 pacientes (10,8%) la indicación fue por incapacidad para tomar anticoagulantes orales debido a razones diferentes del riesgo de hemorragia: en 13 por rechazo del tratamiento anticoagulante, en 6 por un antecedente psiquiátrico que no recomendaba su uso, en 3 por un aumentado riesgo de caída, en 3 por mal control del cociente internacional normalizado y en otros 3 por presentar un ictus cardioembólico a pesar de una adecuada anticoagulación.
El tratamiento al solicitar el procedimiento de cierre de OI fue mayoritariamente anticoagulación (68,8% de los pacientes): antagonistas de la vitamina K (83 casos, 31,9%), anticoagulantes directos (71 casos, 27,3%) o doble terapia (anticoagulación y monoantiagregación, 25 casos, 9,6%). Con respecto a los pacientes sin tratamiento anticoagulante previo al cierre de la OI, 48 (18,5%) estaban en tratamiento antiagregante y 33 (12,7%) no tomaban medicación antiagregante/anticoagulante.
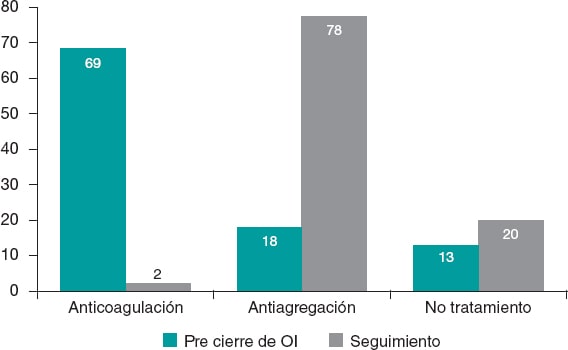
En el momento de realizar el seguimiento (febrero de 2020 o previo al fallecimiento del paciente), el tratamiento que recibía nuestra población fue: ausencia de tratamiento antiagregante/anticoagulante (51 pacientes, 19,9%), monoantiagregación con ácido acetilsalicílico (135 pacientes, 52,5%), monoantiagregación con clopidogrel (51 pacientes, 19,9%), doble antiagregación (14 pacientes, 5,4%) o anticoagulación (6 pacientes, 3%) (figura 1).
Figura 1. Evolución del tratamiento antitrombótico desde antes del cierre percutáneo de la orejuela izquierda (OI) hasta el seguimiento final, en porcentaje.
Características del procedimiento
Los procedimientos se realizaron mayoritariamente con anestesia general y monitorización con ecografía transesofágica (59,6%). La sedación consciente, realizada también bajo monitorización con ecografía transesofágica, se practicó en el 27,3% de los procedimientos. Solo el 13,1% de los procedimientos se llevaron a cabo sin otro apoyo de imagen que la fluoroscopia.
El dispositivo más empleado fue el WATCHMAN (142 pacientes, 54,6%), seguido por el AMPLATZER ACP/Amulet (116 pacientes, 44,6%), y de forma testimonial el LAmbre (2 pacientes, 0,8%). Dada la extensión del periodo de seguimiento, se emplearon 2 modelos de WATCHMAN (generación 2,5 en 125 pacientes y WATCHMAN Flex en 17 pacientes) y 2 modelos de AMPLATZER (ACP en 16 pa- cientes y Amulet en 100 pacientes).
La tasa de éxito del dispositivo fue del 98,5% (no se logró en 4 pacientes). Los casos de fracaso se debieron a que el dispositivo no cumplió los criterios de sellado de la orejuela y hubo que recapturarlo; tras seleccionar un nuevo dispositivo (diferente tamaño, y en un caso también diferente modelo), el procedimiento se finalizó satisfactoriamente.
El éxito del procedimiento fue del 98,8%; 1 hemorragia orofaríngea por intubación traumática y 2 taponamientos fueron los motivos de ausencia de éxito. Los taponamientos (0,77%) se debieron, en un primer caso, a una perforación de la orejuela en la maniobra de recaptura del dispositivo WATCHMAN; el segundo, a las 24 horas, por perforación de la arteria pulmonar izquierda posiblemente erosionada por el dispositivo LAmbre. Estos 2 pacientes cursaron bien, el primero con pericardiocentesis y la segunda tras una intervención quirúrgica con interposición de parche de pericardio entre la arteria pulmonar y la orejuela. No se produjo ninguna muerte, ictus ni embolia sistémica durante el procedimiento ni en las primeras 24 horas.
El número de eventos adversos graves durante la primera semana fue de 6 (2,3%), y se resumen en la tabla 2.
Tabla 2. Eventos adversos graves en los primeros 7 días tras el implante
| Día | Evento | Descripción | Fallecimiento |
|---|---|---|---|
| Procedimiento | Hemorragia | Intubación traumática para anestesia general | No |
| Procedimiento | Taponamiento | Pericardiocentesis | No |
| 1 día | Taponamiento | Perforación de arteria pulmonar Cirugía | No |
| 4 días | Broncoaspiración | Broncoaspiración mientras come | Sí |
| 4 días | Hemorragia | Hemorragia digestiva alta | Sí |
| 6 días | Hemorragia | Hemorragia digestiva alta | No |
El análisis comparativo entre los resultados de los primeros 50 procedimientos de cierre de la OI y los restantes nos dan una visión de la existencia de una curva de aprendizaje, concretada a través de variables del procedimiento que evalúan la destreza técnica del operador (reducción significativa del tiempo de fluoroscopia y de la dosis de radiación a partir de los primeros 50 procedimientos: 13,6 ± 5,5 frente a 18,7 ± 18,2 minutos y 18.413 ± 11.622 frente a 24.798 ± 18.802 µGym2, respectivamente, con p = 0,03). Sin embargo, no se encontraron diferencias en la tasa de éxito del procedimiento (98% para los primeros 50 casos y 99% para los restantes).
Las características del procedimiento de cierre de OI se exponen en la tabla 3.
Tabla 3. Características del procedimiento
| Modalidad del procedimiento | |
| Anestesia general | 155 (59,6%) |
| Sedación consciente | 71 (27,3%) |
| Fluoroscopia | 34 (13,1%) |
| Dispositivo | |
| ACP-Amulet | 116 (44,6%) |
| WATCHMAN | 142 (54,6%) |
| LAmbre | 2 (0,8%) |
| Tamaño del dispositivo (mm) | 25,2 ± 3,4 |
| Tiempo de fluoroscopia (min) | 14,6 ± 9,7 |
| Radiación (µGym2) | 19.636 ± 13.488 |
| Éxito del dispositivo | 98,5% |
| Éxito del procedimiento | 98,8% |
|
Los datos expresan n (%) o media ± desviación estándar. |
|
Seguimiento y eventos
Con un seguimiento medio de 2,5 ± 1,9 años (mediana de 1,4 años; IC95%, 1,1-1,9 años), nuestra serie está compuesta por 637,9 pacientes-año.
Durante el seguimiento se produjeron 58 muertes (22,3% de la muestra, 9,1% pacientes-año), de las cuales la mitad por causa cardiovascular (4,6% pacientes-año). Se produjeron 6 muertes por causas no cardiovasculares durante el primer año, con lo que la tasa de futilidad del cierre de la OI fue del 2,3%.
Los eventos ictus isquémico/embolización sistémica se produjeron en 9 pacientes (1,4% pacientes-año, IC95%, 0,6-2,7); comparado con el riesgo predicho de 5,7% pacientes-año, la reducción del riesgo relativo fue del 75,2% (p < 0,001). Con respecto a las hemorragias mayores, se registraron 19 eventos (3,0% pacientes-año, IC95%, 1,8-4,7), lo que supuso una reducción del riesgo relativo del 58,5% en comparación con el riesgo predicho de 7,2% pacientes-año (p < 0,001).
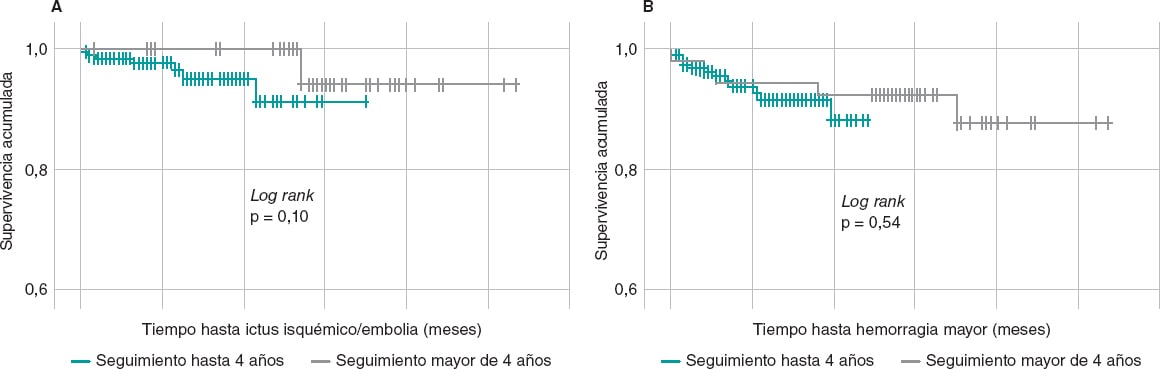
La evaluación de la capacidad protectora del cierre de la OI para evitar fenómenos tromboembólicos y hemorragias mayores a muy largo plazo es muy relevante. Se compararon los eventos en pacientes con seguimientos de hasta 4 años (n = 206; 346,7 pacientes-año) y en aquellos con más de 4 años de evolución (n = 54; 291,3 pacientes-año) y se observó que con el transcurso del tiempo se continúa manteniendo la protección frente a eventos tromboembólicos y hemorrágicos, e incluso se aprecia una tendencia a su reducción: tasa anual por 100 pacientes-año de ictus isquémico/embolia de 2,0 frente a 0,7 (p = 0,17), y para hemorragia mayor de 4,0 frente a 1,7 (p = 0,09) en los pacientes con seguimiento hasta 4 años y más de 4 años, respectivamente. La comparación de las curvas de supervivencia libre de eventos para tromboembolia y hemorragia mayor entre las poblaciones según la extensión del seguimiento no suministró resultados significativos (log rank con p = 0,10 para tromboembolia y p = 0,54 para hemorragia) (figura 2).
Figura 2. Curvas de supervivencia libre de eventos tromboembólicos (A) y de hemorragia mayor (B) de pacientes con seguimiento menor o igual a 4 años (verde) y mayor de 4 años (gris). La comparación de las curvas no arroja diferencias significativas para ambos eventos.
Seguimiento en función del tipo de dispositivo implantado
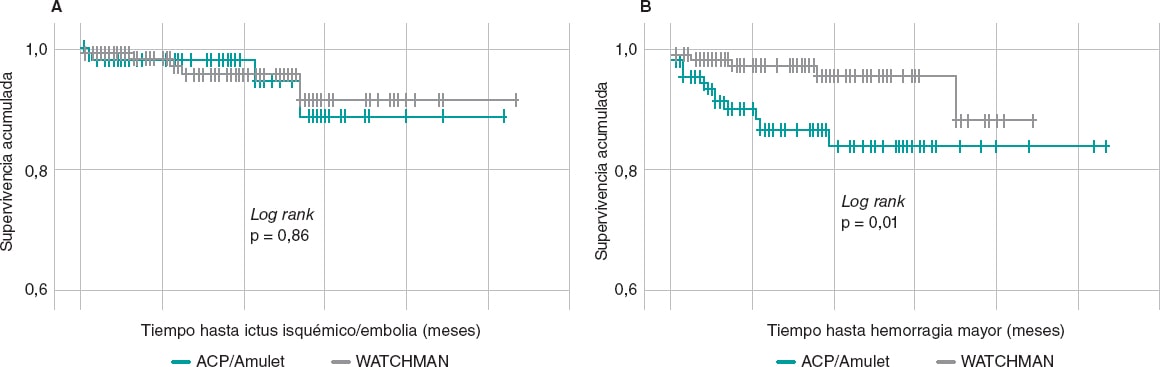
Se realizó un análisis comparativo de supervivencia libre de eventos en los pacientes tratados con WATCHMAN y AMPLATZER, y no se encontraron diferencias significativas entre los dispositivos en cuanto a su capacidad protectora frente a ictus isquémico/embolia sistémica (log rank p = 0,86); sin embargo, el WATCHMAN mostró una incidencia acumulada libre de hemorragia mayor significativamente superior a la del AMPLATZER (log rank p = 0,01) (figura 3).
Figura 3. Curvas de supervivencia libre de eventos tromboembólicos (A) y de hemorragia mayor (B) de pacientes con dispositivo AMPLATZER (verde) y WATCHMAN (gris). No se encuentran diferencias entre los dispositivos para los eventos tromboembólicos, pero sí para la hemorragia mayor, con una mayor tasa de supervivencia libre de eventos en los pacientes tratados con WATCHMAN.
DISCUSIÓN
Este registro unicéntrico de la «vida real» muestra nuestra experiencia con el procedimiento de cierre de OI en 260 pacientes consecutivos con fibrilación auricular no valvular durante los últimos 9 años. Los resultados se han expuesto con la finalidad de contestar a las siguientes preguntas: ¿cuál es el resultado del procedimiento del cierre de OI en nuestra población?, ¿cuál es el rendimiento del tratamiento del cierre de OI, entendido como la reducción de eventos tromboembólicos o de hemorragias en comparación con las tasas previstas de riesgo?, y por último, ¿se mantiene dicha reducción de eventos conforme avanza el seguimiento?
Las características clínicas de nuestra población la definen alineada con la población diana del cierre de la OI en la práctica clínica habitual. Así, nuestra población mostró características clínicas de riesgo tromboembólico similares a las de los grandes registros: la puntuación CHA2DS2-VASc de 4,3 fue intermedia entre el registro AMPLATZER Amulet13, con CHA2DS2-VASc de 4,2, y el registro NCDR14, con CHA2DS2-VASc de 4,6. Con respecto al riesgo hemorrágico, la puntuación HAS-BLED media en nuestra población fue de 3,8, algo superior a lo publicado, situada entre el registro EWOLUTION, con HAS-BLED de 2,315,16, y el registro AMPLATZER Amulet, con HAS-BLED de 3,313.
Este alto riesgo hemorrágico de nuestra población se podría explicar por el hecho de que casi el 90% de los pacientes tuvieron como indicación para el cierre de la OI el antecedente de hemorragia (mayoritariamente gastrointestinal, seguida de la cerebral); para el restante 10%, la indicación para el cierre de la OI fue la «incapacidad para tomar anticoagulantes orales por razones diferentes del riesgo de hemorragia»10, es decir, por un conjunto de motivos que llevaron a que el paciente (5% de la población) o el médico tomaran la decisión de elegir la terapia local mecánica sobre el tratamiento anticoagulante. Aunque en nuestro caso el volumen de decisiones electivas de cierre de la OI está lejos del descrito en el registro alemán LAARGE17, en el cual la elección del paciente fue determinante para plantear la indicación en una cuarta parte de la población, nos permite abrir una reflexión sobre hasta qué punto una información documentada al paciente es decisiva para la expansión de este tratamiento.
El procedimiento de cierre de OI es una intervención con una alta tasa de éxito del dispositivo y del procedimiento en la mayor parte de las series publicadas. En nuestra serie se obtuvo un 98,5% de éxito del dispositivo en el implante; el 1,5% de fracasos se debieron a una errónea selección del tamaño del dispositivo. Sin embargo, finalmente se logró sellar las orejuelas de todos los pacientes de la serie, lo que contrasta con hasta el 7% de cancelaciones del procedimiento por anatomía de la orejuela no abordable14; esto posiblemente se haya debido a nuestra capacidad para abordar el procedimiento con diferentes modalidades (anestesia general, sedación consciente y fluoroscopia sin guía ecográfica) y distintos tipos de dispositivo oclusor (aunque solo en un paciente hubo que cambiar un tipo de dispositivo por otro para finalizar el procedimiento). Nuestra tasa de éxito del procedimiento fue del 98,8%, superior a la comunicada en otros registros con poblaciones similares en cuanto a características clínicas basales14. En cuanto a la seguridad del procedimiento, nuestra tasa de eventos adversos en los primeros 7 días tras su realización fue del 2,3%, cifra en consonancia con la comunicada por los grandes registros13-16 y que muestra de forma generalizada el progresivo descenso en la tasa de eventos adversos durante la fase inicial tras la intervención.
En el análisis consecutivo de los resultados de procedimientos como el cierre de la OI, desde el inicio de nuestra experiencia hasta el momento actual, cabría esperar la existencia de una curva de aprendizaje. Sin embargo, más allá de las variables del procedimiento, como la duración y la dosis de radiación, no hubo diferencias en cuanto a la tasa de éxito del procedimiento entre el periodo más inicial y el resto de la experiencia. La estandarización del procedimiento y el apoyo formativo a los operadores pueden estar detrás de la consecución de una alta tasa de éxito en el cierre de la OI a pesar de la poca experiencia inicial18.
Nuestro registro, con un seguimiento medio de 2,5 años y con una quinta parte de los pacientes con un seguimiento superior a 4 años, nos permite valorar con un adecuado horizonte la eficacia del cierre de la OI. En primer lugar, llama la atención su elevada mortalidad, ya que el 22,3% de los pacientes incluidos murieron durante el seguimiento, lo que corresponde a un 9,1% por año, 3 veces más que lo hallado en el seguimiento a 4 años del estudio Protect AF1, pero prácticamente igual que en registros con población de similar riesgo que la nuestra9. El mayor riesgo de mortalidad en el seguimiento se ha asociado a factores como la edad, el sexo masculino, el antecedente de ictus o de hemorragia intracraneal, la baja fracción de eyección y la enfermedad renal crónica8,9; en cualquier caso, esta alta mortalidad en el seguimiento refleja la fragilidad de la población que atendemos, lo que explica un interesante debate sobre la futilidad del cierre de la OI en algunos pacientes19, que en nuestra serie fue del 2,3%.
El principal objetivo del cierre de la OI es la reducción del riesgo de cardioembolia en una población con fibrilación auricular no anticoagulada. En nuestro caso, el porcentaje anual de ictus isquémico y embolia fue del 1,4%, lo que supuso una reducción significativa del riesgo relativo del 75%, en línea con los mejores datos encontrados en la literatura20. Con respecto a la hemorragia mayor, en una población con una tasa estimada de hemorragia superior al 7%, nuestra tasa fue del 3,0%, la mitad de la comunicada por otros autores9.
Hasta el momento actual han sido escasos los trabajos dedicados a estudiar la eficacia del cierre de la OI a largo plazo. En el registro Ibérico II8, a partir de los 2 años de seguimiento se mantenía la tasa de reducción de los eventos tromboembólicos y mejoraba la reducción de la hemorragia mayor con respecto a las tasas iniciales. En nuestra población, el análisis de los pacientes de muy larga evolución (con tiempo de implante superior a 4 años) permitió observar que la eficacia del cierre de la OI se mantiene e incluso que tanto los eventos tromboembólicos como los hemorrágicos muestran una tendencia a suceder con menor incidencia que en una etapa más inicial.
Limitaciones
El estudio presenta varias limitaciones. En primer lugar, tras el implante no se siguió una pauta antitrombótica fija, sino que quedó a discreción del operador, lo que pudo influir en la tasa de hemorragias a corto plazo. Por otro lado, no se logró organizar un seguimiento sistemático por imagen entre 45 días y 3 meses después del implante, por lo que nos faltó información muy relevante: tasa de trombosis relacionada con el dispositivo, falta de sellado residual…
CONCLUSIONES
El cierre de la OI es una terapia efectiva para los pacientes con fibrilación auricular no valvular y dificultades para su anticoagulación en nuestro medio, con un rendimiento significativo en la reducción de los eventos tromboembólicos y hemorrágicos, que se mantiene a muy largo plazo.
FINANCIACIÓN
No financiado.
CONTRIBUCIÓN DE LOS AUTORES
R.J. Ruiz-Salmerón: autor del manuscrito; M. Ronquillo-Japón, C. Robles-Pérez, M. Iglesias-Blanco, C. Rubio-Iglesias,R. García de la Borbolla, C. Carrascosa-Rosillo, S. Rodríguez de Leiras, M. Vizcaíno-Arellano e I. Méndez-Santos: revisión crítica y J. Polo-Padillo: análisis estadístico.
CONFLICTO DE INTERESES
No se declara ninguno.
¿QUÉ SE SABE DEL TEMA?
- Se estima que solo un 5% de los pacientes con fibrilación auricular no valvular e incapacidad para la toma de anticoagulantes orales se han beneficiado del cierre de la OI. La evidencia de los ensayos aleatorizados se basa en una población que no es similar a la considerada candidata a cierre de OI en la vida real, lo cual es una limitación. Además, los registros importantes en la «vida real» no tienen un seguimiento a largo plazo.
¿QUÉ APORTA DE NUEVO?
-
Nuestro estudio aporta datos del rendimiento del cierre de la OI en nuestra realidad asistencial, tanto en lo referente al éxito del procedimiento como a su rendimiento para reducir eventos tromboembólicos y de hemorragia mayor, que resulta significativo de forma global en comparación con las tasas estimadas y se mantiene a muy largo plazo.
BIBLIOGRAFÍA
1. Reddy VY, Sievert H, Halperin J, et al. Percutaneous Left Atrial Appendage Closure vs Warfarin for Atrial Fibrillation:A Randomized Clinical Trial. JAMA. 2014;312:1988-1998.
2. Fukutomi M, De Backer O, Søndergaard L. Indications, current adoption and future perspectives for percutaneous left atrial appendage closure. EuroIntervention. 2019;14:1707-1709.
3. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2021;42:373-498.
4. Ojeda S, Romaguera R, Cruz-González I, Moreno R. Registro Español de Hemodinámica y Cardiología Intervencionista. XXIX Informe Oficial de la Sección de Hemodinámica y Cardiología Intervencionista de la Sociedad Española de Cardiología (1990-2019). Rev Esp Cardiol. 2020;73:927-936.
5. Wiebe J, Franke J, Lehn K, et al. Percutaneous Left Atrial Appendage Closure With the Watchman Device:Long-Term Results Up to 5 Years. J Am Coll Cardiol Intv. 2015;8:1915-1921.
6. Betts TR, Leo M, Panikker S, et al. Percutaneous left atrial appendage occlusion using different technologies in the United Kingdom:A multicenter registry. Catheter Cardiovasc Interv. 2017;89:484-492
7. Korsholm K, Nielsen KM, Jensen JM, Jensen HK, Andersen G, Nielsen-Kudsk JE. Transcatheter left atrial appendage occlusion in patients with atrial fibrillation and a high bleeding risk using aspirin alone for post-implant antithrombotic therapy. EuroIntervention. 2017;12:2075-2082.
8. López-Mínguez JR, Nogales-Asensio JM, Infante De Oliveira E, et al. Reducción de eventos a largo plazo tras el cierre de la orejuela izquierda. Resultados del Registro Ibérico II. Rev Esp Cardiol. 2019;72:449-551.
9. Regueiro A, Cruz-Gonzalez I, Bethencourt A, et al. Long-term outcomes following percutaneous left atrial appendage closure in patients with atrial fibrillation and contraindications to anticoagulation. J Interv Card Electrophysiol. 2018;52:53-59.
10. Tzikas A, Holmes DR, Gafoor S, et al. Percutaneous left atrial appendage occlusion:the Munich consensus document on definitions, endpoints and data collection requirements for clinical studies. EuroIntervention. 2016;12:103-111.
11. Lip GY, Nieuwlaat R, Pisters R, Lane DA, Crijns HJ. Refining clinical risk stratification for predicting stroke and thromboembolism in atrial fibrillation using a novel risk factor-based approach:the euro heart survey on atrial fibrillation. Chest. 2010;137:263-272.
12. Pisters R, Lane DA, Nieuwlaat R, de Vos CB, Crijns HJ, Lip GY. A novel user-friendly score (HAS-BLED) to assess one-year risk of major bleeding in atrial fibrillation patients:The Euro Heart Survey. Chest. 2010;138:1093-1100.
13. Landmesser U, Schmidt B, Nielsen-Kudsk JE, et al. Left atrial appendage occlusion with the AMPLATZER Amulet device:periprocedural and early clinical/echocardiographic data from a global prospective observational study. EuroIntervention. 2017;13:867-876.
14. Freeman JV, Varosy P, Price MJ, et al. The NCDR left atrial appendage occlusion registry. J Am Coll Cardiol. 2020;75:1503-1518.
15. Boersma LV, Schmidt B, Betts TR, et al. EWOLUTION investigators. Implant success and safety of left atrial appendage closure with the WATCHMAN device:peri-procedural outcomes from the EWOLUTION registry. Eur Heart J. 2016;37:2465-2474.
16. Boersma LV, Ince H, Kische S, et al. Efficacy and safety of left atrial appendage closure with WATCHMAN in patients with or without contraindication to oral anticoagulation:1-year follow-up outcome data of the EWOLUTION trial. Heart Rhythm. 2017;14:1302-1308.
17. Fastner C, Nienaber CA, Park JW, et al. Impact of left atrial appendage morphology on indication and procedural outcome after interventional occlusion:results from the prospective multicenter German LAARGE registry. EuroIntervention. 2018;14:151-157.
18. Sawant AC, Seibolt K, Sridhara S, et al. Operator experience and outcomes after transcatheter left atrial appendage occlusion with the Watchman device. Cardiovasc Revasc Med. 2020;21:467-472.
19. Asmarats L, Rodés-Cabau J. Resultados a largo plazo tras el cierre de la orejuela izquierda:ampliando la perspectiva en la prevención no farmacológica del ictus en pacientes con fibrilación auricular. Rev Esp Cardiol. 2019;72:440-442.
20. Glikson M, Wolff R, Hindricks G, et al. EHRA/EAPCI expert consensus statement on catheter-based left atrial appendage occlusion –an update. EuroIntervention. 2020;15:1133-1180.