RESUMEN
Introducción y objetivos: Comparar los efectos del balón farmacoactivo (BFA) frente al stent farmacoactivo (SFA) en pacientes con enfermedad arterial coronaria (EAC) de vaso grande de novo.
Métodos: Se realizó una búsqueda sistemática de ensayos clínicos aleatorizados comparando BFA frente a SFA en pacientes con EAC de vaso grande de novo. Los datos se agruparon mediante un metanálisis de efectos aleatorios. El objetivo primario fue la necesidad de revascularización de la lesión diana (RLD).
Resultados: Se incluyeron 7 ensayos con 2.961 pacientes. El uso de BFA, en comparación con SFA, se asoció con un riesgo similar de RLD (OR = 1,21; IC95%, 0,44-3,30; I2 = 48%), muerte por todas las causas (OR = 1,56; IC95%, 0,94-2,57; I2 = 0%), muerte de causa cardiovascular (OR = 1,65; IC95%, 0,90-3,05; I2 = 0%), infarto de miocardio (OR = 0,97; IC95%, 0,58-1,61; I2 = 0%), acontecimientos adversos cardiacos mayores (OR = 1,19; IC95%, 0,74-1,90; I2 = 13,5%) y pérdida luminal tardía (DME = −0,35; IC95%, −0,74 a 0.04; I2 = 81,4%). Sin embargo, el BFA se asoció a un mayor riesgo de revascularización del vaso diana (OR = 2,47; IC95%, 1,52-4,03; I2 = 0%) y a un menor diámetro luminal mínimo en el seguimiento (DME: −0,36; IC95%, −0,56 a −0,15; I2 = 34,5%), aunque los intervalos de predicción incluyeron el valor nulo para ambos resultados.
Conclusiones: En los pacientes con EAC de vaso grande de novo, el BFA comparado con el SFA se asoció a un riesgo similar de RLD, obteniendo el SFA mejores resultados angiográficos.
Palabras clave: Balón farmacoactivo. stent farmacoactivo. Enfermedad arterial coronaria.
ABSTRACT
Introduction and objectives: To compare the effects of drug-coated balloon (DCB) vs drug-eluting stent (DES) in patients presenting with de novo large vessel coronary artery disease (CAD).
Methods: We conducted a systematic research of randomized controlled trials comparing DCB vs DES in patients with de novo large vessel CAD. Data were pooled by meta-analysis using a random-effects model. The prespecified primary endpoint was target lesion revascularization (TLR).
Results: A total of 7 trials enrolling 2961 patients were included. The use of DCB vs DES was associated with a similar risk of TLR (OR, 1.21; 95%CI, 0.44-3.30; I2 = 48%), all-cause mortality (OR, 1.56; 95%CI, 0.942.57; I2 = 0%), cardiac death (OR, 1.65; 95%CI, 0.90-3.05; I2 = 0%), myocardial infarction (OR, 0.97; 95%CI, 0.58-1.61; I2 = 0%), major adverse cardiovascular adverse (OR, 1.19; 95%CI, 0.74-1.90; I2 = 13.5%) and late lumen loss (standardized mean difference [SMD], −0.35; 95%CI, −0.74 to 0.04; I2 = 81.4%). However, the DCB was associated with a higher risk of target vessel revascularization (OR, 2.47; 95%CI, 1.52-4.03; I2 = 0%) and smaller minimal lumen diameter during late follow-up (SMD, −0.36; 95%CI, −0.56 to −0.15; I2 = 34.5%). Nevertheless, prediction intervals included the value of no difference for both outcomes.
Conclusions: In patients with de novo large vessel CAD the use of DCB vs DES is associated with a similar risk of TLR. However, the DES achieves better late angiographic results.
Keywords: Drug-coated balloon. Drug-eluting stent. Coronary artery disease.
Abreviaturas
BFA: balón farmacoactivo. DLM: diámetro luminal mínimo. EC: enfermedad coronaria. IM: infarto de miocardio. RLD: revascularización de la lesión diana. SFA: stent farmacoactivo.
INTRODUCCIÓN
En la actualidad, los stents farmacoactivos (SFA) siguen siendo el tratamiento estándar para los pacientes que reciben una intervención coronaria percutánea (ICP)1,2. No obstante, los SFA están asociados a un riesgo paulatino y permanentemente alto de eventos adversos, sobre todo, por la trombosis tardía del stent y la reestenosis intrastent, con una incidencia del 2% anual sin que estos valores hayan alcanzado, todavía, valores meseta1. Este riesgo es, incluso, mayor, cuando se tratan lesiones complejas y largas3. En los últimos años, los balones farmacoactivos (BFA) han surgido como una posible alternativa a los SFA. Tras una adecuada preparación de la lesión, a diferencia de los stents tradicionales, los BFA liberan un fármaco antiproliferativo en la pared vascular sin dejar un armazón metálico permanente tras de sí. Se debe mencionar que el armazón permanente puede distorsionar y constreñir el vaso coronario y, por ende, deteriorar la vasomoción y el remodelado adaptativo promoviendo, en última instancia, la aparición de inflamación crónica4. La ICP con BFA es un tratamiento bien establecido para la reestenosis intrastent y la enfermedad corona- ria (EC) de vasos pequeños5,6. No obstante, el papel que juega en la EC de grandes vasos de novo sigue siendo objeto de debate. En un reciente ensayo clínico aleatorizado (ECA) de pacientes revascularizados por EC de novo, una estrategia de ICP con BFA resultó no ser inferior al SFA en el objetivo combinado orientado dispositivo motivado por una mayor incidencia de la revascularización de la lesión diana (RLD)7. Al contrario de lo que apuntan investigaciones ya publicadas, nuestros hallazgos no avalaron resultados clínicos similares para BFA frente a SFA en pacientes con EC de novo de grandes vasos8,9. Un reciente metanálisis de 15 estudios comparó la ICP con BFA o la angioplastia híbrida frente a la ICP con SFA en pacientes con vasos > 2,75 mm de diámetro y confirmó que no había diferencias significativas en los objetivos de RLD, muerte cardiaca e infarto de miocardio (IM)10. No obstante, 14 de los 15 estudios incluidos no eran ECA y el ECA citado anteriormente no fue incluido. En cualquier caso, los estudios individuales de no inferioridad a menudo carecen del potencial estadístico necesario para realizar comparativas concluyentes de estas tecnologías, lo cual pone de manifiesto la necesidad de una evaluación sistemática de los efectos del tratamiento y la calidad de la evidencia. En este sentido, se llevó a cabo una revisión sistemática y metanálisis de los ECA disponibles para realizar una evaluación integral y cuantitativa de la evidencia existente en torno a la eficacia de los BFA frente a los SFA de última generación en la EC de grandes vasos de novo en términos de eventos adversos en el seguimiento más largo disponible.
MÉTODOS
Estrategia de búsqueda y criterios de selección
Se realizó un metanálisis de ECA de conformidad con la declaración PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses) de 200911. Dos revisores identificaron de forma independiente los estudios más importantes a través de una búsqueda electrónica en las bases de datos MEDLINE y Embase (desde el principio hasta octubre de 2024). También se empleó el método de bola de nieve inversa (revisión bibliográfica de artículos identificados y revisiones pertinentes). No se impuso ninguna restricción idiomática, fecha ni estado de publicación. Este estudio está registrado en PROSPERO y la estrategia de búsqueda está disponible en el material adicional.
Selección de estudios
Dos revisores valoraron, de forma independiente, la elegibilidad de los ensayos en base a los títulos, resúmenes e informes de texto completo de estos. Las discrepancias en la selección de estudios se debatieron y resolvieron con un tercer investigador. Los estudios elegibles debían cumplir los siguientes criterios preespecificados: a) ECA que compararan ICP con BFA y con SFA; b) población de estudio que incluyera a pacientes con EC de grandes vasos de novo (definidos como aquellos con diámetros vasculares ≥ 2,5 mm)12; c) disponibilidad de datos sobre los objetivos del estudio (sin restricción en cuanto al tiempo de seguimiento). Los criterios de exclusión fueron a) la falta de un diseño aleatorizado; b) estudios que incluyeran a pacientes bajo tratamiento por reestenosis intrastent; c) estudios que incluyeran pacientes con EC de vasos pequeños de novo; d) la falta de datos sobre los objetivos del estudio.
Se estableció un diámetro del vaso de referencia ≥ 2,5 mm como valor de corte para definir los grandes vasos a una definición estandarizada propuesta recientemente12.
Obtención de datos
Tres investigadores (J. Llau García, S. Huélamo Montoro y J.A. Sorolla Romero) evaluaron de forma independiente los estudios para su posible inclusión. Por su parte, el investigador principal (J. Sanz-Sánchez) resolvió cualquier discrepancia que pudiese haber. Los artículos considerados irrelevantes fueron excluidos atendiendo a sus títulos y resúmenes. Los mismos investigadores obtuvieron de manera independiente los datos del diseño del estudio, mediciones, características de los pacientes y resultados empleando un formulario estandarizado para la obtención de datos. Los conflictos en la extracción de datos se debatieron y resolvieron con el investigador principal.
Se recopilaron datos sobre los autores, año de publicación, criterios de inclusión y exclusión, tamaño de la muestra, características basales de los pacientes, definiciones de los objetivos de los estudios, estimaciones del efecto y tiempo de seguimiento.
Objetivos
El objetivo primario preespecificado fue la RLD. Los objetivos secundarios, la mortalidad por cualquier causa, la muerte cardiaca, el infarto de miocardio (IM), la revascularización del vaso diana (RVD) y los eventos adversos cardiovasculares mayores (MACE). Los objetivos angiográficos secundarios fueron el diámetro luminal mínimo (DLM) y la pérdida luminal tardía (PLL). Cada objetivo se evaluó de conformidad con las definiciones descritas en los protocolos de estudio originales, tal y como se muestra en la tabla 1 del material adicional. Todos los objetivos se evaluaron en el seguimiento máximo disponible.
Tabla 1. Características principales de los estudios incluidos
| Estudio | Año de publicación | N.º de pacientes | Tipo de dispositivo | Diámetro del vaso de referencia (media ± DE) (mm) | Multicéntrico | Seguimiento clínico (meses) | Seguimiento angiográfico (meses) | |
|---|---|---|---|---|---|---|---|---|
| BFA | SFA | |||||||
| REC-CAGEFREE I7 | 2024 | 1.133 | 1.139 | Paclitaxel-BFA Sirolimus-SFA | 3,00 ± 0,55 | Sí | 24 | No |
| Nishiyama et al.13 | 2016 | 30 | 30 | Paclitaxel-BFA Everolimus-SFA | 2,80 ± 0,63 | No | 8 | 8 |
| Xue Yu et al.8 | 2022 | 85 | 85 | Paclitaxel-BFA Everolimus-SFA | 2,89 ± 0,33 | No | 12 | 9 |
| REVELATION9 | 2019 | 60 | 60 | Paclitaxel-BFA Sirolimus y everolimus SFA | 3,24 ± 0,50 | No | 24 | 9 |
| Gobic et al.15 | 2017 | 38 | 37 | Paclitaxel-BFA Sirolimus-SFA | > 2,50 | No | 6 | 6 |
| Hao et al.16 | 2021 | 38 | 42 | Paclitaxel-BFA ND | > 2,50 | No | 12 | 12 |
| Wang et al.14 | 2022 | 92 | 92 | Paclitaxel-BFA Sirolimus-SFA | 3,37 ± 0,52 | No | 12 | 9 |
|
BFA: balón farmacoactivo; ND: no disponible; SFA: stent farmacoactivo. |
||||||||
Riesgo de sesgo
El riesgo de sesgo en cada estudio se evaluó utilizando la herramienta revisada de riesgo de sesgo de Cochrane (RoB 2.0)11. Tres investigadores (J. Llau García, S. Huélamo Montoro y J. A. Sorolla Romero) evaluaron de forma independiente 5 dominios de sesgo en los ECA: a) proceso de aleatorización, b) desviaciones de las intervenciones previstas, c) datos de resultados faltantes, d) medición de resultados y e) selección de los resultados informados (tabla 2 del material adicional).
Tabla 2. Características clínicas basales de los pacientes incluidos
| Estudio | Edad (años) | Varones (%) | Diabetes (%) | Tabaquismo (%) | Hipertensión (%) | FEVI (%) | Presentación clínica (SCC/SCA) (%) | Multivaso (%) | Lesión compleja (%) |
|---|---|---|---|---|---|---|---|---|---|
| REC-CAGEFREE I7 | 62 | 69,3 | 27,3 | 45 | 60,1 | 60 | 44,9/55,3 | 4,8 | 0 |
| Nishiyama et al.13 | 69 | 73,3 | 41,6 | 60 | 83,3 | ND | 0/100 | ND | 36 |
| Xue Yu et al.8 | 63,3 | 69,3 | 24,1 | 54 | 63,9 | > 40 | 11,1/88,9 | 84 | 44,1 |
| REVELATION9 | 57 | 87 | 10 | 60 | 31 | 57,6 | 0/100 | 71,6 | ND |
| Gobic et al.15 | 57,4 | 87 | 10 | 49,5 | 33,4 | 50,2 | 0/100 | ND | ND |
| Hao et al.16 | 57,5 | 78,5 | 31,5 | 29,5 | 24 | 46 | 0/100 | ND | ND |
| Wang et al.14 | 49,5 | 93,5 | 81,6 | 81,5 | 71,8 | ND | 0/100 | ND | ND |
|
SCA: síndrome coronario agudo; SCC: síndrome coronario crónico; ND: no disponible. |
|||||||||
Análisis estadístico
Tanto las odds ratios (OR) como los intervalos de confianza del 95% (IC95%) se calcularon utilizando el modelo de efectos aleatorios de DerSimonian y Laird y la estimación de la heterogeneidad a partir del método de Mantel-Haenszel. La presencia de heterogeneidad entre los estudios se evaluó con la prueba de X2 Q de Cochran, considerándose un valor p ≤ 0,10 como estadísticamente significativo y utilizando la prueba I2 para la valoración de inconsistencias. Un valor de 0% es indicativo de ausencia de heterogeneidad y valores ≤ 25%, ≤ 50%, > 50% de un nivel de heterogeneidad bajo, moderado y alto, respectivamente. Se calcularon intervalos predictivos (95%) además de los IC95% convencionales alrededor de las OR para evaluar la incertidumbre residual. Se evaluó el sesgo de publicación y el efecto de estudio pequeño para todos los objetivos, empleando gráficos de embudo. La presencia de sesgo de publicación se investigó utilizando las pruebas de Harbord y Egger y la estimación visual con gráficos de embudo. Se realizó un análisis de sensibilidad eliminando un estudio cada vez para confirmar que, tras compararlos con los SFA, los hallazgos no eran fruto de un único estudio. Para dar cuenta de las diferentes duraciones del seguimiento entre los estudios, se realizó otro análisis de sensibilidad utilizando el modelo de regresión de Poisson con efectos de intervención aleatorios para calcular los promedios ponderados por la inversa de la varianza de las razones de tasa de incidencia (RTI) estratificadas logarítmicas específicas de cada estudio. Los resultados se expresaron como RTI, es decir, razones exponenciales del modelo de regresión. También se realizaron análisis de metarregresión de efectos aleatorios para evaluar el impacto de las siguientes variables en el efecto del tratamiento con respecto al objetivo primario: porcentaje de pacientes con síndrome coronario agudo (SCA) y diabetes mellitus, diámetro medio del vaso de referencia y duración del seguimiento. El nivel de significación estadística se situó en un valor de p bilateral < 0,05. Se empleó el software Stata versión 18.0 (StataCorp LP, College Station, Estados Unidos) en los análisis estadísticos.
RESULTADOS
Resultados de la búsqueda
La figura 1 ilustra tanto el proceso de búsqueda como la selección de estudios PRISMA. Se identificaron e incluyeron en este análisis un total de 7 ECA. Las características principales de los estudios incluidos se muestran en la tabla 1.
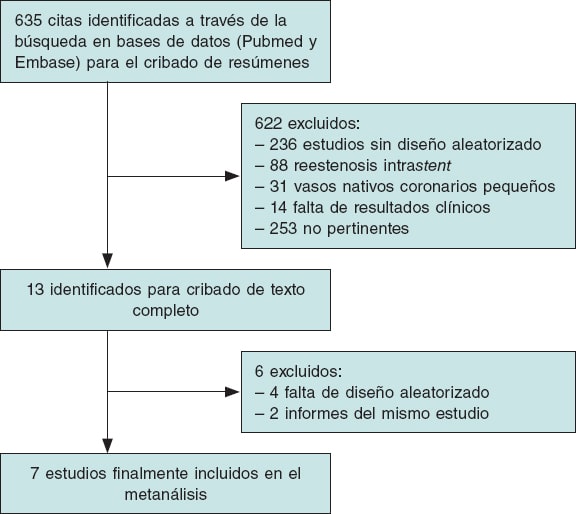
Figura 1. Diagrama de flujo de la búsqueda de estudios incluidos en el metanálisis de conformidad con la declaración PRISMA (Preferred Reporting Items for Systematic Reviews and Meta-Analyses).
Todos los estudios tuvieron un diseño de no inferioridad. Se seleccionó un objetivo primario en 1 estudio7 y otro funcional invasivo en otro estudio9; por su parte, los objetivos primarios angiográficos se preespecificaron en los estudios restantes8,13-16. El seguimiento clínico y angiográfico medio fue de 21,5 y 8,9 meses, respectivamente. Se realizaron 4 estudios en el contexto del SCA9,14-17 y 1 en el contexto de síndrome coronario crónico (SCC)13. Por último, 2 estudios incluyeron a pacientes con SCA y SCC7,8. Tres estudios incluyeron a pacientes tratados con SFA de segunda generación (Firebird 2.0 [Microport, China], Xience Xpedition [Abbott Vascular, Estados Unidos], Orsiro [Biotronik, Alemania])7,9,13 y 2 a pacientes tratados con SFA de tercera generación (Biomine [Meril Life Sciences, India], Cordimax [Rientech, China])14,15. Un estudio incluyó a pacientes tratados con SFA de segunda y tercera generación (Xience Xpedition [Abbott Vascular, Estados Unidos], Resolute Integrity [Medtronic, Estados Unidos], Firehawk [MicroPort, China])8. Todos los estudios incluyeron pacientes tratados de ICP con BFA de paclitaxel ([Pantera Lux, Biotronik, Alemania]9,14, [SeQuent Please, B Braun, Alemania]7,8,13,15, [Bingo DCB, Yinyi Biotech, China])16 y ninguno tratados con ICP y BFA de sirolimus.
Caracterúticas basales
Se incluyó a un total de 2.961 pacientes, 1.476 de los cuales recibieron BFA y 1.485, SFA para el tratamiento de la EC de grandes vasos de novo. Las principales características basales de los pacientes se muestran en la tabla 2.
Sesgo de publicación y asimetrúa
Las distribuciones de los gráficos de embudo pertenecientes a los resultados preespecificados indican la ausencia de sesgo de publicación para todos los resultados (figuras 1-8 del material adicional).
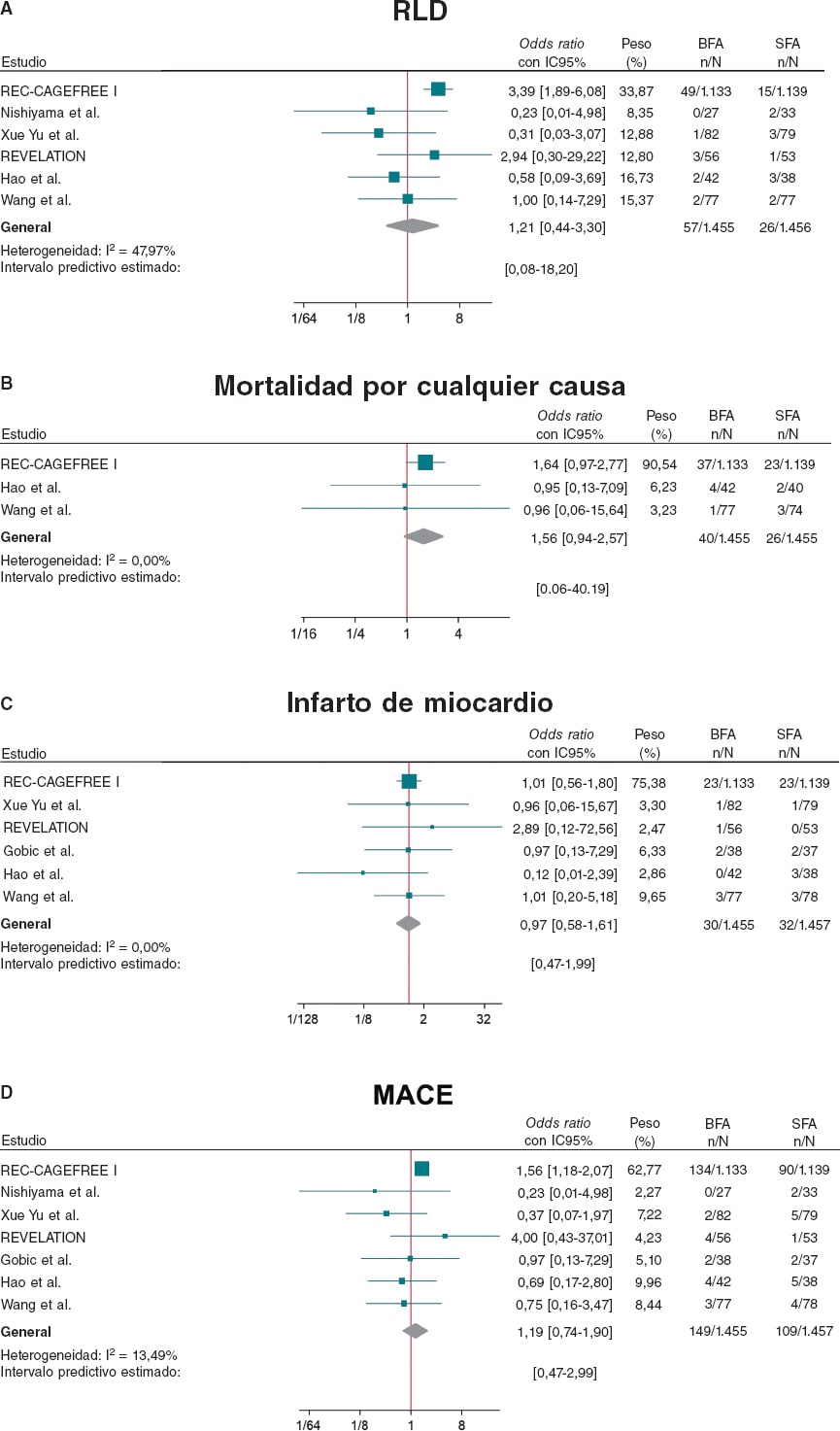
Figura 2. Diagrama de bosque con las OR específicas del ensayo y resumidas con IC95% para el objetivo de A: revascularización de la lesión diana; B: mortalidad por cualquier causa; C: infarto de miocardio; D: MACE. BFA: balón farmacoactivo; IC95%: intervalo de confianza del 95%; MACE: eventos cardiovasculares adversos mayores; OR: odds ratio; SFA: stent farmacoactivo. Las referencias bibliográficas mencionadas en esta Figura corresponden a: REC-CAGEFREE I7, Nishiyama et al.13, Xue Yu et al.8, REVELATION9, Hao et al.16, Wang et al.14 y Gobic et al.15.
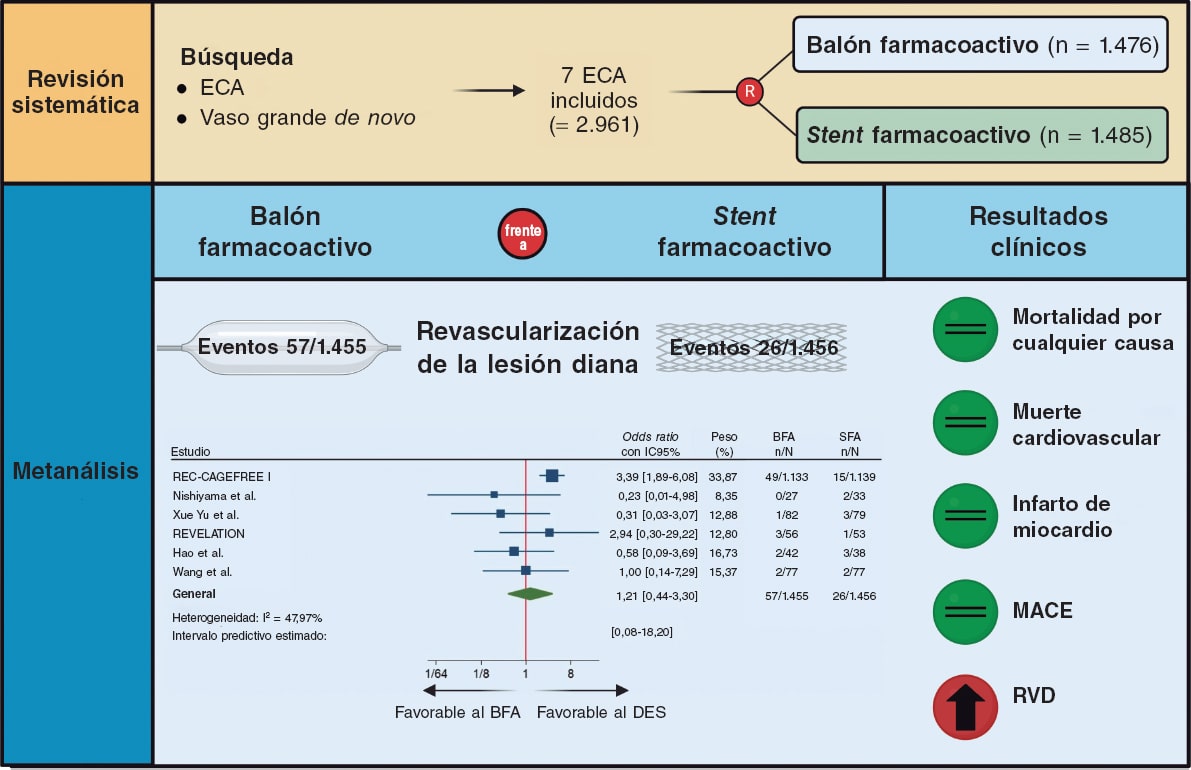
Figura 3. Figura central. BFA: balón farmacoactivo; ECA: ensayo clínico aleatorizado; RVD: revascularización del vaso diana; SFA: stent farmacoactivo. Las referencias bibliográficas mencionadas en esta Figura corresponden a: REC-CAGEFREE I7, Nishiyama et al.13, Xue Yu et al.8, REVELATION9, Hao et al.16 y Wang et al.14.
Resultados angiográficos:
Comparado con el SFA, el BFA produjo un DLM mucho menor (DME = −0,36; IC95%, −0,56 a −0,15; I2 = 34,5%) y un riesgo similar de PLL (DME = −0,35; IC95%, −0,74 a 0,04; I2 = 81,4%) en el seguimiento (figura 4).
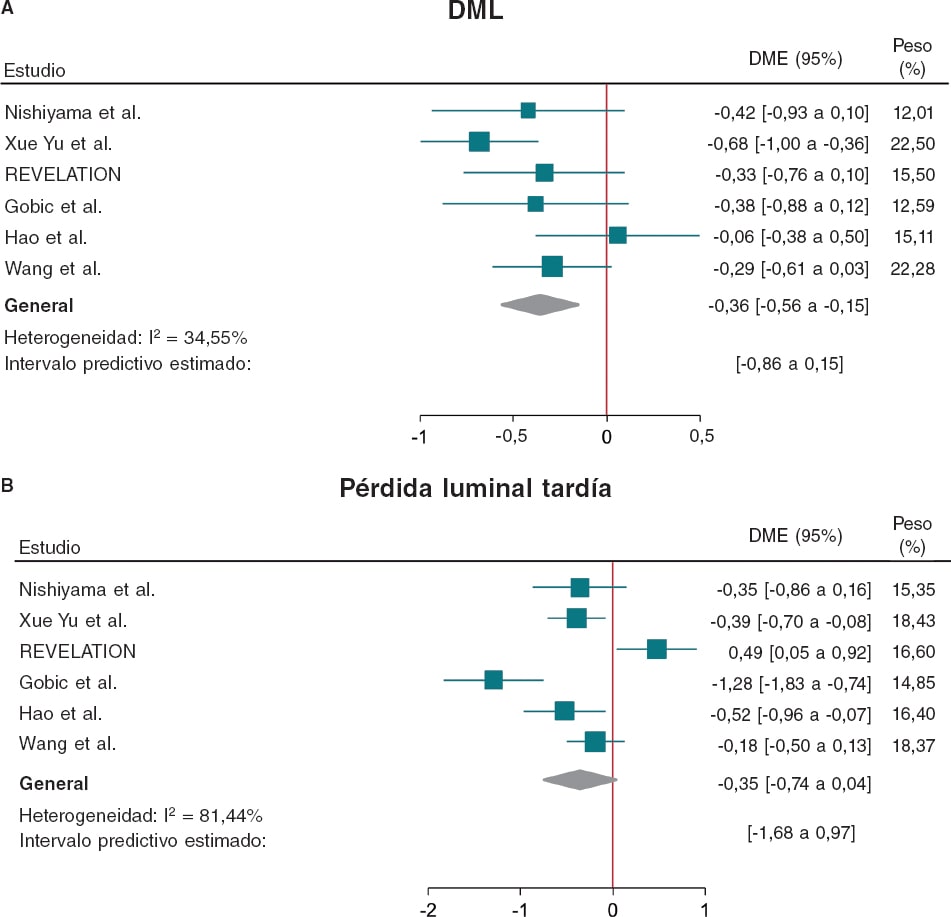
Figura 4. Diagrama de bosque con las OR específicas del ensayo y resumidas con IC95% para el objetivo de A: diámetro luminal mínimo y B: pérdida luminal tardía. BFA: balón farmacoactivo; IC95%: intervalo de confianza del 95%; DLM: diámetro luminal mínimo; DME: diferencia de medias estandarizada; MACE: eventos cardiovasculares adversos mayores; OR: odds ratio; SFA: stent farmacoactivo. Las referencias bibliográficas mencionadas en esta Figura corresponden a: Nishiyama et al.13, Xue Yu et al.8, REVELATION9, Gobic et al.15, Hao et al.16 y Wang et al.14.
Evaluación del riesgo de sesgo
La tabla 2 del material adicional muestra los resultados de la evaluación del riesgo de sesgo con la herramienta RoB 2.0. Un estudio se consideró de bajo riesgo general de sesgo7, 5 fueron preocupantes8,9,13,14,16 y 1 presentó, en líneas generales, un alto riesgo de sesgo15.
Resultados
Objetivos
Comparado con el SFA, el BFA se asoció a un riesgo similar de RLD (OR = 1,21; IC95%, 0,44-3,30; I2 = 48%), mortalidad por cualquier causa (OR = 1,56; IC95%, 0,94-2,57; I2 = 0%), muerte cardiaca (OR = 1,65; IC95%, 0,90-3,05; I2 = 0%), IM (OR = 0,97; IC95%, 0,58-1,61; I2 = 0%) y MACE (OR = 1,19; IC95%, 0,74-1,90; I2 = 13,5%). Por su parte, el BFA se asoció a un mayor riesgo de RVD (OR = 2,47; IC95%, 1,52-4,03; I2 = 0%) (figura 2, figura 3 y figuras 9-10 del material adicional).
Los intervalos predictivos coincidieron con los IC para todos los resultados, salvo para la RVD y el DLM, que incluyeron el valor de no diferencia.
Anáisis de sensibilidad
Se realizó un análisis conjunto de «dejar uno fuera» eliminando iterativamente, cada vez, un estudio para todos los objetivos. Los efectos del tratamiento coincidieron con el análisis principal para la RLD, la mortalidad por cualquier causa, la muerte cardiaca, el IM y el DLM. El riesgo de RVD ya no fue mucho mayor entre los pacientes tratados con BFA tras la eliminación del estudio CAGEFREE I7; por su parte, el riesgo de PLL fue mucho menor entre los pacientes tratados con ICP con BFA tras eliminar el estudio REVELATION9. No obstante, hubo un mayor riesgo de MACE entre los pacientes tratados con ICP con BFA tras la eliminación del estudio de Xue Yu et al.18 (tablas 3-10 del material adicional). El análisis de sensibilidad que se realizó con RTI calculadas para dar cuenta de las diferentes duraciones del seguimiento confirmó que nuestros hallazgos del análisis principal no sufrieron ningún cambio (tabla 11 del material adicional).
El análisis de metarregresión de efectos aleatorios no halló un impacto significativo de la proporción de pacientes con SCA (p = 0,882), diabetes mellitus (p = 0,641), diámetro medio del vaso de referencia (p = 0,985) y duración del seguimiento (p = 0,951) en el efecto del tratamiento con relación al objetivo primario.
DISCUSIÓN
Este metanálisis proporciona un completo y actualizado análisis cuantitativo de la evidencia disponible sobre la comparativa de BFA frente a SFA en el tratamiento de la EC de grandes vasos de novo e incluyó datos de 2.961 pacientes de 7 ECA. Los hallazgos principales del estudio son:
a) El uso del BFA se asoció a un riesgo similar de eventos clínicos frente al SFA, salvo para la RVD. No obstante, los datos de este resultado solo estuvieron disponibles en 3 de los 7 estudios incluidos y el mayor riesgo observado en pacientes tratados de ICP con BFA no fue significativo tras la eliminación del estudio CAGEFREE I. Por su parte, los intervalos predictivos no coincidieron con el IC. En este sentido, los resultados de este desenlace se deben interpretar con cautela.
b) El efecto del BFA sobre el riesgo de RLD no se vio influido por la proporción de pacientes con SCA o diabetes ni por el diámetro medio del vaso de referencia, así como tampoco por la duración del seguimiento, según lo evaluado por el análisis de metarregresión.
c) Aunque los BFA se asociaron a un menor DLM durante el seguimiento angiográfico, la PLL fue parecida a la del SFA.
Los SFA son el patrón oro en pacientes tratados de ICP. No obstante, todavía se observan complicaciones tales como trombosis del stent y reestenosis intrastent con tasas cercanas al 0,7-1% y 5-10% tras 10 años de seguimiento, respectivamente19,20. En este sentido, en los últimos años ha aumentado la preocupación en torno al desarrollo de estrategias para reducir los eventos adversos asociados al stent. En este contexto, el BFA se erige como una posible alternativa de tratamiento a partir de una estrategia de «no dejar nada atrás». No obstante, los datos de pacientes con EC de grandes vasos de novo son pocos y contradictorios. El CAGEFREE I es el único ECA disponible con potencial clínico que incluyó a un total de 2.272 pacientes revascularizados por EC no compleja de novo en 40 centros chinos. La estrategia de ICP con BFA no logró la no inferioridad frente al SFA en lo que respecta al objetivo combinado orientado al dispositivo, impulsado por tasas más altas de RLD en el grupo de ICP con BFA (3,1 frente al 1,2%, p = 0,002)7. Por otro lado, un ECA unicéntrico realizado por Nishiyama et al. de 60 pacientes con SCC tratados de ICP electiva mostró una tendencia hacia tasas más bajas de RLD en el grupo de ICP con BFA (0 frente al 6,1%, p = 0,193) en el seguimiento de 8 meses de duración13. Asimismo, un ECA que incluyó a 170 pacientes tratados de ICP por EC de grandes vasos de novo halló tasas más bajas de RLD en el seguimiento de 12 meses en pacientes tratados de ICP con BFA (1,6 frente al 3,4%, p = 0,306)14. En nuestro análisis, al agrupar los datos de todos los ECA disponibles, el riesgo de RLD fue similar entre pacientes tratados de ICP con BFA o SFA. Se debe mencionar que, como este resultado se obtuvo con una heterogeneidad moderada (I2 ≈ 50%), se debe interpretar con cautela a la hora de cualquier posible extrapolación. Estos hallazgos se mantuvieron inalterados en el análisis de «dejar uno fuera». Además, los intervalos de predicción coincidieron con los IC alrededor de las OR, lo cual demuestra la ausencia de incertidumbre residual. Estudios previos han demostrado que la reestenosis intrastent que sobreviene tras desplegar un SFA no es un fenómeno benigno y se presenta como un SCA en torno al 70% de los casos, resultando entre un 5 y 10% de estos en IM21. Se puede argumentar que la ausencia de un armazón permanente en el BFA frente al SFA predispone a un patrón de reestenosis menos agresivo y a un menor riesgo de oclusión trombótica del vaso > 3 meses después de la cicatrización del vaso tras la ICP con BFA22.
Se debe mencionar que 5 de los 7 estudios de este metanálisis incluyeron a pacientes con SCA. El 34% de los pacientes incluidos en el estudio CAGEFREE presentaban SCA y el 16%, IAMCEST7. Otros 4 estudios solo incluyeron a pacientes con IAMCEST7,9,14-16. Aunque se desconoce el rendimiento de los BFA en el contexto del IAMCEST, su uso está cada vez más extendido en la práctica clínica23. Las placas de la lesión culpable en pacientes con IAMCEST suelen ser blandas y una modificación adecuada de la placa se puede lograr fácilmente mediante ICP con BFA (< 30% de estenosis residual y un grado de disección bajo)23. Además, la placa rica en lípidos rota puede convertirse en un reservorio ideal para una captación efectiva de paclitaxel24. Por otro lado, los BFA se asocian a ciertos riesgos en pacientes con IAMCEST, tales como retroceso agudo y oclusión de la lesión culpable al no contar con un armazón vascular.
En nuestro estudio, la proporción de pacientes con SCA no influyó en los efectos del tratamiento en el análisis de metarregresión. No obstante, se necesitan más ECA con un tamaño de muestra adecuado para contar con evidencias más sólidas sobre esta cuestión. Se debe mencionar que las lesiones complejas, tales como la calcificación grave y las bifurcaciones con técnica programada de doble stent fueron excluidas de los estudios de pacientes con SCC7,8. En este sentido, nuestros hallazgos podrían no ser extrapolables a esta población.
Los mejores resultados angiográficos indirectos obtenidos con ICP con SFA frente a BFA en nuestro metanálisis tras recopilar los datos de 6 estudios podrían explicarse por la ausencia de un armazón metálico para expandir la luz del vaso, así como por el retroceso agudo tras la angioplastia con balón. Esto justifica el menor DLM alcanzado tras la ICP con BFA frente a SFA. Aunque nuestro análisis no mostró diferencias significativas con respecto a la PLL durante el seguimiento, el valor de esta fue menor en pacientes tratados de ICP con BFA tras la eliminación del estudio REVELATION9,17. Este estudio mostró una PLL muy baja tanto en los grupos de BFA como de SFA comparado con otra evidencia disponible de ECA15,16. La presencia de remodelado vascular positivo con agrandamiento tardío de la luz tras el uso del BFA, evaluado mediante técnicas de imagen intracoronarias, se ha evidenciado en muchos estudios y parece estar asociado a la enfermedad de vasos pequeños, placas fibrosas y estratificadas y un arco de disección medial pos-ICP > 90°25-27. No obstante, la evidencia de este fenómeno en pacientes con EC de grandes vasos es menos conocida22. En este sentido, se debe mencionar que todos los estudios de este metanálisis utilizaron BFA de paclitaxel. Aunque la evidencia derivada de una comparativa entre el BFA de sirolimus y paclitaxel es escasa, 2 recientes ECA han hallado mejores resultados angiográficos con el componente lipofílico. En el primero, de 121 pacientes con EC de vasos pequeños de novo, el BFA de sirolimus no logró la no inferioridad para la ganancia neta de luz a los 6 meses28. En el segundo, de 70 pacientes, los 2 dispositivos mostraron resultados similares de PLL a los 6 meses, aunque en pacientes tratados con BFA de paclitaxel el agrandamiento luminal tardío fue un fenómeno más habitual29. Debido al pequeño tamaño de la muestra y aunque no hay suficiente evidencia para evaluar las diferencias entre los objetivos clínicos, no se puede suponer que haya un efecto de clase en todos los BFA. Se están realizando extensos ECA para evaluar los resultados de los BFA de sirolimus frente a los SFA en grandes vasos de los que obtendremos evidencias a este respecto30,31.
Limitaciones
Los resultados de nuestra investigación se deben interpretar teniendo en cuenta algunas limitaciones. En primer lugar, se trata de un metanálisis de estudios que proporciona los efectos promedio del tratamiento. La falta de datos a nivel de pacientes de los estudios incluidos nos impide evaluar el impacto de las características basales clínicas, angiográficas y asociadas a la intervención en los efectos del tratamiento. En segundo lugar, se observaron pequeñas diferencias en la definición de algunos objetivos (por ejemplo, MACE), lo cual limita la fiabilidad de las estimaciones del efecto. En tercer lugar, un estudio representativo del 75% de todos los pacientes incluidos no incluyó seguimiento angiográfico7, lo cual limita la evaluación del BFA y SFA en los resultados angiográficos. En cuarto lugar, el seguimiento clínico fue de entre 6 y 24 meses. Lo ideal es que resultados como la RLD se comparen en seguimientos uniformes entre los distintos estudios (por ejemplo, al año), algo que no fue consistentemente posible en el presente análisis. No obstante, estas diferencias en la duración del seguimiento se tuvieron en cuenta con las RTI, tal y como se detalla en la sección Métodos. En cualquier caso, se necesitan seguimientos más largos para establecer el perfil de seguridad y eficacia del BFA frente al SFA a lo largo del tiempo. En quinto lugar, la definición de vaso grande fue inconsistente entre los estudio y, por lo tanto, una posible fuente de sesgo. Por último, el número limitado de estudios y pacientes y la baja tasa de eventos para objetivos tales como la mortalidad por cualquier causa, podrían minimizar el potencial estadístico necesario para detectar diferencias significativas entre los distintos grupos.
CONCLUSIONES
Este metanálisis proporciona la evidencia cuantitativa más actualizada hasta la fecha sobre el uso de BFA frente a SFA en el tratamiento de la EC de grandes vasos de novo tanto en el SCC como en el SCA. La ICP con BFA se asocia a una RLD y PLL similares en el seguimiento a medio plazo como una opción de tratamiento atractiva para pacientes con EC de grandes vasos.
FINANCIACIáN
Ninguna.
CONSIDERACIONES ÉTICAS
La aprobación ética se consideró innecesaria para este metanálisis, ya que todos los datos se recopilaron y sintetizaron de estudios previos. Tampoco se consideró necesario obtener el consentimiento informado ya que nuestro trabajo no implicó a ningún paciente en concreto. El metanálisis de ECA se realizó de conformidad con la declaración PRISMA de 2009. Confirmamos haber tenido en cuenta los sesgos de sexo/género.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se ha utilizado inteligencia artificial en la preparación de este artículo.
CONTRIBUCIÓN DE LOS AUTORES
J. Llau García, S. Huélamo Montoro y J.A. Sorolla Romero participaron en la investigación bibliográfica y selección de estudios. J.A. Sorolla Romero, L. Novelli y J. Sanz Sánchez contribuyeron a la concepción, diseño, redacción y revisión del artículo. P. Rubio, J.L. Luis Díez Gil, L. Martínez-Dolz, I.J. Amat Santos, B. Cortese, F. Alfonso y H.M. Garcia-Garcia contribuyeron a la revisión crítica del contenido intelectual del artículo.
CONFLICTO DE INTERESES
F. Alfonso es editor asociado de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. Los autores no declararon ninguna relación importante con el contenido del presente artículo.
¿QUÉ SE SABE DEL TEMA?
- Los BFA son un tratamiento bien establecido para pa- cientes con EC de vasos pequeños.
- La evidencia publicada disponible de pacientes con EC de grandes vasos de novo es escasa y ofrece resultados contradictorios.
¿QUÉ APORTA DE NUEVO?
- En el presente metanálisis, con datos de 2.961 pacientes de 7 ECA, los BFA mostraron un riesgo similar de eventos clínicos en el seguimiento que los SFA en el tratamiento de la EC de grandes vasos de novo.
- El uso del BFA podría considerarse una opción alternativa al SFA en pacientes tratados de ICP por EC no compleja de grandes vasos de novo.
BIBLIOGRAFÍA
1. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
2. Lawton JS, Tamis-Holland JE, Bangalore S, et al. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization:Executive Summary:A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022;145:e4-e17.
3. Kong MG, Han JK, Kang JH, et al. Clinical outcomes of long stenting in the drug-eluting stent era:patient-level pooled analysis from the GRAND-DES registry. EuroIntervention J Eur Collab Work Group Interv Cardiol Eur Soc Cardiol. 2021;16:1318-1325.
4. Kawai T, Watanabe T, Yamada T, et al. Coronary vasomotion after treatment with drug-coated balloons or drug-eluting stents:a prospective, open-label, single-centre randomised trial. EuroIntervention. 2022;18:e140?e148.
5. Jeger RV, Eccleshall S, Wan Ahmad WA, et al. Drug-Coated Balloons for Coronary Artery Disease:Third Report of the International DCB Consensus Group. JACC Cardiovasc Interv. 2020;13:1391-1402.
6. Sanz Sánchez J, Chiarito M, Cortese B, et al. Drug-Coated balloons vs drug-eluting stents for the treatment of small coronary artery disease:A meta-analysis of randomized trials. Catheter Cardiovasc Interv Off J Soc Card Angiogr Interv. 2021;98:66-75.
7. Gao C, He X, Ouyang F, et al. Drug-coated balloon angioplasty with rescue stenting versus intended stenting for the treatment of patients with de novo coronary artery lesions (REC-CAGEFREE I):an open-label, randomised, non-inferiority trial. Lancet Lond Engl. 2024;404:1040-1050.
8. Yu X, Wang X, Ji F, et al. A Non-inferiority, Randomized Clinical Trial Comparing Paclitaxel-Coated Balloon Versus New-Generation Drug-Eluting Stents on Angiographic Outcomes for Coronary De Novo Lesions. Cardiovasc Drugs Ther. 2022;36:655-664.
9. Vos NS, Fagel ND, Amoroso G, et al. Paclitaxel-Coated Balloon Angioplasty Versus Drug-Eluting Stent in Acute Myocardial Infarction:The REVELATION Randomized Trial. JACC Cardiovasc Interv. 2019;12:1691-1699.
10. Gobbi C, Giangiacomi F, Merinopoulos I, et al. Drug coated balloon angioplasty for de novo coronary lesions in large vessels:a systematic review and meta-analysis. Sci Rep. 2025;15:4921.
11. Moher D, Liberati A, Tetzlaff J, Altman DG, PRISMA Group. Preferred reporting items for systematic reviews and meta-analyses:the PRISMA statement. BMJ. 2009;339:b2535.
12. Sanz-Sánchez J, Chiarito M, Gill GS, et al. Small Vessel Coronary Artery Disease:Rationale for Standardized Definition and Critical Appraisal of the Literature. J Soc Cardiovasc Angiogr Interv. 2022;1:100403.
13. Nishiyama N, Komatsu T, Kuroyanagi T, et al. Clinical value of drug-coated balloon angioplasty for de novo lesions in patients with coronary artery disease. Int J Cardiol. 2016;222:113-118.
14. Wang Z, Yin Y, Li J, et al. New Ultrasound-Controlled Paclitaxel Releasing Balloon vs. Asymmetric Drug-Eluting Stent in Primary ST-Segment Elevation Myocardial Infarction-A Prospective Randomized Trial. Circ J Off J Jpn Circ Soc. 2022;86:642-650.
15. Gobic´D, Tomulic´V, Lulic´D, et al. Drug-Coated Balloon Versus Drug-Eluting Stent in Primary Percutaneous Coronary Intervention:A Feasibility Study. Am J Med Sci. 2017;354:553-560.
16. Hao X, Huang D, Wang Z, Zhang J, Liu H, Lu Y. Study on the safety and effectiveness of drug-coated balloons in patients with acute myocardial infarction. J Cardiothorac Surg. 2021;16:178.
17. Niehe SR, Vos NS, Van Der Schaaf RJ, et al. Two-Year Clinical Outcomes of the REVELATION Study:Sustained Safety and Feasibility of Paclitaxel-Coated Balloon Angioplasty Versus Drug-Eluting Stent in Acute Myocardial Infarction. J Invasive Cardiol. 2022;34:E39-E42.
18. Xue W, Ma J, Yu X, et al. Analysis of the incidence and influencing factors associated with binary restenosis of target lesions after drug-coated balloon angioplasty for patients with in-stent restenosis. BMC Cardiovasc Disord. 2022;22:493.
19. Coughlan JJ, Maeng M, Räber L, et al. Ten-year patterns of stent thrombosis after percutaneous coronary intervention with new- versus early-generation drug-eluting stents:insights from the DECADE cooperation. Rev Esp Cardiol. 2022;75:894-902.
20. Madhavan MV, Redfors B, Ali ZA, Prasad M, et al. Long-Term Outcomes After Revascularization for Stable Ischemic Heart Disease:An Individual Patient-Level Pooled Analysis of 19 Randomized Coronary Stent Trials. Circ Cardiovasc Interv.2020;13:e008565.
21. Buchanan KD, Torguson R, Rogers T, et al. In-Stent Restenosis of Drug-Eluting Stents Compared With a Matched Group of Patients With De Novo Coronary Artery Stenosis. Am J Cardiol. 2018;121:1512-1518.
22. Antonio Sorolla Romero J, Calderón AT, Tschischke JPV, Luis Díez Gil J, Garcia-Garcia HM, Sánchez JS. Coronary plaque modification and impact on the microcirculation territory after drug-coated balloon angioplasty:the PLAMI study. Rev Esp Cardiol. 2025;78:481-482.
23. Merinopoulos I, Gunawardena T, Corballis N, et al. Assessment of Paclitaxel Drug-Coated Balloon Only Angioplasty in STEMI. JACC Cardiovasc Interv. 2023;16:771-779.
24. Maranhão RC, Tavares ER, Padoveze AF, Valduga CJ, Rodrigues DG, Pereira MD. Paclitaxel associated with cholesterol-rich nanoemulsions promotes atherosclerosis regression in the rabbit. Atherosclerosis. 2008;197:959-966.
25. Kleber FX, Schulz A, Waliszewski M, et al. Local paclitaxel induces late lumen enlargement in coronary arteries after balloon angioplasty. Clin Res Cardiol Off J Ger Card Soc. 2015;104:217-225.
26. Alfonso F, Rivero F. Late lumen enlargement after drug-coated balloon therapy:turning foes into friends. EuroIntervention J Eur Collab Work Group Interv Cardiol Eur Soc Cardiol. 2024;20:523-525.
27. Yamamoto T, Sawada T, Uzu K, Takaya T, Kawai H, Yasaka Y. Possible mechanism of late lumen enlargement after treatment for de novo coronary lesions with drug-coated balloon. Int J Cardiol. 2020;321:30-37.
28. Ninomiya K, Serruys PW, Colombo A, et al. A Prospective Randomized Trial Comparing Sirolimus-Coated Balloon With Paclitaxel-Coated Balloon in De Novo Small Vessels. JACC Cardiovasc Interv. 2023;16:2884-2896.
29. Ahmad WAW, Nuruddin AA, Abdul KMASK, et al. Treatment of Coronary De Novo Lesions by a Sirolimus- or Paclitaxel-Coated Balloon. JACC Cardiovasc Interv. 2022;15:770-779.
30. Spaulding C, Krackhardt F, Bogaerts K, et al. Comparing a strategy of sirolimus-eluting balloon treatment to drug-eluting stent implantation in de novo coronary lesions in all-comers:Design and rationale of the SELUTION DeNovo Trial. Am Heart J. 2023;258:77-84.
31. Greco A, Sciahbasi A, Abizaid A, et al. Sirolimus-coated balloon versus everolimus-eluting stent in de novo coronary artery disease:Rationale and design of the TRANSFORM II randomized clinical trial. Catheter Cardiovasc Interv Off J Soc Card Angiogr Interv. 2022;100:544-552.

