RESUMEN
El estudio de la fisiología coronaria ha pasado de ser una técnica de investigación hace algunos años a convertirse en una herramienta necesaria para el abordaje óptimo de los pacientes con enfermedad coronaria epicárdica y para evaluar la microcirculación. La realización de estas técnicas requiere el uso de una guía de presión para la que hacen falta medios técnicos, tiempo y práctica en su ejecución, y es en parte por ello que su utilización es baja. Existe la necesidad de conocer la evidencia actualizada, las técnicas disponibles y la forma idónea de aplicarlas para ofrecer el mayor beneficio a los pacientes. Esta revisión ofrece un resumen práctico sobre el estado actual de los estudios de fisiología coronaria, con el fin de facilitar el mejor uso posible de esta herramienta diagnóstica esencial.
Palabras clave: Enfermedad coronaria. Fisiología coronaria. Angina microvascular.
ABSTRACT
The study of coronary physiology has evolved from a research topic to a necessary component for the optimal management of patients with coronary artery disease when assessing both epicardial and microvascular coronary segments. The performance of these techniques requires the use of pressure wires with additional supporting systems, time, and practice, which explains the overall low rate of usage. It is essential to know the updated evidence, the techniques available, and how to perform them properly to offer the greatest possible benefit to our patients. This review provides a practical overview on coronary physiology, and it is ultimately aimed at improving the quality of care.
Keywords: Coronary artery disease. Coronary physiology. Microvascular angina.
Abreviaturas CFR: reserva flujo coronario. iFR: índice instantáneo sin ondas. IMR: índice de resistencia microcirculatoria. Pd/Pa: cociente de presión coronaria distal/aórtica. QFR: cociente de flujo cuantitativo. RFF: reserva fraccional de flujo. RMh: resistencia microvascular hiperémica. SCA: síndrome coronario agudo.
INTRODUCCIÓN
Durante décadas, la angiografía ha sido el método de referencia para diagnosticar la enfermedad coronaria. Sin embargo, es una técnica que ignora la repercusión fisiológica de las estenosis coronarias epicárdicas. Por ello, desde finales del siglo xx se despertó un gran interés por caracterizar funcionalmente la circulación coronaria gracias al desarrollo de varias herramientas, tanto invasivas (guías intracoronarias específicas) como no invasivas (índices derivados de la angiografía). Tal es así que hemos asistido a un cambio de paradigma en el diagnóstico y el manejo de la enfermedad coronaria, que ha llevado a pasar de una estrategia basada en la angiografía a una estrategia basada en la isquemia1. Esto ha sido posible gracias a la abundante evidencia científica que avala el uso de índices fisiológicos y que ha hecho que la estrategia basada en la isquemia alcance el grado máximo de recomendación en las últimas guías europeas de revascularización miocárdica2. Sin embargo, la publicación reciente de algunos ensayos clínicos ha cuestionado el impacto de la fisiología coronaria en determinados escenarios, como la enfermedad multivaso y el síndrome coronario agudo (SCA) con elevación del segmento ST3,4. Por otro lado, estas técnicas requieren tiempo, instrumentación invasiva coronaria y, en ocasiones, la administración de fármacos vasodilatadores que no siempre son bien tolerados por los pacientes, además de cierta experiencia clínica. Por todo ello, la adopción de las técnicas de fisiología para guiar la revascularización continúa lejos de ser mayoritaria5.
En los siguientes párrafos se analizan, con un enfoque práctico, las valoraciones fisiológicas de las estenosis coronarias y de la microcirculación mediante índices invasivos e índices derivados de la angiografía. Los detalles de los conceptos fisiológicos subyacentes a cada índice serán obviados o se indicarán textos específicos para su consulta.
Valoración fisiológica de las estenosis coronarias
Índices invasivos
La reserva fraccional de flujo coronario (RFF) es el flujo sanguíneo miocárdico máximo en presencia de una estenosis respecto al flujo normal esperado en ausencia de estenosis; se expresa como una fracción de su valor normal esperado. Se obtiene midiendo la presión intracoronaria con guías específicamente desarrolladas para tal fin. Su determinación requiere la vasodilatación de la microcirculación mediante el uso de fármacos, principalmente adenosina —se ha descrito el uso de regadenosón intravenoso y nitroprusiato intracoronario con resultados equivalentes6, así como la medición del cociente de presión coronaria distal/aórtica (Pd/Pa) mínimo tras la inyección de contraste intracoronario (cRFF)7— y, por lo tanto, se trata de un índice fisiológico coronario hiperémico. Se basa en que en situación de hiperemia máxima se alcanza una relación lineal entre el flujo relativo y la presión intracoronaria relativa, ya que la resistencia coronaria es estable y mínima8. Su resultado es independiente de la microcirculación, la frecuencia cardiaca, la presión arterial y otras variables hemodinámicas. La guía europea para el abordaje del síndrome coronario crónico le otorga una indicación de tipo I y una evidencia de clase A para la estratificación del riesgo en pacientes sintomáticos que no responden de manera adecuada al tratamiento médico y en pacientes asintomáticos en quienes las pruebas no invasivas muestran alto riesgo de eventos, y de tipo IIa en aquellos en los que los resultados de las pruebas no invasivas son no concluyentes1.
En la tabla 1 se encuentra un resumen de los diferentes estudios FAME (Fractional Flow Reserve versus Angiography for Multivessel Evaluation)4,9-11. Los resultados refuerzan la necesidad de continuar investigando en el campo de la fisiología y de individualizar el tratamiento de los pacientes dentro de un equipo multidisciplinario.
Tabla 1. Resumen de los resultados de los estudios FAME
| Estudio | Año | n | Población | Comparación | Seguimiento | Objetivo primario | Muerte | Infarto de miocardio | Nueva revascularización | Otros resultados |
|---|---|---|---|---|---|---|---|---|---|---|
| FAME9 | 2009 | SCC: 677 AI: 328 | Estenosis ≥ 50% en 2 o más vasos, consideradas para ICP | ICP con DES guiada por angiografía frente a guiada por RFF (≤ 0,80) | 1 año | Muerte, IAM, nueva revascularización: 13,2 frente a 18,3%; HR = 0,72; IC95%, 0,54-0,96 | 1,8 frente a 3,0%; HR = 0,58; IC95%, 0,26-1,32 | 5,7 frente a 8,7%; HR = 0,66; IC95%, 0,42-1,04 | 6,5 frente a 9,5%; HR = 0,68; IC95%, 0,45-1,05 | Sin diferencias en eventos por separado Sin diferencias en tasa de angina Menor uso de recursos con RFF |
| FAME II10 | 2012 | SCC: 888 | ≥ 1 estenosis en una arteria coronaria epicárdica con RFF ≤ 0,80 | ICP con stents de 2.a generación y TMO frente a TMO | 7 meses (media) | Muerte, IAM, revascularización urgente: 4,3 frente a 12,7%; HR = 0,32; IC95%, 0,19-0,53 | 0,2 frente a 0,7%; HR = 0,33; IC95%, 0,03-3,17 | 3,4 frente a 3,2%; HR = 1,05; IC95%, 0,51-2,19 | Urgente: 1,6 frente a 11,1%; HR = 0,13; IC95%, 0,06-0,30 No urgente: 1,6 frente a 8,6%; HR = 0,17; IC95%, 0,08-0,39 | Sin diferencias significativas en combinado de muerte y IAM, ni en muerte de origen cardiaco |
| FAME II - 5 años11 | 2018 | SCC: 888 | ≥ 1 estenosis en una arteria coronaria epicárdica con RFF ≤ 0,80 | ICP con stents de 2.ª generación y TMO frente a TMO | 5 años | Muerte, IAM, revascularización urgente: 13,9 frente a 27,0%; HR = 0,46; IC95%, 0,34-0,63 | 5,1 frente a 5,2%; HR = 0,98; IC95%, 0,55-1,75 | 8,1 frente a 12,0%; HR = 0,66; IC95%, 0,43-1,00 | Urgente: 6,3 frente a 21,1%; HR = 0,25; IC95%, 0,18-0,41 No urgente: 7,6 frente a 35,1%; HR = 0,18; IC95%, 0,12-0,26 | Sin diferencias significativas en muerte y IAM El porcentaje de pacientes con angina es menor durante los 3 primeros años; la diferencia no es significativa a los 5 años |
| FAME III4 | 2022 | SCC: 1500 | Enfermedad de 3 vasos | Diseño de no inferioridad: ICP guiada por RFF (≤ 0,80) frente a cirugía de revascularización coronaria | 1 año | Muerte, IAM, ictus, nueva revascularización: 10,6 frente a 6,9%; HR = 1,5; IC95%, 1,1-2,2; p = 0,35 para no inferioridad | 1,6 frente a 0,9%; HR = 1,7; IC95%, 0,7-4,3 | 5,2 frente a 3,5%; HR = 1,5; IC95%, 0,9-2,5 | 5,9 frente a 3,9%; HR = 1,5; IC95%, 0,9-2,3 | Sin diferencias significativas en combinado de muerte, infarto e ictus Menos sangrado mayor, daño renal, FA y rehospitalización a 30 días con ICP |
|
AI: angina inestable; DES: stent liberador de fármacos; FA: fibrilación auricular; FAME: Fractional Flow Reserve Versus Angiography for Multivessel Evaluation; RFF: reserva fraccional de flujo; HR: hazard ratio; IAM: infarto agudo de miocardio; IC95%: intervalo de confianza del 95%; ICP: intervención coronaria percutánea; SCC: síndrome coronario crónico; TMO: tratamiento médico óptimo. |
||||||||||
La hiperemia, especialmente la obtenida con adenosina intravenosa, necesaria para la obtención de la RFF, requiere tiempo, es costosa, altera la hemodinámica sistémica y puede provocar efectos secundarios desagradables (trastornos de la conducción, malestar torácico, náuseas, disnea, mareos, sofocos y cefalea). Por ello, desde su introducción, los índices de reposo, que no requieren fármacos hiperémicos, rápidamente ganaron popularidad. En general, estos índices son fásicos, a diferencia de la RFF (que se basa en presiones medias), y se miden en la parte media o tardía del periodo diastólico, cuando de manera natural hay mayor flujo transestenótico6. Aunque la primera descripción de un índice de reposo la realizaron Grüntzig et al.12 en su publicación inicial de la angioplastia coronaria, su uso clínico no se extendió hasta la aparición del índice instantáneo sin ondas (iFR, Philips, Países Bajos). Se llevaron a cabo varios estudios para comparar la concordancia diagnóstica del iFR y la RFF, así como para comparar el iFR, la RFF y otros parámetros de referencia de isquemia13,14. Dos ensayos clínicos multicéntricos aleatorizados, el DEFINE-FLAIR (Functional Lesion Assessment of Intermediate Stenosis to Guide Revascularization) y el iFR-SWEDEHEART (Evaluation of iFR vs RFF in Stable Angina or Acute Coronary Syndrome) aleatorizaron a 4.529 pacientes para ser tratados mediante revascularización percutánea guiada por RFF o por iFR, tanto con SCA como con síndrome coronario crónico15,16. Ambos estudios demostraron la no inferioridad del iFR respecto a la RFF, con bajas tasas de eventos, definidos como muerte por todas las causas, infarto agudo de miocardio o revascularización no planeada a 1 año: iFR 4,12% frente a RFF 4,05% (hazard ratio [HR] = 1,13; intervalo de confianza del 95% (IC95%), 0,72-1,79; p = 0,60). Además, en los grupos de iFR, el número de estenosis funcionalmente significativas y las tasas de revascularización fueron inferiores, la duración de la intervención fue menor y hubo un porcentaje más bajo de pacientes que sufrieron síntomas adversos asociados a la administración de adenosina15,16. En los últimos años se han desarrollado diferentes índices de reposo, fundamentados en el concepto descrito previamente: DFR (Diastolic Hyperaemia-Free Ratio, Boston Scientific, Estados Unidos)17 y cociente de presiones diastólicas en reposo (dPR) (ACIST, Estados Unidos)18,19. Con la excepción del ciclo cardiaco completo en reposo (RFR) (Abbott, Estados Unidos)18, que es un índice no hiperémico que valora la presión a lo largo de todo el ciclo cardiaco (tabla 2), todos los índices de reposo tienen una alta reproducibilidad y son idénticos al iFR, tanto numéricamente como en su concordancia con la RFF19. La capacidad pronóstica de la relación Pd/Pa es menos robusta que la RFF21, pues su correlación con la RFF en lesiones no culpables de pacientes que han tenido un SCA es del 80%22; con la aparición de los índices no hiperémicos, su interés clínico es escaso.
Tabla 2. Índices para el estudio de estenosis coronarias epicárdicas
| Vasodilatación | Periodo del ciclo | Punto de corte | Evidencia científica | |
|---|---|---|---|---|
| RFF | Hiperémico | – | ≤ 0,80 | ER: FAME, FAME II, FAME III, DEFER, DANAMI-3-PRIMULTI, COMPARE ACUTE, FLOWER-MI, FUTURE |
| iFR | No hiperémico | Diastólico | ≤ 0,89 | ER: DEFINE-FLAIR, iFR-SWEDEHEART Observacional: SYNTAX II |
| DFR | No hiperémico | Diastólico | ≤ 0,89 | Observacional: Johnson et al.14 |
| dPR | No hiperémico | Diastólico | ≤ 0,89 | Observacional: Lee et al.15, Van’t Veer et al.16 |
| RFR | No hiperémico | Todo el ciclo | ≤ 0,89 | Observacional: Lee et al.15 |
| Pd/Pa | No hiperémico | Todo el ciclo | 0,91-0,93 | Observacional: Kobayashi et al.20, Lee et al.15 |
|
DFR: diastolic hyperaemia-free ratio; dPR: cociente de presiones diastólicas en reposo; ER: estudios aleatorizados; RFF: reserva fraccional de flujo; iFR: índice instantáneo sin ondas; Pd/Pa: cociente de presión coronaria distal/aórtica; RFR: ciclo cardiaco completo en reposo. |
||||
En el material adicional se ofrece una descripción detallada del manejo práctico de los índices fisiológicos invasivos.
Procedimiento
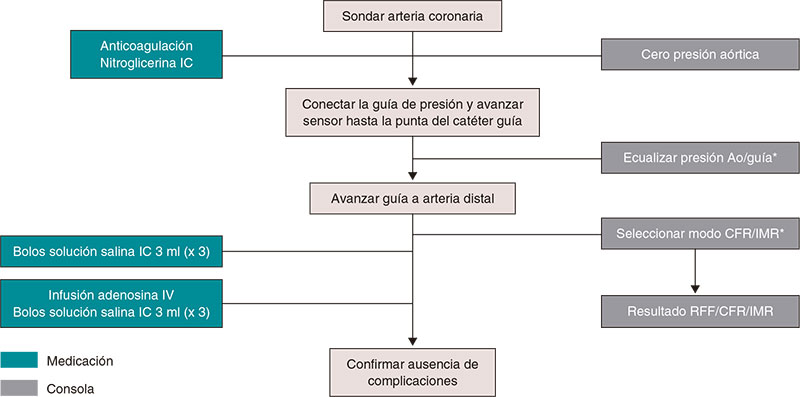
En la figura 1 se muestran los pasos para medir los índices de reposo y de RFF, y en el material adicional hay una descripción detallada paso a paso. La figura 2 ilustra la utilidad de la guía de presión para el diagnóstico y la localización de estenosis significativas.
Figura 1. Pasos para la realización de guía de presión intracoronaria para medir los índices de reposo y la reserva fraccional de flujo. Ao: aorta; RFF: reserva fraccional de flujo; IC: intracoronaria; IV: intravenosa. * Catéter purgado con solución salina y sin introductor de guía.
Problemas, causas, soluciones y escenarios específicos
En la tabla 3 se exponen algunos de los principales problemas que pueden encontrarse al hacer un estudio con guía de presión, sus causas y sus soluciones. En el material adicional se encuentra una explicación detallada para hacer frente a tales problemas, así como una descripción del uso de la guía de presión en diferentes escenarios clínicos (enfermedad coronaria difusa, lesiones ostiales, estenosis aórtica, SCA, valoración tras angioplastia).
Tabla 3. Guía de presión: principales problemas, causas y soluciones
| Problema | Causas | Recomendaciones |
|---|---|---|
| Amortiguación de la presión aórtica | Desproporción catéter/vaso Lesión ostial | Utilizar catéter guía de menor diámetro Desenganchar el ostium para realizar mediciones |
| Presión aórtica falsamente disminuida | Conexiones al catéter guía sueltas No retirar introductor de guía Presencia de contraste en el catéter | Asegurar bien todas las conexiones antes de medir Siempre retirar introductor de guía Purgar catéter guía con solución salina |
| Pérdida de la ecualización (drift) | Necesidad de múltiples conexiones/desconexiones Procedimiento prolongado | Repetir ecualización y medición Ecualizar antes de realizar mediciones tras la ICP Utilizar guías con fibra óptica cuando se prevea un procedimiento prolongado |
| Espasmo, pseudoestenosis | Presencia y manipulación de guía intracoronaria Excesiva tortuosidad | Siempre administrar nitratos IC previo al procedimiento Dosis adicional de nitratos IC si se sospecha pseudoestenosis Considerar métodos alternativos en caso de excesiva tortuosidad |
| Escasa respuesta a adenosina | Consumo de cafeína, teobromina (chocolate), teofilina Inadecuada administración intracoronaria | Advertir a los pacientes de que no consuman café, chocolate ni teofilina 24 h antes del procedimiento Administrar adenosina IC o infusión IV a 210 μg/kg/min Asegurar adecuado sondaje para administrar adenosina IC No utilizar adenosina IC con catéter con agujeros laterales |
| Excesiva variabilidad de las mediciones | Movimientos del paciente Arritmias (FA) | Asegurar que el paciente esté confortable Repetir la medición en caso de tos o movimientos bruscos Seleccionar los puntos de medición manualmente en la consola |
|
FA: fibrilación auricular; IC: intracoronario/a; ICP: intervención coronaria percutánea; IV: intravenosa. |
||
Índices derivados de la angiografía
El estudio fisiológico de las estenosis epicárdicas se encuentra limitado en la práctica clínica habitual por la necesidad del uso de una guía de presión y, en algunos casos, de agentes hiperémicos, que conllevan un aumento del coste del procedimiento y la posibilidad de que aparezcan efectos secundarios23. Por ello, se han generado nuevos índices derivados de la angiografía, tales como el cociente de flujo cuantitativo (QFR), la RFFAngio, el CAAS-vRFF y el vRFF. Estos índices se basan en la reconstrucción tridimensional del árbol coronario a través de la angiografía, usando posteriormente una dinámica computacional de fluidos o simplificaciones matemáticas de esta como subrogado del flujo coronario.
El QFR (Qangio XA 3D, Medis Medical Imaging Systems, Países Bajos) emplea una reconstrucción 3D de la angiografía, y luego, asumiendo una presión y una velocidad de flujo constantes a lo largo de un vaso epicárdico normal, se computa un proxy del valor de RFF a través de distintos modelos: el modelo fijo (fQFR) usa información de una base de datos en la que previamente se han obtenido valores de RFF y velocidades de flujo; el modelo de QFR-contraste (cQFR) tiene en cuenta la velocidad a la que fluye el contraste administrado en la arteria epicárdica mediante recuento de frames; y el modelo QFR-adenosina (aQFR) lo valora tras la inducción de hiperemia mediante la administración de adenosina. Los tres modelos han sido evaluados frente a la RFF y se ha obtenido una mejor precisión diagnóstica con aQFR (87%) y cQFR (86%)24. Varios estudios posteriores han demostrado la utilidad y la alta precisión de este método para el diagnóstico funcional de una estenosis epicárdica25,26, así como la seguridad que confiere la decisión de revascularización o no basada en este27,28. El estudio FAVOR III China, que incluyó 3.825 pacientes, encontró una disminución de los eventos mayores (HR = 0,65; IC95%, 0,51-0,83; p = 0,0004) en los pacientes a quienes se difirió la revascularización basándose en un QFR ≤ 0,80, impulsado por menos infartos de miocardio y menos revascularizaciones guiadas por isquemia, en comparación con la revascularización guiada por angiografía28.
Otro índice es el CAAS-vRFF (Cardiovascular Angiographic Analysis System for vessel RFF, CAAS-vRFF, Pie Medical, Países Bajos), que se basa en el uso de una reconstrucción 3D de la angiografía adquirida y la posterior computación del gradiente de presión a través de una lesión. Su estudio de validación incluyó pacientes con enfermedad estable y SCA sin elevación del segmento ST, y mostró una precisión del 93% para el diagnóstico de lesiones con RFF ≤ 0,80, así como una correlación interobservador del 95%29.
También es de amplio uso el índice RFFAngio (Cathworks, Israel), que utiliza, a diferencia de los previos, al menos tres proyecciones angiográficas para realizar un mapeado funcional 3D. Fearon et al.30 lo evaluaron en una amplia población y encontraron una sensibilidad del 94%, una especificidad del 91% y una precisión diagnóstica del 92% para valores de RFF ≤ 0,80, con alta consistencia interobservador (96%).
Existen además otros índices, como el vRFF (virtual Fractional Flow Reserve, VirtuHeart Medical Physics Group, Reino Unido), que en su estudio de validación llegó a demostrar una alta precisión diagnóstica y unas elevadas sensibilidad y especificidad (97%, 86% y 100%, respectivamente)31, si bien aún se encuentra en fase de experimentación.
Recientemente, un metanálisis realizado por Collet et al.32 ha mostrado que las mediciones de RFF derivadas de la angiografía presentan una sensibilidad global del 89% y una especificidad del 90% respecto a la determinación invasiva de la RFF. No obstante, es posible que exista una zona gris relativamente amplia (0,75-0,86) en la que la determinación invasiva de la RFF podría estar indicada33. Asumiendo esta zona gris, la precisión diagnóstica de estos métodos podría llegar a ser > 95% —como se demostró en el estudio FAVOR II China25—, evitando la necesidad de un estudio invasivo en el 64% de las lesiones34.
A pesar de sus resultados prometedores, estos análisis presentan ciertas limitaciones. Una de las principales es obtener angiografías adecuadas para analizar sin desplazamientos (panning) ni superposición de estructuras35. Otra es la anatomía, ya que lesiones ostiales o en bifurcación presentan mayor dificultad para delinear su contorno y, por tanto, su estudio podría verse sesgado. En un análisis reciente sobre la población del estudio SYNTAX II, la evaluación por QFR frente a la estrategia híbrida iFR/RFF mostró una precisión diagnóstica del QFR cercana al 74%, con un 8,3% de falsos positivos y un 17,9% de falsos negativos, siendo el principal motivo de esta discordancia las lesiones en ramas marginales, vasos pequeños o zonas de bifurcación35. Además, de especial interés resulta el estado de la microcirculación, ya que estas técnicas asumen una máxima vasodilatación para computar la presión desde el flujo obtenido. No obstante, el grado de respuesta a la hiperemia —ya sea por contraste o por agentes hiperémicos farmacológicos— es variable en función del estado de la microcirculación de cada paciente, pudiendo incurrir en error. Mejía-Rentería et al.36 estudiaron la influencia que el estado de la microcirculación ejerce sobre este tipo de evaluaciones no invasivas de la reserva de flujo coronario (CFR), y observaron que la mayor fuente de discordancia venía dada por una alteración en la función microvascular, medida como un valor alterado del índice de resistencia microcirculatoria (IMR) o situación de infarto agudo de miocardio. Se podría pensar que el tiempo de procesado de la imagen y su análisis puede ser mayor que el de la realización de un estudio fisiológico con guía de presión. No obstante, con el debido entrenamiento, se ha demostrado que el estudio se puede hacer con mayor rapidez incluso que la determinación clásica de la RFF37,38. Por último, una limitación pendiente de resolver es la variabilidad (concordancia de 0,01 ± 0,08 para medidas repetidas), que depende del observador, la calidad de la angiografía y el grado de estenosis valorado por RFF39.
En el material adicional se ofrece una descripción detallada sobre el manejo práctico del QFR, la RFFAngio y el vRFF.
Valoración fisiológica de la microcirculación coronaria
Índices invasivos
Aunque la enfermedad coronaria comúnmente se relaciona con la afectación de las arterias epicárdicas, hasta un 25% de los pacientes que sufren angina típica no presentan estenosis epicárdicas significativas1. La disfunción microvascular es un factor contribuyente de la angina y el tratamiento individualizado ha demostrado mejorar la calidad de vida de los pacientes40, por lo que un adecuado diagnóstico intracoronario de la enfermedad microvascular en pacientes sintomáticos, sin estenosis o con estenosis coronarias moderadas, tiene una recomendación IIa en las guías europeas de síndrome coronario crónico1.
Las arteriolas, principal componente de la resistencia vascular coronaria, tienen un papel muy dinámico en el flujo sanguíneo coronario, reguladas por múltiples mecanismos metabólicos, miogénicos, endoteliales, neurales y hormonales41,42. Las alteraciones de la microcirculación pueden ocurrir por cualquiera de estas vías y ofrecer un pronóstico desfavorable, similar al de la enfermedad epicárdica obstructiva43. El tamaño de estos vasos hace imposible su valoración angiográfica, siendo indispensable el uso de otros métodos. La CFR mide la relación de flujo coronario en hiperemia respecto al flujo en reposo, con valores normales entre 3 y 4, que indican que el flujo coronario se incrementa de 3 a 4 veces con la hiperemia máxima. Los resultados de la CFR representan la capacidad de incrementar el flujo tanto de las arterias epicárdicas como de la microvasculatura. Una CFR reducida se asocia con un aumento significativo de la mortalidad (HR = 3,78; IC95%, 2,39-5,97) y de eventos cardiovasculares mayores (HR = 3,42; IC95%, 2,92-3,99) en diversas condiciones, incluyendo pacientes con SCA, disfunción microvascular, trasplante cardiaco y diabetes mellitus44.
La resistencia microcirculatoria se puede medir por termodilución o por Doppler intravascular, en condiciones basales o en hiperemia45. El IMR, índice de referencia para el estudio de la microcirculación, se basa en la medición de la presión distal y del flujo coronario por termodilución, valorado por la inversa del tiempo de llegada (tránsito) de solución salina a temperatura ambiente al segmento distal de la arteria durante la hiperemia máxima. Un IMR elevado, por encima de 25, se ha asociado a peor pronóstico cardiovascular; la combinación de un CFR bajo y un IMR alto tiene peor pronóstico46,47. Recientemente se ha descrito un nuevo método basado en termodilución y un flujo continuo de solución salina (catéter RayFlow, Hexacath, Francia), que permite calcular el flujo coronario absoluto en condiciones hiperémicas y la resistencia microcirculatoria absoluta48,49, con la ventaja de que no depende de los valores basales, lo que hace que la influencia de los cambios hemodinámicos sea menor, y además es independiente del operador. Su utilidad clínica todavía tiene que demostrarse, dada la limitación en la interpretación de valores absolutos.
Con la guía Doppler se puede calcular el CFR dividiendo la velocidad de flujo en hiperemia entre la velocidad de flujo basal, y se considera un punto de corte ≤ 2,5 como diagnóstico de disfunción microvascular en arterias epicárdicas sanas50. El valor pronóstico de la CFR medida de forma invasiva por Doppler en pacientes con angina es independiente de los hallazgos de pruebas no invasivas, con una HR de 2,97 (IC95%, 1,39-6,34) a 5 años para eventos cardiovasculares mayores51. También se calcula la resistencia microcirculatoria hiperémica (RMh) dividiendo la presión intracoronaria entre la velocidad de flujo hiperémica, considerando que una RMh > 1,9 mmHg·cm−1·s−1 es diagnóstica de disfunción microcirculatoria50, aunque existen reportes de que una RMh ≥ 2,5 mmHg·cm−1·s−1 tiene mejores sensibilidad y especificidad para el diagnóstico de disfunción microvascular52.
Abordaje práctico
Termodilución
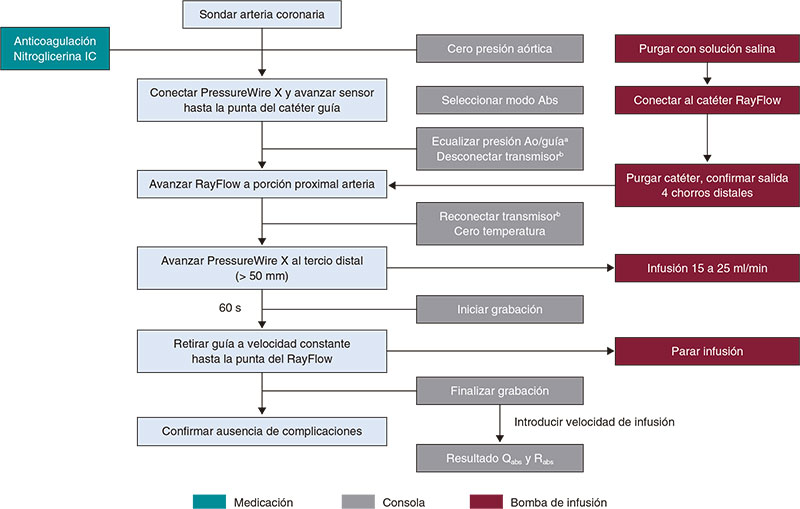
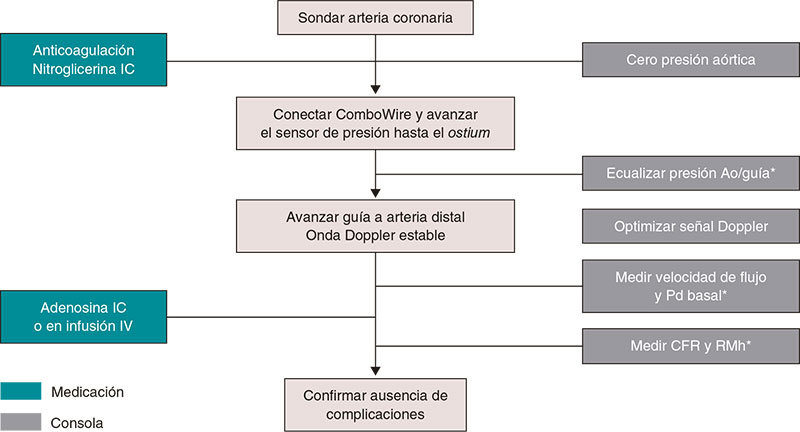
En el material adicional se ofrece una descripción detallada del manejo práctico de la termodilución, tanto mediante bolos (figura 3) como en infusión continua (figura 4), y del estudio fisiológico mediante guía Doppler (figura 5).
Figura 2. A: angiografía de arteria coronaria derecha que muestra afectación difusa, con lesiones más graves a nivel distal (asteriscos). B: grabación del cociente de reposo de ciclo completo (RFR) en retirada que muestra 2 saltos focales correspondientes a los asteriscos marcados en A. C: resultado angiográfico final tras la implantación de 2 stents farmacoactivos. D: RFR final con resultado óptimo de 0,98.
Figura 3. Pasos para el estudio de la microcirculación por termodilución por bolos. Ao: aorta; CFR: reserva de flujo coronario; RFF: reserva fraccional de flujo; IC: intracoronaria; IV: intravenosa; IMR: índice de resistencia microcirculatoria. * Catéter purgado con solución salina y sin introductor de guía.
Figura 4. Pasos para el estudio de la microcirculación por termodilución continua. Ao: aorta; IC: intracoronaria; IV: intravenosa. a Catéter purgado con solución salina y sin introductor de guía. b No apagar el transmisor durante todo el procedimiento.
Figura 5. Pasos para el estudio de la microcirculación con guía Doppler. Ao: aorta; CFR: reserva de flujo coronario; RMh: resistencia microcirculatoria hiperémica; IC: intracoronaria; IV: intravenosa; Pd: presión coronaria distal. * Catéter purgado con solución salina y sin introductor de guía.
Índices derivados de la angiografía
Si bien la evaluación del estado de la microcirculación mediante el uso del IMR ha demostrado ampliamente su beneficio clínico50,53, su estudio en la práctica clínica habitual es limitado debido a la necesidad del uso de una guía de presión y de agentes hiperémicos. Por ello, recientemente se han desarrollado alternativas para la estimación del IMR a partir de la angiografía (IMRAngio) mediante la aplicación de dinámica computacional de fluidos, para lo que existen varias fórmulas.
La primera descripción la realizaron De Maria et al.54, quienes observaron una buena capacidad diagnóstica (92,4%) del IMRAngio frente al IMR invasivo usando otra fórmula derivada del aQFR en pacientes con infarto de miocardio, así como una alta correlación entre un valor alto de IMRAngio y la presencia de obstrucción microvascular detectada por resonancia magnética.
El IMRangio se ha estudiado tanto en pacientes estables como en aquellos que presentaban un SCA55, obteniendo una buena correlación entre IMR e IMRAngio y una alta precisión diagnóstica del último si se usaba adenosina, tanto en pacientes con SCA como en pacientes estables. No obstante, sí se observó que la relación entre IMR e IMRAngio derivado de cQFR (NH-IMRAngio) no se mantenía en arterias no culpables del evento agudo ni en casos de mayor estabilidad clínica, y tan solo mostraba una buena relación en las arterias culpables del infarto. Los autores consideraron como posible explicación para este fenómeno la mayor alteración en la capacidad vasodilatadora que presentan los pacientes con infarto agudo de miocardio con elevación del segmento ST, y propusieron un algoritmo híbrido, por el cual solo sería necesario el uso de adenosina en aquellos casos en que la determinación de NH-IMRAngio fuera > 30 U y < 90 U, lo que evitaría la necesidad de usar adenosina en el 38% de los casos. Además, en casos de infarto agudo de miocardio con elevación del segmento ST —en los que quizás el uso de hiperemia podría estar más restringido debido a la situación clínica—, este grupo mostró que un valor de NH-IMRAngio > 43 podría detectar con alta precisión un valor de IMR > 40 y ser predictor de eventos a largo plazo56 sin necesidad de utilizar adenosina.
Tebaldi et al.57 usan una fórmula a partir del valor de cQFR (NH-IMRAngio) para evaluar el estado de la microcirculación en pacientes con angina estable, y hallaron una alta correlación entre IMRAngio > 44,2 e IMR invasivo > 25.
Paralelamente, otro grupo también usó una fórmula que empleaba el valor de cQFR58 para evaluar la función microvascular en pacientes con síndrome coronario crónico y agudo, que confirmó una buena precisión diagnóstica global y apuntó, además, el valor añadido que podría tener su determinación para disminuir los valores falsamente positivos del QFR, ya que una función microvascular alterada podría influir en la precisión del análisis del QFR36. Un metanálisis de datos agrupados ha demostrado un buen rendimiento diagnóstico de la IMRAngio en comparación con el IMR invasivo, con una sensibilidad del 82%, una especificidad del 83%, una precisión del 83%, un valor predictivo positivo del 76% y un valor predictivo negativo del 85%59.
FlashAngio (Rainmed, China) es otro software para la derivación del IMR no invasivo60,61, que ofrece resultados diagnósticos similares. Además, más allá de su valor diagnóstico, Choi et al.61 demostraron el valor pronóstico de dicho índice, ya que un valor elevado de IMRAngio (< 40 U) se encontró asociado a muerte de causa cardiaca y rehospitalización por problemas cardiovasculares a largo plazo.
En el material adicional se encuentra una descripción detallada del manejo práctico del IMRAngio.
CONCLUSIONES
El estudio de la fisiología coronaria significa un gran avance en el tratamiento de los pacientes con enfermedad coronaria. Poder definir la gravedad funcional de las lesiones epicárdicas y la influencia de la microcirculación en la sintomatología de los pacientes permite personalizar el tratamiento, orientado a reducir los síntomas y, en muchos casos, con un mejor pronóstico. Se han hecho grandes avances en este campo, logrando conocer más a fondo la fisiología y obtener más precisión en el diagnóstico, con pruebas tanto invasivas como no invasivas. El conocimiento, aunque extenso, presenta brechas que se seguirán resolviendo con nuevos estudios. Todo este desarrollo requiere una formación específica y actualizada, que nos permita aprovechar el conocimiento y la tecnología en beneficio de nuestros pacientes.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
J.P. Vilchez-Tschischke, J. Sanz Sánchez y E. Fernández Peregrina contribuyeron a la idea, el diseño, la redacción y la revisión del artículo. J.L. Díez Gil, M. Echevarría Pinto y H.M. Garcia-Garcia contribuyeron tanto a la redacción del artículo como a la revisión crítica de su contenido intelectual.
CONFLICTO DE INTERESES
J. Sanz Sánchez declara haber recibido honorarios por su labor como conferenciante para Cordis y Terumo. H.M. Garcia-Garcia declara haber recibido honorarios por su labor como conferenciante para Biotronik, Abbot, Boston Scientific, Neovasc, Medtronic, Shockwave, Philips y Corflow. Los demás autores no presentan conflictos de intereses.
BIBLIOGRAFÍA
1. Neumann FJ, Sechtem U, Banning AP, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41:407-477.
2. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. EuroIntervention. 2019;14:1435-1534.
3. Puymirat E, Cayla G, Simon T, et al. Multivessel PCI Guided by FFR or Angiography for Myocardial Infarction. N Engl J Med. 2021;385:297-308.
4. Fearon WF, Zimmermann FM, de Bruyne B, et al. Fractional Flow Reserve-Guided PCI as Compared with Coronary Bypass Surgery. N Engl J Med. 2022;386:128-137.
5. Dattilo PB, Prasad A, Honeycutt E, Wang TY, Messenger JC. Contemporary patterns of fractional flow reserve and intravascular ultrasound use among patients undergoing percutaneous coronary intervention in the United States: insights from the National Cardiovascular Data Registry. J Am Coll Cardiol. 2012;60:2337-2339.
6. Lee JZ, Singh N, Nyotowidjojo I, et al. Comparison of regadenoson and nitroprusside to adenosine for measurement of fractional flow reserve: A systematic review and meta-analysis. Cardiovasc Revasc Med. 2018;19:168-174.
7. Leone AM, Campo G, Gallo F, et al. Adenosine-Free Indexes vs. Fractional Flow Reserve for Functional Assessment of Coronary Stenoses: Systematic Review and Meta-Analysis. Int J Cardiol. 2020;299:93-99.
8. Warisawa T, Cook CM, Akashi YJ, Davies JE. Past, Present and Future of Coronary Physiology. Rev Esp Cardiol. 2018;71:656-667.
9. Tonino PAL, de Bruyne B, Pijls NHJ, et al. Fractional Flow Reserve versus Angiography for Guiding Percutaneous Coronary Intervention. N Engl J Med. 2009;360:213-224.
10. de Bruyne B, Pijls NHJ, Kalesan B, et al. Fractional flow reserve-guided PCI versus medical therapy in stable coronary disease. N Engl J Med. 2012;367:991-1001.
11. Xaplanteris P, Fournier S, Pijls NHJ, et al. Five-Year Outcomes with PCI Guided by Fractional Flow Reserve. N Engl J Med. 2018;379:250-259.
12. Grüntzig AR, Senning Å, Siegenthaler WE. Nonoperative Dilatation of Coronary-Artery Stenosis. N Engl J Med. 1979;301:61-68.
13. Sen S, Asrress KN, Nijjer S, et al. Diagnostic classification of the instantaneous wave-free ratio is equivalent to fractional flow reserve and is not improved with adenosine administration. Results of CLARIFY (Classification Accuracy of Pressure-Only Ratios Against Indices Using Flow Study). J Am Coll Cardiol. 2013;61:1409-1420.
14. Petraco R, van de Hoef TP, Nijjer S, et al. Baseline instantaneous wave-free ratio as a pressure-only estimation of underlying coronary flow reserve: results of the JUSTIFY-CFR Study (Joined Coronary Pressure and Flow Analysis to Determine Diagnostic Characteristics of Basal and Hyperemic Indices of Functional Lesion Severity-Coronary Flow Reserve). Circ Cardiovasc Interv. 2014;7:492-502.
15. Davies JE, Sen S, Dehbi HM, et al. Use of the Instantaneous Wave-free Ratio or Fractional Flow Reserve in PCI. N Engl J Med. 2017;376:1824-1834.
16. Götberg M, Christiansen EH, Gudmundsdottir IJ, et al. Instantaneous Wave-free Ratio versus Fractional Flow Reserve to Guide PCI. N Engl J Med. 2017;376:1813-1823.
17. Johnson NP, Li W, Chen X, et al. Diastolic pressure ratio: new approach and validation vs. the instantaneous wave-free ratio. Eur Heart J. 2019;40:2585-2594.
18. Lee JM, Rhee TM, Choi KH, et al. Clinical Outcome of Lesions With Discordant Results Among Different Invasive Physiologic Indices - Resting Distal Coronary to Aortic Pressure Ratio, Resting Full-Cycle Ratio, Diastolic Pressure Ratio, Instantaneous Wave-Free Ratio, and Fractional Flow Reserve. Circ J. 2019;83:2210-2221.
19. Van’t Veer M, Pijls NHJ, Hennigan B, et al. Comparison of Different Diastolic Resting Indexes to iFR: Are They All Equal? J Am Coll Cardiol. 2017;70:3088-3096.
20. Kobayashi Y, Johnson NP, Berry C, et al. The Influence of Lesion Location on the Diagnostic Accuracy of Adenosine-Free Coronary Pressure Wire Measurements. JACC Cardiovasc Interv. 2016;9:2390-2399.
21. Ahn JM, Park DW, Kim SO, et al. Prognostic Value of Resting Distal-to-Aortic Coronary Pressure in Clinical Practice. Circ Cardiovasc Interv. 2020;13:e007868.
22. Piróth Z, Fülöp G, Boxma-de Klerk BM, et al. Correlation and Relative Prognostic Value of Fractional Flow Reserve and Pd/Pa of Nonculprit Lesions in ST-Segment-Elevation Myocardial Infarction. Circ Cardiovasc Interv. 2022;15:e010796.
23. Barauskas M, Ziubryte G, Barauskiene G, Unikaite R, Jodka N, Unikas R. Systemic analysis of diagnostic performance and agreement between fractional flow reserve and quantitative flow ratio. Cor Vasa. 2021;63:683-687.
24. Tu S, Westra J, Yang J, et al. Diagnostic Accuracy of Fast Computational Approaches to Derive Fractional Flow Reserve From Diagnostic Coronary Angiography The International Multicenter FAVOR Pilot Study. JACC Cardiovasc Interv. 2016;9:2024-2035.
25. Xu B, Tu S, Qiao S, et al. Diagnostic Accuracy of Angiography-Based Quantitative Flow Ratio Measurements for Online Assessment of Coronary Stenosis. J Am Coll Cardiol. 2017;70:3077-3087.
26. Westra J, Tu S, Campo G, et al. Diagnostic performance of quantitative flow ratio in prospectively enrolled patients: An individual patient-data meta-analysis. Catheter Cardiovasc Interv. 2019;94:693-701.
27. Spitaleri G, Tebaldi M, Biscaglia S, Westra J, Brugaletta S, Erriquez A. Quantitative Flow Ratio identifies nonculprit coronary lesions requiring revascularization in patients with ST segment elevation myocardial infarction and multivessel disease. Circ Cardiovasc Interv. 2018;11:e006023.
28. Xu B, Tu S, Song L, et al. Angiographic quantitative flow ratio-guided coronary intervention (FAVOR III China): a multicentre, randomised, sham-controlled trial. Lancet. 2021;398:2149-2159.
29. Masdjedi K, Tanaka N, Van Belle E, et al. Vessel fractional flow reserve (vFFR) for the assessment of stenosis severity: the FAST II study. EuroIntervention. 2022;17:1498-1505.
30. Fearon W, Achenbach S, Engstrom T, et al. Accuracy of fractional flow reserve derived from coronary angiography. Circulation. 2019;139:477-484.
31. Morris PD, Ryan D, Morton AC, et al. Virtual Fractional Flow Reserve From Coronary Angiography: Modeling the Significance of Coronary Lesions Results From the VIRTU-1 (VIRTUal Fractional Flow Reserve From Coronary Angiography) Study. JACC Cardiovasc Interv. 2013;6:149-157.
32. Collet C, Onuma Y, Sonck J, et al. Diagnostic performance of angiography-derived fractional flow reserve: A systematic review and Bayesian meta-analysis. Eur Heart J. 2018;39:3314-3321.
33. Yakazi K, Otsuka M, Kataoka S, Kahata, Kumagai A. Applicability of 3-Dimensional Quantitative Coronary Angiography-derived computed Fractional Flow Reserve for intermediate coronary stenosis. Circ J. 2017;81:988-992.
34. Collet C, Onuma Y, Sonck J, et al. Diagnostic performance of angiography-derived fractional flow reserve: A systematic review and Bayesian meta-analysis. Eur Heart J. 2018;39:3314-3321.
35. Asano T, Katagiri Y, Chang CC, et al. Angiography-Derived Fractional Flow Reserve in the SYNTAX II Trial: Feasibility, Diagnostic Performance of Quantitative Flow Ratio, and Clinical Prognostic Value of Functional SYNTAX Score Derived From Quantitative Flow Ratio in Patients With 3-Vessel Dis. JACC Cardiovasc Interv. 2019;12:259-270.
36. Mejía-Rentería H, Lee JM, Lauri F, et al. Influence of Microcirculatory Dysfunction on Angiography-Based Functional Assessment of Coronary Stenoses. JACC Cardiovasc Interv. 2018;11:741-753.
37. Westra J, Andersen BK, Campo G, et al. Diagnostic performance of in-procedure angiography-derived quantitative flow reserve compared to pressure-derived fractional flow reserve: The FAVOR II Europe-Japan study. J Am Heart Assoc. 2018;7:e009603.
38. Haley H, Ghobrial M, Morris P, Gosling R, Williams G, Mills M. Virtual (Computed) Fractional Flow Reserve: Future Role in Acute Coronary Syndromes. Front Cardiovasc Med. 2021;8:735008.
39. Westra J, Sejr-Hansen M, Koltowski L, et al. Reproducibility of quantitative flow ratio: The QREP study. EuroIntervention. 2022;17:1252-1259.
40. Ford TJ, Stanley B, Sidik N, et al. 1-Year Outcomes of Angina Management Guided by Invasive Coronary Function Testing (CorMicA). JACC Cardiovasc Interv. 2020;13:33-45.
41. Chilian WM, Eastham CL, Marcus ML. Microvascular distribution of coronary vascular resistance in beating left ventricle. Am J Physiol. 1986;251(4 Pt 2):H779-H788.
42. Goodwill AG, Dick GM, Kiel AM, Tune JD. Regulation of Coronary Blood Flow. Compr Physiol. 2017;7:321.
43. Broyd CJ, Echavarria-Pinto M, Cerrato E, Escaned J. Evaluation of Microvascular Disease and Clinical Outcomes. Interv Cardiol Clin. 2015;4:443-457.
44. Kelshiker MA, Seligman H, Howard JP, et al. Coronary flow reserve and cardiovascular outcomes: a systematic review and meta-analysis. Eur Heart J. 2022;43:1582-1593.
45. Taqueti VR, di Carli MF. Coronary Microvascular Disease Pathogenic Mechanisms and Therapeutic Options: JACC State-of-the-Art Review. J Am Coll Cardiol. 2018;72:2625-2641.
46. Lee JM, Jung JH, Hwang D, et al. Coronary Flow Reserve and Microcirculatory Resistance in Patients With Intermediate Coronary Stenosis. J Am Coll Cardiol. 2016;67:1158-1169.
47. Padro T, Manfrini O, Bugiardini R, et al. ESC Working Group on Coronary Pathophysiology and Microcirculation position paper on “coronary microvascular dysfunction in cardiovascular disease”. Cardiovasc Res. 2020;116:741-755.
48. Van’t Veer M, Adjedj J, Wijnbergen I, et al. Novel monorail infusion catheter for volumetric coronary blood flow measurement in humans: in vitro validation. EuroIntervention. 2016;12:701-707.
49. Xaplanteris P, Fournier S, Keulards DCJ, et al. Catheter-Based Measurements of Absolute Coronary Blood Flow and Microvascular Resistance: Feasibility, Safety, and Reproducibility in Humans. Circ Cardiovasc Interv. 2018;11:e006194.
50. Kunadian V, Chieffo A, Camici PG, et al. An EAPCI Expert Consensus Document on Ischaemia with Non-Obstructive Coronary Arteries in Collaboration with European Society of Cardiology Working Group on Coronary Pathophysiology & Microcirculation Endorsed by Coronary Vasomotor Disorders International. Eur Heart J. 2020;41:3504-3520.
51. Lee SH, Shin D, Lee JM, et al. Clinical Relevance of Ischemia with Nonobstructive Coronary Arteries According to Coronary Microvascular Dysfunction. J Am Heart Assoc. 2022;11:e025171.
52. Williams RP, de Waard GA, de Silva K, et al. Doppler Versus Thermodilution-Derived Coronary Microvascular Resistance to Predict Coronary Microvascular Dysfunction in Patients With Acute Myocardial Infarction or Stable Angina Pectoris. Am J Cardiol. 2018;121:1-8.
53. Kobayashi Y, Fearon WF. Invasive coronary microcirculation assessment — Current status of index of microcirculatory resistance. Circ J. 2014;78:1021-1028.
54. De Maria GL, Scarsini R, Shanmuganathan M, et al. Angiography-derived index of microcirculatory resistance as a novel, pressure-wire-free tool to assess coronary microcirculation in ST elevation myocardial infarction. Int J Cardiovasc Imaging. 2020;36:1395-1406.
55. Scarsini R, Shanmuganathan M, Kotronias RA, et al. Angiography-derived index of microcirculatory resistance (IMRangio) as a novel pressure-wire-free tool to assess coronary microvascular dysfunction in acute coronary syndromes and stable coronary artery disease. Int J Cardiovasc Imaging. 2021;37:1801-1813.
56. Kotronias R, Terentes-Printzios D, Shanmuganathan M, et al. Long-Term Clinical Outcomes in Patients With an Acute ST-Segment-Elevation Myocardial Infarction Stratified by Angiography-Derived Index of Microcirculatory Resistance. Front Cardiovasc Med. 2021;1:717114.
57. Tebaldi M, Biscaglia S, Di Girolamo D, et al. Angio-based index of microcirculatory resistance for the assessment of the coronary resistance: A proof of concept study. J Interv Cardiol. 2020;2020:8887369.
58. Mejia-Renteria H, Lee JM, Choi KH, et al. Coronary microcirculation assessment using functional angiography: Development of a wire-free method applicable to conventional coronary angiograms. Catheter Cardiovasc Interv. 2021;98:1027-1037.
59. Fernández‐Peregrina E, Garcia‐Garcia HM, Sans‐Rosello J, et al. Angiography‐derived versus invasively‐determined index of microcirculatory resistance in the assessment of coronary microcirculation: A systematic review and meta‐analysis. Catheter Cardiovasc Interv. 2022;99:2018-2025.
60. Ai H, Feng Y, Gong Y, et al. Coronary Angiography-Derived Index of Microvascular Resistance. Front Physiol. 2020;11:605356.
61. Choi KH, Dai N, Li Y, et al. Functional Coronary Angiography–Derived Index of Microcirculatory Resistance in Patients With ST-Segment Elevation Myocardial Infarction. JACC Cardiovasc Interv. 2021;14:1670-1684.
* Autores para correspondencia.
Correos electrónicos: (M. Echevarria Pinto) y (H.M. Garcia-Garcia).
◊ Parte del contenido de este artículo se ha publicado previamente en la página web de la Sociedad Latinoamericana de Cardiología Intervencionista (SOLACI): https://proeducar.solaci.org/es/blog/post/fisiologia-coronaria.