Sr. Editor:
Las fístulas esofagopleurales son una complicación rara de la cirugía torácica. Sobrevienen como resultado directo de un traumatismo durante la cirugía o por el uso de un dispositivo transesofágico. El tratamiento de las fístulas esófago-pleurales puede resultar difícil y raras veces curan espontáneamente. El tratamiento conservador de las fístulas esofagopleurales se asocia a índices altos de mortalidad. El tratamiento tradicional de pacientes sintomáticos es quirúrgico. Sin embargo, este tipo de cirugía presenta índices altos de morbilidad y mortalidad, por lo que son muchos los pacientes considerados no aptos para la cirugía. Las opciones de tratamiento endoscópico para reparar fístulas esofágicas incluyen la inyección de pegamento, el uso de stents recubiertos y suturas o clips por endoscopia. Tras fracasar el tratamiento, consideramos el uso de una técnica terapéutica emergente como tratamiento alternativo. En este contexto, presentamos el caso de una fístula esofágica iatrogénica tratada con un dispositivo Amplazer.
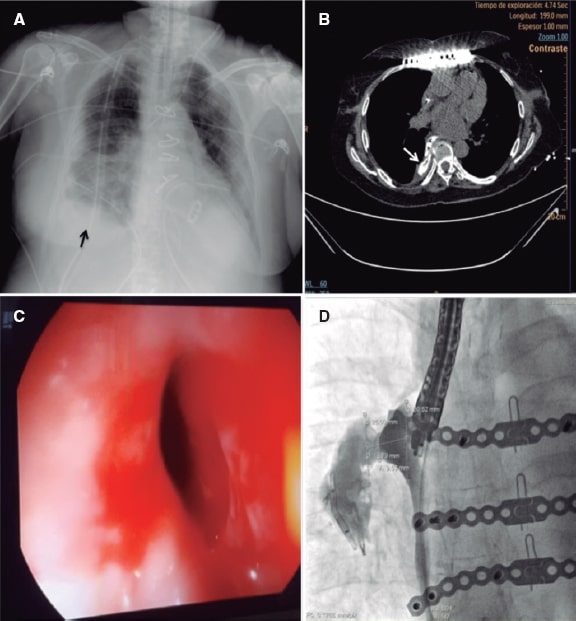
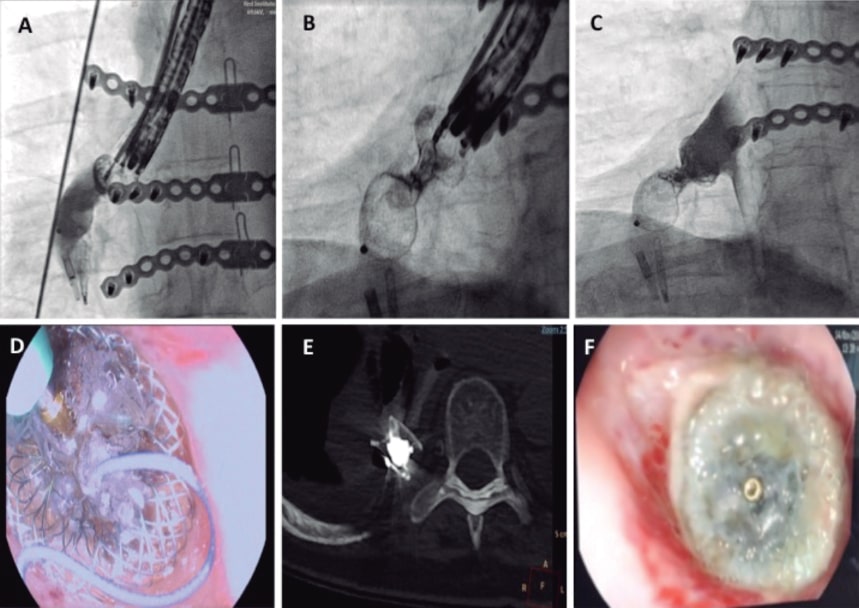
Se trata de una mujer de 72 años, exfumadora, con antecedents de hipertensión, fibrilación auricular crónica y enfermedad de la válvula mitral mixta reumática que ingresó con un síndrome coronario agudo. Se trató con éxito una oclusión trombótica de la arteria circunfleja mediante implante de un stent farmacoactivo. Durante su estancia hospitalaria, la paciente desarrolló una embolia arterial bilateral en ambas extremidades inferiores que se trató con una embolectomía. La ecocardiografía transesofágica confirmó la presencia de insuficiencia mitral grave, estenosis mitral moderada, fracción de eyección del ventrículo izquierdo del 38%, presión sistólica de la arteria pulmonar de 60 mmHg y un trombo en la orejuela izquierda. Se sustituyó la válvula mitral con una válvula ATS de 25 mm y se realizó un cierre quirúrgico de la orejuela que fue guiado mediante ecocardiografía transesofágica. Tras la cirugía, la paciente desarrolló mediastinitis, derrames pleurales recurrentes y empiema. La tomografía computarizada con contraste que reveló la presencia de una perforación esofágica, confirmada por endoscopia (figura 1A-C). Se descartó la cirugía esofágica y se intentó en 2 ocasiones el tratamiento endoscópico de la perforación con hemoclips y un stent metálico recubierto; sin embargo, ambos dispositivos migraron al estómago y tuvieron que ser retirados. Varios hemoclips migraron a la pleura a través del tracto de la fístula y se dejaron in situ. Se realizó una gastrostomía para facilitar la nutrición enteral artificial. Tras varias infecciones y una hospitalización de 4 meses en la unidad de cuidados intensivos, se nos pidió que cerrásemos la perforación con un dispositivo oclusor. Para establecer el tamaño de la fístula, se inyectó un agente de contraste guiado por fluoroscopia a través de la fístula y se obtuvo un plano perpendicular que expuso correctamente el cuello de la fístula para poder elegir el dispositivo oclusor (figura 1D). El implante se llevó a cabo en la sala de hemodinámica bajo anestesia general y guiado por endoscópia y fluoroscópia (figura 2A-F). Se introdujo una guía hidrofílica curva a través de la luz del endoscopio para cruzar la fístula. Como la luz del endoscopio era de 4.2 mm y no había espacio para introducir más material, se procedió a retirar la sonda endoscópica seguido de la inserción paralela de la misma para guiar la intervención. Después se avanzó un catéter GLIDECATH (Terumo Medical Corporation, Estados Unidos) sobre la guía. Se introdujo una guía de alto soporte y se avanzó un introductor guía Destination de 7 Fr (Terumo Medical Corporation). Se inyectó un agente de contraste para localizar la fístula. Se avanzó un dispositivo oclusor VSD muscular Amplatzer (Abbott, Estados Unidos). Se liberaron los discos distal y proximal y se usó una guía de 0,010 pulgadas (Mirage microguidewire, Medtronic, Estados Unidos) para acceder al disco proximal del dispositivo. Después, sobre esta guía se insertó un microcatéter Marathon (Medtronic,) que se colocó en el interior del cuello del dispositivo para la infusión de una sustancia embólica líquida Onyx, un copolímero radiopaco que sella en 5 minutos. La administración de contraste confirmó el sellado y el éxito final de la intervención. Tras la intervención, no hubo recurrencia de derrames pleurales ni de infecciones. En las subsiguientes endoscopias y tomografías computarizadas realizadas (figura 2D-E), se pudo confirmar el sellado efectivo del esófago y se restauró la alimentación normal 1 mes tras el procedimiento. El seguimiento clínico a los 9 meses confirmó la buena evolución de la paciente y la restauración normal de la nutrición oral. La familia firmó un consentimiento informado específico para este procedimiento.
Figura 1. A: radiografía de derrame pleural derecho (flecha). B: tomografía computarizada con contraste oral, la sección axial revela la extravasación de contraste al espacio pleural (flecha blanca). C: imagen endoscópica de la perforación tras ecocardiografía transesofágica. D: fluoroscopia con contraste oral que muestra la morfología y medidas de la fístula esófago-pleural.
Figura 2. A: proyección fluoroscópica que muestra la liberación de un dispositivo oclusor VSD muscular Amplatzer de 14 mm. B: administración del agente de sellado líquido Onyx en el interior del cuello del dispositivo Amplatzer a través de un microcatéter (véase como el cuello del dispositivo se vuelve radiolucente). C: inyección de contraste en el esófago que confirma el sellado inmediato del dispositivo. D: imagen endoscópica del microcatéter durante la inyección del agente de sellado líquido Onyx. E: tomografía computarizada del dispositivo con agente de sellado embólico en el interior. F: imagen endoscópica del dispositivo tras 1 mes con endotelización parcial.
El cierre endoscópico de fístulas con dispositivos cardiovasculares se ha usado principalmente para tratar fístulas broncopleurales, con buenos resultados clínicos. Hay escasa evidencia sobre su uso en el cierre de fístulas esofagopleurales. Hasta la fecha, solo se han publicado 3 casos clínicos. El primero empleó un dispositivo de cierre vascular Amplatzer, coils y pegamento histoacrílico. Además, requirió la administración adicional de coils para lograr un cierre definitivo1. El segundo caso utilizó un dispositivo oclusor de septo interauricular Amplatzer sin agente de sellado. La intervención fue fallida por la migración del dispositivo2. En el tercer caso, se empleó un dispositivo oclusor interventricular Amplatzer y un copolímero líquido que logró un sellado inmediato y buenos resultados clínicos3.
Establecer el tamaño correcto de la fístula es un paso crítico, pero las técnicas que se utilizan a tal efecto no están descritas en la literatura médica. Pensamos que el uso de mediciones fluoroscópicas con agentes de contraste puede ser una opción beneficiosa para una correcta selección del dispositivo y una estrategia a tiempo real. Cuando la visualización del defecto es subóptima, se podría emplear una medida por catéter balón que se utiliza para medir los defectos cardiacos.
El uso del agente líquido de sellado Onyx resultó ser uno de los elementos clave para alcanzar el éxito terapéutico. El aislamiento completo del espacio pleural es vital para evitar futuras infecciones recurrentes3.
FINANCIACIÓN
Este trabajo no recibió financiación.
CONTRIBUCIÓN DE LOS AUTORES
R. Vera-Urquiza: realización del procedimiento, revisión crítica de datos, redacción del manuscrito. J. M. Esteban López-Jamar: realiza el procedimiento, revisa el manuscrito. L. Nombela-Franco: realiza el procedimiento, revisa el manuscrito. M. Vázquez Romero: realiza el procedimiento, revisa el manuscrito. C. Espejo: seguimiento clínico, revisión del manuscrito. P. Jiménez-Quevedo: planifica y realiza el procedimiento, revisión crítica de datos, redacción del manuscrito.
CONFLICTO DE INTERESES
L. Nombela-Franco es proctor en Abbott y ha recibido honorarios por impartir conferencias de Edwards Lifesciences. El resto de autores no tiene conflictos de interés.
BIBLIOGRAFÍA
1. Koo JH, Park KB, Choo SW, Kim K, Do YS. Embolization of postsurgical esophagopleural fistula with AMPLATZER vascular plug, coils, and Histoacryl glue. J Vasc Interv Radiol. 2010;21:1905-1910.
2. Kadlec J, Turner K, Van Leuven M. Attempted closure of a post-pneumonectomy esophagopleural fistula with an Amplatzer atrial septal occluder. Interact Cardiovasc Thorac Surg. 2013;6:538-540.
3. Lassaletta AD, Laham RJ, Pinto DS, et al. Successful closure of an esophagopleural fistula with an Amplatzer occluder sealed with liquid copolymer, with 3-year follow-up and review of literature. Pleura. 2016;3:1-6.
Autor para correspondencia: Unidad de Hemodinámica, Hospital Clínico San Carlos, IdISSC, c/ Prof. Martín Lagos s/n, 28040 Madrid, España.
Correo electrónico: patropjq@gmail.com (P. Jiménez-Quevedo).