RESUMEN
Introducción y objetivos: A pesar del desarrollo de los stents farmacoactivos, el retraso en la endotelización puede causar trombosis tardía. La tomografía de coherencia óptica puede evaluar la cobertura intimal. El objetivo de este estudio fue comparar la cobertura y la aposición en lesiones coronarias no complejas de 3 tipos de stent: stent de everolimus con polímero persistente, stent de everolimus con polímero bioabsorbible y stent de biolimus sin polímero, a 1 y 6 meses del implante.
Métodos: Se diseñó un estudio prospectivo, multicéntrico, no aleatorizado, que comparó 3 stents farmacoactivos. Se realizaron angiografía y tomografía de coherencia óptica a 1 o 6 meses. El objetivo primario fue comparar la cobertura.
Resultados: Se incluyeron 104 pacientes con lesiones coronarias de novo no complejas. Se implantó stent sin polímero a 44 pacientes, stent con polímero bioabsorbible a 35 pacientes y stent con polímero persistente a 25 pacientes. Al mes, se observó una alta tasa de struts no cubiertos, sin diferencias significativas entre los grupos (80,2% sin polímero, 88,1% con polímero bioabsorbible y 82,5% con polímero persistente; p = 0,209). La cobertura mejoró a los 6 meses en los 3 stents, sin diferencias significativas entre ellos (97, 95 y 93,7%, respectivamente; p = 0,172).
Conclusiones: En los pacientes con lesiones coronarias no complejas tratados con stent con polímero persistente, con polímero bsorbible o sin polímero, la cobertura y la aposición fueron subóptimas a 1 mes del implante, con mejoría significativa a los 6 meses.
Palabras clave: Tomografía de coherencia óptica. Stent farmacoactivo. Endotelización. Aposición. Reestenosis.
ABSTRACT
Introduction and objectives: Delayed vascular healing may induce late stent thrombosis. Optical coherence tomography (OCT) is useful to evaluate endothelial coverage. The objective of this study was to compare stent coverage and apposition in non-complex coronary artery lesions treated with durable polymer-coated everolimus-eluting stents (durable-polymer EES) vs biodegradable polymer-coated everolimus-eluting stents (biodegradable-polymer EES) vs polymer-free biolimus-eluting stents (BES) 1 and 6 months after stent implantation.
Methods: Prospective, multicenter, non-randomized study that compared the 3 types of DES. Follow-up angiography and OCT were performed 1 and 6 months later. The primary endpoint was the rate of uncovered struts as assessed by the OCT at 1 month.
Results: A total of 104 patients with de novo non-complex coronary artery lesions were enrolled. A total of 44 patients were treated with polymer-free BES, 35 with biodegradable-polymer EES, and 25 with durable-polymer EES. A high rate of uncovered struts was found at 1 month with no significant differences reported among the stents (80.2%, polymer-free BES; 88.1%, biodegradable-polymer EES; 82.5%, durable-polymer EES; P = .209). Coverage improved after 6 months in the 3 groups without significant differences being reported (97%, 95%, and 93.7%, respectively; P = .172).
Conclusions: In patients with de novo non-complex coronary artery lesions treated with durable vs biodegradable vs polymer-free DES, strut coverage and apposition were suboptimal at 1 month with significant improvement at 6 months.
Keywords: Optical coherence tomography. Drug-eluting stents. Endothelization. Apposition. Restenosis.
Abreviaturas
ICP: intervención coronaria percutánea. OCT: tomografía de coherencia óptica. QCA: angiografía coronaria cuantitativa. SFA: stents farmacoactivos. TAPD: tratamiento antiagregante plaquetario doble.
INTRODUCCIÓN
Los struts de stents no cubiertos son uno de los principales predictores de la trombosis del stent1,2 y la terapia antiplaquetaria dual (TAPD) ha demostrado reducir su riesgo3. No obstante, el TAPD aumenta el riesgo de hemorragias y casi un tercio de los pacientes tratados mediante intervención coronaria percutánea (ICP) se consideran de riesgo hemorrágico alto. Teniendo en cuenta que conviene interrumpir cuanto antes el TAPD para reducir el riesgo de complicaciones hemorrágicas, la curación precoz de los stents parece lo más deseable.
Comparados con los stents metálicos (SM) los farmacoactivos (SFA) reducen significativamente la hiperplasia neointimal y la reestenosis. No obstante, lo que más preocupaba de los SFA de primera generación era la trombosis tardía del stent por la falta de endotelización de los struts del stent1. Por eso se desarrolló un SFA de nueva generación con plataformas de metal mejoradas y más finas, nuevos fármacos (análogos de la clase -limus antiproliferativos alternativos)4-6 y polímeros más biocompatibles7. Los SFA han evolucionado hacia los SFA con polímeros biodegradables8-10. Los estudios comparativos realizados entre SFA con polímeros biodegradables y SM revelaron índices más bajos de mortalidad cardiaca, infarto de miocardio en el vaso diana y revascularización al cabo de 1 año10. Comparados con los SFA con polímero biodegradable, los de polímero persistente no fueron inferiores en el tratamiento de los síndromes coronarios agudos en lo referente a la mortalidad por cualquier causa, el infarto de miocardio no fatal y la revascularización11. Además, el último avance para superar la trombosis del stent ha sido el SFA sin polímero. Este tipo de SFA se diseñó, inicialmente, para reducir el riesgo de trombosis del stent en pacientes de alto riesgo hemorrágico aptos para recibir cursos cortos de TAPD únicamente. Comparado con el SM tiene un mejor perfil de seguridad y eficacia13. Recientemente, se ha comparado al SFA en estudios más amplios, sobre todo, en pacientes de riesgo hemorrágico alto y que precisan cursos más cortos de TAPD. En estos estudios, el uso de stents liberadores de zotarolimus basados en polímeros ha resultado no ser inferior al uso de SFA sin polímero14 ni se han hallado diferencias mensurables en el objetivo combinado orientado al dispositivo15.
No obstante, a pesar de estos extensos ensayos clínicos, hay poca información disponible sobre las diferencias que existen entre las características de curación a nivel arterial coronario entre los distintos tipos de SFA de última generación. La tomografía de coherencia óptica (OCT) es una técnica de imágenes intracoronaria de alta resolución que se emplea habitualmente para valorar la respuesta vascular tras un implante de stent y que es capaz de detectar la cobertura de los struts del stent y su aposición a la pared vascular16,17. La cobertura de los struts del stent estudiada mediante OCT se considera un valioso marcador indirecto de curación vascular tras un implante de SFA.
El objetivo de este estudio fue comparar stents liberadores de everolimus con polímero (SLE con polímero persistente) frente a stents liberadores de everolimus con polímero biodegradable (SLE con polímero biodegradable) frente a stent liberador de biolimus (SLB) sin polímero empleando la cobertura de struts de los stent vista en la tomografía de coherencia óptica (OCT) como marcador indirecto para valorar la curación a nivel arterial coronario a corto plazo.
MÉTODOS
Población de pacientes y recogida de datos
Estudio no aleatorizado, prospectivo y multicéntrico comparador de 3 tipos de SFA distintos: a) el stent liberador de everolimus con polímero persistente Xience (Abbott, Estados Unidos); b) el stent liberador de everolimus con polímero biodegradable Synergy (Boston Scientific, Estados Unidos) y c) el stent liberador de biolimus sin polímero Biofreedom (Biosensors International Ltd, Singapur). El estudio se llevó a cabo en 4 hospitales universitarios españoles.
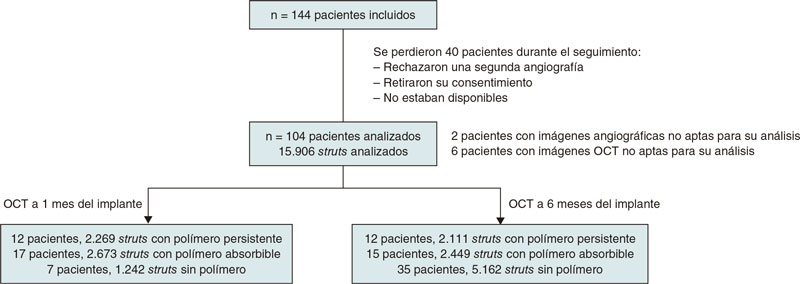
Se incluyó consecutivamente a un total de 144 pacientes entre enero de 2018 y diciembre de 2019. Los pacientes eran aptos para la inclusión en el estudio si habían ingresado con cardiopatía isquémica estable o síndrome coronario agudo sin shock cardiogénico. El equipo médico seleccionó el tipo de stent que implantar. El diagrama de flujo detallado del estudio se muestra en la figura 1. Los criterios de inclusión fueron: a) las lesiones de novo; b) ≥ 1 lesiones diana en la misma arteria coronaria o en otra coronaria distinta; c) la ausencia de necesidad de solapamiento de stents y una distancia mínima de 10 mm entre stents; d) una longitud del stent entre 8 y 30 mm y e) el uso de stents con diámetros ≥ 2,5 mm.
Figura 1. Diagrama de flujo de la inclusión de pacientes.
Los criterios de exclusión fueron: a) lesiones complejas incluidas lesiones ostiales, oclusiones coronarias totales crónicas, lesiones calcificadas que precisaran técnicas de modificación de la placa de calcio y bifurcaciones que requirieran la técnica de kissing balloon; b) lesiones diana en vasos pequeños (< 2,5 mm) y lesiones largas (> 30 mm) que requirieran stents con diámetros pequeños (2,25 mm) o stents solapados; c) pacientes diabéticos; d) arterias muy tortuosas que anticipaban la imposibilidad de acceder con el catéter de la OCT para realizar seguimiento y e) complicaciones durante la intervención índice. Se excluyó del estudio a los pacientes con diabetes mellitus puesto que su estado proinflamatorio puede propiciar trombosis y reestenosis del stent 18.
Después de inscritos, se asignó consecutivamente a los pacientes a un grupo de seguimiento OCT al cabo de 1 o 6 meses. Las características basales, los datos angiográficos y de la intervención, los datos de seguimiento, así como los datos con los resultados clínicos fueron recopilados prospectivamente por los coordinadores del estudio. Los datos clínicos recopilados durante el seguimiento se extrajeron de las historias clínicas. Este estudio se realizó siguiendo los preceptos establecidos en la Declaración de Helsinki, ISO14155, así como en las guías de práctica clínica. El protocolo del estudio fue aprobado tanto por el Comité de Ética de la Investigación (CEI) como por el comité de investigación del hospital. Se obtuvo el consentimiento informado de todos los pacientes participantes en el estudio.
Intervención coronaria percutánea, análisis angiográfico y tomografía de coherencia óptica
En la intervención índice, los stents se implantaron siguiendo el abordaje estándar. Se trató médicamente a los pacientes según indicación de las guías europeas sobre el abordaje y tratamiento de la cardiopatía isquémica crónica o el síndrome coronario agudo19.
En lo que se refiere al análisis angiográfico inicial, se obtuvieron 2 proyecciones ortogonales sin guía coronaria al finalizar la intervención índice. Se obtuvieron las mismas proyecciones durante el seguimiento. El análisis offline de las imágenes angiográficas (la angiografía coronaria cuantitativa [QCA]) se realizó en un laboratorio central independiente (Barcelona Cardiac Imaging Core-Lab [BARCICORElab]) según su protocolo estándar que empleó un software dedicado (CAAS, versión 5.9; Pie Medical BV, Países Bajos). Los métodos usados en este laboratorio central ya se han descrito con anterioridad20.
La angiografía de seguimiento se realizó al cabo de 1 o 6 meses. Se obtuvieron imágenes angiográficas y de OCT de cada paciente. Se empleó la OCT de dominio de frecuencia C7-XR Dragonfly (St. Jude Medical, Estados Unidos). El análisis lo hizo el mismo laboratorio central independiente con un software dedicado (St. Jude Medical). Se puede consultar más información en el material adicional facilitado. Los struts se clasificaron como no cubiertos cuando su superficie quedaba total o parcialmente expuesta a la luz y sin ninguna cobertura tisular sobre su armazón de alta densidad. La aposición de los struts del stent se definió como la distancia perpendicular que existe entre el borde luminal de los struts y la pared vascular. Se entendió que hubo aposición incompleta cuando la distancia fue mayor a la del grosor total de los struts teniendo en cuenta la suma de stent más polímero. La hiperplasia intimal se calculó a partir de la distancia perpendicular existente entre la superficie luminal de los struts del stent y la superficie luminal de la capa neointimal.
Objetivos
El objetivo primario del estudio fue el porcentaje de struts no cubiertos entre SLE con polímero persistente, SLE con polímero biodegradable frente a SLB sin polímero según la OCT realizada a 1 mes del implante.
El objetivo secundario fue comparar la cobertura y aposición de estos 3 tipos distintos de SFA en la OCT 1 y 6 meses después del implante. También se valoró la hiperplasia neointimal en los 3 grupos de stent a lo largo del tiempo.
Análisis estadístico
Las variables continuas se expresaron como media y desviación estándar salvo que no siguieran una distribución normal en cuyo caso se expresaron como mediana y percentil 25-75. Las categóricas se expresaron como frecuencia y porcentaje. El análisis de las diferencias clínicas se realizó mediante la prueba de la X2 o la prueba exacta de Fisher para variables cualitativas. La comparativa entre las diferentes variables cuantitativas se realizó empleando la prueba ANOVA de 1 vía. Teniendo en cuenta el análisis de conglomerados o clúster propio de la OCT, se emplearon ecuaciones de estimación generalizadas para estudiar los struts. Todos los valores de probabilidad fueron bilaterales. Los valores p < 0,05 se consideraron estadísticamente significativos. El análisis estadístico se realizó con el paquete de software estadístico SPSS, versión 22.0 (SPSS, Estados Unidos). El cálculo del tamaño de la muestra se puede consultar en el material adicional.
RESULTADOS
Características clínicas basales
El estudio incluyó a un total de 104 pacientes de 4 hospitales distintos, 44 de los cuales recibieron tratamiento con SLB sin polímero, 35 con SLE con polímero biodegradable y 25 con SLE con polímero persistente. Un total de 37 de estos pacientes recibieron angiografías y OCT de seguimiento 1 mes después de implantar el SFA y 67 pacientes 6 meses después. La media de edad fue de 57 años; la mayoría de los pacientes fueron hombres (un 11% mujeres). Las características clínicas basales entre los distintos grupos se muestran en la tabla 1 según el tipo de stent implantado. Se observó diferencia estadísticamente significativa en la fracción de eyección del ventrículo izquierdo que fue algo más baja en los pacientes que recibieron SLB sin polímero (54 frente al 60%). Más pacientes del grupo de SLE con polímero persistente (68%) que del grupo de SLB sin polímero (38%) necesitaron posdilatación.
Tabla 1. Características clínicas basales, de la lesión y de la intervención
| SLB sin polímero (n = 44) | SLE con polímero biodegradable (n = 35) | SLE con polímero persistente (n = 25) | p | |
|---|---|---|---|---|
| Edad | 57 ± 8 | 61 ± 9 | 59 ± 10 | 0,094 |
| Mujeres | 3 (7) | 4 (11) | 4 (16) | 0,482 |
| Dislipemia | 24 (55) | 19 (54) | 14 (56) | 0,990 |
| Hipertensión | 17 (39) | 14 (40) | 13 (52) | 0,527 |
| Antecedentes familiares de cardiopatía isquémica | 10 (23) | 4 (11) | 6 (24) | 0,353 |
| Fumador | 26 (59) | 13 (37) | 9 (36) | 0,076 |
| FEVI, % | 54 ± 9 | 60 ± 9 | 60 ± 8 | 0,006 |
| Insuficiencia renal crónica (niveles de creatinina > 1,5 mg/dl) | 0 (0) | 1 (3) | 0 (0) | 0,370 |
| IM previo | 2 (5) | 7 (20) | 4 (12) | 0,102 |
| ICP previa | 2 (5) | 6 (17) | 4 (16) | 0,159 |
| CABG previa | 1 (2) | 0 (0) | 1 (4) | 0,526 |
| Localización de la lesion diana | 0,101 | |||
| Descendente anterior | 18 (41) | 10 (29) | 11 (44) | |
| Arteria circunfleja izquierda | 10 (23) | 8 (23) | 19 (40) | |
| Coronaria derecha | 15 (34) | 13 (37) | 4 (16) | |
| Arteria secundaria (diagonal, posterolateral, descendente posterior) | 1 (2) | 4 (11) | 0 (0) | |
| Longitud del stent, mm | 18,6 ± 5 | 18,8 ± 6 | 19,5 ± 6 | 0,769 |
| Diámetro del stent, mm | 3,4 ± 0,8 | 3,1 ± 0,5 | 3,1 ± 0,4 | 0,053 |
| Predilatación, % | 19 (43) | 16 (73) | 13 (53) | 0,076 |
| Posdilatación, % | 16 (38) | 12 (57) | 17 (68) | 0,05 |
|
Los datos expresan n (%) o media ± desviación estándar. |
||||
Características de la intervención y la lesión
Las características de la intervención según el tipo de stent empleado se muestran en la tabla 1. No se hallaron diferencias significativas en el diámetro ni en la longitud de los stent en ninguno de los 3 grupos de stent. La descendente anterior fue la arteria coronaria más tratada y apenas se incluyeron arterias secundarias en el estudio.
Análisis angiográfico
Las características angiográficas de las lesiones se muestran en la tabla 1 y tabla 2 del material adicional. Hubo 2 pacientes con imágenes angiográficas de calidad insuficiente como para poder realizar cualquier análisis, ambos del grupo de SLE con polímero biodegradable. No se observó ninguna diferencia en las lesiones previas o posteriores a la ICP. Tampoco se observaron diferencias significativas en la pérdida luminal ni el porcentaje de estenosis por diámetro 1 mes después del implante, así como tampoco diferencias entre los 3 grupos de stent a 6 meses del implante.
Tabla 2. Análisis angiográfico
| SLB sin polímero (n = 44) | SLE con polímero biodegradable (n = 35) | SLE con polímero persistente (n = 25) | p | |
|---|---|---|---|---|
| 1 mes de seguimiento | (N = 7) | (N = 16) | (N = 12) | |
| Longitud del stent, mm | 17.85 ± 4.32 | 19.24 ± 5.63 | 19.39 ± 4.41 | 0,788 |
| Diámetro luminal de referencia, mm | 2.93 ± 0.60 | 2.80 ± 0.53 | 2.77 ± 0.55 | 0,827 |
| Diámetro luminal mínimo, mm | 2.75 ± 0.46 | 2.65 ± 0.50 | 2.51 ± 0.49 | 0,586 |
| Pérdida luminal tardía, mm | 0.03 ± 0.09 | 0.04 ± 0.10 | 0.03 ± 0.08 | 0,965 |
| Porcentaje de estenosis por diámetro, % | 5.57 ± 6.27 | 6.50 ± 7.14 | 8.67 ± 9.27 | 0,658 |
| 6 meses de seguimiento | (n = 37) | (n = 17) | (n = 13) | |
| Longitud del stent, mm | 18.99 ± 4.92 | 20.03 ± 6.55 | 18.13 ± 4.95 | 0,627 |
| Diámetro luminal de referencia, mm | 2.75 ± 0.57 | 2.79 ± 0.50 | 2.65 ± 0.34 | 0,757 |
| Diámetro luminal mínimo, mm | 2.54 ± 0.45 | 2.34 ± 0.41 | 2.39 ± 0.37 | 0,213 |
| Pérdida luminal tardía, mm | 0.19 ± 0.25 | 0.28 ± 0.24 | 0.20 ± 0.18 | 0,368 |
| Porcentaje de estenosis por diámetro, % | 5.77 ± 15.30 | 15.18 ± 12.92 | 10.08 ± 7.40 | 0,065 |
|
Los datos expresan n (%) o media ± desviación estándar. |
||||
Resultados de la OCT
Los resultados de la OCT se muestran en la tabla 3 y tabla 2 del material adicional. Hubo 6 pacientes con imágenes OCT de mala calidad como para poder realizar cualquier análisis, 2 del grupo de SLB sin polímero, 3 del grupo de SLE con polímero biodegradable y 1 del grupo de SLE con polímero persistente. Se analizó la cobertura y aposición de los struts de los stents y la hiperplasia neointimal. En líneas generales, se analizaron 15.906 struts, 4.380 de los cuales procedían de SLE con polímero persistente, 5.122 de SLE con polímero biodegradable y 6.404 de SLB sin polímero. En total se estudiaron 6.184 y 9.722 struts al mes y a los 6 meses después del implante, respectivamente.
Tabla 3. Análisis de la tomografía de coherencia óptica
| SLB sin polímero | SLE con polímero biodegradable | SLE con polímero persistente | pa | pb | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Seguimiento | 1 mes (n = 7) |
6 meses (n = 35) |
p | 1 mes (n = 17) |
6 meses (n = 15) |
p | 1 mes (n = 12) |
6 meses (n = 12) |
p | ||
| Análisis de los struts | (n = 1.242) | (n = 5.162) | (n = 2.673) | (n = 2.449) | (n = 2.269) | (n = 2.111) | |||||
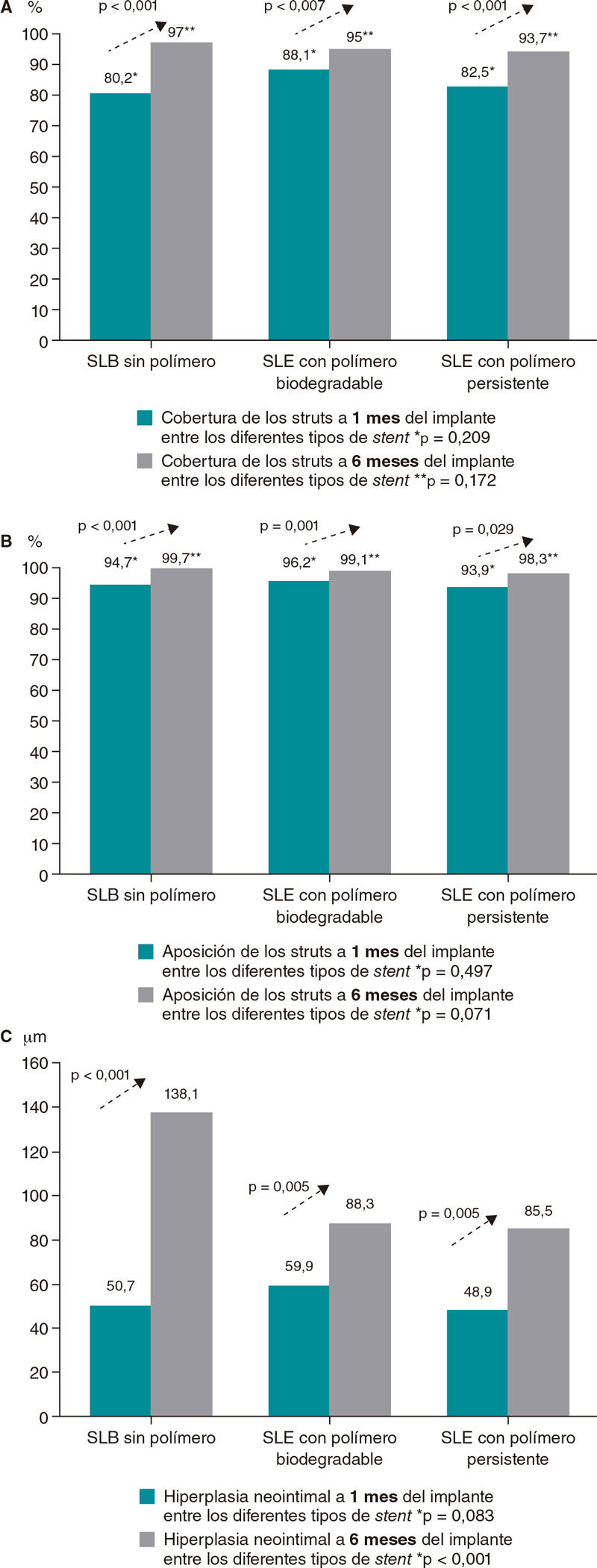
| Struts no cubiertos, n | 238 (19,2) | 154 (3,0) | < 0,001 | 318 (11,9) | 123 (5,0) | 0,007 | 396 (17,5) | 133 (6,3) | 0,001 | 0,209 | 0,172 |
| Struts malapuestos, n | 66 (5,3) | 13 (0,3) | < 0,001 | 101 (3,8) | 21(0,9) | 0,001 | 138 (6,1) | 35 (1,7) | 0,029 | 0,497 | 0,071 |
| Grosor neointimal, µm | 50,7 ± 41,9 | 138,1 ± 102,9 | < 0,001 | 59,9 ± 45,1 | 88,3 ± 83,9 | 0,005 | 48,9 ± 38,1 | 85,5 ± 68,6 | < 0,001 | 0,083 | < 0,001 |
|
Los datos expresan n (%) o media ± desviación estándar. Las variables categóricas se calcularon empleando la prueba de la χ2, las cuantitativas empleando la prueba ANOVA de 1 vía y, teniendo en cuenta el análisis de conglomerados o clúster propio de la OCT, se emplearon ecuaciones de estimación generalizadas para estudiar los struts. |
|||||||||||
Se observó un alto índice de struts no cubiertos entre los distintos stents a 1 mes del implante sin diferencias significativas (p = 0,209). Se observó ≥ 5% de struts no cubiertos en > 80% de los pacientes. Se observó una mayor cobertura en los 3 grupos de stent a 6 meses frente a 1 mes del implante (SLB sin polímero, p < 0,001; SLE con polímero biodegradable, p = 0,007; SLE con polímero persistente, p = 0,001). No hubo diferencias estadísticamente significativas en la cobertura de los struts a 6 meses del implante entre los distintos tipos de stent (p = 0,172) (figura 2, figura 3A).
Figura 2. Comparativa de objetivos al cabo de 1 y 6 meses. A: porcentaje de struts cubiertos al cabo de 1 y 6 meses; B: porcentaje de struts apuestos al cabo de 1 y 6 meses; C: hiperplasia neointimal al cabo de 1 y 6 meses. SLB: stent liberador de biolimus; SLE: stent liberador de everolimus.
Figura 3. Tomografía de coherencia óptica. A: tomografía de coherencia óptica que muestra los struts del stents cubiertos y sin cubrir al cabo de 1 y 6 meses; B: OCT que muestra la presencia de struts del stent malapuestos al cabo de 1 y 6 meses. SLB: stent liberador de biolimus; SLE: stent liberador de everolimus; M: meses.
En lo que a la aposición de los struts a las paredes vasculares se refiere, tampoco se observaron diferencias entre los 3 stents al mes del implante (p = 0,497). Hubo ≥ 5% de struts malapuestos en el 29-30% de los pacientes sin observarse ninguna diferencia entre los diferentes stents. Tampoco se observó ninguna diferencia entre los distintos stents a 6 meses del implante. El índice de aposición fue más alto a 6 meses que a 1 mes del implante en todos los grupos de stent (SLB sin polímero, p = 0,001; SLE con polímero biodegradable, p = 0,001; SLE con polímero persistente, p = 0,029) (figura 2, figura 3B).
Cuando se analizó la hiperplasia neointimal, tampoco se observaron diferencias a 1 mes del implante entre los 3 grupos a estudio (p = 0,083). A 6 meses del implante, hubo más hiperplasia en el grupo de SLB sin polímero que en el de SLE con polímero persistente (p < 0,001). También hubo más hiperplasia a 6 meses que a 1 mes del implante en todos los grupos (SLB sin polímero, p < 0,001; SLE con polímero biodegradable, p < 0,001; SLE con polímero persistente, p = 0,005; figura 2).
DISCUSIÓN
Los principales hallazgos de este registro prospectivo y multicéntrico son: a) en pacientes no diabéticos con lesiones coronarias no complejas de novo tratadas con SFA con polímero persistente frente a biodegradable frente a sin polímero, la cobertura de los struts fue similar y baja (≥ 5% de los struts no cubiertos en > 80% de los pacientes) a 1 mes del implante; b) hubo un índice alto parecido de struts del stent malapuestos (entre el 4 y el 6%) a 1 mes del implante; c) tanto la cobertura intimal como la aposición mejoraron significativamente a 6 meses del implante; d) el SLB sin polímero tuvo más hiperplasia intimal a 6 meses del implante.
Los hallazgos de la OCT sugieren que, en pacientes no diabéticos con lesiones coronarias no complejas tratados con 3 SFA de última generación hay un índice parecido de struts no cubiertos y malapuestos a 1 mes del implante. Después 6 meses, no obstante, la cobertura y aposición son mejores.
Se han realizado varios estudios OCT de pequeña escala para comparar la cobertura y aposición de stents con polímeros persistentes y absorbibles21-24. Las conclusiones de estos estudios varían porque, aunque la mayoría aseguran que el stent con polímero absorbible ofrece una mayor cobertura que la del polímero persistente, uno de estos estudios asegura precisamente lo contrario23. Uno de los estudios descubrió que la cobertura era suficiente a los 3 meses del implante22 mientras que otro aseguró que la cobertura mejoraba a los 12 meses24. En nuestro estudio, el análisis realizado mediante OCT no halló ninguna diferencia estadísticamente significativa en la cobertura de los struts del stent ni en la aposición de estos entre el polímero persistente y el absorbible al mes ni a los 6 meses del implante (figura 2). Las diferencias observadas en la cobertura de los struts del stent durante el seguimiento se explicarían, en parte, por la plataforma del stent, los polímeros empleados para controlar la liberación de fármacos y el propio fármaco antiproliferativo. Los stents del estudio compartían ciertas características farmacológicas (análogos de la clase -limus) pero diferían en sus características poliméricas (persistente frente a biodegradable frente a sin polímero) y en el grosor de las distintas plataformas (el SLB sin polímero tenía una plataforma más gruesa). Probablemente, durante el primer mes, el efecto del fármaco es lo más importante, y este fue similar entre los distintos tipos de stent (análogos de la clase -limus antiproliferativos). No obstante, con el paso del tiempo (entre 1 y 6 meses), otras características de los stents tales como el grosor de la plataforma o las características poliméricas juegan también un papel importante que explicaría las diferencias observadas, en otros estudios, en la cobertura de los struts a 3 meses del implante22,23.
Otros estudios han analizado otros tipos de stents sin polímero diferentes a los de nuestro estudio25,26. Estos grupos hallaron que la cobertura de los struts se alcanzó, en un alto porcentaje, al cabo de entre 3 y 9 meses, llegando a conclusiones parecidas a las nuestras. Uno de los estudios26 realizó OCT al cabo de 1, 3 y 9 meses y confirmó la mayor cobertura de los struts del stent con el paso del tiempo, lo cual coincide con nuestros resultados. Solo 1 estudio analizó el stent Biolimus A9 sin polímero mediante OCT sin compararlo a otros stents27. Se trató de un estudio prospectivo de 1 único centro y 1 único grupo que analizó la cobertura de los struts del stent Biolimus A9 sin polímero al cabo de 1, 2, 3, 4, 5 y 9 meses. Los investigadores determinaron que la cobertura de los struts fue rápida y mejoró con el paso del tiempo manteniéndose, además, la seguridad y eficaz del stent. Estos resultados son similares a los nuestros en el sentido de que la cobertura fue mucho mejor a 6 meses del implante. No obstante, también comparamos stents con y sin polímero algo que, hasta donde nosotros sabemos, no se había hecho hasta la fecha.
Una de las limitaciones de extrapolar el perfil de seguridad clínica de los stents y el grado de cobertura intimal observado en la OCT es que no hay consenso acerca del valor de corte de cobertura que permitiría interrumpir el TAPD de forma segura. Son pocos los estudios1,28 que han intentado determinar un porcentaje de cobertura. El único estudio in vivo realizado hasta la fecha asegura que un porcentaje de struts no cubiertos > 5,9% ya es un factor de riesgo independiente de desarrollar trombosis del stent28. No obstante, estos estudios se han visto limitados por el número de pacientes incluidos. Además, solo se han probado algunos stents. Hay que realizar estudios más extensos para conocer el umbral de seguridad de cobertura de struts que garantice una interrupción segura del TAPD sin un mayor riesgo de trombosis del stent. Así pues, el índice de cobertura a 1 mes del implante (del 80 al 88%) de nuestro estudio parece insuficiente alcanzándose, no obstante, un porcentaje muy alto 6 meses después (del 94 al 97%) en los 3 tipos de stent.
Por último, nuestro estudio confirma que la hiperplasia intimal fue mucho más alta en stents sin polímero a 6 meses del implante. El Biolimus A9 sin polímero tiene una plataforma más gruesa de acero inoxidable que anteriores estudios han asociado a una mayor hiperplasia intimal y reestenosis intrastent27. Los otros 2 tipos de SFA incorporan una plataforma de cobalto-cromo que, en su mayoría, ha sustituido ya al acero inoxidable y que proporciona seguridad y visibilidad suficientes con struts más finos de entre 70 y 90 μm, lo cual reduce los índices reestenosis angiográfica y clínica29. Por eso, esta respuesta inflamatoria a esta plataforma de stent más gruesa (130–140 μm) podría ser, en parte, responsable de este hallazgo.
Limitaciones del estudio
Este fue un estudio basado en OCT; desgraciadamente, no estuvo dotado de potencia estadística como para poder valorar resultados clínicos. Nuestro estudio fue no aleatorizado. No obstante, minimizamos los factores de confusión mediante criterios de inclusión/exclusión seleccionados para pacientes y lesiones (pacientes no diabéticos con lesiones coronarias no complejas). Se analizaron las diferencias existentes entre los distintos grupos, pero no se hallaron diferencias estadísticamente significativas salvo en la fracción de eyección del ventrículo izquierdo que fue más baja en el grupo de stents sin polímero. Si una fracción de eyección del ventrículo izquierdo más baja se asocia, o no, a la trombosis del stent es algo que no se ha descrito todavía en la literatura médica. Este estudio incluyó a pacientes no diabéticos seleccionados con lesiones coronarias simples razón por la cual las conclusiones no se pueden extrapolar a otros grupos con características distintas.
La distribución de los pacientes que recibieron seguimiento angiográfico en el grupo de SFA sin polímero al cabo de 1 o 6 meses fue desigual. Más pacientes del grupo con SFA sin polímero rechazaron el seguimiento angiográfico a 1 mes del implante, lo cual explicaría esta diferencia. Por último, la complejidad del análisis de los 3 grupos en 2 momentos distintos provocó una disgregación de casos que llevó a una n pequeña en cada grupo con el correspondiente riesgo de sesgo asociado.
CONCLUSIONES
En pacientes no diabéticos, la OCT realizada a 1 mes del implante detectó muchos más struts no cubiertos en SFA de última generación con independencia de las características poliméricas (stent persistente frente a biodegradable frente a sin polímero) en el contexto de lesiones coronarias no complejas. Los hallazgos de la OCT no avalan mejores características de curación a corto plazo de stents con polímero biodegradable ni de los stents clase -limus sin polímero frente a la generación actual de SFA con polímero persistente.
FINANCIACIÓN
Este estudio ha sido financiado por Abbott Vascular y Biosensors International, que no participaron en el diseño, recopilación, análisis ni interpretación de los datos, redacción del manuscrito, así como tampoco en la decisión de enviarlo para su publicación.
CONTRIBUCIÓN DE LOS AUTORES
A. Calvo-Fernández, R. Elosua y B. Vaquerizo diseñaron el estudio. J. Gómez-Lara, Héctor Cubero-Gallego, Helena Tizón-Marcos, N. Salvatella, A. Negrete, R. Millán, J.L. Díez, J.M. de la Torre Hernández y B. Vaquerizo participaron tanto en el reclutamiento de pacientes como en las aportaciones hechas a la base de datos. A. Calvo-Fernández, C. Ivern, A. Sánchez-Carpintero y B. Vaquerizo gestionaron la base datos. A. Calvo-Fernández, X. Durán, N. Farré y B. Vaquerizo realizaron tanto el análisis de datos como el estadístico. A. Calvo-Fernández, R. Elosua, N. Farré, H. Cubero-Gallego y B. Vaquerizo redactaron el artículo con los comentarios de los autores.
CONFLICTO DE INTERESES
J. M. de la Torre Hernandez es editor asociado de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito, ha recibido becas de investigación de Abbott Medical, Biosensors, Bristol Myers Squibb y Amgen, así como honorarios como consultor para Boston Scientific, Medtronic, Biotronik, Astra Zeneca y Daiichi-Sankyo. N. Salvatella declaró haber recibido honorarios por la labor docente desarrollada para Abbott Vascular y honorarios como consultor de Boston Scientific. Los autores restantes no declararon ningún otro conflicto de intereses.
¿QUÉ SE SABE DEL TEMA?
- Los actuales SFA con polímero biodegradable o el nuevo stent liberador de biolimus sin polímero se han propuesto como la mejor solución para resolver el problema de la curación tardía de la enfermedad coronaria detectado en los SFA con polímero persistente de primera generación.
¿QUÉ APORTA DE NUEVO?
- Este registro multicéntrico comparo 3 tipos distintos de SFA con liberación de fármacos parecida (análogos de la clase -limus) pero características poliméricas distintas (persistente frente a biodegradable frente a sin polímero).
- Empleando el porcentaje de struts no cubiertos a corto plazo según valoración mediante tomografía de coherencia óptica como marcador indirecto, las características de curación a 1 mes del implante fueron parecidas, aunque insuficientes, entre los distintos tipos de stent.
- Nuestros hallazgos no avalan el uso preferente de stents con polímero biodegradable ni sin polímero para acortar el curso de tratamiento antiagregante plaquetario doble a 1 mes del implante.
BIBLIOGRAFÍA
1. Finn AV, Joner M, Nakazawa G, et al. Pathological Correlates of Late Drug-Eluting Stent Thrombosis: Strut Coverage as a Marker of Endothelization. Circulation. 2007;115:2435-2441.
2. Guagliumi G, Sirbu V, Musumeci G, et al. Examination of the In Vivo Mechanisms of Late Drug-Eluting Stent Thrombosis. J Am Coll Cardiol Intv. 2012;5:12-20.
3. Magnani G, Valgimigli M. Dual Antiplatelet Therapy After Drug-eluting Stent Implantation. Interv Cardiol. 2016;11:51-53.
4. Kelly CR, Teirstein PS, Meredith IT, et al. Long-Term Safety and Efficacy of Platinum Chromium Everolimus-Eluting Stents in Coronary Artery Disease: 5-Year Results From the PLATINUM Trial. J Am Coll Cardiol Intv. 2017;10:2392-2400.
5. Maeng M, Tilsted HH, Jensen LO, et al. Differential clinical outcomes after 1 year versus 5 years in a randomised comparison of zotarolimus-eluting and sirolimus-eluting coronary stents (the SORT OUT III study): a multicentre, open-label, randomised superiority trial. Lancet. 2014;383:2047-2056.
6. Jakobsen L, Christiansen EH, Maeng M, et al. Final five-year outcomes after implantation of biodegradable polymer-coated biolimus-eluting stents versus durable polymer-coated sirolimus-eluting stents. EuroIntervention. 2017;13:1336-1344.
7. Sarno G, Lagerqyist B, Fröbert O, et al. Lower risk of stent thrombosis and restenosis with unrestricted use of ‘new-generation’ drug-eluting stents: a report from the nationwide Swedish Coronary Angiography and Angioplasty Registry (SCAAR). Eur Heart J. 2021;33:606-613.
8. von Birgelen C, Kok MM, van der Heijden LC, et al. Very thin strut biodegradable polymer everolimus-eluting and sirolimus-eluting stents versus durable polymer zotarolimus-eluting stents in allcomers with coronary artery disease (BIO-RESORT): a three-arm, randomised, non-inferiority trial. Lancet. 2016;388:2607-2617.
9. Raungaard B, Jensen LO, Tilsted HH, et al. Zotarolimus-eluting durable-polymer-coated stent versus a biolimus-eluting biodegradable-polymer-coated stent in unselected patients undergoing percutaneous coronary intervention (SORT OUT VI): a randomised non-inferiority trial. Lancet. 2015;385:1527-1535.
10. Jensen LO, Thayssen P, Maeng M, et al. Randomized Comparison of a Biodegradable Polymer Ultrathin Strut Sirolimus-Eluting Stent With a Biodegradable Polymer Biolimus-Eluting Stent in Patients Treated With Percutaneous Coronary Intervention. Circ Cardiovasc Interv. 2019;9:e003610.
11. Räber L, Kelbæk H, Ostojic M, et al. Effect of biolimus-eluting stents with biodegradable polymer vs bare-metal stents on cardiovascular events among patients with acute myocardial infarction: the COMFORTABLE AMI randomized trial. JAMA. 2012;308:777-787.
12. Kim HS, Kang J, Hwang D, et al, HOST-REDUCE-POLYTECH-ACS Trial Investigators. Durable Polymer Versus Biodegradable Polymer Drug-Eluting Stents After Percutaneous Coronary Intervention in Patients with Acute Coronary Syndrome: The HOST-REDUCE-POLYTECH-ACS Trial. Circulation. 2021;143:1081-1091.
13. Urban P, Meredith IT, Abizaid A, et al. Polymer-free Drug-Coated Coronary Stents in Patients at High Bleeding Risk. N Engl J Med. 2015;373:2038-2047.
14. Windecker S, Latib A, Kedhi E, et al; ONYX-ONE Investigators. Polymer-based or Polymer-free Stents in Patients at High Bleeding Risk. N Engl J Med. 2020;382:1208-1218.
15. Kufner S, Ernst M, Cassese S, et al; ISAR-TEST-5 Investigators. 10-Year Outcomes From a Randomized Trial of Polymer-Free Versus Durable Polymer Drug-Eluting Coronary Stents. J Am Coll Cardiol. 2020;76:146-158.
16. Lee KS, Lee JZ, Hsu CH, et al. Temporal Trends in Strut-Level Optical Coherence Tomography Evaluation of Coronary Stent Coverage: A Systematic Review and Meta-Analysis. Catheter Cardiovasc Interv. 2016;88:1083-1093.
17. Tearney GJ, Regar E, Akasaka T, et al. Consensus standards for acquisition, measurement, and reporting of intravascular optical coherence tomography studies: a report from the International Working Group for Intravascular Optical Coherence Tomography Standardization and Validation. J Am Coll Cardiol. 2012;59:1058-1072.
18. Yuan, J. Xu GM. Early and Late Stent Thrombosis in Patients with Versus Without Diabetes Mellitus Following Percutaneous Coronary Intervention with Drug-Eluting Stents: A Systematic Review and Meta-Analysis. Am J Cardiovasc Drugs. 2018;18:483-492.
19. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
20. Gomez-Lara J, Teruel L, Homs S, et al. Lumen enlargement of the coronary segments located distal to chronic total occlusions successfully treated with drug-eluting stents at follow-up. EuroIntervention. 2014;9:1181-1188.
21. Teeuwen K, Spoormans E, Bennett J, et al. Optical coherence tomography findings: insights from the “randomised multicentre trial investigating angiographic outcomes of hybrid sirolimus-eluting stents with biodegradable polymer compared with everolimus-eluting stents with durable polymer in chronic total occlusions” (PRISON IV) trial. EuroIntervention. 2017;13:e522-e530.
22. Kretov E, Naryshkin I, Baystrukov V, et al. Three-months optical coherence tomography analysis of a biodegradable polymer, sirolimus-eluting stent. J Interv Cardiol. 2018;31:442-449.
23. Adriaenssens T, Ughi GJ, Dubois C, et al. STACCATO (Assessment of Stent sTrut Apposition and Coverage in Coronary ArTeries with Optical coherence tomography in patients with STEMI, NSTEMI and stable/unstable angina undergoing everolimus vs biolimus A9-eluting stent implantation): a randomised controlled trial. EuroIntervention. 2016;11:e1619-e1626.
24. Kim BK, Hong MK, Shin DH, et al. Optical coherence tomography analysis of strut coverage in biolimus- and sirolimus-eluting stents: 3-Month and 12-month serial follow-up. Int J Cardiol. 2013;168:4617-4623.
25. Suwannasom P, Onuma Y, Benit E, et al. Evaluation of vascular healing of polymer-free sirolimus-eluting stents in native coronary artery stenosis: a serial follow-up at three and six months with optical coherence tomography imaging. EuroIntervention. 2016;12:e574-e583.
26. Worthley SG, Abizaid A, Kirtane AJ, et al. First-in-Human Evaluation of a Novel Polymer-Free Drug-Filled Stent. JACC Cardiovasc Interv. 2017;10:147-156.
27. Lee SWL, Tam FCC, Chan KKW, et al. Establishment of healing profile and neointimal transformation in the new polymer-free biolimus A9-coated coronary stent by longitudinal sequential optical coherence tomography assessments: the EGO-BIOFREEDOM study. EuroIntervention. 2018;14:780-788.
28. Won H, Shin DH, Kim BK, et al. Optical coherence tomography derived cut-off value of uncovered stent struts to predict adverse clinical outcomes after drug-eluting stent implantation. Int J Cardiovasc Imaging. 2013;29:1255-1263.
29. Pache J, Kastrati A, Mehilli J, et al. Intracoronary stenting and angiographic results: Strut thickness effect on restenosis outcome (ISAR-STEREO-2) trial. J Am Coll Cardiol. 2003;41:1283-1288.