INTRODUCCIÓN
El ensayo clínico aleatorizado (ECA) se ha convertido en el patrón oro para valorar tratamientos clínicos gracias a su bajo sesgo de selección y a los escasos factores de confusión desconocidos. No obstante, el rigor de las guías de práctica clínica y las exigencias de las agencias reguladoras se han ido complicando con el paso del tiempo hasta el punto de que prácticamente solo las grandes compañías farmacéuticas disponen de los recursos necesarios para poder hacer ECA. Por eso se corre el riesgo de que cuestiones importantes que interesan a la comunidad científica y académica se queden sin evaluar en un ensayo clínico adecuado.
Una forma de evitar estos problemas es usar un diseño de ensayo clínico aleatorizado basado en registros (ECA-R). Un ECA-R utiliza la plataforma de un registro de salud observacional de alta calidad ya existente como formulario del caso clínico a efectos de aleatorización y seguimiento. Este diseño posibilita la aleatorización de gran número de pacientes durante periodo de tiempo corto, reduce el coste a una fracción del de un ensayo clínico aleatorizado convencional y permite hacer seguimiento a todos los pacientes elegibles no inscritos en el estudio (tabla 1).1-4
Tabla 1. Principales funciones para la realización de un ensayo proporcionadas por el registro
| Identificación de pacientes elegibles |
| Alerta al investigador de turno de un paciente elegible |
| Enlace a un módulo de aleatorización |
| Aleatorización |
| Recopilación de las características basales y de la intervención a partir |
| de un registro (FECC) |
| Presentación de cuestiones adicionales específicas del ensayo a efectos del FECC |
| Identificación de los objetivos clínicos (detección de objetivos) |
| Divulgación de los resultados clínicos. |
| Divulgación de las características de los pacientes incluidos y no incluidos |
| de la población general |
|
FECC: formulario electrónico de registro de casos clínicos. |
REGISTROS ELEGIBLES PARA REALIZAR ECA-R
En la actualidad, casi todos los datos sanitarios se almacenan digitalmente, lo cual es una excelente oportunidad de poder usar estos datos en un ECA-R. No obstante, las historias clínicas no suelen estructurarse de forma que permitan una extracción útil de los datos. Hoy en día, los registros nacionales de calidad específicos de enfermedades son los más aptos para ser la base de un ECA-R, aunque esto podría no ser así en un futuro. Nuestra experiencia se basa en el sistema web sueco para la mejora y desarrollo de cuidados basados en la evidencia en cardiopatías evaluadas según los tratamientos recomendados (SWEDEHEART) y en su registro de coronariografías y angioplastias (SCAAR)5 a través del cual se han llevado o se están llevando a cabo gran número de ECA-R (tabla 2)6-10. La validación de los datos de registros ofrece un grado de acuerdo global del 96% frente a las historias clínicas11. El primer ECA-R puro fue el ensayo TASTE que estudió la tromboaspiración en pacientes con infarto agudo de miocardio con elevación del segmento ST (IAMCEST) con la mortalidad como objetivo primario1. Se incluyó rápidamente a un gran número de pacientes con un presupuesto limitado, usando solo registros de datos demográficos, aleatorización y recopilación de objetivos basales de forma prospectiva y aleatorizada. En este ensayo de una única intervención con dispositivo y un objetivo sólido, el registro SWEDEHEART proporcionó todos los pasos a seguir para la realización de un ECA (tabla 1). En primer lugar, identificar a los pacientes elegibles y «asignárselos» al investigador de turno mediante una ventana emergente antes de la intervención. En segundo lugar, abrir una ventana de aleatorización con 2 preguntas: ¿se han cumplido los criterios de inclusión y exclusión? y ¿ha dado el paciente su consentimiento para participar en el estudio? Si las respuestas a ambas preguntas eran afirmativas, se aleatorizaba al paciente mostrándose el resultado en pantalla temporalmente. En tercer lugar, tanto las características basales como los objetivos durante el seguimiento se recopilaron del registro. También se recogieron los datos de todos los pacientes no inscritos con las características basales completas. Es interesante comparar el estudio TASTE con el TOTAL que analizó la tromboaspiración a partir de un diseño de ECA tradicional12. Mientras los costes del estudio TOTAL ascendieron a 15.000.000 € con 87 centros inscribiendo pacientes durante 48 meses con un seguimiento de 6 meses, los costes del TASTE fueron de 500.000 € (¡un 3%!) con 30 centros inscribiendo pacientes durante 33 meses con un seguimiento de 42 meses. Los resultados de ambos estudios fueron casi idénticos. En estas circunstancias de baja complejidad tanto a nivel de tratamiento como de objetivos, los ECA-R superan a los tradicionales ECA en casi todos los aspectos.
Tabla 2. Ensayos clínicos aleatorizados basados en registros del registro SWEDEHEART: completados, en fase de inclusión o en planificación
| ECA-R | Pacientes, n | Cuestión | Fecha de inicio |
|---|---|---|---|
| TASTE, Fröbert et al.1 (2013) | 7.200 | romboaspiración en ICP primaria | 2013 + 2014 |
| IFR-SWEDEHEART, Gotberg et al.6 (2017) | 2.018 | iFR frente a FFR en angina estable o SCA | 2017 |
| VALIDATE-SWEDEHEART Erlinge et al.7 (2017) | 6.006 | Bivalirudina frente a HNF para ICP en SCA | 2017 |
| DETO2X-AMI, Hofmann et al.8 (2017) | 6.629 | Oxígenoterapia en IM | 2017 |
| FULL-REVASC, NCT02862119 | 4.052 | Guiado por FFR en IM | Inclusión interrumpidatras 1.545 pacientes |
| PROSPECT-II, NCT02171065 | 900 | Espectroscopía de infrarrojo cercano en ICP | Presentado, TCT 2020 |
| IAMI, Fröbert et al.9 (2017) | 4.400 | Vacuna de la gripe tras IM | Inclusión completada |
| SPIRRIT, NCT02901184 | 3.200 | Espironolactona para el manejo de la ICFEP | En fase de inclusión |
| REDUCE, NCT03278509 | 6.600 | Bloqueadores beta post-IM en pacientes con una fracción de eyección > 50% | En fase de inclusión |
| ABC-AF, NCT03753490 | 6.500 | Tratamiento basado en valores de biomarcadores frente a tratamiento estándar | En fase de inclusión |
| MINOCA-BAT, NCT03686696 | 2.048 | IECA/bloqueadores beta tras IM con EC no obstructiva | En fase de inclusión |
| TACSI, NCT03560310 | 2.200 | SCA post-CABG, ticagrelor | En fase de inclusión |
| SWEDEGRAFT, NCT03501303 | 902 | CABG | Inclusión completada |
| Infinity-Swedeheart, NCT04562805 | 2.400 | SFA capaz de desconectar sus struts metálicos frente a SFA | En fase de inclusión |
| DAPA-MI, NCT04564742 | 6.400 | Inhibidores del SGLT2 post-IAM | ]En fase de inclusión |
| HELP-SWEDEHEARTa | 20.000 | Cribado de Helicobacter pylori tras IAM para evitar hemorragiasgastrointestinales superiores (aleatorización por conglomerados) | T2, 2021 |
| SWITCHb | 20.000 | Prasugrel o ticagrelor post-IM (aleatorización por conglomerados) | En fase de planificación |
| BROKEN-Swedeheart, NCT04666454 | 1.000 | Tratamiento médico óptimo contra el síndrome de tako-tsubo | En fase de planificación |
|
a Pendiente de registro; estudio piloto: NCT04289012. b Pendiente de registro. CABG: cirugía de revascularización coronaria; EC: enfermedad coronaria; FFR: reserva fraccional de flujo; HNF: heparina no fraccionada; IAM: infarto agudo de miocardio; ICFEP: insuficiencia cardiaca con fracción de eyección preservada; ICP: intervención coronaria percutánea; IECA: inhibidores de la enzima convertidora de angiotensina; iFR: índice diastólico instantáneo sin ondas; IM: infarto de miocardio; SCA: síndrome coronario agudo; SFA: stent farmacoactivo; SGLT2: cotransportador sodio-glucosa tipo 2; TCT: congreso Transcatheter Cardiovascular Therapeutics. |
|||
VENTAJAS Y LIMITACIONES DE LOS ECA-R PUROS COMPARADOS CON LOS ECA TRADICIONALES
Las principales ventajas del diseño de un ECA-R son: a) una población de pacientes más amplia y representativa de la realidad clínica; los estudios TASTE y VALIDATE-SWEDEHEART incluyeron al 70% de todos los pacientes elegibles1,7; b) se incluyeron los objetivos más importantes a nivel clínico en lugar de varios objetivos subrogados débiles; c) periodos de seguimiento a largo plazo, de hecho, de por vida, cuando fuese necesario; d) gracias a la selección aleatoria, tanto los sesgos como los factores de confusión se reducen al mínimo; e) costes mucho más bajos; f) inclusión rápida de gran número de pacientes; y g) iniciados y dirigidos por investigadores académicos independientes sin ninguna relación con la industria.
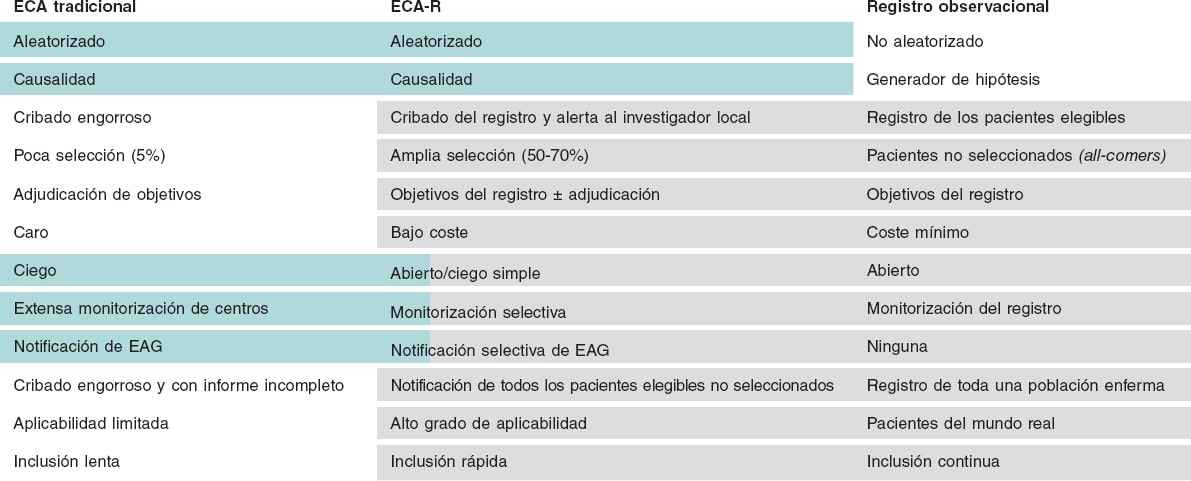
Las limitaciones son: a) diseño de ensayo abierto con el correspondiente riesgo de dar una información sesgada de los objetivos; b) pueden pasarse por alto episodios raros e inesperados y haber problemas a la hora de informar sobre los eventos adversos graves; c) los eventos, en su mayoría, no están adjudicados, lo cual podría influir en la calidad de los datos; d) problemas para realizar análisis bioquímicos centralizados y biobancos; e) los fármacos orales a largo plazo pueden ser difíciles de distribuir y hacer seguimiento; y f) monitorización del centro limitada o ausente (figura 1).
Figura 1. Comparativa de ensayo clínico aleatorizado (ECA) tradicional, estudios de registro y ensayo clínico aleatorizado basado en registros (ECA-R). Los ECA-R clásicos son el patrón oro de la investigación clínica. No obstante, presentan ciertas limitaciones porque son muy caros, selectivos y su proceso es complicado. Los estudios de registro retrospectivos son mucho más baratos de realizar y quizá incluso más representativos del mundo real; no obstante, están siempre lastrados por factores de confusión desconocidos. Un ECA-R se beneficia de lo mejor de estas modalidades tan distintas. EAG: eventos adversos graves.
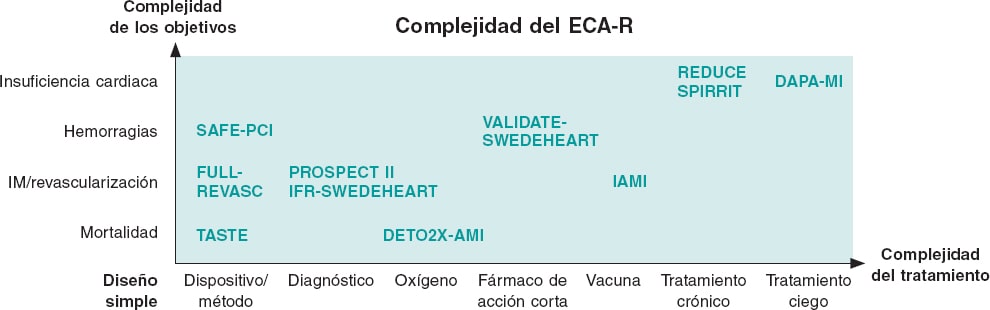
Dependiendo de las limitaciones del registro utilizado, de la necesidad de escalar el tratamiento o de la complejidad de los objetivos, el ECA-R se puede complementar con diferentes elementos procedentes de un ensayo tradicional y convertirse en un ECA-R híbrido (figura 2).
Figura 2. Ensayos clínicos aleatorizados basados en registros ECA-R simples frente a complejos. El ECA-R más puro que existe analiza un único tratamiento como, por ejemplo, un dispositivo de tromboaspiración y tiene un objetivo robusto como la mortalidad. A medida que aumenta la complejidad del tratamiento o el objetivo, deben incorporarse ciertas adiciones al diseño del ECA-R. Estas adiciones, que pueden ser llamadas telefónicas, adjudicación central o tratamiento ciego con placebo, aumentan la complejidad y los costes, pero permiten que el registro siga siendo la base del ensayo facilitando, así, su rendimiento. IM: infarto de miocardio.
DESARROLLO DE UN ECA-R
En la serie SORT-OUT de estudios de stents coronarios, tanto los datos demográficos basales como el cribado de los objetivos se realizaron desde una óptica de registro. Sin embargo, la aleatorización se hizo usando diferentes abordajes (servicio de asignación de llamadas telefónicas, sistemas de aleatorización por internet) con adjudicación central de objetivos13. En el estudio SAFE-PCI, la aleatorización se realizó fuera del registro y se obtuvo información y adjudicación clínica adicionales a los datos del registro14.
El estudio VALIDATE-SWEDEHEART evaluó 2 agentes antitrombóticos intravenosos de acción corta (bivalirudina y heparina) desde la óptica de un ECA-R. Que se sepa, se trata del primer ECA-R farmacéutico jamás realizado7. En un estudio farmacéutico los requisitos de las autoridades reguladores son más exigentes, aunque los fármacos ya estén aprobados y lleven décadas empleándose. También nos dimos cuenta de que nuestro registro no incluyó satisfactoriamente las complicaciones hemorrágicas. Por eso incorporamos llamadas telefónicas entre 7 y 180 días después seguido de la adjudicación central de las complicaciones hemorrágicas e IM, información limitada de los eventos graves y datos sobre todo lo ocurrido durante la hospitalización índice. Gracias a la simplicidad del estudio, 25 centros lograron inscribir a más de 6.000 pacientes con IM en un plazo de 2 años. De hecho, algunos centros grandes inscribieron a más de 1.000 pacientes (figura 2, tabla 2).
El estudio IFR-SWEDEHEART valoró el índice diastólico instantáneo sin ondas. Aunque la intervención no tuvo mucha complicación, el objetivo compuesto incluyó IM y revascularización no programada6. Aunque se hallaron los objetivos en los registros, los datos se recopilaron de las historias clínicas de los centros y fueron adjudicados por un comité central.
En el estudio DETO2X-AMI el objetivo fue la mortalidad, que no necesita adjudicación; no obstante, durante la intervención el oxígeno se tuvo que administrar a los pacientes de forma ciega, lo cual le dio un extra de complejidad al estudio8 (figura 2, tabla 2). Asimismo, el estudio sobre la vacuna de la gripe post-IM (ensayo IAMI) precisó tratamiento ciego9. Además, se necesitaron otros países sin la estructura del registro SWEDEHEART para contar con un número suficiente de pacientes, dando como resultado, paralelamente, un módulo de aleatorización y formularios electrónicos de casos clínicos (figura 2, tabla 2)9.
En la actualidad, hay 2 ECA-R en marcha sobre tratamiento oral crónico y un objetivo compuesto de muerte y hospitalizaciones por insuficiencia cardiaca: El REDUCE (bloqueadores beta post-IM, NCT03278509) y el SPIRRIT (espinorolactona en pacientes con insuficiencia cardiaca y fracción de eyección preservada NCT02901184). No obstante, a pesar del complejo tratamiento y de los objetivos de ambos, básicamente solo se basan en registros. El tratamiento está aleatorizado en el registro y prescrito y el seguimiento corre a cuenta del Registro Sueco del Medicamento. Las hospitalizaciones por insuficiencia cardiaca se han recopilado del Registro Nacional de Pacientes, donde este diagnóstico ha demostrado tener una alta validez en anteriores estudios.
POSIBILIDADES DEL DISEÑO ECA-R EN EL FUTURO
Hasta la fecha, la tecnología de los ECA-R viene empleándose, principalmente, para valorar dispositivos o fármacos genéricos que llevan décadas usándose, a menudo con resultados de que el tratamiento analizado ha sido redundante, como en el caso con los estudios TASTE y VALIDATE-SWEDEHEART. En ocasiones, como sucedió con el estudio IFR-SWEDEHEART, un nuevo procedimiento diagnóstico resulta no ser inferior al estándar actual6. Esto propició una recomendación de nivel IA para el índice diastólico instantáneo sin ondas en las guías de práctica clínica. En líneas generales, los ECA-R se consideran no aptos por las autoridades reguladores en primera aprobación, aunque esto está a punto de cambiar. El estudio INFINITY (NCT04562805) está analizando un nuevo tipo de stent capaz de desconectar sus struts metálicos medio año después de ser implantado. El objetivo de este ECA-R, aún en fase de reclutamiento, es avalar una aprobación de la US Food and Drug Administration (FDA). De los datos demográficos, aleatorización y seguimiento de los objetivos ya se está encargando el registro SWEDEHEART; aun así, se ha incorporado una llamada telefónica al cabo de 1 mes y 1 año acompañada de adjudicación central.
El primer estudio en analizar un uso ampliado para un fármaco oral, el DAPA-MI (NCT04564742), está probando el uso de dapagliflozina en pacientes post-IM con fracción de eyección reducida, pero sin diabetes. Aunque el registro es la base del estudio, se han incorporado visitas para dispensar la medicación en modo ciego. El estudio está financiado por AstraZeneca y pretende desarrollar nuevas fórmulas más rentables de realizar ensayos fase III. El estudio cuenta con el apoyo de Reino Unido y Suecia y sus registros nacionales sobre IM, el MINAP16 y el SWEDEHEART5, respectivamente.
En Europa, la Sociedad Europea de Cardiología se basa principalmente en encuestas para llevar a cabo el registro de diferentes cardiopatías. Son herramientas valiosas que, sin embargo, solo ofrecen una instantánea de un corto periodo de tiempo. Además, como la selección de pacientes no está bien definida, pueden no ser representativas del mundo real. No obstante, una nueva iniciativa llamada EuroHeart17 intentará establecer una estructura básica común para registros cardiacos continuos que podrán usar todos los países. Uno de sus objetivos es posibilitar la realización de ECA-R en diferentes países europeos de tal forma que los resultados sean más representativos y los estudios grandes puedan agilizarse más si cabe.
ECA-R DE ALEATORIZACIÓN POR CONGLOMERADOS
El diseño de aleatorización por conglomerados o clusters simplifica el reclutamiento de pacientes y no requiere de la firma de un consentimiento informado, tan solo información general sobre el estudio en fase de inlcusión. Facilita el reclutamiento de casi todos los pacientes de una región determinada durante un periodo de tiempo determinado y emplea, principalmente, un diseño cruzado. En el estudio HELP-SWEDEHEART, todavía pendiente de registro, se aleatorizará por conglomerados a 20.000 pacientes diagnosticados de IM en el registro SWEDEHEART en un diseño cruzado según sus datos hospitalarios, dentro de un programa de cribado de Helicobacter pylori. Si dan positivo se les recomendará terapia de erradicación. El objetivo primario son las hemorragias gastrointestinales superiores que se recopilarán del Registro Nacional de Pacientes. El estudio SWITCH, también pendiente de registro, investigará el uso de prasugrel frente a ticagrelor para el tratamiento de pacientes hospitalizados post-IM con el objetivo compuesto de muerte, IM o accidente cerebrovascular a partir de datos del Registro Nacional de Pacientes y Registro Nacional de Causa de Muerte. Se aleatorizará, por bloques, a un total de 4 regiones suecas que recibirán tratamiento estándar con prasugrel o ticagrelor durante un periodo de 2 años.
En conclusión, los ECA-R aúnan, por un lado, algunas de las mejores partes del diseño de un ECA clásico y por el otro, de registros tradicionales para realizar grandes estudios clínicos rentables, aleatorizados y representativos del mundo real. Dan a los investigadores académicos la oportunidad de obtener importantes respuestas clínicas que, de otro modo, jamás habrían existido por falta de financiación por parte de la industria.
FINANCIACIÓN
Este estudio ha contado con financiación de la Swedish Heart and Lung Foundation, el Swedish Scientific Research Council y la Knut and Alice Wallenberg Foundation. El autor es el único responsable del contenido de este manuscrito.
CONFLICTO DE INTERESES
D. Erlinge declara honorarios como conferenciante o asesor para AstraZeneca, Bayer, Sanofi y Chiesi.
BIBLIOGRAFÍA
1. Fröbert O, Lagerqvist B, Olivecrona GK, et al. Thrombus aspiration during ST-segment elevation myocardial infarction. N Engl J Med. 2013;369:1587-1597.
2. James S, Frobert O, Lagerqvist B. Cardiovascular registries:a novel platform for randomised clinical trials. Heart. 2012;98:1329-1331.
3. Yndigegn T, Hofmann R, Jernberg T, Gale CP. Registry-based randomised clinical trial:efficient evaluation of generic pharmacotherapies in the contemporary era. Heart. 2018;104:1562-1567.
4. Lauer MS, D'Agostino RB, Sr. The randomized registry trial--the next disruptive technology in clinical research?N Engl J Med. 2013;369:1579-1581.
5. Start - SWEDEHEART (uu.se). Disponible en: https://www.ucr.uu.se/swedeheart/start-scaar. Consultado 8 Feb 2021.
6. Gotberg M, Christiansen EH, Gudmundsdottir IJ, et al. Instantaneous Wave-free Ratio versus Fractional Flow Reserve to Guide PCI. N Engl J Med. 2017;376:1813-1823.
7. Erlinge D, Omerovic E, Frobert O, et al. Bivalirudin versus Heparin Monotherapy in Myocardial Infarction. N Engl J Med. 2017;377:1132-1142.
8. Hofmann R, James SK, Jernberg T, et al. Oxygen Therapy in Suspected Acute Myocardial Infarction. N Engl J Med. 2017;377:1240-1249.
9. Fröbert O, Gotberg M, Angeras O, et al. Design and rationale for the Influenza vaccination After Myocardial Infarction (IAMI) trial. A registry-based randomized clinical trial. Am Heart J. 2017;189:94-
10. Hambraeus K, Held C, Johansson P, et al. SWEDEHEART Annual report 2012. Scan Cardiovasc J. 2014;48(Suppl 63):2-133.
11. Jernberg T, Attebring MF, Hambraeus K, , et al. The Swedish Web-system for enhancement and development of evidence-based care in heart disease evaluated according to recommended therapies (SWEDEHEART). Heart. 2010;96:1617-1621.
12. Jolly SS, Cairns JA, Dzavik V. Primary PCI with or without Thrombectomy. N Engl J Med. 2015;373:682-683.
13. Raungaard B, Jensen LO, Tilsted HH, et al. Zotarolimus-eluting durable-polymer-coated stent versus a biolimus-eluting biodegradable-polymer-coated stent in unselected patients undergoing percutaneous coronary intervention (SORT OUT VI):a randomised non-inferiority trial. Lancet. 2015;385:1527-1535.
14. Rao SV, Hess CN, Barham B, et al. A registry-based randomized trial comparing radial and femoral approaches in women undergoing percutaneous coronary intervention:the SAFE-PCI for Women (Study of Access Site for Enhancement of PCI for Women) trial. JACC Cardiovasc Interv. 2014;7:857-867.
15. Neumann FJ, Sousa-Uva M, Ahlsson A, et al.;ESC Scientific Document Group. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
16. NICOR. Myocardial Ischaemia/MINAP (Heart Attack audit). Disponible en: https://www.nicor.org.uk/national-cardiac-audit-programme/heart-attack-audit-minap. Consultado 8 Feb 2021.
17. European Society of Cardiology. EuroHeart. Disponible en: https://www.nicor.org.uk/national-cardiac-audit-programme/heart-attack-audit-minap. Consultado 8 Feb 2021.