¿Cómo lo haría?
Los autores presentan un caso clínico de un varón octogenario con estenosis aórtica grave sintomática, función ventricular preservada e insuficiencia mitral ligera y sin enfermedad coronaria. Presentaba un riesgo quirúrgico bajo (puntuación de la Society of Thoracic Surgeons: 3,1%) y en sesión médico-quirúrgica se decidió realizar un recambio valvular aórtico quirúrgico, que se hizo con una bioprótesis aórtica sin suturas Perceval (Perceval Sutureless Aortic Heart Valve, Sorin) de tamaño L. El ecocardiograma de seguimiento previo al alta mostró ausencia de gradiente transvalvular aórtico significativo y dos chorros de regurgitación periprotésicos que sugerían insuficiencia aórtica de ligera a moderada. Cinco meses después del reemplazo valvular, el paciente ingresó por edema agudo de pulmón y el ecocardiograma mostró una insuficiencia aórtica grave secundaria a la ausencia de cobertura del stent de la bioprótesis aórtica a nivel del anillo aórtico en la zona correspondiente al seno no coronariano y la mayor parte del seno coronario derecho con 2 chorros de regurgitación hacia el ventrículo izquierdo, el cual se encontraba algo dilatado. La fracción de eyección del ventrículo izquierdo estaba ligeramente deprimida.
Antes de plantear cualquier actitud terapéutica en un paciente con insuficiencia aórtica tras un implante valvular debemos conocer 3 datos fundamentales: 1) la gravedad exacta de la regurgitación; 2) la localización (transvalvular o paravalvular); y 3) el mecanismo subyacente según las técnicas de imagen oportunas.
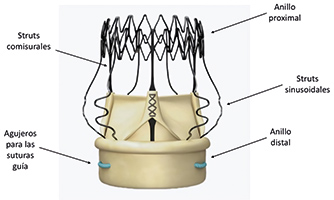
La información suministrada nos indica que la insuficiencia aórtica era grave. En cuanto a la localización de la insuficiencia, si nos guiamos por el resultado tras el implante y la descripción del ecocardiograma al ingreso, es periprotésica. El tercer punto clave para el planteamiento terapéutico futuro es dilucidar el mecanismo que provoca la insuficiencia aórtica grave periprotésica en un paciente portador de una prótesis Perceval. Se trata de una prótesis de pericardio bovino montada sobre un stent de nitinol (aleación de níquel y titanio). La armadura tiene dos anillos cilíndricos (figura 1): uno proximal (outflow ring) y otro distal (inflow ring)1. Tras su montaje, se coloca en la válvula y se libera en la raíz aórtica. Se utilizan 3 puntos de sutura en el anillo aórtico nativo como guía para localizar el punto exacto de implante. Se despliega girando un tornillo de liberación y se expande totalmente mediante un catéter-balón. Una vez desplegada, se retiran las suturas. Se comercializa hasta la fecha en cuatro tamaños: S (19 a 21 mm), M (21 a 23 mm), L (23 a 25 mm) y XL (25 a 27 mm). Cada tamaño es adecuado para una serie de anillos aórticos y diámetros sinotubulares, por lo que resulta esencial disponer de las medidas anatómicas del paciente. No se recomienda su uso en pacientes con la aorta ascendente dilatada con una relación de diámetro de la unión sinotubular respecto al diámetro del anillo aórtico ≥ 1,3 ni en pacientes con una válvula aórtica bicúspide.
Figura 1. Componentes de la válvula Perceval (Perceval Sutureless Aortic Heart Valve, Sorin).
Al igual que ocurre con las prótesis transcatéter, después de implantar una Perceval no es infrecuente observar cierto grado de fuga perivalvular. Los mecanismos de las fugas son los siguientes:
- Reintervención y recambio valvular por una prótesis más pequeña, Perceval M, o por una válvula con suturas.
- Tamaño inadecuado de la prótesis: tanto una prótesis pequeña en relación al anillo (undersizing) como una grande (oversizing) se asocian con la presencia de fugas perivalvulares.
Teniendo en cuenta la descripción del ecocardiograma y que los errores más frecuentes son por oversizing, y asumiendo una correcta posición de la prótesis, me parece que el mecanismo de fallo de la prótesis pudiera ser el recoil o colapso de la estructura metálica que aloja los velos de la bioprótesis, que con frecuencia afecta a la zona del seno no coronariano, complicación bien conocida por los cirujanos y descrita en varios casos en la literatura2. Debemos tener en mente que esta deformidad del stent, que causa ausencia de contacto entre la prótesis y la raíz aórtica en cualquier zona desde el anillo aórtico hasta la unión sinotubular, puede producirse en el intraoperatorio o de forma diferida días después de la intervención, y se produce especialmente en caso de anillos pequeños; por ello, varios autores recomiendan elegir la prótesis más pequeña cuando la dimensión del anillo se encuentre entre 2 tamaños de prótesis.
Ante el colapso del armazón metálico, las opciones terapéuticas, todas ellas publicadas en la literatura3, son:
- Reintervención y recambio valvular por una prótesis más pequeña, Perceval M, o por una válvula con suturas.
- Tratamiento percutáneo con valvuloplastia con balón de 22-23 mm, ya que el diámetro interno verdadero de la válvula Perceval L declarado por el fabricante es de 21,5-23 mm.
- Tratamiento percutáneo mediante implante percutáneo de válvula aórtica, procedimiento de valve-in-valve.
Personalmente me inclinaría por hacer una valvuloplastia como primera opción, pero dado que no se ha solucionado el problema de base (prótesis demasiado grande para el anillo), lo más probable es que esta maniobra no fuera efectiva. En tal caso, implantaría una válvula transcatéter que tenga la mayor fuerza radial posible (procedimiento de valve-in-valve).
Agradecimientos
Agradezco la evaluación crítica del artículo que han realizado C. Moris de la Tassa (cardiólogo intervencionista) y D. Hernández-Vaquero (cirujano cardiaco).
Bibliografía
1. Baert J, Astarci P, Noirhomme P, de Kerchove L. The risk of oversizing with sutureless bioprosthesis in small aortic annulus. J Thorac Cardiovasc Surg. 2017;153;270-272.
2. Chandola R, Teoh K, Elhenawy A, Christakis G. Perceval Sutureless Valve — are Sutureless Valves Here? Curr Cardiol Rev. 2015;11;220-228.
3. Powell R, Pelletier MP, Chu MWA, Bouchard D, Melvin KN, Adams C. The Perceval Sutureless Aortic Valve: Review of Outcomes, Complications, and Future Direction. Innovations (Phila). 2017;12;155-173.