RESUMEN
Introducción y objetivos: La calcificación coronaria es uno de los principales factores que inciden negativamente en la seguridad y la eficacia del intervencionismo coronario percutáneo. Existen varias técnicas de modificación del calcio, pero falta evidencia de estudios aleatorizados sobre la terapia de elección en este escenario.
Métodos: El ROLLERCOASTR es un estudio prospectivo, multicéntrico y aleatorizado, diseñado para comparar la seguridad y la eficacia de 3 técnicas de modificación de la placa en el contexto de calcificación coronaria moderada o grave: aterectomía rotacional (AR), aterectomía coronaria con láser láser excimer (ACLE) y litotricia intracoronaria (LIC). El objetivo primario es la expansión del stent evaluada mediante tomografía de coherencia óptica. Su análisis se hará por intención de tratar, con un α de 0,05 entre el grupo de referencia (AR) y cada uno de los otros grupos (ACLE y LIC). Se realizará también un análisis del objetivo primario por protocolo para mantener la coherencia. Si se confirma la hipótesis de no inferioridad, se realizará un análisis bilateral de superioridad. El comité de eventos clínicos y el laboratorio central independiente no conocerán la rama de tratamiento. Asumiendo un error α de 0,05, un error β de 0,2 (80% de potencia), un margen de irrelevancia (ε) del 7% y un 10% de pérdidas por dificultad de medición o imposibilidad de completar la intervención, se estima un tamaño de muestra de 56 casos en cada grupo. Los objetivos secundarios son el éxito del dispositivo, el éxito del procedimiento, la tasa de cruce entre técnicas y la presentación de eventos cardiovasculares adversos importantes al año de seguimiento.
Conclusiones: El estudio ROLLERCOASTR evaluará y comparará la seguridad y la eficacia, en pacientes con estenosis coronaria calcificada, de 3 técnicas de modificación de placa: AR, ACLE y LIC. Este ensayo se ha registrado en Clinicaltrials.gov: NCT04181268.
Palabras clave: Intervencionismo coronario percutáneo. Placas calcificadas. Láser. Litotricia. Aterectomía rotacional. Tomografía de coherencia óptica.
Design of the ROLLERCOASTR trial: rotational atherectomy, lithotripsy or laser for the management of calcified coronary stenosis
ABSTRACT
Introduction and objectives: Coronary calcification is one of the leading factors that affect negatively the safety and effectiveness of percutaneous coronary intervention. Several calcium modification techniques exist. However, there is a lack of randomized evidence on the therapy of choice in this scenario.
Methods: The ROLLERCOASTR is a prospective, multicenter, randomized clinical trial designed to compare the safety and efficacy profile of 3 plaque modification techniques in the moderate-to-severe coronary calcification setting: rotational atherectomy (RA), excimer laser coronary angioplasty (ELCA), and intravascular lithotripsy (IVL). The study primary endpoint is stent expansion evaluated by optical coherence tomography. An intention-to-treat analysis will be conducted with an alpha coefficient of 0.05 between the reference group (RA) and the remaining 2 groups (ELCA and IVL). An analysis of the study primary endpoint per protocol will be conducted for consistency purposes. If the non-inferiority hypothesis is confirmed, a superiority 2-sided analysis will be conducted. Both the clinical events committee and the independent core laboratory will be blinded to the treatment arm. Assuming an α error of 0.05, an β error of 0.2 (80% power), a margin of irrelevance (ε) of 7, and losses of 10% due to measurement difficulty or impossibility to complete the intervention, we estimate a sample size of 56 cases per group. The study secondary endpoints are device success, procedural success, crossover rate among the different techniques used, and the occurrence of major adverse cardiovascular events at 1-year follow-up.
Conclusions: The ROLLERCOASTR trial will evaluate and compare the safety and effectiveness of 3 plaque modification techniques: RA, ELCA, and IVL in patients with calcified coronary stenosis. This trial was registered at clinicaltrials.gov with identifier NCT04181268.
Keywords: Percutaneous coronary intervention. Calcified plaques. Laser. Lithotripsy. Rotational atherectomy. Optical coherence tomography.
Abreviaturas
ACLE: aterectomía coronaria con láser Excimer. AR: aterectomía rotacional. ICP: intervención coronaria percutánea. LIC: litotricia intracoronaria. OCT: tomografía de coherencia óptica. SFA: stent farmacoactivo.
INTRODUCCIÓN
La intervención coronaria percutánea (ICP) con implante de stent farmacoactivo (SFA) es el método más común de revascularización coronaria.
Las lesiones coronarias calcificadas plantean todo un desafío a la hora de realizar ICP con éxito1. La calcificación coronaria dificulta la ICP a través de varios mecanismos, por ejemplo, dificulta el cruce de la lesión con el SFA, altera la cinética de liberación del fármaco e interfiriere con la expansión óptima del stent. Por si fuera poco, la expansión inadecuada del stent resulta ser un potente predictor de trombosis y reestenosis del stent2-6. La calcificación coronaria también aumenta la posibilidad de sufrir complicaciones asociadas a la ICP como, por ejemplo, disecciones, perforaciones, infartos de miocardio y resultados clínicos adversos tardíos tales como reestenosis, nuevas revascularizaciones, fracturas del stent y trombosis1. El abordaje óptimo para el manejo de la estenosis calcificada requiere tener en cuenta las características de la lesión, la distribución del calcio y el mecanismo de acción de cada dispositivo de modificación de la placa. En este sentido, técnicas de imágenes intracoronarias tales como la ecografía intravascular y la tomografía de coherencia óptica (OCT) se antojan esenciales no solo para evaluar la gravedad de la calcificación y su patrón, sino también para optimizar el implante del stent7.
En la actualidad, las técnicas de modificación de la placa se clasifican en tecnologías a) basadas en balón (balones de tallado/scoring balloons, balones no distensibles y de alta presión, y litotricia intracoronaria [LIC]) y b) no basadas en balón (aterectomía rotacional [AR], aterectomía orbital y aterectomía coronaria con láser Excimer [ACLE])8,9.
El uso generalizado de estas técnicas y dispositivos se ha visto limitado por el riesgo de complicaciones, la experiencia del operador y el inevitable uso de recursos sanitarios. Durante las últimas décadas, la AR ha sido el tratamiento de elección para el manejo de lesiones calcificadas resistentes. No obstante, el desarrollo de nuevas tecnologías como la LIC o la mejora de tratamientos clásicos como la ACLE ha sembrado dudas en torno a cuál es la herramienta óptima para modificar placas calcificadas al haberse realizado comparativas no aleatorizadas entre estas técnicas.
El objetivo de este estudio aleatorizado es evaluar el perfil de seguridad y eficacia de la modificación intensiva de la placa empleando AR, LIC o ACLE antes de implantar un SFA.
MÉTODOS
Pacientes y diseño del estudio
El ROLLERCOASTR (Aterectomía rotacional, litotricia intracoronaria o láser para el tratamiento de la estenosis calcificada) es un ensayo clínico aleatorizado, prospectivo, multicéntrico e iniciado por investigadores que incluye a 6 centros de gran volumen. También incluye a varones y mujeres de ≥ 18 años con indicaciones clínicas para tratamiento con ICP (cardiopatía isquémica estable o inestable) en vasos con diámetros de referencia ≥ 2,5 y ≤ 4,0 mm y calcificaciones entre moderadas y graves según estimación por coronariografía. Los principales criterios de exclusión del estudio son el síndrome coronario agudo con elevación del segmento ST como presentación clínica, el shock cardiogénico, no tolerar cursos de tratamiento antiagregante plaquetario doble durante, como mínimo, 6 meses en pacientes que no toman tratamiento anticoagulante oral, imposibilidad de obtener el consentimiento informado del paciente o realizar un seguimiento de, como mínimo, 1 año.
Los pacientes que cumplen todos los criterios de inclusión y ninguno de los criterios de exclusión se aleatorizarán en proporción 1:1:1 a preparación de la lesión mediante AR, ACLE o LIC. La aleatorización, por su parte, se realizará en una plataforma web. Todos los criterios de inclusión y exclusión se muestran en la tabla 1 y el diagrama de flujo del estudio en la figura 1.
Tabla 1. Criterios de inclusión y exclusión del estudio
| Criterios de inclusión |
|---|
| ≥ 18 años |
| Diámetro de estenosis ≥ 70% o reserva fraccional de flujo < 0,8/índices no hiperémicos < 0,89 |
| Diámetro del vaso de referencia ≥ 2,5 y ≤ 4 mm |
| Calcificación entre moderada y grave según coronariografía |
| Pacientes con cardiopatía isquémica estable o síndrome coronario agudo sin elevación del segmento ST |
| Lesiones culpables en vasos nativos o puentes coronarios |
| Criterios de exclusión |
| Incapacidad para tolerar un curso de tratamiento antiagregante plaquetario doble de 6 meses de duración en pacientes que no toman anticoagulación oral |
| Síndrome coronario agudo con elevación del segmento ST |
| Shock cardiogénico |
| Imposibilidad de obtener el consentimiento informado del paciente o su representante legal |
| Imposibilidad de realizar, como mínimo, el seguimiento a 1 año |
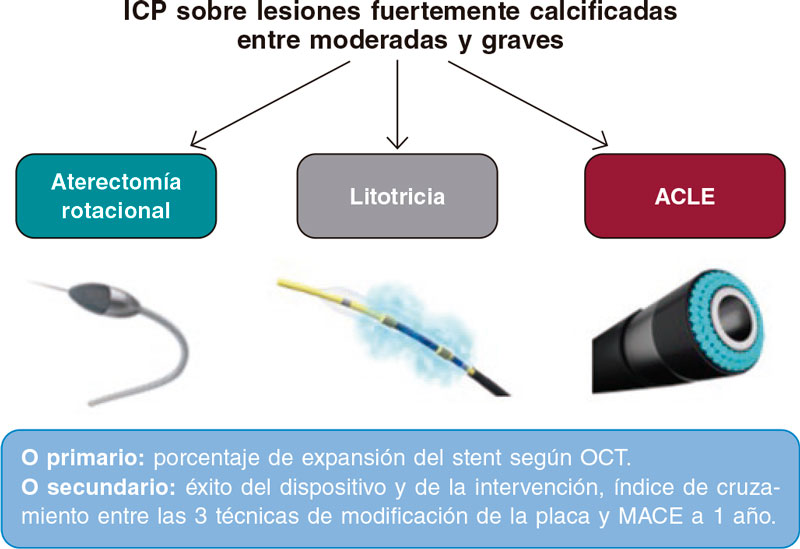
Figura 1. Diagrama de flujo del estudio. ACLE: aterectomía coronaria con láser Excimer; ICP: intervención coronaria percutánea; MACE: eventos cardiovasculares adversos mayores; O: objetivo; OCT: tomografía de coherencia óptica.
Objetivos principales y secundarios del estudio
El objetivo de este estudio es evaluar y comparar los resultados de la AR, LIC y ACLE en el manejo de lesiones coronarias calcificadas. Esta comparativa se llevará a cabo valorando los hallazgos angiográficos y de la OCT tras implementar estas técnicas de modificación de la placa e implantar y optimizar el SFA.
El objetivo principal del estudio es una comparativa AR (grupo de referencia) frente a ACLE y AR frente a LIC para determinar el porcentaje de expansión del stent calculado mediante OCT. Como objetivos secundarios, se analizará el éxito del dispositivo (implante exitoso del stent con un área mínima de este ≥ 5,5 mm2, un grado 3 de flujo TIMI final y no necesitar otra estrategia de preparación de la placa), el éxito de la intervención (éxito del dispositivo y ausencia de complicaciones graves asociadas a la intervención tales como muerte cardiovascular, infarto de miocardio del vaso diana perioperatorio, necesidad de una nueva revascularización de la lesión diana, trombosis del stent, accidente cerebrovascular o perforación del vaso con extravasación [tipos II o III]), cambio de la técnica de modificación de placa asignada a otras distinta y ocurrencia de eventos cardiovasculares adversos mayores en el seguimiento a 1 año (muerte cardiovascular, infarto de miocardio del vaso diana, revascularización de la lesión diana o trombosis del stent). También se analizará el éxito del dispositivo según el tipo de placa calcificada (concéntrica, excéntrica o nódulo de calcio). Los objetivos principales y secundarios del estudio se muestran en la tabla 2.
Tabla 2. Objetivos principales del estudio
| Objetivos principales |
|---|
| Porcentaje de expansión del stent según OCT |
| Principales objetivos secundarios |
| Éxito del dispositivo (implante exitoso del stent con un área mínima del stent ≥ 5,5 mm2, un grado 3 de flujo TIMI final y ausencia de necesidad de otra estrategia de preparación de la placa) |
| Éxito del dispositivo según el tipo de placa calcificada: concéntrica, excéntrica o nódulo de calcio |
| Éxito de la intervención (éxito del dispositivo en ausencia de complicaciones graves asociadas a la intervención) |
| Índice de cruzamiento de una técnica de modificación de la placa asignada a otra |
| Índice de MACE a 1 año (MC, IMVD, RLD o TS) |
|
IMVD: infarto de miocardio del vaso diana; MACE: eventos cardiovasculares adversos mayores; MC: muerte cardiovascular; OCT: tomografía de coherencia óptica; RLD: revascularización de la lesión diana; TS: trombosis del stent. |
Dispositivos
- – AR: Rotablator o RotaPro System (Boston Scientific, Estados Unidos).
- – Láser coronario: Dispositivo emisor de láser coronario (CVX-300 ELCA System, Spectranetics Inc., United States).
- – Litotricia intracoronaria: Shockwave System, (Shockwave Medical, Estados Unidos).
- – Máquina de OCT: OCT Imaging system (Abbott Vascular, Estados Unidos)
- – Stents: se requieren SFA de última generación (los empleados, en la actualidad, en los centros participantes durante el período de inclusión).
Intervención
La angioplastia se realizará según recomendaciones que ofrecen las actuales guías de práctica clínica sobre el tratamiento de la revascularización coronaria10. Después de franquear la lesión con la guía de angioplastia, se deberá realizar una primera OCT. Llegado el caso, se puede dilatar mediante el uso de un balón para cruzar el catéter de OCT. Después de este primer retroceso, o pullback de OCT, es necesario usar una técnica de modificación de la placa (AR, láser o litotricia) de forma aleatorizada. Después, se recomienda realizar una segunda OCT para ver los efectos conseguidos por el tratamiento. Por último, la angioplastia se completará con el implante de un SFA de última generación. La pre o posdilatación se dejará a criterio del operador. Tras implantar el stent (en ausencia de posdilatación) o tras la última posdilatación (si esta llega a realizarse), se realizará un último pullback de OCT para valorar la expansión definitiva del stent.
Técnica de aterectomía rotacional
La lesión se cruzará con el RotaWire (Boston Scientific, Estados Unidos) directamente o bien microcatéteres o balones coaxiales. El tipo de RotaWire que se utilizará (RotaWire Extra Support y RotaWire Floppy) dependerá de las características de la placa, del soporte requerido y de las preferencias del operador. Después, se empleará la técnica de aterectomía rotacional según las recomendaciones actuales11. Se recomienda una ratio 0,5:0,6 entre la fresa y el vaso. La velocidad de rotación recomendada es de 135.000 y 180.000 rpm. Se deben evitar desaceleraciones > 5.000 rpm y se recomienda avanzar la fresa, poco a poco, con suaves movimientos hacia atrás y hacia adelante. El tiempo de rotación debe ser inferior a 20 segundos con pausas entre cada ciclo. Tras realizar la rotablación, se debe retirar la fresa activando el modo dynaglide.
Técnica de litotricia intracoronaria
El Shockwave (Shockwave Medical, Inc., Estados Unidos) es un balón de angioplastia de 12 mm de longitud con diámetros que van desde los 2,5 hasta los 4 mm. Se puede montar sobre una guía de 0,014 pulgadas. La energía mecánica se transmite a la lesión cuando el balón Shockwave entra en contacto con la capa íntima de la arteria y rompe las capas de calcio superficial y profundo. En este sentido, la ratio entre el diámetro del balón Shockwave y el diámetro de referencia del vaso debe ser de 1:112. También se recomienda realizar una OCT antes de seleccionar el tamaño del balón. Se puede predilatar con balones de diámetros más pequeños para facilitar el paso del balón de litotricia.
Tras introducir el balón Shockwave en la lesión, este se infla a una presión de 4 atmósferas. Se pueden administrar hasta un máximo de 80 pulsos por balón (8 series de 10 pulsos). Después de cada serie (≤ 10 pulsos), el Shockwave se infla a 6 atmósferas y, tras desinflarlo, si se cree necesario, se puede aplicar un nuevo ciclo. Se recomiendan, como mínimo, 20 pulsos por lesión.
Técnica láser
El tamaño del catéter ACLE se seleccionará en base al diámetro del vaso diana en proporción 0,5-0,6 y en relación con su diámetro13. No obstante, se dará prioridad a catéteres de 0,9 mm por su mayor capacidad de cruce y emisión de energía láser a mayor fluencia (80 mJ/mm2) a la máxima frecuencia de repetición de pulsos (80 Hz). En cuanto a la configuración del dispositivo, se recomienda comenzar aplicando una fluencia de 60 mJ/mm2 y una frecuencia de repetición de pulsos a 60 Hz que pueden aumentarse hasta los 80 mJ/mm2 y 80 Hz a criterio del operador. Los pulsos de energía se liberan a medida que se va avanzando el catéter, lentamente, a través de la lesión a una velocidad de 0,5 mm/s, lo cual posibilita una adecuada absorción de energía y modificación de la placa. La aplicación retrógrada también es viable, sobre todo, en lesiones graves con resistencia anterógrada. Se aconseja emplear la técnica de infusión de solución salina. Tanto la sangre como el contraste yodado contienen macromoléculas celulares no acuosas, como proteínas que absorben la mayor parte de la energía liberada por el láser, que crean microburbujas que aumentan las posibilidades de disección traumática14. Por el contrario, la solución salina facilita el paso de la luz desde la punta del catéter hasta el tejido sin interferencias ni microburbujas a ese nivel. Por eso se emplea la técnica de infusión de solución salina, para controlar de forma segura la energía que se va liberando y así minimizar el riesgo de disección15. Para poder lavar la sangre de la interfaz tisular basada en el catéter, este deberá estar debidamente intubado y la solución salina convenientemente infusionada mientras se aplica el láser. La aplicación del láser a la sangre o al contraste se permite en algunos casos seleccionados de lesiones no franqueables o no dilatables dejándose a criterio del operador16. Al final de la intervención, se deben recoger parámetros tales como el número de pulsos administrados, el tiempo de tratamiento, la fluencia y la frecuencia de repetición.
Cruce entre técnicas
Se pueden combinar varias técnicas de modificación de la placa que ya han demostrado ser complementarias en algunos casostabla 3). Este cambio coincide con lo que suele hacerse en la práctica clínica habitual. Todo el material y las técnicas empleadas se registrarán para su análisis posterior.
Tabla 3. Cruzamiento de las técnicas de modificación de la placa
| Técnica inicial fallida | Razón del fallo de la técnica | Segunda técnica |
|---|---|---|
| Aterectomía rotacional | Lesión no franqueable con oliva de rotablación | ACLE |
| Lesión no dilatable (expansión subóptima del balón tras rotablación) | Litotricia | |
| Litotricia | Lesión no franqueable con el balón Shockwave (a pesar de la predilatación, llegado el caso) | Aterectomía rotacional |
| Lesión no dilatable (expansión subóptima del balón tras litotricia) | ACLE | |
| ACLE | Lesión no franqueable con ACLE | Aterectomía rotacional |
| Lesión no dilatable (expansión subóptima del balón tras ACLE) | Litotricia | |
|
ACLE: aterectomía coronaria con láser Excimer. |
||
Adquisición de imágenes por tomografía de coherencia óptica y protocolo de optimización del stent
La OCT intravascular se realiza con un sistema disponible en el mercado (los sistemas ILUMIEN OPTIS, OPTIS Integrated, OPTIS Mobile, OPTIS Integrated Next y OPTIS Mobile Next de Abbott Vascular) que incorpora un catéter de intercambio rápido (Dragonfly OPTIS, Dragonfly OpStar Imaging Catheter; Abbott Vascular) y un sistema de pullback integrado (18-36 mm/s). Permite obtener imágenes a alta resolución axial (~15 μm) con desplazamiento de sangre. Se recomienda realizar 3 pullbacks antes y después de emplear la técnica de modificación de la placa (para describir la lesión calcificada y los efectos de cada técnica sobre ella, respectivamente) y optimizar el SFA implantado. Se utilizará el corregistro automático OCT-angiografía (siempre y cuando sea posible) y las recomendaciones para el guiado de la ICP con OCT19 quedarán a criterio del operador. La expansión del stent se puede calcular de 2 formas distintas (figura 2): 1) método doble: identifica la región del stent y la parte por la mitad. Se calcula expansión luminal mínima en el área del stent (EXP) en cada mitad (área mínima del stent en cada segmento dividido por el área de referencia proximal o distal x 100). El usuario puede desplazar el punto central (tanto el área mínima del stent como el EXP se recalculan automáticamente); 2) modo cónico: se calcula el perfil luminal de referencia en base al diámetro medio de los fotogramas de referencia distal y proximal y al diámetro medio de la rama lateral entre ambos. El software muestra automáticamente el área mínima del stent identificando el fotograma con la expansión luminal mínima del área que lleva el stent (EXP). Cuando se detecta un stent, aparece automáticamente un indicador de expansión en color. Detección automática: fotograma del área mínima del stent/Detección automática del fotograma de expansión mínima (EXP).
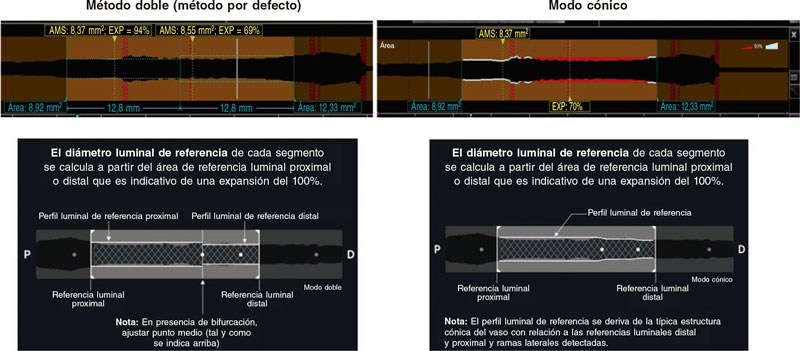
Figura 2. Cálculo de la expansión del stent según tomografía de coherencia óptica. AMS: área mínima del stent; EXP: área implantada con el stent. Modificado con permiso de Abbott Vascular del manual de usuario Ultreon 1.0 y las instrucciones de uso del software AptiVue.
Con longitudes de stent > 50 mm, se suele optar por el método doble. Con longitudes < 50 mm, suele emplearse el método cónico. Cuando se utiliza el primero, se registra el porcentaje de expansión del stent de ambos segmentos teniéndose en cuenta a efectos de estudio el más bajo de los 2.
Seguimiento y definiciones clínicas
Tanto los resultados intrahospitalarios como de seguimiento se predefinieron en la base de datos en línea y cumplieron todos y cada uno de los requisitos que marca la legislación española en materia de protección de datos, y son únicamente accesibles para los operadores participantes y coordinadores del estudio.
Tras cada ICP, se realizará una seriación mediante electrocardiografía y biomarcadores cardiacos. Las valoraciones clínicas se realizarán 1, 6 y 12 meses después de la ICP. El seguimiento angiográfico se realizará solo bajo criterios clínicos en pacientes con síntomas nuevos, empeoramiento de la función ventricular o nueva isquemia en las pruebas no invasivas.
La calcificación se define como moderada si solo se observan radiopacidades durante el ciclo cardiaco antes de la inyección de contraste y como severa en presencia de radiopacidades sin movimiento cardiaco antes de la inyección de contraste, a menudo con compromiso de los 2 lados de la luz arterial.
El éxito del dispositivo se define como el implante exitosa del stent con áreas mínimas de este ≥ 5,5 mm2 según la OCT, un grado 3 de flujo TIMI final y no necesidad de otra estrategia de preparación de la placa.
El éxito de la intervención se define como el éxito del dispositivo y la ausencia de complicaciones graves asociadas a la intervención tales como muerte cardiovascular, infarto de miocardio del vaso diana perioperatorio, necesidad de una nueva revascularización de la lesión diana, trombosis del stent, accidente cerebrovascular o perforación del vaso con extravasación (tipos II o III).
Otras complicaciones asociadas a la intervención incluyeron las arritmias ventriculares o la inestabilidad hemodinámica durante la ICP, las hemorragias mayores (con necesidad de transfusión, vasopresores, cirugía o intervención percutánea) y las disecciones limitantes del flujo.
Los eventos adversos cardiovasculares mayores incluyen muerte cardiovascular, infarto de miocardio del vaso diana, trombosis del stent o revascularización de la lesión diana. Todas las muertes se consideraron de origen cardiaco salvo que se documentaran otras causas específicas. El infarto de miocardio se definió según las recomendaciones actuales20 y solo se tuvieron en cuenta aquellos asociados a la lesión diana, perioperatorios o durante el periodo de seguimiento. La revascularización de la lesión diana o la trombosis del stent se definieron según los criterios establecidos por el Academic Research Consortium21.
La valoración del objetivo primario se realizará en un laboratorio central analizando las imágenes de OCT tras implantar el stent. Todos los datos médicos serán codificados y almacenados de forma anónima. Además, la confidencialidad se protegerá en todo momento según la legislación vigente. Tanto el comité de eventos clínicos como el laboratorio central independiente permanecerán ciegos al grupo de tratamiento.
Los objetivos secundarios se valorarán mediante angiografía y OCT en un laboratorio central y sesiones de seguimiento clínico con los pacientes in situ o por teléfono
Consideraciones estadísticas
Determinación del tamaño de la muestra
Este es un estudio de no inferioridad. Esperamos obtener resultados similares en lo que respecta a la expansión del stent con la aterectomía rotacional, el láser y la litotricia intracoronaria. El tamaño de la muestra se calculó en base al diseño del estudio y los resultados de estudios anteriores22-24. No existen criterios estándar para definir la expansión del stent en la práctica clínica habitual. En un reciente documento de consenso de expertos, expansiones del stent > 80% se consideraron apropiadas19. No obstante, la mayoría de los estudios publicados no han alcanzado este umbral. En el estudio ILUMIEN II, la expansión media del stent según la OCT fue del 72,8% con una desviación estándar de 12,6%24. Para calcular el tamaño de la muestra, asumimos errores α y β de 0,05 y 0,2, respectivamente, (potencial estadístico del 80%), un margen de irrelevancia (ε) de 7 y pérdidas del 10% por las dificultades de medición o la imposibilidad de completar la intervención. Con estos parámetros, se calculó un tamaño de la muestra de 56 casos por grupo.
Análisis estadístico
El análisis del objetivo principal del estudio se realizará por lesión e intención de tratar con una prueba t de Student unidireccional y un coeficiente alfa de 0,05 entre el grupo de referencia y los otros grupos (ACLE y LIC). Se analizará el objetivo principal por protocolo y se presentará con fines de consistencia. Si se confirma la hipótesis de no inferioridad, se realizará un análisis de superioridad bidireccional. Los resultados clínicos se analizarán por paciente.
Las variables cuantitativas que sigan una distribución normal se expresarán como mediana ± desviación estándar. Las que no, como mediana y valores mínimos y máximos. Las variables cualitativas se expresarán como valores absolutos y frecuencias.
Se considerarán estadísticamente significativos valores p < 0,05 y se calculará el intervalo de confianza del 95% de las variables del estudio. Se empleará la prueba de Kolmogorov-Smirnov para confirmar el ajuste de las variables a una distribución normal. En lo que a las comparativas de las medias hace referencia, se utilizará la prueba t de Student o la prueba U de Mann-Whitney no paramétrica (en el caso de variables dicotómicas cualitativas), y la prueba de ANOVA o la prueba de Kruskal-Wallis no paramétrica (en el caso de variables no dicotómicas cualitativas). En lo referente al análisis bivariado de las variables cualitativas, se empleará la prueba X2 o la prueba exacta de Fisher. Llegado el caso, se realizará una correlación lineal entre las diferentes variables cuantitativas con el coeficiente de correlación de Pearson o el de Spearman.
Respecto al análisis multivariado, se empleará el modelo de regresión logística de Cox con el método de selección hacia delante, dibujando curvas de supervivencia libre de eventos con el estimador de Kaplan-Meier. Las variables se considerarán potenciales predictores de riesgo en el modelo multivariado en presencia de una correlación estadísticamente significativa en el análisis univariado o una tendencia hacia la significación. Se utilizará el paquete de software estadístico SPSS (versión 20.0, SPSS Inc) para todos los cálculos.
Organización y consideraciones éticas
El protocolo de estudio ha sido aprobado por el comité de ética interno de cada centro participante. Todos los pacientes deberán dar su consentimiento informado por escrito antes de participar en el estudio, un ensayo iniciado por investigadores que sigue las pautas de buena práctica clínica que se aplican a los estudios epidemiológicos. Tanto los derechos como la integridad de los participantes quedarán garantizados, en todo momento, y la confidencialidad de los datos quedará, asimismo, salvaguardada de acuerdo con las directivas de la UE, la Declaración de Helsinki y la legislación local. El estudio ROLLERCOASTR se ha registrado en clinicaltrials.gov con el número de identificador NCT04181268. El promotor del estudio es la Fundación EPIC, un estudio que cuenta con el apoyo de subvenciones ilimitadas concedidas por dicha fundación. El comité directivo es el principal responsable de la toma de decisiones del ensayo y tiene la última palabra sobre el enfoque médico-científico de este. El comité de eventos clínicos incluye a cardiólogos intervencionistas que no participan en el ensayo que permanecerán ciegos al tratamiento aleatorizado. El comité de eventos clínicos será responsable de desarrollar criterios específicos para la adjudicación de los eventos clínicos y objetivos del estudio según protocolo. Todos los miembros del comité de eventos clínicos permanecerán ciegos a los resultados primarios del estudio.
DISCUSIÓN
Al menos la tercera parte de todas las lesiones coronarias que requieren ICP presentan una calcificación significativa9. De hecho, este es probablemente uno de los mayores desafíos a los que se enfrentan los cardiólogos intervencionistas en la actualidad. Existen diferentes herramientas para preparar placas calcificadas. Estas técnicas se emplean cada vez más en el contexto clínico habitual según la experiencia o disponibilidad del operador25 ya que apenas hay estudios comparativos al respecto.
El papel que juega la aterectomía rotacional es facilitar el implante de stents en lesiones calcificadas no dilatables. La tecnología ha avanzado durante los últimos 20 años y ya se han tratado a muchos pacientes con esta técnica. El inconveniente es que tiene una curva de aprendizaje más larga que otras técnicas de modificación de la placa y requiere una guía específica. La evidencia disponible sobre la AR en el contexto de lesiones calcificadas revela índices de éxito de la intervención más altos que los de balones convencionales o modificados con casi los mismos resultados clínicos. No obstante, incluso los estudios más recientes presentan importantes limitaciones como un uso limitado de las técnicas de imágenes intracoronarias y de los stents de última generación22,23.
La llegada del láser para el tratamiento de la ateroesclerosis se remonta a la década de 1980, cuando se empezó a utilizar para tratar la isquemia de las extremidades inferiores y luego la enfermedad coronaria26. No obstante, por aquel entonces, catéteres y técnicas eran rudimentarios y las complicaciones eran algo habitual. Los primeros ensayos clínicos aleatorizados que compararon la ACLE a la AR o a la angioplastia con balón (antes de la llegada de los stents) no arrojaron resultados favorables27. El perfeccionamiento de esta tecnología sumado a la llegada de técnicas seguras basadas en láser ha mejorado los resultados. No obstante, durante los últimos años, no se han realizado comparativas directas. Aunque, tradicionalmente, la calcificación grave ha sido un escenario desfavorable para la ACLE, esta técnica ha obtenido buenos resultados, repetidamente, en situaciones en las que el calcio es un hallazgo habitual tales como fracaso del balón (lesiones infranqueables o no dilatables), reestenosis intrastent, infraexpansión del stent u oclusiones coronarias totales crónicas13. El láser Excimer emite energía en el rango de luz UV en pulsos muy cortos (nanosegundos). Se rompen miles de millones de moléculas por pulso. La profundidad de absorción es de 50 μm, lo cual minimiza el riesgo de daño a los tejidos colaterales (comparado con los antiguos láseres infrarrojos). El láser realiza la ablación del material ateroesclerótico empleando 3 mecanismos distintos: fotoquímico (fractura de los enlaces moleculares): el pulso de luz UV golpea la placa absorbiéndose con alta eficacia portando cada fotón generado suficiente energía como para romper los enlaces moleculares; fototérmico (vaporización del tejido): los enlaces moleculares también vibran durante el proceso de absorción generando calor. El agua intracelular se vaporiza provocando la rotura de las células y creando una burbuja de vapor y fotocinético (eliminación de subproductos): la rápida expansión y colapso de la burbuja de vapor descompone, aún más, la placa y ayuda a eliminar subproductos derivados de la ablación tales como agua, gases y micropartículas. El efecto del láser se ve amplificado, especialmente, cuando actúa directamente sobre la sangre o un agente de contraste. En este sentido, a fin de minimizar el riesgo de disección coronaria, la ablación por láser suele realizarse durante la infusión continua de una solución salina13. Una ventaja del láser es su corta curva de aprendizaje. Se puede utilizar con guías convencionales de 0,014 pulgadas en intercambios rápidos con catéteres guía convencionales de 6 Fr. Además, la mayoría de estas partículas son lo bastante pequeñas como para poder ser eliminadas por el sistema reticuloendotelial, lo cual, a su vez, minimiza el riesgo de microembolización distal (una ventaja más frente a distintas técnicas de modificación de la placa)13.
La litotricia es la última tecnología disponible para el tratamiento de lesiones fuertemente calcificadas. Emite ondas mecánicas pulsátiles a través de unos emisores integrados en un balón semidistensible que se infla, inicialmente, a 4 atmósferas. Después, se aplican pulsos de energía y las vibraciones producidas interactúan con la placa ateroesclerótica descomponiendo los depósitos de calcio superficiales y profundos9. Este efecto sobre los depósitos profundos de calcio es una de las mayores ventajas de la litotricia frente a otras técnicas. Además, la curva de aprendizaje de esta técnica es corta ya que se basa en una tecnología de balón coronario bien conocida. Los estudios DISRUPT CAD12 han confirmado el perfil de seguridad y eficacia de esta técnica en el tratamiento de lesiones fuertemente calcificadas y, desde entonces, su uso ha crecido exponencialmente. La principal limitación de esta técnica es que, al ser una tecnología basada en balón con diámetros < 2,5 mm, las estenosis extremadamente estrechas podrían complicar su uso como tratamiento de primera línea, haciéndose necesaria la predilatación con balones de perfil más bajo incluso empleando, conjuntamente, AR17 o láser18 para resolver este problema.
Las técnicas de imágenes intracoronarias permiten estudios más precisos de la enfermedad coronaria que la angiografía convencional y nos brindan información esencial para poder planificar la ICP. Esto es especialmente importante durante el manejo de lesiones calcificadas y complejas ya que afecta los resultados de la angioplastia y el pronóstico del paciente28 al optimizar el implante del SFA, lo cual, a su vez, mejora la expansión de este, su aposición a la pared del vaso y, en última instancia, agranda el área luminal. La OCT tiene más resolución espacial9 que la ecografía intracoronaria y ha demostrado su utilidad al revelar los efectos de los tratamientos de modificación de la placa y optimización del stent. Todas estas razones sumadas a la falta de uso de técnicas de imágenes intracoronarias en técnicas previas de modificación de la placa nos han llevado a emplear la OCT para valorar el objetivo principal del estudio: el porcentaje de expansión del stent.
El estudio ROLLERCOASTR comparará las 3 estrategias más utilizadas en la práctica clínica habitual para el tratamiento de lesiones con calcificaciones entre moderadas y graves. Además, nos proporcionará información sobre el efecto de cada una de estas estrategias y en qué contexto específico pueden ser más útiles. A tal fin, se realizará un estudio de imágenes intracoronarias mediante OCT para conocer el sustrato específico de la calcificación, el tipo de placa sobre el que se aplicará el tratamiento y los efectos de este. La hipótesis del estudio es que las 3 técnicas se complementan entre sí provocando diferentes efectos según las características de la lesión. Al envío de este artículo, se habían incluido 135 pacientes.
CONCLUSIONES
El ROLLERCOASTR es un ensayo clínico prospectivo, multicéntrico y aleatorizado diseñado para comparar el perfil de seguridad y eficacia de 3 técnicas de modificación de la placa en un contexto de calcificación coronaria entre moderada y grave: AR, ACLE y LIC. El objetivo principal del estudio es la expansión del stent según la OCT. Los objetivos secundarios, el éxito del dispositivo y de la intervención, el índice de cruzamiento de una técnica a otra y la ocurrencia de eventos cardiovasculares adversos mayores al año de seguimiento (muerte cardiaca, infarto de miocardio del vaso diana, necesidad de una nueva revascularización de la lesión diana o trombosis del stent). También se hará una descripción de los efectos de las 3 técnicas de imagen en lesiones calcificadas mediante OCT. El periodo de inscripción de pacientes finaliza en 2023.
FINANCIACIÓN
Este estudio ha sido financiado por subvenciones ilimitadas concedidas por Fundación EPIC.
CONTRIBUCIÓN DE LOS AUTORES
A. Jurado-Román: idea, redacción original, revisión y edición del artículo. A. Gómez-Menchero, I.J. Amat-Santos, J. Caballero-Borrego, S. Ojeda y R. Ocaranza-Sánchez: redacción, revisión y edición. S. Jiménez-Valero, G. Galeote y R. Moreno: idea, redacción original, revisión y edición del artículo.
CONFLICTO DE INTERESES
S. Ojeda y R. Moreno son editores asociados de REC: Interventional Cardiology. Se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. S. Ojeda declaró haber recibido honorarios como consultor, participado en las juntas de monitorización de datos y juntas asesoras y recibido pagos y honorarios por su participación en conferencias, presentaciones, paneles de conferenciantes, redacción del manuscrito o por la realización de eventos educativos organizados por Philips, Biomenco y World Medica. R. Moreno declaró haber recibido pagos u honorarios por su participación en conferencias, presentaciones, paneles de conferenciantes, redacción del manuscrito o por la realización de eventos educativos organizados por Medtronic Inc., Boston Scientific, Abbott vascular, Biosensors, Biotronik, Edwards Lifesciences, AMGEN, Astra Zeneca, Daiichi Sankyo New Vascular Therapies y Biosensors. A. Jurado-Román declaró haber recibido pagos u honorarios por su participación en conferencias, presentaciones, paneles de conferenciantes, redacción del manuscrito o por la realización de eventos educativos organizados por Boston Scientific, Shockwave, Philips, Biotronik, Biomenco, Abbott y Medtronic. A. Gómez-Menchero, J. Caballero-Borrego, R. Ocaranza, G. Galeote y S. Jiménez-Valero no declararon ningún conflicto de intereses. I. Amat-Santos declaró haber recibido pagos u honorarios por su participación en conferencias, presentaciones, paneles de conferenciantes, redacción del manuscrito o por la realización de eventos educativos organizados por Boston Scientific.
¿QUÉ SE SABE DEL TEMA?
- La calcificación coronaria empeora el perfil de seguridad y eficacia de la intervención coronaria percutánea.
- En la actualidad, existen varias técnicas de modificación de la placa de calcio. No obstante, existen pocas evidencias aleatorizadas sobre el tratamiento de elección en este contexto.
¿QUÉ APORTA DE NUEVO?
- El ROLLERCOASTR es un estudio aleatorizado y multicéntrico que comparó 3 técnicas avanzadas de modificación de la placa en un contexto de calcificación coronaria: aterectomía rotacional, láser Excimer y litotricia.
- El objetivo principal del estudio es la expansión del stent según tomografía de coherencia óptica.
- Los objetivos secundarios son el éxito de la intervención y del dispositivo (general y según el tipo de placa calcificada), el índice de cruzamiento de una técnica a otra y la ocurrencia de eventos cardiovasculares adversos mayores al año.
BIBLIOGRAFÍA
1. Bourantas CV, Zhang YJ, Garg S, et al. Prognostic implications of coronary calcification in patients with obstructive coronary artery disease treated by percutaneous coronary intervention: a patient-level pooled analysis of 7 contemporary stent trials. Heart Br. 2014;100:1158-1164.
2. Mori S, Yasuda S, Kataoka Y, Morii I, Kawamura A, Miyazaki S. Significant association of coronary artery calcification in stent delivery route with restenosis after sirolimus-eluting stent implantation. Circ J. 2009;73:1856-1863.
3. Tzafriri AR, Garcia-Polite F, Zani B, et al. Calcified plaque modification alters local drug delivery in the treatment of peripheral atherosclerosis.
J Control Release. 2017;264:203-210.
4. Wiemer M, Butz T, Schmidt W, Schmitz KP, Horstkotte D, Langer C. Scanning electron microscopic analysis of different drug eluting stents after failed implantation: from nearly undamaged to major damaged polymers. Catheter Cardiovasc Interv. 2010;75:905-911.
5. Kobayashi Y, Okura H, Kume T, et al. Impact of target lesion coronary calcification on stent expansion. Circ J. 2014;78:2209-2214.
6. Lee MS, Shah N. The Impact and Pathophysiologic Consequences of Coronary Artery Calcium Deposition in Percutaneous Coronary Interventions. J Invasive Cardiol. 2016;28:160-167.
7. di Mario C, Koskinas KC, Räber L. Clinical Benefit of IVUS Guidance for Coronary Stenting: The ULTIMATE Step Toward Definitive Evidence? J Am Coll Cardiol. 2018;72:3138-1341.
8. Barbato E, Shlofmitz E, Milkas A, Shlofmitz R, Azzalini L, Colombo A. State of the art: evolving concepts in the treatment of heavily calcified and undilatable coronary stenoses - from debulking to plaque modification, a 40-year-long journey. EuroIntervention. 2017;13:696-705.
9. De Maria GL, Scarsini R, Banning AP. Management of Calcific Coronary Artery Lesions: Is it Time to Change Our Interventional Therapeutic Approach? JACC Cardiovasc Interv. 2019;12:1465-1478.
10. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
11. Barbato E, Carrié D, Dardas P, et al. European expert consensus on rotational atherectomy. EuroIntervention. 2015;11:30-36.
12. Kereiakes DJ, Di Mario C, Riley RF, et al. Intravascular Lithotripsy for Treatment of Calcified Coronary Lesions: Patient-Level Pooled Analysis of the Disrupt CAD Studies. JACC Cardiovasc Interv. 2021;14:1337-1348.
13. Rawlins J, Din JN, Talwar S, O’Kane P. Coronary Intervention with the Excimer Laser: Review of the Technology and Outcome Data. Interv Cardiol. 2016;11:27-32.
14. Baumbach A, Haase KK, Rose C, Oberhoff M, Hanke H, Karsch KR. Formation of pressure waves during in vitro excimer laser irradiation in whole blood and the effect of dilution with contrast media and saline. Lasers Surg Med. 1994;14:3-6.
15. Tcheng JE. Saline infusion in excimer laser coronary angioplasty. Semin Interv Cardiol SIIC. 1996;1:135-41.
16. Latib A, Takagi K, Chizzola G, et al. Excimer Laser LEsion modification to expand non-dilatable stents: the ELLEMENT registry. Cardiovasc Revasc Med. 2014;15:8-12.
17. Jurado-Román A, Gonzálvez A, Galeote G, Jiménez-Valero S, Moreno R. RotaTripsy: Combination of Rotational Atherectomy and Intravascular Lithotripsy for the Treatment of Severely Calcified Lesions. JACC Cardiovasc Interv. 2019;12:e127-129.
18. Jurado-Román A, García A, Moreno R. ELCA-Tripsy: Combination of Laser and Lithotripsy for Severely Calcified Lesions. J Invasive Cardiol. 2021;33:
E754-755.
19. Räber L, Mintz GS, Koskinas KC, et al. Clinical use of intracoronary imaging. Part 1: guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. EuroIntervention. 2018;14:656-677.
20. Thygesen K, Alpert JS, Jaffe AS, et al. Fourth Universal Definition of Myocardial Infarction (2018). J Am Coll Cardiol. 2018;72:2231-2264.
21. Cutlip DE, Windecker S, Mehran R, et al. Clinical end points in coronary stent trials: a case for standardized definitions. Circulation. 2007;115:2344-2351.
22. de Waha S, Allali A, Büttner HJ, et al. Rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions: Two-year clinical outcome of the randomized ROTAXUS trial. Catheter Cardiovasc Interv. 2016;87:691-700.
23. Abdel-Wahab M, Toelg R, Byrne RA, et al. High-Speed Rotational Atherectomy Versus Modified Balloons Prior to Drug-Eluting Stent Implantation in Severely Calcified Coronary Lesions. Circ Cardiovasc Interv. 2018;11:e007415.
24. Maehara A, Ben-Yehuda O, Ali Z, et al. Comparison of Stent Expansion Guided by Optical Coherence Tomography Versus Intravascular Ultrasound: The ILUMIEN II Study (Observational Study of Optical Coherence Tomography [OCT] in Patients Undergoing Fractional Flow Reserve [FFR] and Percutaneous Coronary Intervention). JACC Cardiovasc Interv. 2015;
8:1704-1714.
25. Romaguera R, Ojeda S, Cruz-González I, Moreno R. Spanish Cardiac Catheterization and Coronary Intervention Registry. 30th Official Report of the Interventional Cardiology Association of the Spanish Society of Cardiology (1990-2020) in the year of the COVID-19 pandemic. Rev Esp Cardiol. 2021;74:1095-1105.
26. Bittl JA, Sanborn TA, Tcheng JE, Siegel RM, Ellis SG. Clinical success, complications, and restenosis rates with excimer laser coronary angioplasty. The Percutaneous Excimer Laser Coronary Angioplasty Registry. Am J Cardiol. 1992;70:1533-1539.
27. Appelman YE, Piek JJ, Strikwerda S, et al. Randomised trial of excimer laser angioplasty versus balloon angioplasty for treatment of obstructive coronary artery disease. Lancet. 1996;347:79-84.
28. Ahn JM, Kang SJ, Yoon SH, et al. Meta-analysis of outcomes after intravascular ultrasound-guided versus angiography-guided drug-eluting stent implantation in 26,503 patients enrolled in three randomized trials and 14 observational studies. Am J Cardiol. 2014;113:1338-1347.

