Resumen
Introducción y objetivos: La insuficiencia mitral es una de las enfermedades valvulares más prevalentes en nuestro medio. La reparación mitral transcatéter con el sistema MitraClip es un procedimiento cada vez más utilizado en este contexto. Los objetivos del estudio fueron evaluar los cambios morfológicos anulares, la recurrencia de la insuficiencia mitral significativa y un objetivo combinado de reingreso por insuficiencia cardiaca y mortalidad global.
Métodos: Estudio prospectivo, observacional y unicéntrico. Se incluyeron pacientes tratados con reparación mitral transcatéter entre octubre de 2015 y octubre de 2018. Se realizó un análisis tridimensional del anillo con el software de cuantificación mitral MVQ QLAB 10.0 (Philips; Amsterdam, Países Bajos).
Resultados: Se realizaron 50 procedimientos en 48 pacientes. Tras el procedimiento se observó una disminución significativa de ambos diámetros anulares, así como del perímetro y del área, y una mayor reducción del diámetro anteroposterior en los pacientes con insuficiencia mitral funcional con respecto a aquellos con insuficiencia mitral orgánica (13,2 ± 8,8 frente a 8,6 ± 7,5; p = 0,05). El porcentaje de grasping sobre el velo posterior fue el único parámetro que se asoció estadísticamente a una menor probabilidad de desarrollar insuficiencia mitral significativa (OR = 0,89; IC95%, 0,79-0,98).
Conclusiones: Tras el implante de MitraClip se producen cambios morfológicos en el anillo mitral. La magnitud de estos cambios es diferente según la etiología de la insuficiencia mitral. El grasping del velo posterior es el principal factor asociado a dichos cambios y previene la recurrencia de la insuficiencia mitral significativa.
Palabras clave: Anillo mitral. Insuficiencia mitral grave. MitraClip. Reparación mitral transcatéter.
Abstract
Introduction and objectives: Mitral regurgitation is one society’s most prevalent valvular diseases. Transcatheter mitral valve repair with the MitraClip system has become more widely used for the management of this condition. The endpoints of the study were the changes in the mitral annular morphology, the recurrent grade III-IV mitral valve regurgitation, and a composite endpoing of heart failure readmission and all-cause mortality.
Methods: Single-centre, prospective and observational study. We included patients admitted due to transcatheter mitral valve repair between October 2015 and October 2018. The three-dimensional analysis of the mitral valve annulus was performed using the MVQ QLAB mitral valve quantification software (Philips; Amsterdam, The Netherlands).
Results: Fifty procedures were performed on 48 patients. A significant decrease of both annular diameters, perimeter and area was observed after the procedure. The antero-posterior diameter reduction was more significant in patients with functional mitral regurgitation compared to patients with organic mitral regurgitation (13.2 ± 8.8 vs 8.6 ± 7.5; P = .05). The posterior leaflet grasping was the only parameter associated with less chances of significant recurrent mitral regurgitation (OR = 0.89; 95CI%, 0.79-0.98).
Conclusions: Mitral annular morphological changes occur after MitraClip implantation. The magnitude of these changes varies depending on the etiology of mitral regurgitation. Posterior leaflet grasping is the main factor associated with these changes and prevents the recurrence of significant mitral regurgitation.
Keywords: Transcatheter mitral valve repair. MitraClip. Severe mitral regurgitation. Mitral annulus.
Abreviaturas: IM: insuficiencia mitral. RMT: reparación mitral transcatéter.
Introducción
La insuficiencia mitral (IM) es la enfermedad valvular cardiaca más prevalente en los Estados Unidos, y la segunda en Europa1,2. La reparación mitral transcatéter (RMT) tratada con el sistema MitraClip (Abbott Vascular, Menlo Park, California, Estados Unidos) imita la técnica quirúrgica de aproximación de bordes libres propuesta por Alfieri para conseguir una reducción efectiva del grado de IM3,4. Esta técnica se utiliza cada vez más, especialmente en pacientes de riesgo quirúrgico alto o prohibitivo, por ser menos invasiva y haber demostrado buenos resultados de eficacia y seguridad a medio plazo5-7.
Se cree que este procedimiento puede producir cambios en la conformación anatómica del anillo mitral que van más allá de la aproximación de los bordes libres de los velos valvulares, pero hay muy poca información disponible al respecto. Algunos estudios ponen de manifiesto un cambio significativo en cuanto al diámetro anteroposterior en la IM de etiología funcional8, mientras que otros estudios describen cambios en el diámetro y en áreas no constantes y dependientes de la etiología9.
El objetivo de nuestro estudio es analizar los cambios morfológicos que se producen en la válvula mitral tras el procedimiento de RMT, así como su relación con el grado de reducción de la IM a corto y medio plazo y su correlación con los objetivos clínicos.
Métodos
Se trata de un estudio prospectivo, observacional, realizado en el Hospital Universitario Central de Asturias de Oviedo, España.
Inclusión de pacientes
Se incluyeron pacientes desde octubre de 2015 hasta octubre de 2018. Los criterios de inclusión fueron los siguientes: pacientes con regurgitación mitral de grado III-IV sintomática pese a la optimización del tratamiento médico, considerados de alto riesgo quirúrgico por el equipo multidisciplinario y que cumpliesen adecuadamente con los criterios anatómicos que hacen factible el implante4,7. Se excluyeron aquellos pacientes con anuloplastia quirúrgica mitral previa por imposibilidad de medir los cambios anatómicos anulares. A todos los pacientes se les realizó previamente ecocardiografía transesofágica. Se categorizó la etiología de la IM en orgánica o degenerativa y funcional. Aquellos pacientes con datos de perfil etiológico mixto de la IM se reclasificaron en uno de los 2 grupos previos atendiendo a su componente predominante, mediante consenso entre 2 cardiólogos expertos a partir de las imágenes de ecocardiografía transesofágica. Todos los pacientes recibieron información oral y escrita sobre los riesgos y los beneficios del procedimiento, y firmaron un consentimiento informado que cumplía con la Declaración de Helsinki.
Descripción del procedimiento
La RMT se realizó utilizando el sistema MitraClip. Este dispositivo recibió el certificado europeo de conformidad (CE Mark) en marzo de 2008. El procedimiento de implante se ha descrito en estudios previos7. En resumen, la intervención se realiza con anestesia general, guiada por ecocardiografía transesofágica tridimensional y con el asesoramiento de un técnico especialista en MitraClip. Se implantó más de un clip en aquellos casos en que la reducción del grado de IM no había sido de al menos un grado, y siempre y cuando no existiese una estenosis mitral residual importante estimada mediante el gradiente medio diastólico transmitral10.
Estudio ecocardiográfico
A todos los pacientes se les realizó un estudio ecocardiográfico transesofágico en 2 y 3 dimensiones antes e inmediatamente después de finalizar el procedimiento, por un ecocardiografista experimentado, utilizando un equipo de ecocardiografía de última generación, modelo EPIQ 7 (Philips; Amsterdam, Países Bajos). Se tuvo en consideración que la condición hemodinámica de poscarga del paciente fuese comparable antes y después del procedimiento.
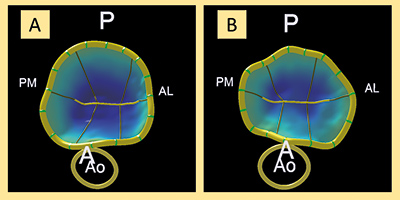
Para realizar el estudio tridimensional del anillo mitral se tomaron imágenes tridimensionales (Zoom 3D, Philips; Amsterdam, Países Bajos) durante el procedimiento, que luego se analizaron con el software de cuantificación mitral MVQ QLAB 10.0 (Philips; Amsterdam, Países Bajos). En la figura 1 puede verse un ejemplo de reconstrucción tridimensional antes y después del procedimiento.
El análisis del grasping de los velos se calculó mediante las longitudes antes y después del procedimiento de ambos velos en el mismo plano de implante del dispositivo. La longitud antes del clip se midió entre el punto de anclaje del velo al anillo y el borde libre del propio velo, y tras el clip, entre el punto de anclaje del velo al anillo y el punto del velo inmediatamente proximal a la parte de este englobada dentro del dispositivo:
– Grasping total (mm): longitud velo mitral pre − longitud velo mitral post.
– Grasping porcentual (%): ([longitud velo mitral pre − longitud velo mitral post]/longitud velo mitral pre) × 100.
Figura 1. Análisis tridimensional previo al clip (A) y tras el clip (B) del anillo mitral en visión frontal desde el ventrículo izquierdo. A: anterior; AL: anterolateral; Ao: aorta; P: posterior; PM: posteromedial.
Variables del estudio
Variables ecocardiográficas
El éxito técnico, el éxito del dispositivo y el éxito del procedimiento se definieron según el documento de consenso del Mitral Valve Academic Research Consortium11. La etiología y la gravedad de la IM se clasificaron y evaluaron de acuerdo con las guías de práctica clínica de la Sociedad Europea de Cardiología12-14, subdividiendo la gravedad en cuatro grados de forma similar a lo dispuesto en el ensayo clínico EVEREST4,7.
Variables clínicas
Se evaluó la capacidad funcional de los pacientes mediante la escala de la New York Heart Association. Se definió como ingreso por insuficiencia cardiaca cuando los pacientes ingresaban en planta por esa causa o eran atendidos en urgencias con necesidad de pernoctación. Se calcularon el EuroSCORE II y el Surgeon Thoracic Score. Se definió evento en el seguimiento como ingreso hospitalario por insuficiencia cardiaca o muerte por cualquier causa.
Objetivos del estudio
Los objetivos del estudio fueron la evaluación de los cambios morfológicos anulares, la recurrencia de la IM (al menos de grado III/IV) y un objetivo combinado de reingreso por insuficiencia cardiaca y mortalidad global.
Análisis estadístico
Las variables cualitativas se representan como número absoluto y porcentaje, y las cuantitativas como media ± desviación estándar. Se utilizó la prueba t de Student para datos apareados para evaluar los cambios morfológicos antes y después del procedimiento. Se utilizaron la prueba de χ2 y la prueba t de Student para grupos diferentes, según correspondiese, como métodos para comparar variables categóricas y cuantitativas. Se realizaron un análisis de regresión lineal para evaluar predictores de modificación cuantitativa del anillo, regresión logística binaria para el estudio de la recurrencia de la IM y un análisis de supervivencia con el método de Kaplan-Meier. Se asumió un error alfa máximo de 0,05. Todos los análisis se llevaron a cabo con el software Stata 14 (Stata Statistical Software: Release 14. College Station, Texas: StataCorp LP).
Resultados
Se realizaron 50 procedimientos de RMT, entre octubre de 2015 y octubre de 2018, en 48 pacientes: 48 implantes primarios de MitraClip y dos repeticiones de procedimiento por desprendimiento (detachment) parcial del velo posterior. La edad media fue de 74,8 ± 7,2 años y el 31,3% eran mujeres. Se realizaron 10 (20,8%) procedimientos en pacientes con IM orgánica y 38 (79,2%) en pacientes con IM funcional. Las características basales de la población según la etiología de la IM y los datos ecocardiográficos se muestran en la tabla 1 y la tabla 2. Se colocaron de media 1,5 ± 0,5 clips por procedimiento. En 43 (86%) casos se utilizó el clip de primera generación, mientras que en 7 (14%) se utilizó el clip XTr. El éxito técnico fue del 100% y el éxito del procedimiento fue del 92% (46/50). Los 4 casos no exitosos fueron por dos desprendimientos parciales, una reintervención fallida y una persistencia del grado III/IV tras el implante.
Tabla 1. Características basales de la población
| Global N = 48 (100%) |
Orgánica n = 10 (20,8%) |
Funcional n = 38 (79,2%) |
p | |
| Edad, años | 74,8 ± 7,2 | 76,6 ± 2,2 | 74,3 ± 1,2 | 0,70 |
| Mujeres | 15 (31,3) | 5 (50) | 10 (26,3) | 0,15 |
| Peso, kg | 74,8 ± 14,2 | 75,3 ± 5,2 | 74,8 ± 2,2 | 0,90 |
| Talla, cm | 164,1 ± 9,1 | 158,6 ± 2,4 | 165,6 ± 2,5 | 0,03 |
| Hipertensión | 36 (75) | 9 (90) | 27 (71,1) | 0,22 |
| Diabetes mellitus | 16 (33,3) | 5 (50) | 11 (29) | 0,21 |
| Dislipemia | 22 (45,8) | 6 (60) | 14 (36,8) | 0,24 |
| Enfermedad renal | 20 (41,6) | 3 (30) | 17 (44,7) | 0,19 |
| ACV previo | 10 (20,8) | 2 (20) | 8 (21) | 0,94 |
| Cardiopatía isquémica ICP CABG |
23 (47,9) 16 (33,3) 7 (14,6) |
4 (40) 3 (30) 1 (10) |
19 (50) 13 (24,4) 6 (15,8) |
0,48 0,34 0,36 |
| Fibrilación auricular | 30 (62,5) | 6 (60) | 24 (63,2) | 0,84 |
| Grado de IM III/IV IV/IV |
8 (16,7) 40 (83,3) |
2 (20) 8 (80) |
6 (15,8) 32 (84,2) |
0,79 0,80 |
| PSAP, mmHg | 43,5 ± 12,4 | 49,5 ± 4,4 | 41,8 ± 2,2 | 0,06 |
| EPOC | 11 (22,9) | 3 (30) | 8 (21) | 0,55 |
| Clase funcional NYHA III NYHA IV |
35 (72,9) 13 (27,1) |
7 (70) 3 (30) |
28 (73,7) 10 (26,3) |
0,83 0,79 |
| EuroSCORE II | 5,4 ± 4 | 4,7 ± 1,6 | 5,6 ± 2,2 | 0,62 |
| STS mortalidad | 5,2 ± 3,2 | 7,2 ± 5,4 | 4,7 ± 2,1 | 0,02 |
|
ACV: accidente cerebrovascular; CABG: cirugía de revascularización coronaria; EPOC: enfermedad pulmonar obstructiva crónica; ICP: intervención coronaria percutánea; IM: insuficiencia mitral; NYHA: New York Heart Association; PSAP: presión sistólica en la arteria pulmonar; STS: Society of Surgeon Thoracic score. Los datos se expresan como n (%) o media ± desviación estándar. |
||||
Tabla 2. Características ecocardiográficas
| Global | IM orgánica | IM funcional | p | |
| Fracción de eyección del ventrículo izquierdo | 41,5 ± 12,8 | 50,46 ± 4,1 | 39,15 ± 1,9 | 0,01 |
| VVITDi, ml/m2 | 85 ± 32,2 | 61,1 ± 19,9 | 91,4 ± 32 | 0,01 |
| DVITDi, mm/m2 | 60,5 ± 9,5 | 29,9 ± 4,1 | 33,9 ± 5 | 0,02 |
| ORE, cm2 | 0,38 ± 0,12 | 0,43 ± 0,12 | 0,36 ± 0,13 | 0,09 |
| Diámetro intercomisural, mm | 39,2 ± 4,7 | 37,8 ± 2,5 | 39,4 ± 5,1 | 0,17 |
| Diámetro anteroposterior, mm | 38,1 ± 5,3 | 35,8 ± 3,2 | 39,2 ± 5,6 | 0,01 |
| Perímetro bidimensional, mm | 124,6 ± 14,6 | 114,9 ± 10,4 | 126,7 ± 14,6 | 0,02 |
| Perímetro tridimensional, mm | 130,6 ± 16 | 117,7 ± 10 | 133,8 ± 15,7 | 0,01 |
| Área bidimensional, cm2 | 12,04 ± 3,1 | 10,1 ± 2,1 | 12,5 ± 3,1 | 0,02 |
| Área tridimensional, cm2 | 12,45 ± 3,2 | 10,2 ± 1,9 | 12,9 ± 3,2 | 0,01 |
| Longitud velo anterior, mm | 24,7 ± 3,2 | 25,1 ± 2,8 | 26,2 ± 3,1 | 0,11 |
| Longitud velo posterior, mm | 13,7 ± 2,4 | 12,6 ± 2,4 | 13,8 ± 2,4 | 0,12 |
| Ángulo anillo-velo anterior, grados | 27,9 ± 6,3 | 25,8 ± 2,7 | 28,5 ± 6,5 | 0,12 |
| Ángulo anillo-velo posterior, grados | 43,3 ± 10,8 | 39,7 ± 8,5 | 44,2 ± 11,2 | 0,13 |
|
DVITDi: diámetro telediastólico indexado del ventrículo izquierdo; IM: insuficiencia mitral; ORE: orificio regurgitante efectivo; VVITDi: volumen telediastólico indexado del ventrículo izquierdo. |
||||
Después del procedimiento, en el análisis tridimensional del anillo mitral, se observó una disminución significativa de ambos diámetros anulares, así como del perímetro y del área tanto bidimensional como tridimensional (tabla 3). En el análisis comparativo según la etiología (tabla 4) se halló una mayor reducción del diámetro anteroposterior en los pacientes con IM funcional que en aquellos con IM orgánica (13,2 ± 8,8 frente a 8,6 ± 7,5 de reducción porcentual, respectivamente; p = 0,05), así como una tendencia a una mayor reducción del área en el mismo sentido (13,3 ± 12,4 frente a 7,2 ± 11,1 reducción porcentual, respectivamente; p = 0,1).
Tabla 3. Cambios anulares globales
| Reducción absoluta | Reducción relativa (%) | p | |
| Diámetro intercomisural, mm | 2,4 ± 2,2 | 5,99 ± 5,6 | < 0,01 |
| Diámetro anteroposterior, mm | 4,7 ± 3,8 | 12,1 ± 8,7 | < 0,01 |
| Perímetro anular 2D, mm | 7,6 ± 7,1 | 6,1 ± 5,6 | < 0,01 |
| Perímetro anular 3D, mm | 8,5 ± 6,2 | 6,4 ± 6,1 | < 0,01 |
| Área anular 2D, cm2 | 1,43 ± 1,3 | 11,8 ± 11,4 | < 0,01 |
| Área anular 3D, cm2 | 1,52 ± 1,3 | 11,9 ± 12,2 | < 0,01 |
|
2D: 2 dimensiones; 3D: 3 dimensiones. |
|||
Tabla 4. Cambios anulares y grasping de los velos mitrales según la etiología de la insuficiencia mitral
| IM orgánica |
IM funcional |
p | |
| Reducción diámetro intercomisural, % | 6,1 ± 5,1 | 5,9 ± 6,3 | 0,48 |
| Reducción diámetro anteroposterior, % | 8,6 ± 7,5 | 13,2 ± 8,8 | 0,05 |
| Reducción perímetro anular 2D, % | 5,4 ± 6,1 | 6,2 ± 5,5 | 0,35 |
| Reducción perímetro anular 3D, % | 5,6 ± 5,5 | 6,7 ± 6,2 | 0,35 |
| Reducción área anular 2D, % | 6,8 ± 11,3 | 13,1 ± 12,4 | 0,09 |
| Reducción área anular 3D, % | 7,2 ± 11,1 | 13,3 ± 12,4 | 0,10 |
| Grasping velo anterior, mm | 9,1 ± 3,8 | 7,3 ± 3,2 | 0,07 |
| Grasping velo anterior, % | 36,6 ± 11,5 | 27,8 ± 11,4 | 0,02 |
| Grasping velo posterior, mm | 4,3 ± 1,4 | 4,8 ± 1,8 | 0,19 |
| Grasping velo posterior, % | 34 ± 8,1 | 34,4 ± 10,6 | 0,44 |
|
2D: 2 dimensiones; 3D: 3 dimensiones; IM: insuficiencia mitral. |
|||
En cuanto al grasping de ambos velos, se observó que en los pacientes con IM orgánica se consigue abordar un mayor porcentaje de tejido del velo anterior dentro del dispositivo (36,6 ± 11,5% en IM orgánica frente a 27,8 ± 11,4% en IM funcional; p = 0,02), mientras que el grasping del velo posterior es similar en ambos subtipos (34 ± 8,1% en IM orgánica frente a 34,4 ± 10,6% en IM funcional; p = 0,4).
En el análisis de regresión lineal simple de factores predictores de reducción del diámetro anteroposterior anular se observó que el porcentaje de grasping del velo posterior y el propio diámetro anteroposterior antes del implante fueron los únicos factores asociados a una mayor reducción. Tras ajustar por la etiología de la IM, los volúmenes ventriculares indexados, los diámetros anulares antes del implante y el grasping del velo anterior, esta asociación entre el grasping del velo posterior y la reducción del diámetro anular anteroposterior mantenía la significación estadística (coeficiente ß = 0,27; IC95%, 0,05-0,48; p = 0,02).
Tras un seguimiento medio de 454 días (rango intercuartílico, 195-699), 7 de los 48 pacientes (14,6%) y 8 de los 50 procedimientos (16%) presentaron IM de al menos grado III/IV. En el análisis de regresión logística binaria para predictores de IM de grado III-IV/IV en el seguimiento ecocardiográfico (tabla 5) se observó que el porcentaje de grasping sobre el velo posterior fue el único parámetro que se asoció estadísticamente a una menor probabilidad de desarrollar IM significativa (0R = 0,89; IC95%, 0,79-0,98).
Tabla 5. Regresión logística binaria. Predictores de insuficiencia mitral de grado III-IV/IV tras la reparación mitral transcatéter
| OR (IC95%) | p | |
| Fracción de eyección del ventrículo izquierdo | 1,03 (0,97-1,1) | 0,29 |
| VVITDi | 1,01 (0,98-1,03) | 0,31 |
| Reducción relativa diámetro intercomisural | 1,02 (0,9-1,16) | 0,65 |
| Reducción relativa diámetro anteroposterior | 0,95 (0,86-1,05) | 0,50 |
| Reducción perímetro anular tridimensional | 0,94 (0,8-1,1) | 0,47/td> |
| Reducción área anular tridimensional | 0,99 (0,92-1,06) | 0,41 |
| Grasping velo anterior | 0,99 (0,93-1,06) | 0,96 |
| Grasping velo posterior | 0,89 (0,79-0,98) | 0,04 |
|
IC95%: intervalo de confianza del 95%; OR: odds ratio; VVITDi: volumen telediastólico indexado del ventrículo izquierdo. |
||
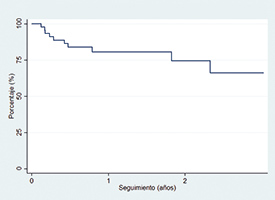
Hubo un 16% de reingresos por insuficiencia cardiaca y una mortalidad total del 12,5% (tabla 6). El objetivo combinado de muerte por cualquier causa o reingreso por insuficiencia cardiaca se dio en 10 (20,8%) pacientes. En el análisis de regresión para el evento combinado de mortalidad o reingreso por insuficiencia cardiaca no se observó asociación entre los parámetros de reducción anular o de grasping de los velos y el objetivo planteado. La curva de supervivencia libre de insuficiencia cardiaca o de mortalidad por cualquier causa se muestra en la figura 2.
| Mortalidad global | n (%) |
| Muerte de causa cardiovascular Insuficiencia cardiaca congestiva Muerte súbita Síndrome coronario agudo |
4 (8,33) 2 (4,17) 1 (2,08) 1 (2,08) |
| Muerte de causa no cardiovascular Sepsis Neoplasia |
2 (4,17) 1 (2,08) 1 (2,08) |
| Total | 6 (12,5) |
Figura 2. Supervivencia libre de muerte o de reingreso por insuficiencia cardiaca estimada por el método de Kaplan-Meier.
Discusión
El principal hallazgo de nuestro estudio es que tras la RMT con MitraClip se producen cambios anatómicos importantes en cuanto a la reducción de los diámetros anteroposterior e intercomisural, los perímetros y las áreas anulares, medidos tanto en 2 como en 3 dimensiones. Se observó que, a excepción del diámetro intercomisural, el resto de las medidas anulares (diámetro anteroposterior, perímetro y área) se encontraban aumentadas de manera significativa en los pacientes con IM funcional en comparación con aquellos con IM orgánica.
Al igual que en otros estudios publicados8,9, se ha observado una reducción importante del diámetro anteroposterior tras el implante. Sin embargo, al contrario de lo descrito por Remy et al.9, en los pacientes de nuestra serie con IM funcional se encontró una reducción relativa mayor del diámetro anteroposterior, así como una tendencia no significativa a una mayor reducción del área en estos pacientes. Además, en nuestra serie se observó una disminución del diámetro intercomisural, lo que se especula que esté en relación con una reducción acentuada y brusca del volumen de regurgitación, así como de la presión intraauricular izquierda, más que con un efecto mecánico directo del clip.
Respecto a la repercusión de estos cambios anatómicos en los resultados clínicos relevantes en el seguimiento, no se observó una relación estadísticamente significativa entre ellos y el reingreso por insuficiencia cardiaca o la mortalidad global. Sí se ponía de manifiesto una tendencia inversamente proporcional entre la reducción del diámetro anteroposterior y la posibilidad de recurrencia de la IM al menos de grado III/IV (OR = 0,95; IC95%, 0,89-1,05). Este dato se ha publicado en estudios previos en los que ha alcanzado significación estadística15. Se cree que la ausencia de significación en nuestro estudio respecto a estos objetivos, así como la no asociación entre la magnitud de los diámetros antes del implante y la recurrencia de la IM, podrían relacionarse con el número de pacientes de la cohorte global y el bajo número de eventos en el seguimiento.
Se observó un mayor grasping porcentual del velo anterior en los pacientes con IM orgánica que en aquellos con IM funcional. Este dato puede explicarse por el mayor diámetro anular anteroposterior de los pacientes con IM de etiología funcional, así como su asociación con el fenómeno de tenting o desplazamiento apical del punto de coaptación, ocasionando un ángulo de mayor magnitud entre el anillo y el velo, y por tanto más dificultades para englobar el velo anterior durante el procedimiento. Por otro lado, se observó que el grasping del velo posterior era similar en ambos grupos, lo cual es un aspecto de particular importancia porque unos mayores porcentajes de grasping se asociaron con una mayor reducción relativa del diámetro anteroposterior con un coeficiente cercano a 0,3, lo que implica que logrando un 10% más de grasping del velo posterior se consigue una reducción del 3% en el diámetro anular anteroposterior. El grasping posterior fue, además, un elemento protector respecto a la posibilidad de recurrencia de IM significativa durante el seguimiento. En este sentido, se cree que los pacientes que presenten una conformación del anillo mitral que impida una coaptación mínima entre los velos en su estado basal, o bien que ocasione una tensión excesiva en estos al realizar el grasping con riesgo de rasgado y rotura, son aquellos que más podrían beneficiarse de un sistema de anuloplastia asociado.
No se ha estudiado el papel que puede desempeñar la nueva generación de MitraClip XTr en los cambios anulares mitrales en nuestra cohorte, debido al bajo número de implantes de este último dispositivo. Sería de interés publicar en el futuro si este nuevo dispositivo produce cambios de diferente magnitud al previo, y si estos se corresponden con cambios clínicos importantes en el seguimiento.
Limitaciones
Se trata de un estudio unicéntrico y con un modesto número de pacientes (48) y procedimientos (50). El análisis de los predictores de mortalidad y de reingreso por insuficiencia cardiaca puede verse afectado por el escaso tamaño de la muestra y del número de eventos. Se trata de una técnica de introducción relativamente reciente en nuestro centro, con lo que la representación de pacientes con seguimiento a largo plazo es escasa, además de que no se ha realizado un análisis tridimensional del anillo mitral a largo plazo tras el implante.
Conclusiones
Tras el RMT con MitraClip se producen cambios morfológicos en el anillo mitral. La magnitud de estos cambios es diferente según la etiología de la IM. El grasping del velo posterior es el principal factor que influye en la aparición de los cambios, y además se asocia a una menor probabilidad de recurrencia de IM significativa durante el seguimiento.
Financiación
No se ha recibido financiación para este estudio.
Conflicto de intereses
No existen conflictos de intereses.
¿Qué se sabe del tema?
- Tras un procedimiento de RMT hay cambios morfológicos en el anillo mitral.
- Se demostraron reducciones significativas de los diámetros anteroposterior en los pacientes con IM funcional, así como una relación inversa entre la reducción del diámetro anteroposterior y la probabilidad de recurrencia de la IM significativa.
¿Qué aporta de nuevo?
- Los cambios morfológicos no se producen aisladamente en el diámetro anteroposterior mitral, sino que afectan también a otros diámetros, el área y el perímetro.
- Postulamos que la RMT con el sistema MitraClip puede inducir una reconfiguración de la estructura tridimensional de la válvula mitral, no solo por el efecto mecánico directo, sino también por las modificaciones de los volúmenes y de las presiones intracavitarios. La cuantía de dichos cambios es diferente según la etiología de la IM.
- El grasping del velo posterior demostró ser un parámetro clave en los cambios morfológicos observados, así como un factor protector de la recurrencia de la IM significativa.
Bibliografía
1. Nkomo VT, Gardin JM, Skelton TN, Gottdiener JS, Scott CG, Enriquez-Sarano M. Burden of valvular heart diseases: a population-based study. Lancet. 2006;368:1005-1011.
2. Iung B, Baron G, Butchart EG, et al. A prospective survey of patients with valvular heart disease in Europe: The Euro Heart Survey on Valvular Heart Disease. Eur Heart J. 2003;24:1231-1243.
3. Alfieri O, Maisano F, De Bonis M, et al. The double-orifice technique in mitral valve repair: a simple solution for complex problems. J Thorac Cardiovasc Surg. 2001;122:674-681.
4. Feldman T, Kar S, Rinaldi M, et al. Percutaneous mitral repair with the MitraClip system: safety and midterm durability in the initial EVEREST (Endovascular Valve Edge-to-Edge REpair Study) cohort. J Am Coll Cardiol. 2009;54:686-694.
5. Puls M, Lubos E, Boekstegers P, et al. One-year outcomes and predictors of mortality after MitraClip therapy in contemporary clinical practice: results from the German transcatheter mitral valve interventions registry. Eur Heart J. 2016;37:703–712.
6. Maisano F, Franzen O, Baldus S, et al. Percutaneous mitral valve interventions in the real world: early and 1-year results from the ACCESS-EU, a prospective, multicenter, nonrandomized post-approval study of the Mitraclip therapy in Europe. J Am Coll Cardiol. 2013;62:1052-1061.
7. Feldman T, Foste Er, Glower DD, et al. Percutaneous Repair or Surgery for Mitral Regurgitation. N Engl J Med. 2011;364:2187-2198.
8. Hidalgo F, Mesa D, Ruiz M, et al. Effects of Mitral Annulus Remodeling Following MitraClip Procedure on Reduction of Functional Mitral Regurgitation. Rev Esp Cardiol. 2016;69:1020-1025.
9. Remy T, Bertog SC, Wunderlich N, et al. Change in mitral annular size and geometry after mitraclip implantation in patients with functional and degenerative mitral regurgitation. J Interv Cardiol. 2014;27:516-524.
10. Carrasco-Chinchilla F, Arzamendi D, Romero M, et al. Experiencia inicial del tratamiento percutáneo de la regurgitación mitral con dispositivo MitraClip en España. Rev Esp Cardiol. 2018;67:1007-1012.
11. Stone GW, Adams DH, Abraham WT, et al. Clinical Trial Design Principles and Endpoint Definitions for Transcatheter Mitral Valve Repair and Replacement: Part 2: Endpoint Definitions. J Am Coll Cardiol. 2015;66:308-321.
12. Flachskampf FA, Wouters PF, Edvardsen T, et al. Recommendations for transoesophageal echocardiography: EACVI update 2014. Eur Heart J Cardiovasc Imaging. 2014;15:353-365.
13. Lancellotti P, Tribouilloy C, Hagendorff A, et al. Recommendations for the echocardiographic assessment of native valvular regurgitation: an executive summary from the European Association of Cardiovascular Imaging. Eur Heart J Cardiovasc Imaging. 2013;14:611-644.
14. Baumgartner H, Falk V, Bax JJ, et al. 2017 ESC/EACTS guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739-2791.
15. Schueler R, Momcilovic D, Weber M, et al. Acute changes of mitral valve geometry during interventional edge-to-edge repair with the MitraClip system are associated with midterm outcomes in patients with functional valve disease: preliminary results from a prospective single-center study. Circ Cardiovasc Interv. 2014;7:390-399.