RESUMEN
Introducción y objetivos: El cierre de la orejuela izquierda (COI) puede ser una alternativa de tratamiento eficaz para prevenir eventos cardiovasculares en pacientes con fibrilación auricular, en especial en aquellos con alto riesgo de sangrado. Sin embargo, algunos de estos pacientes en los que se realiza COI desarrollan trombosis relacionada con el dispositivo (TRD). Este estudio presenta las características del flujo sanguíneo que son clave en la formación de TDR, a partir de simulaciones personalizadas para cada paciente.
Métodos: Para crear las simulaciones personalizadas se incluyeron en el estudio pacientes intervenidos de COI entre 2014 y 2019 en un único centro, de quienes se disponía de imágenes de tomografía computarizada previas al procedimiento y de seguimiento, así como de control ecocardiográfico. Para el COI se utilizaron los dispositivos Amulet. Las simulaciones se analizaron de forma ciega al diagnóstico de TRD.
Resultados: En total se estudiaron 6 pacientes, de los que la mitad presentaban TRD según las imágenes del seguimiento clínico. Tras analizar los resultados de las simulaciones, los índices hemodinámicos asociados con TRD fueron la presencia de flujo estancado, las recirculaciones de sangre a velocidades bajas (< 0,20 m/s) cerca de la superficie del dispositivo y las regiones con alta complejidad de flujo y baja tensión de cizallamiento en la pared.
Conclusiones: Las simulaciones de flujo personalizadas en pacientes con COI predijeron correctamente el diagnóstico clínico de TRD en todos los casos analizados. Los resultados obtenidos demuestran el potencial de los modelos personalizados para recomendar configuraciones óptimas del dispositivo y minimizar el riesgo de TRD.
Palabras clave Trombosis relacionada con el dispositivo. Simulaciones de flujo. Cierre de la orejuela izquierda. Personalización del paciente.
ABSTRACT
Introduction and objectives: Left atrial appendage occlusion (LAAO) can be an efficient treatment to prevent strokes in patients who suffer from atrial fibrillation, especially those at risk of bleeding. A non-negligible number of patients treated with LAAO develop device-related thrombosis (DRT) after device implantation. Our study aimed to identify the key blood flow characteristics leading to DRT using patient-specific flow simulations.
Methods: Patients treated with LAAO between 2014 and 2019 at a single center with preoperative and follow-up computerized tomography images and ultrasound imaging (US) were used to create patient-specific flow simulations. Amulet LAAO devices were implanted in the study patients. Flow simulations were blindly assessed to discard the presence of DRT in the follow-up imaging.
Results: A total of 6 patients were processed in this pivotal study, half of them with DRT at the follow-up according to the imaging analysis. After a comprehensive analysis of the simulations, the most relevant in silico indices associated with DRT were the presence of stagnant blood flow, recirculation with low flow velocities (< 0.20 m/s) next to the device surface, and regions with high flow complexity combined with low wall shear stress.
Conclusions: Patient-specific flow simulations of LAAO were successfully used to predict blood flow patterns with different device configurations. The results show the potential of the present modelling and simulation approach to recommend optimal settings capable of minimizing the risk of DRT.
Keywords: Device-related thrombosis. Flow simulation. Left atrial appendage occlusion. Patient-specific.
Abreviaturas
FA: fibrilación auricular. TC: tomografía computarizada. TRD: trombosis relacionada con el dispositivo. PACE: potencial de activación de las células endoteliales. COI: cierre de la orejuela auricular izquierda.
INTRODUCTION
Son varios los estudios aleatorizados que aseguran que el cierre de la orejuela auricular izquierda (COI) es una estrategia eficiente para predecir la ocurrencia de eventos cardioembólicos en pacientes seleccionados con fibrilación auricular no valvular (FANV) como alternativa a la anticoagulación oral (ACO) de por vida1,2. No obstante, la trombosis relacionada con el dispositivo (TRD) se ha convertido en una auténtica preocupación por su tasa de incidencia (2-5%)3 y por el mayor índice de accidentes cerebrovasculares asociados descrito4. A pesar del uso de diferentes tratamientos antitrombóticos, la incidencia de la TRD no ha cambiado5. Se puede argüir que incorporando o intensificando el tratamiento anticoagulante se reduce eficazmente la carga trombótica de pacientes diagnosticados de TRD6. Sin embargo, en estos pacientes de riesgo alto, los tratamientos antitrombóticos intensivos pueden desembocar en un mayor riesgo hemorrágico. Por lo tanto, identificar los predictores de la TRD resulta clave para individualizar los tratamientos antitrombóticos más apropiados tras el COI e identificar qué pacientes son susceptibles de un seguimiento más estrecho.
Diferentes variables clínicas (tales como la edad, la FA en el momento del implante, la insuficiencia cardiaca congestiva y la escala CHA2DS2-VASc) se asocian a un mayor riesgo de TRD, principalmente, por el impacto que tienen sobre la hipercoagulabilidad7. Se han sugerido las fugas peridispositivo y la cresta venosa pulmonar no cubierta como posibles factores de la TRD, aunque los datos publicados a este respecto siguen siendo controvertidos8. Cabe destacar que son pocos los datos que hay sobre el impacto que tiene la estasis sanguínea alrededor del dispositivo, si bien las características del flujo sanguíneo influyen enormemente en la formación de trombos9-11.
Obtener datos de imágenes caracterizando el complejo comportamiento en 4D de los patrones del flujo sanguíneo en la aurícula izquierda es todo un reto. No obstante, los modelos cardiacos computacionales específicos de cada paciente, también conocidos como modelos de ‘gemelo digital’ son una tecnología valiosa en la práctica clínica para apoyar la toma de decisiones y ayudar a planificar los procedimientos intervencionistas, el diagnóstico y la optimización de los dispositivos12-14. Se han propuesto diferentes estudios para analizar los patrones del flujo sanguíneo en la AI y la OAI con modelos computacionales del flujo sanguíneo15,16. No obstante, la mayoría se han aplicado a un grupo muy limitado de datos clínicos específicos de cada paciente sin seguimiento. Además, solo algún que otro estudio ha tenido en cuenta el implante de dispositivos de COI11,17. De hecho, solo 1 de estos estudios ha analizado el impacto directo de la dinámica de fluidos en la generación de TRD con modelos computacionales11.
Este manuscrito es un estudio de prueba de concepto que describe nuestra primera experiencia con el análisis de un flujo de trabajo computacional para valorar el riesgo de TRD a través de simulaciones personalizadas del flujo tras implante de un dispositivo de COI. Nuestro objetivo fue identificar a qué pacientes habría que someter a seguimientos más estrechos tras la intervención por un mayor riesgo de TRD.
MÉTODOS
Resumen general
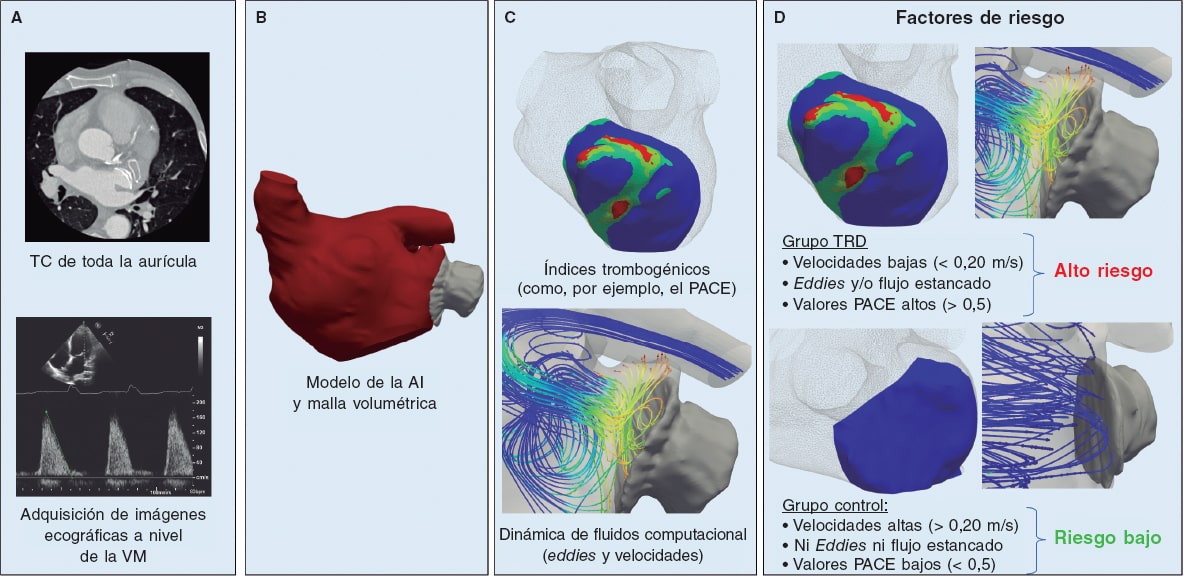
Se desarrolló una metodología computacional para construir modelos específicos de cada paciente y se diseñaron índices personalizados in silico a partir de los datos clínicos disponibles, de forma estandarizada, en pacientes implantados con un dispositivo de COI. La figura 1 muestra un esquema del flujo de trabajo metodológico propuesto. Para ponerlo a prueba, se realizó un estudio retrospectivo de un único centro que incluyó a 6 pacientes (3 con TRD y 3 sin TRD, respectivamente) derivados para recibir un dispositivo de COI, imágenes obtenidas mediante tomografía computarizadas cardiaca posimplante de toda la aurícula e imágenes ecográficas de la válvula mitral (VM). El protocolo del estudio fue aprobado por el comité de ética del Hospital de la Santa Creu i Sant Pau y todos los pacientes dieron su consentimiento informado.
Figura 1. Esquema del flujo de trabajo computacional específico de cada paciente para predecir el riesgo de trombosis relacionada con el dispositivo (TRD) tras implante de dispositivo de oclusión de la orejuela auricular izquierda (COI). A: obtención de imágenes por tomografía computarizada de toda la aurícula izquierda (AI) y mediciones mediante ecografía Doppler de la válvula mitral (VM). B: segmentación en 3D de la AI y generación del modelo en el que se realizó el análisis de volumen finito. C: velocidades del flujo sanguíneo e índices in silico como el índice de potencial de activación de las células endoteliales (PACE) calculados a partir de simulaciones de dinámica de fluidos computacionales personalizadas. D: los factores de riesgo predictores de la presencia de TRD fueron unas velocidades bajas (< 0,20 m/s), la presencia de flujo estancado próximo a la superficie del dispositivo y unos valores altos del índice PACE (indicativo de patrones complejos de flujo sanguíneo y una tensión de cizallamiento baja).
Datos clínicos
Las imágenes por TC se obtuvieron en, al menos, 2 ocasiones entre el primer y tercer mes, así como entre el tercer y sexo mes, respectivamente, tras implantar el dispositivo de COI. Se realizó una angiotomografía computarizada coronaria prospectiva con un escáner Phillips Brilliance iCT (Philips Healthcare, Países Bajo). Se empleó un protocolo de inyección de contraste bifásico: se infundieron 40 cc de material yodado (Iomeprol 350 mg/ml, Bracco, Italia) a través de un catéter cubital de 18G a una velocidad de 5 ml/s seguido de una descarga de solución salina de 40 ml.
Se empleó la técnica de bolus tracking para las imágenes de la fase arteria situándose la región de interés en la aorta ascendente con un umbral de 100 UH. Se realizó un escáner volumétrico desde el corazón hasta el diafragma (de 14 a 16 cm). La reconstrucción de la fase cardiaca se realizó al 30-40% del intervalo entre el complejo QRS. Tanto el posprocesado como la reconstrucción digital de las imágenes se realizaron con la Estación de Trabajo Brilliance para comprobar la posición del dispositivo de COI y la presencia/ubicación de la TRD (definida como una hipodensidad destacada en la TC en el extremo del dispositivo de cierre de orejuela izquierda): a) no explicada por artefactos en imágenes, b) incompatible con una curación normal, c) visible en múltiples planos TC y d) en contacto con el dispositivo. Los datos de los pacientes estuvieron protegidos por el anonimato antes de realizar el procesado computacional. Tras analizar las imágenes por TC ningún paciente presentó fugas y se siguieron tanto la metodología como la definición facilitadas por Linder et al.18.
Se realizó unaecocardiograma Doppler en 2D 7 días después de obtener las imágenes TC de seguimiento. Se registraron las velocidades de flujo transmitral observadas en el ecocardiograma mediante Doppler pulsado en proyección de 4 cámaras situándose las imágenes Doppler entre las puntas de las valvas mitrales. A 4 de los 6 pacientes se les diagnosticó FA permanente y a 2 FA paroxística. Uno de los pacientes de este último grupo estaba en ritmo sinusal cuando se obtuvieron las imágenes ecográficas. Como estos pacientes no presentaban ondas A, las curvas de velocidad se correspondían con la media obtenida de las medidas de sus ondas E en 3 o 5 latidos.
Construcción del modelo en 3D y experimentos de simulación
Se construyó un modelo geométrico personalizado de toda la aurícula izquierda para cada paciente a partir de imágenes TC obtenidas mediante segmentación semiautomática empleándose el software Slicer 4.10.1. La geometría y posición del dispositivo de COI implantado también se extrajeron de los escáneres TC realizados después de la intervención. Los trombos se segmentaron como una parte de la AI. Por lo tanto, el modelador no conocía la posible presencia de un trombo cuando recibió el modelo en 3D segmentado. Las regiones segmentadas se construyeron a partir de modelos de malla en 3D para simulaciones de dinámica de fluidos mediante técnicas computacionales.
Las curvas de velocidad en la válvula mitral se obtuvieron a partir de la ecografía Doppler que impuso unas condiciones límite específicas para cada paciente en términos de flujo de salida durante las simulaciones del flujo de la aurícula izquierda. Todas las simulaciones emplearon una onda de presión genérica procedente de un paciente con FA a nivel de las venas pulmonares. El movimiento del plano anular de la válvula mitral se definió con arreglo a la literatura médica disponible19 distribuyéndose por toda la AI mediante un abordaje de malla dinámica. Las simulaciones del flujo se realizaron con el Ansys Fluent 19 R3 solver (ANSYS Inc, Estados Unidos). Tanto para el posprocesado como para ver los resultados de las simulaciones se empleó el software ParaView 5.4.1 (Sandia National Laboratories, Kitware Inc., Los Alamos National Laboratory, Estados Unidos). En el material adicional se ofrecen más datos tanto sobre la modelización para la reconstrucción en 3D como sobre el pipeline de simulación computacional.
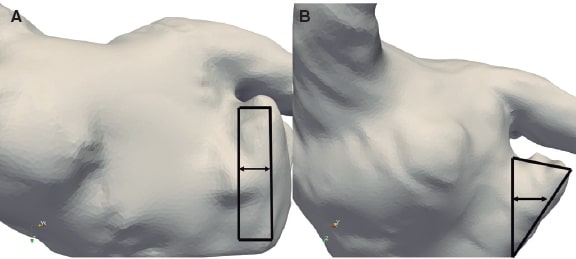
Las simulaciones específicas de cada paciente permitieron análisis locales de los siguientes índices in silico: a) la presencia de flujos en torbellino (como, por ejemplo, eddies) o estancados cerca de la superficie del dispositivo; b) la magnitud de velocidad promediada durante todo el ciclo cardiaco en el área descrita entre la cresta pulmonar y la superficie del dispositivo (ver figura 2); los valores de velocidad bajos (< 0,20 m/s) se definieron como un potente indicador de la formación de trombos20; y c) las regiones con patrones de flujo complejos y tensiones bajas de cizallamiento se caracterizaron con ayuda del índice PACE (potencial de activación de las células endoteliales)21 (PACE > 0,5).
Figura 2. Dos ejemplos: paciente nº 2 (A) y nº 6 (B): región (rectángulo y triángulo negros, respectivamente) en la que se calcularon las velocidades a partir de la simulación de flujo entre la línea perpendicular en dirección hacia la cresta pulmonar y el borde del dispositivo.
RESULTADOS
Características de los pacientes
Se seleccionó a 6 pacientes tratados de COI con el dispositivo Amulet de la base de datos general de COI según la disponibilidad de las imágenes TC completas durante el seguimiento incluida toda la anatomía auricular y un estudio ecocardiográfico con análisis del flujo mitral. Se diagnosticaron 3 casos de TRD y se incluyeron 3 controles (sin TRD) para realizar los análisis de dinámica de fluidos específicos de cada paciente.
La indicación para el cierre de la OAI vino motivada por los antecedentes de hemorragias mayores descritos en 5 pacientes y por el alto riego hemorrágico del paciente restante. Las características basales de los pacientes se muestran en la tabla 1 y tabla 2 (los grupos TRD y control, respectivamente). Se recetó tratamiento antitrombótico post-COI durante un mínimo de 3 meses (tabla 1 y tabla 2). No sobrevino ningún accidente cerebrovascular cardioembólico durante un seguimiento clínico mínimo de 12 meses.
Tabla 1. Características de los pacientes con trombos asociados al dispositivo
| Paciente nº 1 | Paciente nº 2 | Paciente nº 3 | |
|---|---|---|---|
| Edad, Años | 83 | 86 | 75 |
| Sexo | Varón | Varón | Varón |
| FEVI, % | 68% | 47% | 62% |
| Indicación para el COI | Sangrado intracraneal | Sangrado GI | Alto riesgo de sangrado |
| Creatinina, mmol/l | 121 | 122 | 71 |
| Fibrilación auricular | Permanente | Permanente | Permanente |
| Diabetes | No | No | No |
| Fumador en la actualidad | No | No | No |
| Hipertensión arterial | Sí | Sí | No |
| Antecedentes de ACV/AIT | Sí | No | No |
| Escala CHA2DS2VASc | 6 | 4 | 3 |
| Escala HAS-BLED | 4 | 1 | 4 |
| Tamaño del dispositivo, mm | 31 | 28 | 22 |
| Tiempo transcurrido tras COI, Detección de trombo en la TC, en semanas | 12 | 22 | 15 |
| Tratamiento en el momento de la detección del trombo | Clopidogrel | Sin tratamiento | Sin tratamiento |
|
AIT: accidente isquémico transitorio; COI: cierre de la orejuela auricular izquierda; escala CHA2DS2VASc (insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, accidente cerebrovascular o isquémico transitorio o tromboembolismo previo, enfermedad vascular, edad 65-74, sexo); escala HAS-BLED (hipertensión, función renal/hepática anómala, accidente cerebrovascular, antecedentes hemorrágicos o predisposición, razón internacional normalizada lábil, ancianos, consumo concomitante de drogas/alcohol); FEVI: fracción de eyección del ventrículo izquierdo; GI: gastrointestinal; TC: tomografía computarizada. |
|||
Tabla 2. Características de los pacientes sin trombosis relacionada con el dispositivo (grupo control)
| Paciente nº 4 | Paciente nº 5 | Paciente nº 6 | |
|---|---|---|---|
| Edad, Años | 66 | 64 | 65 |
| Sexo | Varón | Varón | Varón |
| FEVI, % | 77 | 29 | 29 |
| Indicación para COI | Sangrado GI | Sangrado GI | Sangrado GI |
| Creatinina, mmol/l | 75 | 170 | 147 |
| Fibrilación auricular | Permanente | Paroxística | Paroxística |
| Diabetes | No | Sí | No |
| Fumador en la actualidad | No | Sí | No |
| Hipertensión arterial | Sí | Sí | Sí |
| Antecedentes de ACV/AIT | No | No | No |
| Escala CHA2DS2VASc | 3 | 4 | 4 |
| Escala HAS-BLED | 3 | 2 | 3 |
| Tamaño del dispositivo, mm | 28 | 28 | 22 |
| Tiempo transcurrido tras COI, TC realizada en semanas | 25 | 5 | 38 |
| Tratamiento en el momento de la detección del trombo | TAPD | Acenocumarol | Ácido acetilsalicílico |
|
AIT: accidente isquémico transitorio; COI: cierre de la orejuela auricular izquierda; escala CHA2DS2VASc (insuficiencia cardiaca congestiva, hipertensión, edad ≥ 75, diabetes mellitus, accidente cerebrovascular o isquémico transitorio o tromboembolismo previo, enfermedad vascular, edad 65-74, sexo); escala HAS-BLED (hipertensión, función renal/hepática anómala, accidente cerebrovascular, antecedentes hemorrágicos o predisposición, razón internacional normalizada lábil, ancianos, consumo concomitante de drogas/alcohol); FEVI: fracción de eyección del ventrículo izquierdo; GI: gastrointestinal; TC: tomografía computarizada. |
|||
Análisis de flujos simulados para predecir el riesgo de TRD
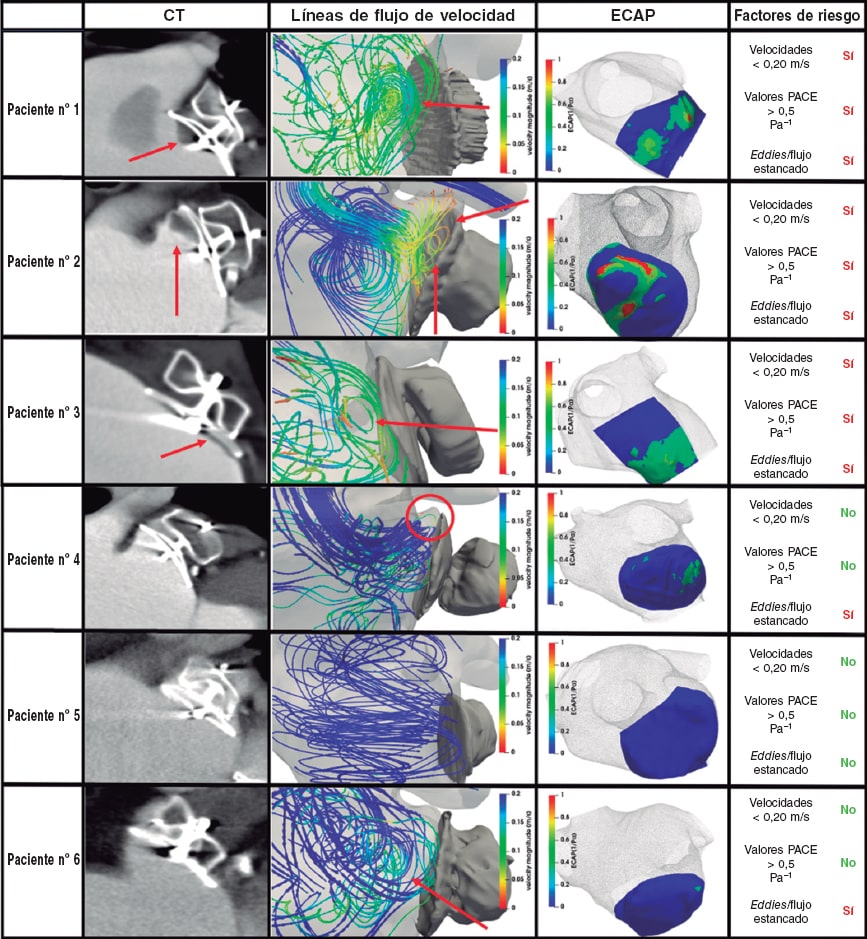
Se hallaron flujos en torbellino o eddies (figura 3, columna 2, marcadores rojos) debidos al estancamiento de la sangre y a la recirculación de esta cerca de la superficie del dispositivo de COI en todos los pacientes salvo en el nº 5. Las áreas con recirculación del flujo de las simulaciones se correspondían exactamente con la ubicación donde se hallaron los trombos en los seguimientos post-TC (figura 3, columna 1) de pacientes con TRD. Además, la magnitud de las velocidades de la sangre próximas a la superficie del dispositivo, promediadas durante todo el latido, eran distintas en el grupo TRD que en los casos control: alrededor de 0,15 m/s para el grupo TRD y > 0,20 m/s para los casos control. La tabla 3 muestra las velocidades medias de la sangre en sístole, diástole, así como durante todo el ciclo cardiaco. Por lo general, estas velocidades fueron más altas durante la diástole ventricular. Cabe destacar que, según las simulaciones, el paciente nº 5 que tenía insuficiencia mitral grave presentaba velocidades de flujo especialmente altas (2-3 m/s durante las ondas E y 0,87 m/s de media) tanto en la región del COI como en los datos Doppler. Por el contrario, el paciente nº 2 presentaba los valores medios más bajos de velocidad a razón de 0,10 m/s.
Figura 3. Resultados del análisis del modelo computacional para predecir la trombogénesis relacionada con el dispositivo (TRD). Columna TC: tomografía computarizada, las flechas rojas indican el lugar donde se hallaron los trombos durante el análisis de seguimiento. Columna con líneas de flujo de velocidad: patrones de flujo sanguíneo simulados coloreados en función de la magnitud de velocidad (azul, valores altos; rojo, valores bajos), las flechas rojas indican el flujo estancado o la recirculación. Columna con el índice PACE: mapa del índice PACE (potencial de activación de las células endoteliale) in silico próximo a la superficie del dispositivo indicativo del riesgo alto y bajo de TRD (rojo y azul, respectivamente). Columna con los factores de riesgo: lista de factores de riesgo, según la simulación, de desarrollar TRD.
Tabla 3. Velocidades del flujo sanguíneo e índice PACE próximos a la superficie del dispositivo
| Vel-sist (m/s) | Vel-diast (m/s) | Vel-todo (m/s) | Índice PACE max (Pa–1) | Índice PACE medio (Pa–1) | |
|---|---|---|---|---|---|
| Paciente nº 1 (TRD) | 0,07 ± 0,02 | 0,27 ± 0,08 | 0,16 ± 0,11* | 1,23* | 0,23 ± 0,14 |
| Paciente nº 2 (TRD) | 0,11 ± 0,03 | 0,09 ± 0,02 | 0,10 ± 0,03* | 1,50* | 0,24 ± 0,26 |
| Paciente nº 3 (TRD) | 0,10 ± 0,03 | 0,19 ± 0,07 | 0,14 ± 0,07* | 0,61* | 0,25 ± 0,11 |
| Paciente nº 4 (control) | 0,13 ± 0,03 | 0,24 ± 0,13 | 0,20 ± 0,12 | 0,45 | 0,10 ± 0,08 |
| Paciente nº 5 (control) | 0,28 ± 0,10 | 1,6 ± 0,77 | 0,87 ± 0,83 | 0,07 | 0,01 ± 0,01 |
| Paciente nº 6 (control) | 0,08 ± 0,02 | 0,37 ± 0,17 | 0,29 ± 0,19 | 0,30 | 0,03 ± 0,04 |
|
diast: diástole; max: máximo; PACE: potencial de activación de las células endoteliales; sist: sístole; todo: todo el ciclo cardiaco; vel: velocidad (media ± DE). * Valores de velocidad promediados en todo el ciclo cardiaco < 0,20 m/s y valores del índice PACE > 0,5 pues son indicadores de un riesgo alto de trombogénesis relacionada con el dispositivo. |
|||||
Se hallaron valores PACE > 0,5 Pa–1 próximos a la superficie del dispositivo en todos los pacientes con TRD (ver tabla 3 para los valores PACE más altos y medios). Los valores PACE más altos de los pacientes nº 1 y 2 (figura 3, columna 3, áreas rojas) nos permitieron localizar las áreas específicas en las que las simulaciones predijeron la formación de TRD, algo que después se comparó con los análisis de las imágenes post-TC. Por ejemplo, la locación espacial de los valores PACE más altos del paciente nº 2 (figura 3, fila 2) en la región superior del dispositivo próxima a la cresta pulmonar coincide con la localización del trombo en las imágenes de seguimiento. No obstante, el mapa PACE del paciente nº 1 sugirió un área trombogénica inferior mientras que el verdadero trombo también se formó en la región superior del dispositivo. En el paciente nº 3, los valores del índice PACE se distribuyeron más homogéneamente por toda la superficie del dispositivo, aunque los valores más altos siguieron viéndose donde se formó el trombo (esto es, 2en la región inferior del dispositivo). En lo que al grupo control se refiere, los resultados del índice PACE fueron muy bajos salvo los del paciente nº 4. En cualquier caso, el umbral de 0,5 no pudo alcanzarse y el seguimiento confirmó que este paciente no desarrolló TRD.
DISCUSIÓN
El diagnóstico precoz, e incluso predicción, de la TRD parece esencial para minimizar futuras complicaciones que puedan surgir tales como accidentes cerebrovasculares o embolismos sistémicos tras el implante de un dispositivo de COI. También ayuda a personalizar los tratamientos antirombóticos óptimos sobre los que todavía no hay consenso entre la comunidad médica. En este estudio, la suma de varios índices in silico predijo la presencia o ausencia de TRD en todos los casos simulados (3 controles y 3 pacientes con TRD diagnosticada en las imágenes TC de seguimiento). El pipeline de simulación computacional desarrollado precisó de la reconstrucción en 3D de toda la anatomía AI, que se obtuvo mediante imágenes por TC cardiaca y estudio ecográfico estándar. Esto es algo que ya se hace de manera rutinaria en candidatos a recibir un dispositivo de COI, lo cual nos permitió definir condiciones límite específicas de cada paciente tales como el perfil de velocidad del flujo mitral obtenido a partir de los datos Doppler. De media, la simulación de cada paciente se prolongó por espacio de 48 horas. Estos requisitos hacen que la herramienta propuesta sea especialmente apta para su uso clínico y los cálculos indicaron que se puede hacer un diagnóstico precoz de TRD dentro de las 72 horas siguientes al implante del dispositivo.
Este es el primer estudio en validar el índice PACE con un objetivo clínico claro y evaluar su rendimiento en pacientes tratados de COI. El índice PACE distingue entre casos TRD y no TRD atendiendo a las características de la complejidad del flujo. No obstante, no predijo, de forma solvente, la localización exacta de la formación de trombos en ninguno de los casos pues sugirió, erróneamente, la formación de un trombo inferior en el paciente nº 1 en quien, en cambio, se identificó un trombo superior a nivel clínico. Aunque se trató de una cohorte pequeña, los resultados sugirieron que cuando es necesario estudiar el riesgo trombótico post-COI, el índice PACE por sí solo no basta y debe acompañarse de otras variables.
Los resultados de velocidad obtenidos en nuestro análisis in silico coinciden con los de estudios sobre velocidades bajas con formación de trombo ya que pueden favorecer el estancamiento del flujo y, en consecuencia, desencadenar el proceso inflamatorio11,20. Los resultados de velocidad durante la sístole fueron más parecidos entre los pacientes que los obtenidos durante la diástole que variaron más. La medición de la velocidad punta se llevó a cabo próximo a la superficie del dispositivo, muy cerca de la VM. Así pues, por regla general, durante la sístole ventricular, que es cuando se cierran las válvulas, las velocidades en esta región suelen ser bajas y, por lo tanto, las diferencias son difíciles de ver. Cuando se abre la VM aumenta la velocidad. La velocidad media de todo el ciclo cardiaco (tabla 3, columna 3) reveló que los pacientes que desarrollaron TRD tenían velocidades más bajas en todos los latidos que los pacientes del grupo control. No obstante, todavía no se entiende el proceso por el cual la estasis sanguínea desencadena la cascada inflamatoria. Por ejemplo, la proximidad espacial de la orejuela auricular izquierda a la VM hace que el flujo que llega a la OAI dependa, en buena medida, de la dinámica de la VM tal y como ocurrió con el paciente nº 5. El comportamiento hemodinámico tan inusual de este paciente (como, por ejemplo, velocidades muy altas de la sangre) se debió a la insuficiencia mitral, un efecto que captaron las simulaciones gracias a las condiciones límite específicas de cada paciente según la ecografía. Cabe reseñar que estas observaciones coinciden con estudios que plantean la posibilidad de que exista un cierto grado de protección frente al estancamiento del flujo y la formación de trombos en pacientes con insuficiencia mitral gracias a un mejor lavado de sangre de la OAI22.
Las áreas de recirculación del flujo a velocidades bajas serían indicativas de posibles regiones en riesgo de formación de trombos, aunque su localización precisa depende tanto de la anatomía AI del paciente como del implante final del dispositivo de COI. Nuestras simulaciones de flujo confirmaron que la región superior del dispositivo con cresta pulmonar (CP) no cubierta es el área preferida para la ocurrencia de eddies tal y como muestra la figura 3. Este hallazgo coincide con la literatura médica en materia de crestas pulmonares no cubiertas y el mayor riesgo de TRD: el 82% de los casos de TRD con cresta venosa pulmonar superior izquierda no cubierta4,8,11. No obstante, se comprobó que la falta de cobertura de la cresta pulmonar aumenta el riesgo de TRD solo cuando las velocidades del flujo son bajas y no se puede lavar toda la cresta pulmonar como es debido. Así pues, la cobertura de la cresta pulmonar, que no suele ser posible por las restricciones anatómicas (como, por ejemplo, por la proximidad de una circunfleja a otras estructuras) es sería esencial si las velocidades del flujo no son lo bastante altas.
Limitaciones
Las principales limitaciones de nuestro estudio fueron el reducido número de pacientes para poder confirmar los factores basados en la simulaciones, los diferentes tratamientos anticoagulantes empleados en el grupo TRD, las diferencias descritas en el tiempo de adquisición de las imágenes TC durante el seguimiento entre los distintos pacientes, la falta de un protocolo unificado durante el seguimiento y las diferencias descritas entre las escalas de estratificación del riesgo de accidente cerebrovascular. La necesidad de obtener imágenes TC de toda la aurícula izquierda y los perfiles de velocidad de la VM específicos de cada paciente según la ecocardiografía, esenciales ambos para generar las simulaciones, confirmó que solo unos pocos pacientes fueron aptos para ser incluidos en este estudio. Por eso los descriptores basados en la dinámica de fluidos para la predicción de TRD deben verse como posibles nuevos biomarcadores candidatos accesibles mediante tecnología de gemelo digital. Afortunadamente, las imágenes TC se aceptan cada vez más como una tecnología clave para planificar intervenciones de COI y análisis de seguimiento23, lo cual permitirá realizar estudios más extensos en el futuro. En concreto, la necesidad del modelo computacional de disponer de imágenes TC de toda la AI durante el seguimiento no debería cambiar sustancialmente el protocolo clínico en centros con capacidad para realizar esta técnica de imagen. Además, el examen puede realizarse dentro de las 72 horas siguientes al implante del dispositivo de COI. Además, en el futuro, las mejoras constantes en la resolución espaciotemporal de los ecocardiogramas permitirán construir modelos específicos de cada paciente basados en reconstrucciones 3D de la anatomía AI a partir de estas imágenes. Por lo tanto, se podrá lograr una cohorte más extensa de casos prospectivos que permitirá validaciones y análisis más rigurosos de los factores y umbrales candidatos (tanto en las velocidades como en el índice PACE) que confirmen el rendimiento de los índices in silico propuestos para predecir el riesgo de TRD tras implante de dispositivo de COI.
No hay consenso claro sobre las condiciones límite óptimas para realizar un modelo realista de la hemodinámica de la AI. Por un lado, se empleó un perfil de velocidad como desembocadura en la válvula mitral ya que es un perfil que se puede obtener, de forma rutinaria, a partir de imágenes ecocardiográficas estándar, en candidatos a una intervención de COI. Por otro lado, se aplicaron ondas de presión genéricas de un paciente con FA de un estudio previo a las venas pulmonares como modelo de entrada a pesar de que la medición de las presiones de cada paciente requeriría un cateterismo invasivo, algo que no se suele hacer en estos pacientes. Asimismo, en nuestro estudio, el movimiento de la pared AI se extrapoló del movimiento pasivo del plano anular de la válvula mitral, impuesto por el ventrículo izquierdo que se extrajo de la literatura médica. Aunque nuestras aproximaciones a las condiciones límite específicas de cada paciente permitieron simular de forma única los efectos de la insuficiencia mitral, se puede extraer una dinámica más realista de la pared auricular izquierda a partir de las secuencias de las imágenes temporales.
Las simplificaciones están intrínsecamente asociadas al concepto de modelización aplicado a este estudio. Aun así, la integración de la información funcional y estructural específica de cada paciente en nuestro modelo y flujo de trabajo para el diseño de las simulaciones dio como resultado condiciones límite lo bastante realistas como para poder calcular, de un modo preciso, el riesgo de TRD tras implante de un dispositivo de COI.
CONCLUSIONES
En este estudio de prueba de concepto se describió el flujo de trabajo de un modelo in silico capaz de integrar datos específicos de pacientes, simulaciones hemodinámicas dentro de la AI y la predicción del riesgo de TRD tras implante de un dispositivo de COI. El modelo se empleó para realizar un estudio retrospectivo de 6 pacientes: 3 pacientes con TRD y 3 sin TRD. Las simulaciones reprodujeron la dinámica de fluidos que tiene lugar dentro de la AI y revelaron que la velocidad de recirculación del flujo sanguíneo de pacientes con TRD era baja y presentaba patrones más complejos cerca de la superficie del dispositivo. Combinando varios índices in silico representativos de factores protrombóticos que no pueden medirse in situ, a nivel clínico, se pueden detectar diferencias y diferenciar a pacientes con TRD de aquellos del grupo control. Este fue un primer estudio de prueba de concepto con índices in silico a partir de modelos personalizados capaces de identificar posibles complicaciones derivadas del implante de dispositivos de COI e individualizar tratamientos durante el seguimiento para minimizar la incidencia de resultados clínicos desfavorables. No obstante, los estudios que se realicen a partir de ahora deberían centrarse en validar el flujo de trabajo computacional desarrollado en una cohorte de casos más extensa.
FINANCIACIÓN
Este estudio está financiado por el Ministerio español de Ciencia, Innovación y Universidades bajo los programas Retos I+D (RTI2018-101193-B-I00), las Unidades de Excelencia «María de Maeztu» (MDM-2015-0502), la Formación de Doctores (PRE2018-084062) y el Reclutamiento de Talentos (RYC-2015-18888).
CONTRIBUCIÓN DE LOS AUTORES
J. Mill: idea del estudio, metodología, investigación y redacción; V. Agudelo: idea del estudio, metodología e investigación; C. H. Li: recopilación de datos; J. Noailly: análisis formal, supervisión y metodología; X. Freixa y D. Arzamendi: idea del estudio, supervisión y validación; O. Camara: supervisión, redacción, validación e idea del estudio.
CONFLICTO DE INTERESES
D. Arzamendi declaró haber recibido subvenciones personales por su labor como proctor para Abbott y Boston Scientific. X. Freixa declaró haber recibido, también, subvenciones personales por su labor como proctor para Abbott y Lifetech. Los autores restantes no han declarado ningún conflicto de intereses.
¿QUÉ SE SABE DEL TEMA?
- La TRD se ha convertido en toda una preocupación por su tasa de incidencia (del 2 al 5%), así como por la mayor incidencia de accidentes cerebrovasculares asociados. A pesar del uso de diferentes tratamientos antitrombóticos, la incidencia de la TRD sigue siendo la misma.
- Según la tríada de Virchow son 3 los factores que contribuyen a la formación de trombos: hipercoagulabilidad, lesión endotelial y estasis sanguínea.
- Factores tales como fugas peridispositivo y cresta venosa pulmonar no cubierta se han sugerido como posibles factores desencadenantes de la TRD, si bien los datos publicados a este respecto siguen siendo controvertidos.
¿QUÉ APORTA DE NUEVO?
- Los modelos de flujo específicos de cada paciente predijeron, en todos los casos estudiados, la formación o ausencia de trombos asociados al dispositivo tras un implante de dispositivo de COI.
- Los índices in silico más importantes para predecir la TRD tras el implante de un dispositivo de COI fueron la presencia de estancamiento del flujo, unos valores de velocidad bajos próximos a la superficie del dispositivo y el ratio entre la complejidad del flujo (alta) y la tensión de cizallamiento de las paredes (baja).
- Se puede valorar el riesgo de TRD y administrar tratamientos antitrombóticos de seguimiento más individualizados en pacientes tratados de COI empleando simulaciones diseñadas a partir de las TC e imágenes ecográficas posoperatorias de cada paciente.
BIBLIOGRAFÍA
1. Reddy VY, Doshi SK, Kar S, et al. 5-Year Outcomes After Left Atrial Appendage Closure:From the PREVAIL and PROTECT AF Trials. J Am Coll Cardiol. 2017;70:2964-2975.
2. Holmes DR, Kar S, Price MJ, et al. Prospective Randomized Evaluation of the Watchman Left Atrial Appendage Closure Device in Patients With Atrial Fibrillation Versus Long-Term Warfarin Therapy:The PREVAIL Trial. J Am Coll Cardiol. 2014;64:1-12.
3. Fauchier L, Cinaud A, Brigadeau F, et al. Device-Related Thrombosis After Percutaneous Left Atrial Appendage Occlusion for Atrial Fibrillation. J Am Coll Cardiol. 2018;71:1528-1536.
4. Aminian A, Schmidt B, Mazzone P, et al. Incidence, Characterization, and Clinical Impact of Device-Related Thrombus Following Left Atrial Appendage Occlusion in the Prospective Global AMPLATZER Amulet Observational Study. JACC Cardiovasc Interv. 2019;12:1003-1014.
5. Boersma L V., Ince H, Kische S, et al. Evaluating Real-World Clinical Outcomes in Atrial Fibrillation Patients Receiving the WATCHMAN Left Atrial Appendage Closure Technology:Final 2-Year Outcome Data of the EWOLUTION Trial Focusing on History of Stroke and Hemorrhage. Circ Arrhythmia Electrophysiol. 2019;12:1-13.
6. Asmarats L, Cruz-González I, Nombela-Franco L, et al. Recurrence of Device-Related Thrombus After Percutaneous Left Atrial Appendage Closure. Circulation. 2019;140:1441-1443.
7. Sedaghat A, Schrickel J-W, AndriéR, Schueler R, Nickenig G, Hammerstingl C. Thrombus Formation After Left Atrial Appendage Occlusion With the Amplatzer Amulet Device. JACC Clin Electrophysiol. 2017;3:71-75.
8. Freixa X, Cepas-Guillen P, Flores-Umanzor E, et al. Impact of Pulmonary Ridge Coverage after Left Atrial Appendage Occlusion. EuroIntervention. 2021;16:e1288-e1294.
9. Freixa X, Chan JLK, Tzikas A, Garceau P, Basmadjian A, Ibrahim R. The AmplatzerTM Cardiac Plug 2 for left atrial appendage occlusion:novel features and first-in-man experience. EuroIntervention. 2013;8:1094-1098.
10. Cochet H, Iriart X, Sridi S, et al. Left atrial appendage patency and device-related thrombus after percutaneous left atrial appendage occlusion:a computed tomography study. Eur Hear J Cardiovasc Imaging. 2018;19:1351-1361.
11. Mill J, Olivares AL, Arzamendi D, et al. Impact of flow-dynamics on device related thrombosis after left atrial appendage occlusion. Can J Cardiol. 2020;36:968.e13-968.e14.
12. Ribeiro JM, Astudillo P, de Backer O, et al. Artificial Intelligence and Transcatheter Interventions for Structural Heart Disease:A glance at the (near) future. Trends in Cardiovascular Medicine. 2021. https://doi.org/10.1016/j.tcm.2021.02.002.
13. Detmer FJ, Mut F, Slawski M, Hirsch S, Bijlenga P, Cebral JR. Incorporating variability of patient inflow conditions into statistical models for aneurysm rupture assessment. Acta Neurochir (Wien). 2020;162:553-566.
14. Jorge Corral-Acero et al. The 'Digital Twin'to enable the vision of precision cardiology. Eur Heart J. 2020;41:4556–4564.
15. Otani T, Al-Issa A, Pourmorteza A, McVeigh ER, Wada S, Ashikaga H. A Computational Framework for Personalized Blood Flow Analysis in the Human Left Atrium. Ann Biomed Eng. 2016;44:3284-3294.
16. Masci A, Alessandrini M, Forti D, et al. A Patient-Specific Computational Fluid Dynamics Model of the Left Atrium in Atrial Fibrillation:Development and Initial Evaluation. In:Pop M, Wright GA, eds. Functional Imaging and Modelling of the Heart. Cham:Springer International Publishing;2017, 392-400.
17. Aguado AM, Olivares AL, Yagüe C, et al. In silico Optimization of Left Atrial Appendage Occluder Implantation Using Interactive and Modeling Tools. Front Physiol. 2019;10:1-26.
18. Lindner S, Behnes M, Wenke A, et al. Assessment of peri-device leaks after interventional left atrial appendage closure using standardized imaging by cardiac computed tomography angiography. Int J Cardiovasc Imaging. 2019;35:725-731.
19. Veronesi F, Corsi C, Sugeng L, et al. Quantification of Mitral Apparatus Dynamics in Functional and Ischemic Mitral Regurgitation Using Real-time 3-Dimensional Echocardiography. J Am Soc Echocardiogr. 2008;21:347-354.
20. Tamura H, Watanabe T, Hirono O, et al. Low Wall Velocity of Left Atrial Appendage Measured by Trans-Thoracic Echocardiography Predicts Thrombus Formation Caused by Atrial Appendage Dysfunction. J Am Soc Echocardiogr. 2010;23:545-552.e1.
21. Di Achille P, Tellides G, Figueroa CA, Humphrey JD. A haemodynamic predictor of intraluminal thrombus formation in abdominal aortic aneurysms. Proc R Soc A. 2014. http://dx.doi.org/10.1098/rspa.2014.0163.
22. Karatasakis GT. Influence of Mitral Regurgitation on Lefi Atrial Thrombus and Spontaneous Contrast With Rheumatic Valve Disease. Am J Cardiol. 1995;76:279-281.
23. Jaguszewski M, Manes C, Puippe G, et al. Cardiac CT and echocardiographic evaluation of peri-device flow after percutaneous left atrial appendage closure using the AMPLATZER cardiac plug device. Catheter Cardiovasc Interv. 2015;85:306-312.