RESUMEN
Introducción y objetivos: El coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2) genera una enfermedad infecciosa que puede presentarse como síndrome de distrés respiratorio del adulto (SDRA). Sin un tratamiento farmacológico eficaz, el oxigenador extracorpóreo de membrana (ECMO) es fundamental cuando en los casos graves fracasa la ventilación mecánica invasiva. Presentamos una revisión sistemática de los trabajos publicados en el año 2020 para analizar la mortalidad de pacientes con SDRA por SARS-CoV-2 que precisaban ECMO.
Métodos: Se realizó una revisión sistemática en Medline combinando palabras clave sobre SARS-CoV-2 y ECMO. Se incluyeron todos los estudios publicados durante el año 2020 que registraran casos positivos de SARS-CoV-2 tratados con ECMO, ya fueran estudios observacionales o series de casos. Sin embargo, debido a la heterogeneidad en la metodología de los trabajos, no se pudo llevar a cabo un análisis estadístico adecuado, lo cual limita los hallazgos.
Resultados: La búsqueda identificó 41 publicaciones y se recogieron 2.007 casos de pacientes con infección grave por SARS-CoV-2 que precisaron soporte invasivo con ECMO. De estos, 985 (49%) mejoraron clínicamente y fueron descanulados o dados de alta del hospital, y 660 (32,8%) fallecieron a pesar del soporte invasivo. Solo 357 (17,7%) pacientes aún persistían con necesidad de asistencia ventilatoria con ECMO en el momento de la publicación de los estudios, sin que se describa la evolución clínica final.
Conclusiones: El tratamiento con ECMO podría ser útil en pacientes con SDRA por SARS-CoV-2, según las directrices de las guías clínicas y en función de la disponibilidad de los recursos económicos durante la pandemia. La realización de un ensayo clínico aleatorizado que compare el uso de ECMO con el tratamiento convencional ventilatorio invasivo arrojaría mayor evidencia, con el fin de aportar más datos sobre el tratamiento de la infección grave por SARS-CoV-2.
Palabras clave: COVID-19. ECMO. SARS-CoV-2. Oxigenador extracorpóreo de membrana. Mortalidad. SDRA.
ABSTRACT
Introduction and objectives: The severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) causes an infectious disease that can present as adult respiratory distress syndrome (ARDS). Without an effective drug therapy, extracorporeal membrane oxygenation (ECMO) is essential when invasive mechanical ventilation fails in severe cases. Our study carried out a systematic review of the studies published in 2020 to analyze the mortality of patients with ARDS due to SARS-CoV-2 who required ECMO.
Methods: A systematic review was conducted on Medline combining keywords on SARS-CoV-2 and ECMO. All studies published during 2020 with positive cases of SARS-CoV-2 treated with ECMO were included, whether observational studies or case series. However, due to the heterogeneity in the methodology of the studies, a proper statistical analysis could not be carried out, which ended up limiting our findings.
Results: Our research identified 41 publications during this period including 2007 cases of patients with severe SARS-CoV-2 infection who required invasive support with ECMO. Among these, 985 (49%) improved clinically and were decannulated or discharged from the hospital, while 660 (32.8%) died despite invasive mechanical support. Only 357 patients (17.7%) still needed ventilation support with ECMO at the time of publication of these studies without describing the final clinical outcome.
Conclusions: ECMO therapy could be useful in patients with ARDS due to SARS-CoV-2 according to the recommendations established in the clinical guidelines and based on the availability of financial resources during the pandemic. Conducting a randomized clinical trial comparing the use of ECMO with conventional invasive ventilatory therapy would provide more evidence on this regard and, consequently, more data on the management of severe SARS-CoV-2 infection.
Keywords: COVID-19. ECMO. SARS-CoV-2. Extracorporeal membrane oxygenation. Mortality. ARDS.
Abreviaturas
SARS-CoV-2: coronavirus del síndrome respiratorio agudo grave de tipo 2. COVID-19: enfermedad por coronavirus de 2019. SDRA: síndrome de distrés respiratorio agudo. ECMO: oxigenador extracorpóreo de membrana.
INTRODUCCIÓN
En 2020, la Organización Mundial de la Salud (OMS) catalogó como emergencia sanitaria pública internacional la infección por una nueva cepa de coronavirus diferente del coronavirus del síndrome respiratorio agudo grave (SARS-CoV) y del coronavirus del síndrome respiratorio de Oriente Medio (MERS-CoV), aunque comparten algunas características1. Esta nueva cepa, conocida como coronavirus del síndrome respiratorio agudo grave de tipo 2 (SARS-CoV-2), genera una enfermedad infecciosa, denominada por la OMS enfermedad por coronavirus de 2019 (COVID-19)1. El primer caso publicado tuvo su origen en la ciudad de Wuhan, China, en diciembre de 20191. Desde entonces, el aumento de las cifras de contagios y de muertes atribuibles a la COVID-19 ha ido en aumento y con unos números sin precedentes. En todo el mundo, hasta enero de 2021 se han diagnosticado 91.492.398 de casos de COVID-19; en España, hasta dicha fecha se han confirmado 2.252.164 casos de COVID-192. En todo el mundo se han constatado 1.979.507 fallecimientos por el virus. En España se han contabilizado 19.516 casos que han precisado ingreso en una unidad de cuidados intensivos y 53.314 fallecidos2.
El espectro clínico es variable, desde una infección de vías respiratorias altas hasta un cuadro grave de distrés respiratorio. Es posible que la intensidad de la respuesta clínica se relacione con la cantidad de expresión de citocinas proinflamatorias3. De hecho, los casos que ingresan en una unidad de cuidados intensivos tienen mayor expresión de citocinas, principalmente interleucinas (IL) 2, 7 y 10, factor estimulador de colonias de granulocitos (GCSF), proteína 10 inducible por interferón gamma (IP-10), proteína quimioatrayente de monocitos 1 (MCP-1), proteína inflamatoria de macrófagos (MIP) 1A y factor de necrosis tumoral alfa (TNFα)3. Este mecanismo contribuye a desencadenar un síndrome de distrés respiratorio agudo (SDRA). Los pacientes que desarrollan SDRA y sobreviven tienen una alta probabilidad de morir por fibrosis pulmonar en el futuro4. Un estudio del año 2013, mediante un análisis de autopsias de pacientes fallecidos por SDRA encontró que la prevalencia de fibrosis pulmonar con un curso clínico entre 1 y 3 semanas era del 24%, y si la duración del SDRA era de más de 3 semanas, la prevalencia ascendía al 63%5. Es más, en los supervivientes de un SDRA se puede llegar a encontrar un patrón reticular en la tomografía computarizada hasta en el 85% de los casos4. Este patrón reticular es frecuente encontrarlo en la tomografía computarizada desde la fase aguda de los pacientes con COVD-191.
Aunque el pulmón es el órgano habitualmente más afectado en los casos graves, la infección por SARS-CoV-2 puede afectar a otros órganos y degenerar en fallo multiorgánico. En esta pandemia se han utilizado varios fármacos, sin que ninguno haya mejorado la supervivencia6. El tratamiento del SDRA en los casos graves de COVID-19 se basa en ventilación mecánica invasiva, relajación muscular y pronación1. Cuando estas medidas fracasan, a falta de un tratamiento farmacológico eficaz, las guías Extracorporeal Life Support Organization sugieren el uso de un oxigenador extracorpóreo de membrana (ECMO)7.
El uso del ECMO ha resultado beneficioso en el tratamiento del SDRA originado por otras infecciones virales. Durante la pandemia de gripe A H1N1 de 2009, en Australia y Nueva Zelanda se logró una reducción de la mortalidad del 21% en los pacientes tratados con ECMO tras desarrollar un SDRA8. Asimismo, estos datos fueron similares en el Reino Unido, donde la mortalidad fue del 23% en los pacientes en tratamiento con ECMO frente al 52% en los que no se usó9. Además, la insuficiencia respiratoria refractaria debida al MERS-CoV se estudió en 2014-2015 en Arabia Saudí y se demostró una reducción de la mortalidad intrahospitalaria en el grupo que recibió tratamiento con ECMO10.
Por tanto, el objetivo principal de nuestro trabajo fue analizar, mediante una revisión sistemática, la mortalidad de los pacientes con infección grave por SARS-CoV-2 que precisaron soporte invasivo con ECMO debido al desarrollo de un SDRA refractario al tratamiento convencional.
MÉTODOS
Se llevó a cabo una revisión sistemática según los criterios establecidos por la guía Preferred Reporting Items for Systematic Reviews and Meta-Analyses (PRISMA)11. Se utilizó una combinación de palabras clave en Medline: «COVID-19», «ECMO», «SARS-CoV-2», «oxigenador extracorpóreo de membrana/membrana de oxigenación extracorpórea», «mortalidad» y «SDRA». Como criterios de inclusión se establecieron que fueran trabajos del año 2020 y que registraran la mortalidad de pacientes con SDRA e infección por SARS-CoV-2 tratados con ECMO, ya fueran estudios observacionales o series de casos. Se consideraron como criterios de exclusión que fueran publicaciones sobre ECMO y COVID-19 en las que no se añadiesen pacientes adicionales propios de su investigación, su objetivo se centrara en las complicaciones atribuidas al ECMO, demostrasen su beneficio en combinación con otros tratamientos, de autores que expusieran casos clínicos aislados y las que incluyeran niños, embarazadas y puérperas con COVID-19 que precisasen ECMO. Sin embargo, debido a la heterogeneidad en la metodología de los trabajos incluidos, no se pudo llevar a cabo un análisis estadístico adecuado. El estudio se llevó a cabo siguiendo la Declaración de Helsinki sobre los principios éticos para las investigaciones médicas con seres humanos, y fue aprobado por el Comité Ético de Investigación del Complejo Hospitalario Universitario de Canarias.
RESULTADOS
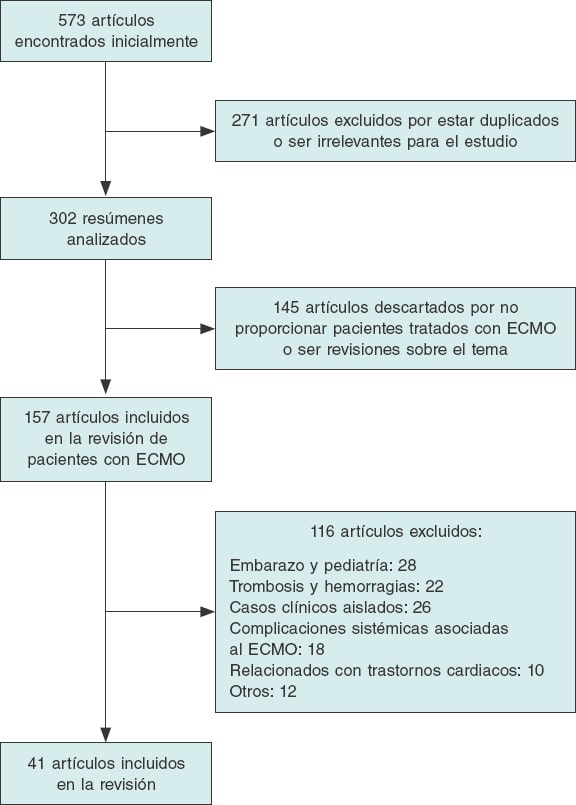
En la búsqueda con la combinación de las palabras clave se identificaron 573 publicaciones, de las que se descartaron 271 por ser duplicadas o resultar irrelevantes. Al revisar los resúmenes de los 302 artículos restantes, se excluyeron 145 por no recoger ningún caso adicional de pacientes con necesidad de soporte mecánico con ECMO o bien por ser revisiones sobre el ECMO y la COVID-19. De los 157 trabajos que describen casos con ECMO, se descartaron 116 según los criterios de exclusión. Finalmente, se analizaron 41 publicaciones (figura 1) con un total de 2.007 casos de pacientes con infección grave por SARS-CoV-2 que precisaron soporte con ECMO, con una edad media de 54 años y predominio del sexo masculino (72%) (tabla 1). Se asignó a ECMO venovenoso o venovenovenoso (ECMO-VV o ECMO-VVV) a 1.545 pacientes debido a hipoxemia refractaria (a pesar de la pronación) o SDRA, y a 84 pacientes a ECMO venoarterial o venoarteriovenoso (ECMO-VA o ECMO-VAV) por shock cardiogénico. De estos, 985 (49%) mejoraron clínicamente y fueron descanulados del ECMO o dados de alta del hospital. Por el contrario, 660 (32,8%) fallecieron a pesar del soporte mecánico invasivo con ECMO. Por último, 357 (17,7%) aún persistían con necesidad de asistencia con ECMO en el momento de la publicación del estudio, sin que se conozca el evento clínico final.
Figura 1. Diagrama de flujo de la búsqueda de artículos sobre oxigenador extracorpóreo de membrana (ECMO) y COVID-19.
Tabla 1. Registro de los estudios disponibles, número de pacientes con oxigenador extracorpóreo de membrana (ECMO) y número de pacientes dados de alta del hospital, fallecidos y que aún persistían con el ECMO al publicar el trabajo
| Estudio | Revista | Pacientes con COVID-19 | Edad media, años (rango) | Sexo masculino /femenino | Total pacientes ECMO | Pacientes con ECMO VV o VVV/VA o VAV | Pacientes descanulados o dados de alta del hospital (%) | Pacientes fallecidos (%) | Pacientes aún con ECMO (%) |
|---|---|---|---|---|---|---|---|---|---|
| Total | 6.636 | 54 (44-71) | 1.448/457 | 2007 | 1.545/84 | 985 (49%) | 660 (32,8%) | 357 (17,7%) | |
| Ahmadi ZH et al.34 | J Card Surg | 7 | 46 | 6/1 | 7 | 7/0 | 2 | 5 | 0 |
| Akhtar W et al.35 | Indian J Thorac Cardiovasc Surg | 18 | 47 | 16/2 | 18 | 15/3 | 14 | 4 | 0 |
| Alnababteh M et al.36 | Perfusion | 59 | 44 | 8/5 | 13 | 13/0 | 7 | 6 | 0 |
| Barbaro RP et al.24 | Lancet | 1.035 | 49 | 764/269 | 1.035 | 978/57 | 599 | 380 | 56 |
| Charlton M et al.37 | J Infect | 34 | 46 | 27/7 | 34 | ND | 18 | 16 | 0 |
| Cousin N et al.38 | ASAIO J | 30 | 57 | 24/6 | 30 | 30/0 | 14 | 16 | 0 |
| Falcoz PE et al.39 | Am J Respir Crit Care Med | 377 | 56 | 16/1 | 17 | 16/1 | 11 | 6 | 0 |
| Guo Z et al.40 | J Cardiothorac Vasc Anesth | 667 | 63 | 7/1 | 8 | 8/0 | 4 | 4 | 0 |
| Hu H et al.41 | Curr Med Sci | 55 | 50 | 4/5 | 9 | 9/0 | 5 | 4 | 0 |
| Huang S et al.42 | J Clin Anesth | 3 | 62 | 1/2 | 3 | 3/0 | 0 | 2 | 1 |
| Huette P et al.43 | Can J Anaesth | 12 | ND | ND | 12 | ND | 8 | 4 | 0 |
| Jacobs JP et al.44 | ASAIO J | 32 | 52 | 22/10 | 32 | 26/5b | 5 | 10 | 17 |
| Kon ZN et al.45 | Ann Thorac Surg | 1.900 | 40 | 23/4 | 27 | 27/0 | 11 | 1 | 15 |
| Le Breton C et al.46 | J Crit Care | 13 | 58 | 10/3 | 13 | 13/0 | 11 | 2 | 0 |
| Li J et al.47 | Am J Med Sci | 74 | 71 | ND | 2 | ND | 0 | 2 | 0 |
| Loforte A et al.48 | ASAIO J | 4 | 49 | 4/0 | 4 | 4/0 | 1 | 2 | 1 |
| Marullo AG et al.31 | Minerva Cardioangiol | 333 | 52 | 285/48 | 333 | 150/9b,c | 54 | 57 | 222c |
| Miike S et al.49 | J Infect Chemother | 14 | 58 | 2/1 | 3 | ND | 2 | 1 | 0 |
| Mustafa AK et al.50 | JAMA Surg | 40 | 48 | 30/10 | 40 | ND | 29 | 6 | 5 |
| Osho AA et al.51 | Ann Surg | 6 | 47 | 5/1 | 6 | 6/0 | 5 | 1 | 0 |
| Riera J et al.52 | Crit Care Explor | 19 | 50 | 16/3 | 19 | 19/0 | 13 | 4 | 2 |
| Rieg S et al.53 | PLoS One | 213 | 65 | ND | 23 | ND | 9 | 14 | 0 |
| Ruan Q et al.19 | Intensive Care Med | 150 | 67 | ND | 7 | ND | 0 | 7 | 0 |
| Santos-Martínez S et al.54 | REC Interv Cardiol | 14 | 48 | 11/3 | 14 | 12/2 | 8 | 4 | 0 |
| Schmidt M et al.30 | Lancet Respir Med | 492 | 49 | 61/22 | 83 | 81/2 | 52 | 30 | 1 |
| Schroeder I et al.55 | Anaesthesist | 70 | 66 | 5/2 | 7 | ND | 1 | 6 | 0 |
| Shen C et al.56 | JAMA | 5 | 36-65 | 1/0 | 1 | ND | 1 | 0 | 0 |
| Sromicki et al.57 | Circ J | 9 | 59 | 6/3 | 9 | 7/2 | 7 | 2 | 0 |
| Sultan I et al.32 | J Card Surg | 10 | 31-62a | 7/3 | 10 | 10/0 | 2 | 1 | 7 |
| Wu C et al.58 | JAMA Intern Med | 201 | 51 | ND | 1 | ND | 0 | 1 | 0 |
| Xu Y et al.59 | Front Med (Lausanne) | 45 | 56 | ND | 10 | ND | 6 | 2 | 2 |
| Xuan W et al.60 | J Clin Anesth | 5 | 61 | ND | 5 | 4/1b | 2 | 3 | 0 |
| Yang X et al.61 | Crit Care Med | 21 | 58 | 12/9 | 21 | ND | 9 | 12 | 0 |
| Yang X et al.62 | Lancet Respir Med | 52 | 59 | ND | 6 | ND | 0 | 5 | 1 |
| Yang Y et al.63 | Card Fail Rev | 7 | 45 | 3/4 | 7 | 6/1b | 6 | 1 | 0 |
| Yankah CA et al.64 | Thorac Cardiovasc Surg | 42 | 51 | 30/12 | 42 | 42/0 | 17 | 7 | 18 |
| Yao K et al.65 | J Infect Chemother | 101 | 60 | ND | 11 | ND | 9 | 2 | 0 |
| Zayat R et al.66 | Artif Organs | 17 | 57 | 11/6 | 17 | 16/1 | 9 | 8 | 0 |
| Zeng Y et al.67 | Critical Care | 12 | 51 | 11/1 | 12 | ND | 3 | 5 | 4 |
| Zhang G et al.13 | J Clin Virol | 221 | 55 | ND | 10 | ND | 2 | 3 | 5 |
| Zhang J et al.68 | ERJ Open Res | 43 | 46 | 20/13 | 43 | 43/0 | 29 | 14 | 0 |
| Zhou F et al.69 | Lancet | 191 | 56 | ND | 3 | ND | 0 | 3 | 0 |
|
COVID-19: enfermedad por coronavirus de 2019; ECMO: oxigenador extracorpóreo de membrana; ND: datos no disponibles; VA: venoarterial; VAV: venoarteriovenoso; VV: venovenoso; VVV: venovenovenoso. a Rango de edad del estudio. b Indicación de ECMO-VA o VAV no disponible. c Datos incompletos. |
|||||||||
DISCUSIÓN
Se presenta una revisión sistemática de las publicaciones sobre pacientes con infección grave por SAR-CoV-2 tratados con ECMO durante el año 2020, desde el inicio de la pandemia de COVID-19. Este trabajo recoge, hasta la fecha en la literatura, una de las mayores series de pacientes que precisaron ECMO debido a infección grave por SARS-CoV-2.
La principal presentación clínica de la COVID-19 es una infección leve con tos seca y fiebre como síntomas más comunes; la incidencia global del SDRA es del 3,4%12. Sin embargo, al analizar series de pacientes que desarrollan neumonía y que requieren hospitalización, la incidencia del SDRA puede llegar a alcanzar un 17-21%13,14. La respuesta inflamatoria sistémica de los pacientes con COVID-19 puede afectar en mayor o menor medida al epitelio y el endotelio respiratorios15. No obstante, el SARS-CoV-2 parece afectar menos al endotelio, generando menor exudación alveolar, lo que puede contribuir a la producción de tos seca. Por otro lado, el SDRA en los pacientes graves con COVID-19 no presenta la reducción de la distensibilidad que produciría un SDRA habitual, lo que sugiere otros mecanismos que generen una hipoxemia grave15. Esta menor agresión endotelial podría contribuir a una escasa afectación por el virus en órganos a distancia15.
El daño miocárdico está presente en el 7,2-20% de los casos15-18 y el daño renal en el 2,9-15%, según la fuente analizada15. El daño miocárdico puede asociar una mayor mortalidad hospitalaria16-18 y debería servir como alerta para descartar un shock cardiogénico por miocarditis fulminante en caso de inestabilidad hemodinámica tras una infección por SARS-CoV-219. Además de ser multifactorial, el daño miocárdico puede deberse a cardiotoxicidad directa del virus sobre los cardiomiocitos16. Esta posibilidad puede estar relacionada con la afinidad del virus por el receptor de la angiotensina II, presente en más del 7,5% de los cardiomiocitos. No debemos olvidar la respuesta inflamatoria sistémica derivada de la infección, que puede provocar directamente inflamación y supresión contráctil miocárdica16. Asimismo, la reducción de las consultas en urgencias por síndromes coronarios agudos y la menor activación del código infarto durante la pandemia han llevado a una mayor incidencia del shock cardiogénico de origen isquémico20, lo cual ha propiciado un descenso de la actividad asistencial durante la pandemia, con menor intervencionismo coronario. Esta grave complicación pudo incrementar las necesidades de asistencias ventriculares en este tipo de pacientes, en especial de ECMO, en el contexto de una escasa disponibilidad de este dispositivo al estar ocupado por pacientes con infección grave por SARS-CoV-2.
Para combatir casos graves de COVID-19, ya sea por SDRA refractario a ventilación mecánica invasiva protectora, relajación muscular y posición en prono, o por shock cardiogénico refractario a soporte inotrópico y vasopresor, se dispone del ECMO-VV y del ECMO-VA, respectivamente, según las guías de la Extracorporeal Life Support Organization7. El problema de este tratamiento es que es un recurso caro y limitado. Por tanto, durante esta crisis sanitaria debe intentar utilizarse en población joven, con alta mortalidad y poca comorbilidad7. El fallo renal no es una contraindicación absoluta. Se debe evitar su uso en pacientes con ventilación mecánica invasiva de más de 7 días, por su peores resultados7. Debido a todo esto, sería útil una valoración exhaustiva para indicar la asistencia con ECMO más adecuada en los pacientes con infección grave por SARS-CoV-221. El momento más idóneo para su uso sería cuando la ventilación mecánica invasiva protectora y la posición en prono fracasan, siempre y cuando el paciente no se encuentre en shock séptico ni en situación de fallo multiorgánico22. Una vez implantada la asistencia, se recomienda evaluar las concentraciones de IL-6 y de linfocitos en sangre, ya que, si a pesar de este tratamiento no mejoran las cifras de dichos marcadores, los pacientes presentan un peor pronóstico23.
La búsqueda realizada halló una mortalidad más alta en los pacientes que recibieron ECMO por SDRA tras una infección grave por SARS-CoV-2 que en aquellos que sufrieron la gripe A H1N1 en el Reino Unido durante la pandemia de 2009: un 32,8% frente a un 23%9, respectivamente. Estos hallazgos se acercan a los de Barbaro et al.24 en uno de los mayores registros publicados, con 1.035 pacientes, en el que se describe una mortalidad hospitalaria del 39%. Por otra parte, durante la epidemia de MERS-CoV en 2015 se evaluó la mortalidad de un grupo que recibió tratamiento con ECMO, que fue del 64%, comparada con el 100% en el grupo sin este dispositivo10. Sin embargo, debido a la ausencia de un ensayo clínico en la literatura que incluya un grupo control de tratamiento sin ECMO en el SDRA por SARS-CoV-2, no debemos afirmar aún que su uso no sea beneficioso. Además, la alta presión asistencial en los centros sanitarios al inicio de la pandemia pudo contribuir a la obtención de peores resultados, como los publicados por Ruan et al.19, en comparación con otras series que estudiaron la mortalidad con ECMO en estos pacientes cuando la presión asistencial posiblemente había descendido24.
En los primeros meses de 2020 se publicaron 2 metanálisis sobre pacientes con SDRA por SARS-CoV-2 tratados con ECMO. El primero recogió 4 estudios realizados en China y mostró un escaso beneficio de la asistencia para 17 pacientes, ya que solo 1 de ellos consiguió sobrevivir25. El otro metanálisis engloba 6 series con 17 pacientes en total, de los que fallecieron 14, con una mortalidad estimada del 82,3%26. La limitación de estos trabajos radica en el escaso número de pacientes incluidos para el análisis, y ambos recomendaban realizar más estudios.
En la literatura ya se dispone de revisiones sobre este tema. Sin embargo, una de ellas solo incluye 274 pacientes que precisaban ECMO, y no se pudo analizar adecuadamente la mortalidad ya que el 45,6% de los pacientes seguían hospitalizados en el momento de publicar los trabajos incluidos27. Otra revisión, con 479 pacientes procedentes de 25 estudios, halla una mortalidad del 19,83%, aunque los autores indican que es una estimación ya que en algunos trabajos que no se revela la mortalidad de sus sujetos28. Por último, Melhuish et al.29, tras agrupar 331 casos procedentes de 10 estudios y de 4 registros de bases de datos, estiman una mortalidad del 46%. Como limitación común de estos trabajos cabe mencionar que ninguno incluye el registro de Barbaro et al.24, el más grande publicado. Nuestra revisión amplía y da mayor robustez a estos hallazgos al incluir las 3 series más grandes publicadas, que aportan 83, 333 y 1.035 pacientes24,30,31. Aunque hemos encontrado una mayor mortalidad que en la pandemia de gripe A H1N1 de 20098,9, la asistencia con ECMO en estos pacientes podría ser asumible en caso de no tener otra opción terapéutica. Sin embargo, hay que individualizar cada caso; los pacientes mayores de 60 años y con comorbilidad, como enfermedad cardiovascular y diabetes, tienen mayor riesgo de muerte17,28,31.
Debido a la complejidad del soporte con ECMO, además de la necesidad de una curva de aprendizaje y una experiencia clínica adecuadas, los resultados de este tratamiento pueden estar sesgados. De 2003 a 2019 se cuadruplicó el número de centros en el mundo que usan este dispositivo y se multiplicó por 6 la cantidad de implantes realizados32. Tanto es así que durante una inesperada pandemia, cuando los recursos se tienen que reestructurar de forma inmediata, los resultados obtenidos en los trabajos de los primeros meses de 2020 deben tomarse con cautela. Por ejemplo, durante la pandemia de 2009 se usó mucho más el ECMO, lo que pudo suponer una mayor probabilidad de recuperación de casos en comparación con la limitación de recursos actual para el implante de dicho dispositivo, lo cual puede alterar los resultados en cuanto a mortalidad1.
Finalmente, hay que añadir que, a pesar de que los pacientes sobrevivan con el soporte invasivo que proporciona el ECMO, las probabilidades de que presenten fibrosis pulmonar en el futuro no son desdeñables, con el consiguiente aumento de la mortalidad5. Se necesitan más estudios para identificar a los pacientes con mayor probabilidad de presentar esta complicación; además, el tratamiento antifibrótico podría tener utilidad en la infección por SARS-CoV-2 que genera fibrosis parenquimatosa pulmonar5.
Limitaciones
Como limitaciones de nuestro trabajo, en primer lugar destacamos que se han excluido los registros multicéntricos no publicados en revistas científicas33. Además, hemos excluido pacientes con ECMO de trabajos que se centraban en estudiar complicaciones asociadas a este y casos clínicos aislados. No se han podido analizar conjuntamente las características de los pacientes de cada estudio ni comparar sus metodologías, por ser diferentes.
CONCLUSIONES
Creemos que el soporte invasivo con ECMO podría ser útil en determinados pacientes, según las directrices de las guías clínicas y en función de la disponibilidad de los recursos, a pesar de los resultados dispares obtenidos. La realización de un ensayo clínico aleatorizado que compare el uso del ECMO con la ventilación mecánica invasiva convencional arrojaría mayor evidencia.
FINANCIACIÓN
Este estudio no ha recibido financiación.
CONTRIBUCIÓN DE LOS AUTORES
N. Báez-Ferrer: búsqueda de fuentes bibliográficas, análisis de datos y redacción del manuscrito. A. Bompart-Cairós y D. López-Rial: búsqueda de fuentes bibliográficas. P. Abreu-González y D. Hernández-Vaquero: revisión y redacción del texto. A. Domínguez-Rodríguez: revisión final del manuscrito.
CONFLICTO DE INTERESES
Los autores declaran la ausencia de conflictos de intereses.
¿QUÉ SE SABE DEL TEMA?
- La infección por SARS-CoV-2 se puede presentar clínicamente como SDRA.
- Múltiples líneas farmacológicas han fracasado para esta enfermedad. Cobra importancia el uso del ECMO en los pacientes refractarios a ventilación mecánica, relajación muscular y pronación.
- Desde el inicio de la pandemia de COVID-19, durante el año 2020 se han publicado artículos sobre pacientes coninfección grave por SARS-CoV-2 que se manifestó como SDRA en los que se evaluó la mortalidad del tratamiento con ECMO. Sin embargo, hasta la fecha no hay ningún ensayo clínico aleatorizado que evalúe el beneficio clínico del ECMO en estos pacientes.
¿QUÉ APORTA DE NUEVO?
- Se presentan los resultados de una revisión sistemática de los trabajos publicados en el año 2020, durante la pande- mia de COVID-19, para analizar la mortalidad de los pa- cientes con SDRA por SARS-CoV-2 que precisaron ECMO.
- Se identificaron 41 publicaciones del año 2020 y se recogieron 2.007 casos de pacientes con infección grave por SARS-CoV-2 que precisaron soporte invasivo con ECMO.
- De todos los casos recogidos, se halló una mortalidad con ECMO en pacientes con infección grave por SARS-CoV-2 del 32,8%; 660 fallecieron a pesar del soporte mecánico invasivo.
- El tratamiento con ECMO podría ser útil en los pacientes con SDRA por SARS-CoV-2. No obstante, sería de interés realizar un ensayo clínico aleatorizado para comparar el uso del ECMO con el tratamiento convencional ventilatorio invasivo en esta pandemia.
BIBLIOGRAFÍA
1. Tang D, Comish P, Kang R. The hallmarks of COVID-19 disease. PLoS Pathog. 2020;16:1-24.
2. Actualización n.º291. Enfermedad por el coronavirus (COVID-19). 15.01.2021. Disponible en https://www.mscbs.gob.es/profesionales/saludPublica/ccayes/alertasActual/nCov/documentos/Actualizacion_291_COVID-19.pdf. Consultado 18 Ene 2021.
3. Rothan HA, Byrareddy SN. The epidemiology and pathogenesis of coronavirus disease (COVID-19) outbreak. J Autoimmun. 2020;109:18-21.
4. Yan-Rong G, Qing-Dong C. The origin, transmission and clinical therapies on coronavirus disease 2019 (COVID-19) outbreak –an update on the status. Mil Med Res. 2020;7:11.
5. George PM, Wells AU, Jenkins RG. Pulmonary fibrosis and COVID-19:the potential role for antifibrotic therapy. Lancet Respir Med. 2020;8:807-815.
6. Thille AW, Esteban A, Fernández-Segoviano P, et al. Chronology of histological lesions in acute respiratory distress syndrome with diff use alveolar damage:A prospective cohort study of clinical autopsies. Lancet Respir Med. 2013;1:395-401.
7. Bartlett RH, Ogino MT, Brodie D, et al. Initial ELSO Guidance Document:ECMO for COVID-19 Patients with Severe Cardiopulmonary Failure. ASAIO J. Published online 2020;472-474.
8. Australia and New Zealand Extracorporeal Membrane Oxygenation (ANZ ECMO) Influenza Investigators, Davies A, Jones D, Bailey M, et al. Extracorporeal Membrane Oxygenation for 2009 Influenza A(H1N1) Acute Respiratory Distress Syndrome. J Am Med Assoc. 2009;302:1888-1895.
9. Noah MA, Peek GJ, Finney SJ, et al. Referral to an extracorporeal membrane oxygenation center and mortality among patients with severe 2009 influenza A(H1N1). J Am Med Assoc. 2011;306:1659-1668.
10. Alshahrani MS, Sindi A, Alshamsi F, et al. Extracorporeal membrane oxygenation for severe Middle East respiratory syndrome coronavirus. Ann Intensive Care. 2018;8:3.
11. Liberati A, Altman DG, Tetzlaff J, et al. The PRISMA Statement for Reporting Systematic Reviews and Meta-Analyses of Studies That Evaluate Health Care Interventions:Explanation and Elaboration. J Clin Epidemiol. 2009;62:e1-34.
12. Guan W, Ni Z, Hu Y, et al. Clinical characteristics of coronavirus disease 2019 in China. N Engl J Med. 2020;382:1708-1720.
13. Zhang G, Hu C, Luo L, et al. Clinical features and short-term outcomes of 221 patients with COVID-19 in Wuhan, China. J Clin Virol. 2020;127:104364.
14. Chen N, Zhou M, Dong X, et al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China:a descriptive study. Lancet. 2020;395:507-513.
15. Li X, Ma X. Acute respiratory failure in COVID-19:Is it “typical“ARDS?Crit Care. 2020;24:1-5.
16. Kang Y, Chen T, Mui D, et al. Cardiovascular manifestations and treatment considerations in COVID-19. Heart. 2020;106:1132-1141.
17. Li X, Guo Z, Li B, et al. Extracorporeal Membrane Oxygenation for Coronavirus Disease 2019 in Shanghai, China. ASAIO J. 2020:475-481.
18. Shi S, Qin M, Shen B, et al. Association of Cardiac Injury with Mortality in Hospitalized Patients with COVID-19 in Wuhan, China. JAMA Cardiol. 2020;5:802-810.
19. Ruan Q, Yang K, Wang W, Jiang L, Song J. Clinical predictors of mortality due to COVID-19 based on an analysis of data of 150 patients from Wuhan, China. Intensive Care Med. 2020;46:846-848.
20. Rodríguez-Leor O, Cid-Álvarez B, Ojeda S, et al. Impact of the COVID-19 pandemic on interventional cardiology activity in Spain. REC Interv Cardiol. 2020;2:82-89.
21. Khan R, Anandamurthy B, McCurry K, Krishnan S. Utility of extracorporeal membrane oxygenation in COVID-19. Cleve Clin J Med. 2020 May 5. doi:10.3949/ccjm.87a.ccc014.
22. Li L, Li R, Wu Z, et al. Therapeutic strategies for critically ill patients with COVID-19. Ann Intensive Care. 2020;10:45.
23. Henry BM. COVID-19, ECMO, and lymphopenia:a word of caution. Lancet Respir Med. 2020;8:e24.
24. Barbaro R, MacLaren G, Boonstra P, Iwashyna, TH, Slutsky A, Fan E. Extracorporeal membrane oxygenation support in COVID-19:an international cohort study of the Extracorporeal Life Support Organization registry. Lancet. 2020;396:1071-1078.
25. Henry BM, Lippi G. Poor survival with extracorporeal membrane oxygenation in acute respiratory distress syndrome (ARDS) due to coronavirus disease 2019 (COVID-19):Pooled analysis of early reports. J Crit Care. 2020;58:27-28.
26. Ñamendys-Silva SA. ECMO for ARDS due to COVID-19. Hear Lung. 2020;49:348-349.
27. Oliveira TF de, Rocha CA de O, Santos AGG dos, et al. Extracorporeal Membrane Oxygenation in COVID-19 Treatment:a Systematic Literature Review. Brazilian J Cardiovasc Surg. 2021;8:84-123.
28. Haiduc AA, Alom S, Melamed N, Harky A. Role of extracorporeal membrane oxygenation in COVID-19:A systematic review. J Card Surg. 2020;35:2679-2687.
29. Melhuish TM, Vlok R, Thang C, Askew J, White L. Outcomes of extracorporeal membrane oxygenation support for patients with COVID- 19:A pooled analysis of 331 cases. Am J Emerg Med. 2020;39:245-246.
30. Schmidt M, Hajage D, Lebreton G, et al. Extracorporeal membrane oxygenation for severe acute respiratory distress syndrome associated with COVID-19:a retrospective cohort study. Lancet Respir Med. 2020;8:1121-1131.
31. Marullo A, Cavaretta E, Biondi-zoccai G, et al. Extracorporeal membrane oxygenation for critically ill patients with coronavirus-associated disease 2019 :an updated perspective of the European experience. Minerva Cardioangiol. 2020;68:368-372.
32. Sultan I, Habertheuer A, Usman AA, et al. The role of extracorporeal life support for patients with COVID-19:Preliminary results from a statewide experience. J Card Surg. 2020;35:1410-1413.
33. The Extracorporeal Life Support Organization (ELSO):ECMO in COVID-19. Disponible en: https://www.elso.org/Registry/FullCOVID19RegistryDashboard.aspx. Consultado 18 Ene 2021.
34. Ahmadi ZH, Jahangirifard A, Farzanegan B, et al. Extracorporeal membrane oxygenation and COVID-19:The causes of failure. J Card Surg. 2020;35:2838-2843.
35. Akhtar W, Olusanya O, Baladia MM, Young H, Shah S. SARS-CoV-2 and ECMO:early results and experience. Indian J Thorac Cardiovasc Surg. 2021;37:53-60.
36. Alnababteh M, Hashmi MD, Vedantam K, et al. Extracorporeal membrane oxygenation for COVID-19 induced hypoxia:Single-center study. Perfusion (United Kingdom). 2020. http://dx.doi.org/10.1177/0267659120963885.
37. Charlton M, Dashey S, Stubbs A, Lai FY, Tang JW. Comparing SARS-CoV-2 and influenza A(H1N1)pdm09-infected patients requiring ECMO. A single-centre, retrospective observational cohort experience. J Infect. 2021;8:84-123.
38. Cousin N, Bourel C, Carpentier D, et al. SARS-CoV-2 versus influenza associated acute respiratory distress syndrome requiring veno-venous extracorporeal membrane oxygenation support. ASAIO J. 2021;67:125-131.
39. Falcoz P-E, Puyraveau M, Perrier S, et al. Extracorporeal Membrane Oxygenation for Critically Ill Patients with COVID-19–related Acute Respiratory Distress Syndrome:Worth the Effort?Am J Respir Crit Care Med. 2020;202:460-463.
40. Guo Z, Sun L, Li B. Anticoagulation Management in Severe Coronavirus Disease 2019 Patients on Extracorporeal Membrane Oxygenation. J Cardiothorac Vasc Anesth. 2021;35:389-397.
41. Hu H, Xu S, Wang J, Rao X. Respiratory Support in Severely or Critically Ill ICU Patients With COVID-19 in Wuhan, China. Curr Med Sci. 2020;40:636-641.
42. Huang S, Xia H, Wu Z, et al. Clinical data of early COVID-19 cases receiving extracorporeal membrane oxygenation in Wuhan, China. J Clin Anesth. 2021;68:110044.
43. Huette P, Beyls C, Guilbart M, et al. Extracorporeal membrane oxygenation for respiratory failure in COVID-19 patients:outcome and time-course of clinical and biological parameters. Can J Anesth. 2020;67:1486-1488.
44. Jacobs JP, Stammers AH, Louis J, et al. Extracorporeal Membrane Oxygenation in the Treatment of Severe Pulmonary and Cardiac Compromise in Coronavirus Disease 2019:Experience with 32 Patients. ASAIO J. 2020;66:722-730.
45. Kon ZN, Smith DE, Chang SH, et al. Extracorporeal Membrane Oxygenation Support in Severe COVID-19. Ann Thorac Surg. 2021;111:537-543.
46. Breton C Le, Besset S, Amouretti M, Billiet PA, Dao M. Extracorporeal membrane oxygenation for refractory COVID-19 acute respiratory distress syndrome. J Crit Care. 2020;60:10-12.
47. Li J, Xu G, Yu H, Peng X, Luo Y, Cao C. Clinical Characteristics and Outcomes of 74 Patients With Severe or Critical COVID-19. Am J Med Sci. 2020;360:229-235.
48. Loforte A, Dal Checco E, Gliozzi G, et al. Veno-venous extracorporeal membrane oxygenation support in covid-19 respiratory distress syndrome:Initial experience. ASAIO J. 2020;66:734-738.
49. Miike S, Sakamoto N, Washino T, et al. Critically ill patients with COVID-19 in Tokyo, Japan:A single-center case series. J Infect Chemother. 2021;27:291-295.
50. Mustafa AK, Alexander PJ, Joshi DJ, et al. Extracorporeal Membrane Oxygenation for Patients with COVID-19 in Severe Respiratory Failure. JAMA Surg. 2020;155:990-992.
51. Osho AA, Moonsamy P, Hibbert KA, et al. Veno-venous Extracorporeal Membrane Oxygenation for Respiratory Failure in COVID-19 Patients:Early Experience From a Major Academic Medical Center in North America. Ann Surg. 2020;272:e75-e78.
52. Riera J, Argudo E, Martínez-Martínez M, et al. Extracorporeal Membrane Oxygenation Retrieval in Coronavirus Disease 2019:A Case-Series of 19 Patients Supported at a High-Volume Extracorporeal Membrane Oxygenation Center. Crit Care Explor. 2020;2:e0228.
53. Rieg S, von Cube M, Kalbhenn J, et al. COVID-19 in-hospital mortality and mode of death in a dynamic and non-restricted tertiary care model in Germany. PLoS One. 2020;15:1-16.
54. Santos-Martínez S, Martín Moreiras J, Vázquez-Álvarez M, Peñasco Y, Uribarri A, Amat-Santos I. Oxigenador extracorpóreo de membrana con implante percutáneo durante la pandemia de COVID-19. Registro multicéntrico español. REC Interv Cardiol. 2020;2:312-314.
55. Schroeder I, Scharf C, Zoller M, et al. Characteristics and outcome of 70 ventilated COVID-19 patients:Summary after the first wave at a university center. Anaesthesist. 2020. http://dx.doi.org/10.1007/s00101-020-00906-3.
56. Shen C, Wang Z, Zhao F, et al. Treatment of 5 Critically Ill Patients with COVID-19 with Convalescent Plasma. J Am Med Assoc. 2020;323:1582-1589.
57. Sromicki J, Schmiady M, Maisano F, Mestres CA. ECMO therapy in COVID-19:The Zurich experience. J Card Surg. 2021;36:1707-12.
58. Wu C, Chen X, Cai Y, et al. Risk Factors Associated with Acute Respiratory Distress Syndrome and Death in Patients with Coronavirus Disease 2019 Pneumonia in Wuhan, China. JAMA Intern Med. 2020;180:934-943.
59. Xu Y, Xu Z, Liu X, et al. Clinical Findings of COVID-19 Patients Admitted to Intensive Care Units in Guangdong Province, China:A Multicenter, Retrospective, Observational Study. Front Med. 2020;7:1-9.
60. Xuan W, Chen C, Jiang X, et al. Clinical characteristics and outcomes of five critical COVID-19 patients treated with extracorporeal membrane oxygenation in Leishenshan Hospital in Wuhan. J Clin Anesth. 2020;67:110033.
61. Yang X, Cai S, Luo Y, et al. Extracorporeal Membrane Oxygenation for Coronavirus Disease 2019-Induced Acute Respiratory Distress Syndrome:A Multicenter Descriptive Study. Crit Care Med. 2020;3:1289-1295.
62. Yang X, Yu Y, Xu J, et al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China:a single-centered, retrospective, observational study. Lancet Respir Med. 2020;8:475-481.
63. Yang Y, Rali AS, Inchaustegui C, et al. Extracorporeal Membrane Oxygenation in Coronavirus Disease 2019-associated Acute Respiratory Distress Syndrome:An initial US Experience at a High-volume Centre. Card Fail Rev. 2020;6:7-9.
64. Yankah CA, Trimlett R, Sandoval E, et al. COVID-19 Pulmonary Failure and Extracorporeal Membrane Oxygenation:First Experience from Three European Extracorporeal Membrane Oxygenation Centers. Thorac Cardiovasc Surg. 2021;69:259-62.
65. Yao K, Hasegawa S, Tagashira Y, et al. Experience of 101 patients with coronavirus infectious disease 2019 (COVID-19) at a tertiary care center in Japan. J Infect Chemother. 2021;27:413-417.
66. Zayat R, Kalverkamp S, Grottke O, et al. Role of extracorporeal membrane oxygenation in critically Ill COVID-19 patients and predictors of mortality. Artif Organs. 2020. http://dx.doi.org/10.1111/aor.13873.
67. Zeng Y, Cai Z, Xianyu Y, Yang BX, Song T, Yan Q. Prognosis when using extracorporeal membrane oxygenation (ECMO) for critically ill COVID-19 patients in China:A retrospective case series. Crit Care. 2020;24:8-10.
68. Zhang J, Merrick B, Correa GL, et al. Veno-venous extracorporeal membrane oxygenation in coronavirus disease 2019:a case series. ERJ Open Res. 2020;6:00463-02020.
69. Zhou F, Yu T, Du R, et al. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China:a retrospective cohort study. Lancet. 2020;395:1054-1062.
Autor para correspondencia: Servicio de Cardiología, Hospital Universitario de Canarias, Ofra s/n, 38320 La Cuesta, Tenerife, España.
Correo electrónico: nestor.baez@hotmail.com (N. Báez-Ferrer).