INTRODUCCIÓN
Las terapias contra el fallo cardiovascular han protagonizado el gran beneficio sobre la esperanza y la calidad de vida que ha experimentado la población, pero son medidas paliativas que no han servido para resolver la destrucción tisular que origina este problema, cuya malignidad se concreta en cerca de 20 millones de muertes por causas cardiovasculares al año en todo el mundo1. La medicina de reparación y regeneración surgió hace más de 2 décadas para dar una respuesta biológica a la necesidad imperiosa de innovación en este campo, y tiene como objetivo orquestar herramientas diagnósticas y estrategias de tratamiento destinadas a restaurar la salud molecular, celular y tisular de los órganos cardiovasculares dañados2.
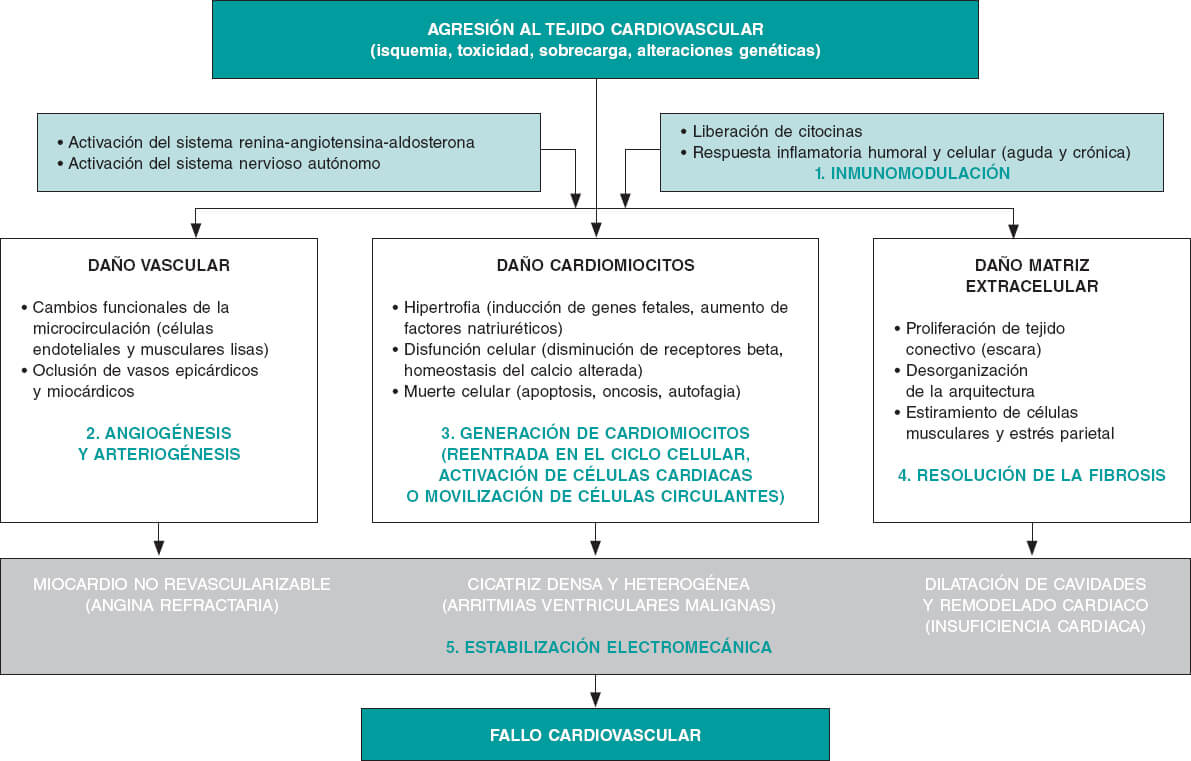
Aunque se puede afirmar tajantemente que el corazón adulto tiene una pequeña capacidad de regeneración, que depende de la formación de nuevas células (musculares cardiacas, endoteliales y de músculo liso) a partir de un reservorio de células madre existentes en la propia víscera3, es posible decir con la misma fuerza que dicha capacidad es marginal e insuficiente para la reparación de los órganos cardiovasculares tras su afectación por cualquier daño (isquémico, tóxico, valvular o heredado)4, e incluso tras su envejecimiento fisiológico5. Al contrario, la respuesta «reparadora» mayoritaria del miocardio consiste en hipertrofia celular en algunos casos y en sustitución del tejido funcionante destruido por tejido fibroso más o menos denso (escara) en la gran mayoría de ellos, proceso causante del remodelado ventricular adverso que define los estadios avanzados de la insuficiencia cardiaca (disfunción ventricular sistólica y dilatación de las cavidades cardiacas), de origen tanto isquémico como no isquémico (figura 1).
FUNDAMENTOS PATOBIOLÓGICOS Y EXPERIENCIAS PRECLÍNICAS
Desde finales de los años 1990 se han estudiado en el laboratorio y se han administrado en modelos de animales pequeños y grandes diferentes tipos celulares; por orden cronológico: mioblastos esqueléticos, células hematopoyéticas y endoteliales (en la mayoría de los casos provenientes de la médula ósea), células mesenquimales (de médula ósea o de tejido adiposo), células cardiacas y, más recientemente, células pluripotentes de origen embrionario o inducidas a partir de células somáticas adultas6. Todos estos tipos celulares se han estudiado mayoritariamente en modelos de cardiopatía isquémica, y en algunos casos se han explorado en su origen alogénico de donantes sanos de la misma especie (en contraposición a las autólogas, provenientes del mismo receptor). Con el paso de los años han aparecido nuevos productos con intención regenerativa o reparadora. Además de la terapia génica, que coexiste con la celular prácticamente desde sus orígenes, se han desarrollado productos «no celulares» (factores de crecimiento, citocinas, proteínas o tipos de ácido ribonucleico —microARN, muchos de ellos contenidos en las microvesículas o «exosomas» que liberan las células madre o las células adultas al ser agredidas). Estos productos, así como las plataformas de ingeniería tisular (nanopartículas, geles y matrices), han irrumpido en la medicina regenerativa en fechas mucho más recientes, por lo que su incorporación a la investigación clínica es en este momento muy incipiente.
Los experimentos en el laboratorio o en modelos animales han sido de gran utilidad, ya que han permitido demostrar que: a) el proceso de reparación miocárdica y vascular es de una enorme complejidad, tanto molecular como celular y tisular, y a día de hoy es mayoritariamente desconocido; b) la contribución a este proceso de las células madre cardiacas es marginal, y existe un proceso de reentrada de cardiomiocitos maduros al ciclo celular que también es minoritario; c) los efectos beneficiosos de los diferentes productos en el miocardio se explican por el efecto de las proteínas y las citocinas liberadas por las células administradas (efecto paracrino), no por la fusión celular, la proliferación o la diferenciación de estas células a cardiomiocitos, células endoteliales o células musculares lisas (hecho solo demostrado con las células pluripotentes y embrionarias, no utilizadas aún en la investigación clínica); y d) estos efectos positivos incluyen protección de la apoptosis, reducción del tejido fibroso resultante del daño miocárdico, modulación de la inflamación que ineludiblemente precede o acompaña a ese daño, creación de nuevos vasos sanguíneos o formación de pequeñas cantidades de cardiomiocitos (figura 1).
Figura 1. Mecanismos patobiológicos comunes que definen la afectación del miocardio en sus componentes vascular, muscular y extracelular por diferentes tipos de daño tisular, incluidos el papel de los mecanismos neurohormonales de compensación y de la respuesta inflamatoria. En la parte inferior, los 3 componentes principales del fallo cardiovascular (angina, arritmias ventriculares y remodelado ventricular). En verde, los 5 mecanismos de acción beneficiosos demostrados en la investigación básica y preclínica mediante los que intervienen las terapias reparadoras y regenerativas.
Sin embargo, como ha sucedido en otros campos de la investigación cardiovascular7, en la medicina regenerativa se ha producido también un «vacío traslacional» de gran importancia, con un impacto de las terapias aplicadas tanto más bajo cuanto más cercana a la clínica humana ha sido la investigación animal. Por ejemplo, un metanálisis de 80 estudios demostró que en los modelos de animal pequeño la reducción media del tamaño del infarto con diferentes productos fue del 11%8. Sin embargo, en animales grandes esa reducción fue del 5%, y es sabido que en los humanos ronda el 2-4%9. Esta discrepancia entre los resultados en animales y en humanos se explica, aparte de por la complejidad de los procesos celulares que regulan la reparación cardiaca, por la gran diferencia de tamaño entre las especies y la cantidad de células (o productos) necesarias para revertirla. Otras áreas de mejora y otros conceptos que precisan más estudio en esta vertiente de la investigación preclínica son las dosis y los tiempos de administración, y la combinación de productos. Finalmente, el rigor propio de la investigación clínica no se aplica siempre con tanta contundencia en la investigación animal, lo que hace necesaria la estandarización de modelos animales y de protocolos de obtención y preparación de los productos reparadores, así como el desarrollo de estudios multicéntricos, aleatorizados y previamente registrados2.
EVIDENCIAS CLÍNICAS
La necesidad apremiante de innovaciones contra el fallo cardiovascular catapultó muy pronto la investigación de terapias regenerativas en los humanos, con estudios piloto y de fase I a los que siguieron rápidamente ensayos clínicos con un reducido número de pacientes. Algunos productos alcanzaron la fase III de la investigación clínica, en particular en pacientes con infarto agudo de miocardio, angina refractaria o insuficiencia cardiaca isquémica y no isquémica. De toda la evidencia disponible hasta este momento pueden extraerse las siguientes conclusiones: a) salvo en casos excepcionales bien identificados (arritmias ventriculares con los tipos celulares iniciales), todos los productos administrados en humanos han demostrado su seguridad, sin que se hayan documentado casos de rechazo (incluso con productos alogénicos), formación de tumores, empeoramiento del estado cardiovascular de los pacientes ni complicaciones relevantes durante su administración; b) la eficacia clínica real de estos tratamientos no está demostrada de forma definitiva con objetivos «duros», hay estudios con resultados neutros y otros que han demostrado una reducción del tamaño del infarto, un aumento de la perfusión miocárdica o de la fracción de eyección, y una mejoría de parámetros clínicos «blandos»; c) los escenarios más prometedores son la insuficiencia cardiaca con disfunción ventricular sistólica y la angina refractaria; y d) se ha desarrollado un amplio y muy sofisticado arsenal de estrategias de administración, algunas quirúrgicas, pero mayoritariamente percutáneas, que aseguran la inyección de material biológico en áreas cardiacas concretas a través de catéteres convencionales o especiales, así como sistemas de navegación que permiten guiar la administración de forma muy precisa.
Al igual que en el ámbito preclínico, la evidencia clínica disponible permite identificar algunas variables que deben ser demostradas y mejor definidas antes de continuar con la investigación en ensayos clínicos a gran escala; entre ellas, la elección del tipo de producto, la dosis total y el momento óptimos de administración en cada afección concreta, los estudios comparativos de productos, la administración repetida y la mejora de la retención miocárdica de los productos infundidos o inyectados. Todos estos aspectos deben analizarse rigurosamente en la investigación básica y preclínica antes de plantearse nuevas investigaciones en humanos. Llegados a este punto, no hay que olvidar el diseño riguroso de los ensayos clínicos, con objetivos bien definidos, tamaños muestrales adecuados y un riguroso control regulatorio.
ALIANZAS INTERNACIONALES Y GRUPOS DE TRABAJO ESPECÍFICOS
Como parte del desarrollo de la medicina regenerativa, con el objetivo de profundizar en su estudio y de organizar y estructurar una investigación que sigue siendo minoritaria, se han creado 2 organizaciones principales:
- – La alianza internacional TACTICS (Transnational Alliance for Regenerative Therapies in Cardiovascular Syndromes)10, que agrupa a más de 100 grupos de investigación líderes en este campo distribuidos globalmente y que constituye un consorcio global colaborativo en red destinado a la redacción de artículos de posicionamiento y recomendaciones, a la promoción rigurosa en todos los ámbitos (científico, institucional y social) y al diseño y el desarrollo de proyectos de investigación clínica y preclínica coordinados y eficientes.
- – El Working Group on Cardiovascular Regenerative and Reparative Medicine11, dentro de la estructura de la Sociedad Europea de Cardiología (ESC), que se configura como un organismo dinámico apoyado en los pilares de formación, educación, investigación, participación en congresos y soporte al campo definidos por los estatutos de la propia ESC.
Ambas agrupaciones tienen como objetivo común inicial analizar las evidencias disponibles en medicina reparadora y regenerativa cardiovascular, establecer las líneas de investigación del futuro y, finalmente, facilitar el desarrollo de tratamientos que mejoren la salud cardiovascular de los pacientes.
CONCLUSIONES
Aunque no se ha demostrado aún una eficacia clínica que permita su incorporación a la práctica clínica habitual, la medicina reparadora y regenerativa ha contribuido a ampliar de forma abrumadora el conocimiento sobre los procesos biológicos moleculares, celulares y tisulares que gobiernan la pérdida funcional, la homeostasis y la reparación del sistema cardiovascular. Analizando y planificando la investigación futura con una metodología rigurosa, fundamentada, coordinada, multicéntrica y multidisciplinaria, estaremos más cerca de conseguir tratamientos capaces de revertir por completo o parcialmente el daño miocárdico tisular irreversible y mejorar la salud cardiovascular.
CONFLICTO DE INTERESES
Los autores no tienen conflictos de intereses que declarar.
BIBLIOGRAFÍA
1. GBD 2017 Causes of Death Collaborators. Global, regional, and national age-sex-specific mortality for 282 causes of death in 195 countries and territories, 1980–2017:a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2018;392:1736-1788.
2. Fernández-Avilés F, Sanz-Ruiz R, Climent AM, et al. Global position paper on cardiovascular regenerative medicine. Eur Heart J. 2017;38:2532-2546.
3. Messina E, De Angelis L, Frati G, et al. Isolation and expansion of adult cardiac stem cells from human and murine heart. Circ Res. 2004;95:911-921.
4. Bergmann O, Zdunek S, Felker A, et al. Dynamics of Cell Generation and Turnover in the Human Heart. Cell. 2015;161:1566-1575.
5. Climent AM, Sanz-Ruiz R, Fernández-Avilés F. Cardiac rejuvenation:a new hope in the presbycardia nightmare. Eur Heart J. 2017;38:2968-2970.
6. Buja LM. Cardiac repair and the putative role of stem cells. J Mol Cell Cardiol. 2019;128:96-104.
7. Roolvink V, Ibáñez B, Ottervanger JP, et al. Early Intravenous Beta-Blockers in Patients With ST-Segment Elevation Myocardial Infarction Before Primary Percutaneous Coronary Intervention. J Am Coll Cardiol. 2016;67:2705-2715.
8. Zwetsloot PP, Végh AM, Jansen of Lorkeers SJ, et al. Cardiac Stem Cell Treatment in Myocardial Infarction:A Systematic Review and Meta-Analysis of Preclinical Studies. Circ Res. 2016;118:1223-1232.
9. Fisher SA, Doree C, Mathur A, et al. Meta-analysis of cell therapy trials for patients with heart failure. Circ Res. 2015;116:1361-1377.
10. TACTICS Alliance. Disponible en:https://www.tacticsalliance.org. Consultado 7 Oct 2019.
11. ESC Working Group on Cardiovascular Regenerative and Reparative Medicine. Disponible en:https://www.escardio.org/Working-groups/Working-Group-on-Cardiovascular-Regenerative-and-Reparative-Medicine. Consultado 7 Oct 2019.
Autor para correspondencia: Servicio de Cardiología, Hospital General Universitario Gregorio Marañón, Dr. Esquerdo 46, 28007 Madrid, España.
Correo electrónico: faviles@secardiologia.es (F. Fernández-Avilés).