Sr. Editor:
La estenosis aórtica (EA) congénita grave y crítica representa un reto en la toma de decisiones y tiene una alta morbimortalidad1; en estos pacientes, el tratamiento percutáneo es el realizado en la mayoría de los centros. El objetivo del presente trabajo fue valorar la evolución clínica y ecocardiográfica de las EA congénitas tratadas con valvuloplastia percutánea (VP) y los factores predictivos de peor evolución2,3.
Se incluyeron retrospectivamente las EA graves (velocidad pico > 4 m/s o gradiente medio > 40 mmHg) y críticas (flujo sistémico dependiente del ductus), según la primera ecocardiografía posnatal, diagnosticadas en época fetal y hasta el mes de vida, tratadas mediante VP en un centro terciario entre los años 2009 y 2019. Se cumplieron los criterios la Declaración de Helsinki, con exención de la solicitud de consentimiento informado.
Se analizaron prenatalmente la fracción de eyección del ventrículo izquierdo (FEVI), la fibroelastosis endomiocárdica, los flujos en el ductus, el foramen oval, la aorta ascendente y el arco, la insuficiencia mitral y el hidrops. Se recogieron el tamaño y la forma de la válvula aórtica, el tamaño, la función y la fibroelastosis ven-tricular al nacimiento, en el control inmediato tras la VP y en el seguimiento, así como los gradientes hemodinámicos de la VP, y las complicaciones. La VP se consideró efectiva ante un gradiente hemodinámico pico residual ≤ 35 mmHg o un 50% de disminución, con FEVI normal. Se categorizaron como evolución desfavorable la necesidad de cirugía de Ross, el trasplante cardiaco y la muerte. Las variables cualitativas se describieron mediante porcentaje, y las cuantitativas, con mediana y rango intercuartílico [RIC]. El contraste de hipótesis univariante se realizó mediante test U de Mann-Whitney y el test exacto de Fisher. La distinción de variables confusoras se llevó a cabo mediante análisis multivariante con el método reverso de verosimilitud de regresión lineal. La significación se estableció en un riesgo alfa de 0,05%.
Se obtuvieron 23 pacientes, 6 (26,09%) de sexo femenino. Del total, 7 (30,44%) asociaron coartación aórtica y 2 (11,39%) estenosis mitral moderada-grave. Se encontraron 6 (26,09%) EA críticas, 2 (11,39%) unicúspides, 8 (34,78%) bicúspides puras y 12 (52,17%) tricúspides; se describieron 8 rafes entre velos no coronárico y coronárico derecho, y 2 entre coronáricos derecho e izquierdo.
En cuanto al momento del diagnóstico, en 6 (26,09%) fue prenatal y en 17 (73,91%) en el periodo neonatal. De los prenatales, 3 (13,05) presentaron disfunción grave, con fibroelastosis de grado 4 y flujo reverso en la aorta ascendente y transversa. Uno presentó hidrops, y a otro se le realizó valvuloplastia fetal, que fue efectiva, en la semana 26.
Se encontró que 6 (26,09%) presentaron shock cardiogénico al nacimiento. Hubo disfunción sistodiastólica solo en EA críticas, con una FEVI mediana del 42,50% [RIC: 40,00-57,25], inferior respecto a las graves (p = 0,011). Presentaron insuficiencia mitral 10 (47,83%) neonatos, 2 (8,70%) de ellos grave.
La VP se realizó de mediana a los 42 días de vida [RIC: 12,25-56], 7 (30,43%) de ellas en la primera semana de vida. El balón usado fue un TYSHAK mini o II (NuMED Inc., USA). La ratio balón/diámetro valvular fue de 1,00 [RIC: 0,91-1,03]; y en el grupo de EA unicúspides fue significativamente más alta. El acceso vascular fue la arteria femoral. La efectividad global fue del 78,26%; en las EA críticas fue del 83,33% (n = 5/6) y en las graves del 76,5% (n = 13/17).
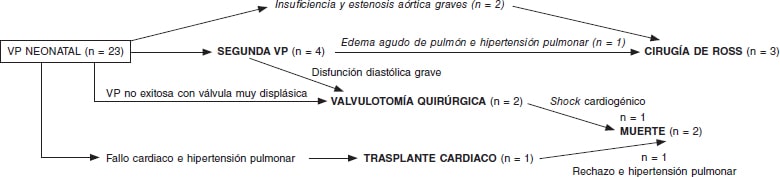
Tras una mediana de seguimiento de 4 años [RIC: 3,5-6,25], la supervivencia fue del 92,31%. NO hubo necesidad de reintervención en 15 pacientes (65,22%). Las reintervenciones (figura 1) se produjeron en el primer año de vida: 4 pacientes necesitaron una nueva VP, 3 una cirugía de Ross, 2 una valvulotomía quirúrgica (1 de ellos falleció por shock cardiogénico posoperatorio) y 1 un trasplante cardiaco por insuficiencia cardiaca e hipertensión pulmonar (falleció por rechazo e hipertensión pulmonar).
Figura 1. Necesidad de nuevos procedimientos tras la valvuloplastia percutánea (VP).
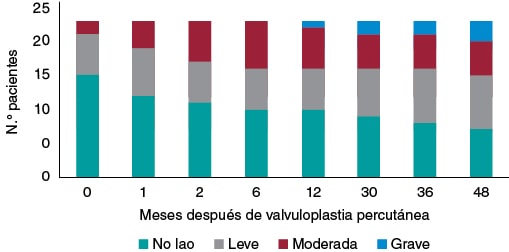
En la evolución se observó un 69,57% de insuficiencia aórtica (un 33% moderada y un 8% grave) (figura 2). No se hallaron diferencias estadísticamente significativas en la evolución a insuficiencia aórtica moderada-grave según la ratio balón/anillo (p = 0,435), ni tampoco según el éxito del procedimiento (p = 0,446).
Figura 2. Evolución de la insuficiencia aórtica (Iao).
En el contraste univariante para factores de riesgo de evolución desfavorable hubo diferencias estadísticamente significativas en EA de grado crítico (p = 0,021); en mayor gradiente transvalvular sistólico al nacimiento (p = 0,027), diámetro menor del anillo aórtico (p = 0,017), flujo sistémico dependiente del ductus (p = 0,003), ventilación mecánica (p = 0,009) y menor peso al nacimiento (p = 0,001); en menor edad en la primera VP (p = 0,013), y en menor FEVI (p = 0,021) y menor diámetro anillo aórtico tras la VP (p = 0,009). No se observaron diferencias según la morfología valvular (p = 1).
En el análisis multivariante (table 1) de las variables previamente significativas y con relevancia clínica se obtuvo significación estadística para un menor diámetro de anillo aórtico (hazard ratio = 2,82; p = 0,016).
Tabla 1. Predictores de evolución desfavorable
| Test exacto de Fisher o U de Mann-Whitney | Test multivariante: método reverso de verosimilitud de análisis bivariante | Test exacto de Fisher o U de Mann-Whitney | Test multivariante: método reverso de verosimilitud de análisis bivariante | |||||
|---|---|---|---|---|---|---|---|---|
| Variables | p | HR (IC95%) | p | Variables | p | HR (IC95%) | p | |
| EA crítica | 0,021* | Insuficiencia mitral al nacimiento | 0,069 | |||||
| Diagnóstico prenatal | 0,275 | Z-score anillo mitral al nacimiento | 0,268 | |||||
| Válvula unicúspide | 0,462 | Z-score anillo aórtico al nacimiento | 0,017* | 1,234 (0,436-3,4494) | 0,692 | |||
| Afectados de coartación aorta | 0,369 | Z-score diámetro telediastólico del VI | 1,000 | |||||
| Afectados de síndrome de Shone | 0,146 | Gradiente telediastólico del VI pre-VP | 0,841 | |||||
| FEVI al nacimiento | 0,101 | Score inotrópico al nacimiento | 0,500 | |||||
| S’ de VI al nacimiento | 0,222 | Infusión de prostaglandinas | 0,003* | |||||
| Disfunción diastólica al nacimiento | 0,131 | Ventilación mecánica | 0,009* | |||||
| Gradiente medio EA al nacimiento | 0,143 | Menor peso al nacimiento | 0,001* | |||||
| Gradiente sistólico EA al nacimiento | 0,027* | 0,983 (0,906-1,066) | 0,676 | Edad al cateterismo | 0,013* | 0,896 (0,569-1,344) | 0,596 | |
| Insuficiencia aórtica al nacimiento | 0,481 | Presión hemodinámica sistólica aorta pre-VP | 0,687 | |||||
| Diámetro anillo aórtico al nacimiento | 0,039* | Presión hemodinámica media aorta pre-VP | 0,622 | |||||
| Estenosis mitral al nacimiento | 0,481 | Presión hemodinámica diastólica aorta pre-VP | 0,107 | |||||
| Presión hemodinámica media VI pre-VP | 0,154 | Insuficiencia aórtica ecocardiografía post-VP | 0,609 | |||||
| Presión hemodinámica sistólica VI pre-VP | 0,424 | Z-score anillo aórtico ecocardiografía post-VP | 0,009* | 0,355 (0,153-0,826) | 0,016* | |||
| Presión hemodinámica sistólica aorta post-VP | 0,398 | Insuficiencia mitral control post-VP | 0,635 | |||||
| FEVI post-VP | 0,021* | 1,007 (0,896-1,131) | 0,910 | Estenosis mitral control post-VP | 0,100 | |||
| S’ VI ecocardiografía post-VP | 0,106 | |||||||
|
EA: estenosis aórtica; FEVI: fracción de eyección del ventrículo izquierdo; HR: hazard ratio; IC95%: intervalo de confianza del 95%; VI: ventrículo izquierdo; VP: valvuloplastia percutánea. * Variables estadísticamente significativas. |
||||||||
En este estudio, que refleja la complejidad y la heterogeneidad de la EA, se encontró que en el seguimiento tras una VP neonatal aórtica se requirió de alguna forma una nueva intervención en un tercio de los pacientes, siendo estos resultados similares a los de otras series4. Debido a las complejas decisiones, es importante conocer aquellas características que asocian evoluciones más negativas5,6. Se observa un peor pronóstico asociado a menor peso, flujo sistémico dependiente del ductus y ventilación mecánica, EA de grado crítico y mayor gradiente transvalvular aórtico sistólico al nacimiento, menores tamaños del anillo y peor FEVI tras la VP, y cuando esta se tiene que realizar más precozmente. Estos factores suelen presentarse de forma concomitante, pero solo el diámetro del anillo tiene significancia estadística en el análisis multivariante. Probablemente una mayor muestra hubiese resultado con más variables significativas. Aun así, se puede ver que los pacientes con mala evolución suelen presentar unas mismas características, lo que sugiere que forman otro espectro de la enfermedad con diferentes necesidades de tratamiento, y precisan una valoración multidisciplinaria e individualizada.
FINANCIACIÓN
Los autores declaran que este trabajo no ha recibido ningún tipo de financiación.
CONTRIBUCIÓN DE LOS AUTORES
A. Freixa-Benavente fue la promotora de la idea y realizó la recogida de datos y su análisis, así como la redacción del texto y su envío. P. Betrián-Blasco supervisó el trabajo, la recogida de pacientes y de los datos, y su análisis; también revisó el manuscrito final y dio su aprobación. F. Rosés-Noguer y G. Giralt-García revisaron el texto y realizaron aportaciones importantes. Q. Ferrer-Menduiña fue la impulsora y realizó la supervisión del trabajo, la recogida de pacientes y de datos, y la redacción; también revisó el manuscrito final y dio su aprobación.
CONFLICTO DE INTERESES
Los autores declaran que no existen conflictos de intereses.
BIBLIOGRAFÍA
1. Freud LR, Mc Elhinney DB, Marshanll AC, et al. Fetal aortic valvuloplasty for evolving hypoplastic left heart syndrome: postnatal outcomes of the first 100 patients. Circulation. 2014;130:638-645.
2. Zaban NB, Herrmann JL, Hoyer MH, et al. Short- and intermediate-term results of balloon aortic valvuloplasty and surgical aortic valvotomy in neonates. Cardiol Young. 2020;30:489-492.
3. Feltes TF, Bacha E, Beekman RH , et al. Indications for Cardiac Catheterization and Intervention in Pediatric Cardiac Disease. A Scientific Statement from the American Heart Association. Circulation. 2011;123:2607-2652.
4. Brown DW, Dipilato AE, Chong ED, et al. Aortic Valve Reinterventions After Balloon Aortic Valvuloplasty for Congenital Aortic Stenosis. J Am Coll Cardiol. 2010;56:1740-1749.
5. Siddiqui J, Brizard CP, Galati JC, et al. Surgical Valvotomy and Repair for Neonatal and Infant Congenital Aortic Stenosis Achieves Better Results Than Interventional Catheterization. J Am Coll Cardiol. 2013;62:2134-2140.
6. Mc Lean KM, Lorts A, Pearl JM. Current treatment for congenital aortic stenosis. Curr Opin Cardiol. 2006;21:200-204.