RESUMEN
Introducción y objetivos: La nefropatía inducida por contraste (NIC) es una potencial complicación de los procedimientos angiográficos. El sistema DyeVert Power (Osprey Medical, Estados Unidos) permite reducir la concentración renal del medio de contraste al disminuir la cantidad administrada a los pacientes. Al contrario que sobre los sistemas manuales, existen pocos datos disponibles sobre el sistema DyeVert, que se utiliza junto a la inyección automática de contraste. El objetivo principal de este estudio fue evaluar su eficacia en procedimientos de intervencionismo coronario percutáneo (ICP).
Métodos: Entre 2020 y 2022 se incluyó a 101 pacientes a quienes se realizó ICP utilizando el sistema DyeVert Power XT (grupo de casos) para evaluar la cantidad ahorrada de medio de contraste, así como la tasa, la gravedad y los predictores de NIC. Además, se seleccionó un grupo control de pacientes a los que se había realizado ICP sin utilizar el sistema DyeVert para comparar la cantidad de medio de contraste administrado y la tasa de NIC.
Resultados: En el grupo de casos se redujo la administración de medio de contraste en 114 ± 42 ml (una media del 32% del total). Desarrollaron NIC 14 pacientes (13,9%). Los predictores de NIC fueron el hematocrito (OR = 0,86; IC95%: 0,74-0,99; p = 0,04) y la fracción de eyección (OR = 0,88; IC95%: 0,82-0,95; p = 0,001). Como resultado de la utilización del sistema DyeVert, la cantidad administrada de medio de contraste fue menor, pero sin diferencias estadísticamente significativas (252 frente a 267 ml; p = 0,42). La tasa de NIC fue menor con el sistema DyeVert, pero sin alcanzar la significación estadística (14,3 frente a 16,3%; p = 1,0).
Conclusiones: El hematocrito y la fracción de eyección, más que la cantidad de contraste administrada, pueden ser predictores de NIC en los pacientes que reciben ICP. El beneficio del sistema DyeVert fue bajo.
Palabras clave: Insuficiencia renal aguda. Medios de contraste. Intervención coronaria percutánea. DyeVert.
ABSTRACT
Introduction and objectives: Contrast-induced-acute kidney injury (CI-AKI) is a potential complication of angiographic procedures. The DyeVert Contrast Reduction system (Osprey Medical, United States) is a device to reduce the concentration of contrast medium (CM) in the kidneys by decreasing the amount of CM delivered to patients. Unlike manual systems, few data are available on the DyeVert Power XT system, which is used in conjunction with automated contrast injection. The main aim of our study was to evaluate its effectiveness during percutaneous coronary interventions (PCI).
Methods: Between 2020 and 2022, 101 patients who underwent PCI with the DyeVert Power XT system (case group) were enrolled to evaluate the amount of CM saved through the use of this device, as well as the rate, severity, and predictors of CI-AKI. Patients who underwent PCI without the use of the device (control group) were enrolled to create a matched group allowing assessment of differences in CM and the CI-AKI rate.
Results: In the case group, the amount of CM saved was 114 ± 42 mL, representing an average of 32% of the total CM. Fourteen patients (13.9%) developed CI-AKI. The only independent predictors of CI-AKI were hematocrit (OR, 0.86; 95%CI, 0.74-0.99; P = .04) and ejection fraction (OR, 0.88; 95%CI, 0.82-0.95; P = .001). As a result of diversion by the device, the amount of CM delivered was lower in the case group than in controls (252 vs 267 mL; P = .42), but this difference was nonsignificant. Equally, the reduction in CI-AKI (14.3% vs 16.3%) was nonsignificant.
Conclusions: Hematocrit and ejection fraction may be more important predictors of CI-AKI than the CM volume normally used during PCI in the general population. The net practical benefit of DyeVert Power XT was low.
Keywords: Acute kidney injury. Contrast media. Percutaneous coronary intervention. DyeVert.
Abreviaturas
DRA-IC: daño renal agudo inducido por contraste. ICP: intervención coronaria percutánea. MC/VMC: medio de contraste/volumen medio de contraste.
INTRODUCCIÓN
El daño renal agudo inducido por contraste (DRA-IC) es una complicación temida tras la realización de procedimientos angiográficos diagnósticos e intervencionistas y está asociada a una mayor morbimortalidad. En un gran metanálisis realizado recientemente, la incidencia acumulada del DRA-IC tras angiografía coronaria se situó en el 12,8%, con un intervalo de confianza del 95% (IC95%) del 11,7 al 13,9% y una mortalidad asociada del 20,2% (IC95%, 10,7 al 29,7%)1. Se han identificado múltiples factores de riesgo tales como el volumen medio de contraste (VMC) empleado, la edad avanzada (> 75 años), la diabetes, la anemia, las condiciones asociadas a la hipotensión y una fracción de eyección (FE) < 40%2,3. Muchos de estos factores de riesgo están ya incluidos en la escala de Mehran2 que identifica 4 clases distintas de riesgo de nefropatía inducida por contraste (NIC) tras una intervención coronaria percutánea (ICP): riesgo bajo (≤ 5 puntos), moderado (6-10 puntos), alto (11-15 puntos) y muy alto (≥ 16 puntos). La escala de Mehran y la reciente escala de Mehran 24 asignan 1 punto por cada 100 ml de VMC hasta una dosis máxima de 299 ml. Como la depleción del volumen aumenta la concentración del MC en los túbulos renales, la principal medida preoperatoria para reducir la aparición de DRA-IC es la administración intravenosa de una solución salina normal antes y después de la intervención, puesto que otras soluciones no ofrecen beneficios5; la hidratación debe comenzar 12 horas antes y prolongarse p 24 horas tras la intervención a una velocidad de infusión de 1 o 0,5 ml/kg/h con FE < 35% o una clasificación funcional de la New York Heart Association (NYHA) > 26. Otra forma de reducir la concentración del MC en los riñones es mediante el sistema de reducción de contraste DyeVert (Osprey Medical Inc, Estados Unidos), que reduce la cantidad de VMC administrado a los pacientes durante la realización de angiografías, sin perder calidad en las imágenes, tal y como han podido comprobar revisores independientes7,8. Los sistemas DyeVert, DyeVert Plus y DyeVert Plus EZ se emplean en la inyección manual de medios de contraste y el DyeVert Power XT en la inyección automatizada; este último se ha estudiado poco, no obstante. El principal objetivo de nuestro estudio fue evaluar la eficacia del sistema DyeVert Power XT a la hora de reducir la administración de MC durante la realización de ICP.
MÉTODOS
Población del estudio
Este estudio observacional de un único centro se realizó entre pacientes tratados de ICP entre septiembre de 2020 y diciembre de 2022 con el sistema DyeVert Power XT (grupo de casos) y entre aquellos tratados de ICP durante un periodo similar sin el uso del dispositivo (grupo de control).
Los criterios de inclusión para ambos grupos fueron: insuficiencia renal crónica (IRA) [tasa de filtración glomerular estimada (TFGe) < 60 ml/min/m²] o necesidad de una ICP compleja con probabilidad de recibir grandes cantidades de MC, cirugía de revascularización coronaria (CABG) previa, oclusión coronaria total crónica (OTC) (bloqueo completo de una coronaria durante de, como mínimo, 3 meses de evolución), bifurcación y enfermedad de tronco común izquierdo o multivaso (con compromiso de 2 vasos como mínimo).
El criterio de exclusión para los 2 grupos fue la presencia de enfermedad renal terminal a diálisis. Se recopilaron las variables de laboratorio, instrumentales, clínicas y de la intervención tanto en el grupo de casos como en el de control. Las definiciones de todas estas variables se detallan en la tabla 1, tabla 2, tabla 3 y tabla 4. Para las variables incluidas en la escala de Mehran, se emplearon las mismas descripciones que las empleadas en dicha escala. La TFGe se calculó con la ecuación de 4 variables basada en la Modificación de la Dieta en la Enfermedad Renal (MDRD), la FE del ventrículo izquierdo mediante ecocardiografía bidimensional durante la hospitalización y previo a la entrada en la sala de hemodinámica y el riesgo de cualquier NIC tras la ICP según puntuación obtenida en la escala de Mehran. El manejo de la bifurcación/tronco común izquierdo (con un único/doble stent) se llevó a cabo con la técnica de optimización proximal (POT) con inflado de kissing balloon y, finalmente, re-POT en todos los casos. El VMC total es el volumen que se habría administrado si no se hubiese empleado el DyeVert, es decir, la suma del VMC administrado a los pacientes y el VMC ahorrado por el DyeVert. La velocidad de infusión del MC fue de 4 y 3 ml/segundos para las coronarias izquierda y derecha, respectivamente.
Tabla 1. Características de laboratorio, instrumentales, clínicas y puntuación obtenida en la escala de Mehran en la población general y según la incidencia del DRA-IC en el grupo de casos
| Características | Población total (n = 101) |
Sin DRA-IC (n = 87) |
Con DRA-IC (n = 14) |
p |
|---|---|---|---|---|
| Características de laboratorio e instrumentales | ||||
| TFGe, ml/min | 51 ± 18 | 52 ± 19 | 45 ± 16 | 0,18 |
| HCT | 38,6 ± 4,9 | 39,1 ± 4,8 | 35,5 ± 4,8 | 0,01* |
| FE | 50 [35-55] | 50 [40-55] | 30 [28-36] | < 0,001* |
| IRA [TFGe < 60 ml/min/1,73 m2] | 73 (72,3) | 63 (72,4) | 10 (71,4) | 0,1 |
| Anemia [HCT < 39% en varones y < 36% en mujeres] | 48 (47,5) | 38 (43,7) | 10 (71,4) | 0,10 |
| Características clínicas | ||||
| Edad, años | 74 (68-80) | 73 (67-80) | 75 (74-81) | 0,09 |
| Edad > 75 años | 39 (38,6) | 32 (36,8) | 7 (50) | 0,52 |
| Sexo varón | 80 (79,2) | 68 (78,2) | 12 (85,7) | 0,73 |
| Sobrepeso [índice de masa corporal ≥ 25] | 52 (51,5) | 46 (52,9) | 6 (42,9) | 0,68 |
| Hipertensión | 78 (77,2) | 70 (80,5) | 8 (57,1) | 0,08 |
| Diabetes | 48 (47,5) | 40 (46) | 8 (57,1) | 0,62 |
| Dislipemia | 68 (67,3) | 57 (66) | 11 (79) | 0,51 |
| Fumador actual | 24 (23,8) | 20 (23) | 4 (28,6) | 0,74 |
| Exfumador | 35 (34,7) | 32 (36,8) | 3 (21,4) | 0,37 |
| ICC [clase funcional NYHA ≥ 3 y/o antecedentes de edema pulmonar] | 37 (36,6) | 25 (28,7) | 12 (85,7) | < 0,001* |
| Síndrome coronario agudo en la presentación | 38 (37,6) | 31 (35,6) | 7 (50) | 0,46 |
| Hipotensión [presión arterial sistólica < 80 mmHg durante ≥ 1 h con necesidad de tratamiento inotrópico] | 4 (4) | 2 (2,3) | 2 (14,3) | 0,09 |
| Puntación obtenida en la escala de Mehran | ||||
| Clase de riesgo DRA-IC según la escala de Mehran: | ||||
| Bajo | 24 (23,8) | 24 (27,6) | 0 (0) | 0,04* |
| Moderado | 26 (25,7) | 24 (27,6) | 2 (14,3) | 0,51 |
| Alto | 34 (33,7) | 29 (33,3) | 5 (35,7) | 0,1 |
| Muy alto | 17 (16,8) | 10 (11,5) | 7 (50) | 0,002* |
| Puntuación obtenida en la escala de Mehran, puntos | 11 ± 5 | 10 ± 5 | 15 ± 4 | < 0,001* |
|
Los datos expresan n (%), media ± desviación estándar o mediana [primer cuartil-tercer cuartil]. * Valores p significativos a nivel estadístico (p < 0,05). DRA-IC: daño renal agudo inducido por contraste; FE: fracción de eyección; HCT: hematocrito; NYHA: New York Heart Association; ICC: insuficiencia cardiaca congestiva; IRA: insuficiencia renal aguda; TFGe: tasa de filtración glomerular estimada. |
||||
Tabla 2. Características de la intervención en la población general y según la incidencia del DRA-en el grupo de casos
| Características | Población general (n = 101) |
Sin DRA-IC (n = 87) |
CI-AKI (n = 14) |
p |
|---|---|---|---|---|
| Características de la intervención (complejidad angiografía/ICP/complicaciones) | ||||
| CABG previa | 20 (19,8) | 18 (20,7) | 2 (14,3) | 0,73 |
| OTC [obstrucción completa de 1 coronaria de, como mínimo, 3 meses de evolución] | 12 (11,9) | 11 (12,6) | 1 (7,1) | 1 |
| Nº de vasos tratados en la misma intervención: | ||||
| 1 | 57 (56,4) | 52 (59,8) | 5 (35,7) | 0,09 |
| 2 | 40 (39,6) | 32 (36,8) | 8 (57,1) | 0,15 |
| 3 | 4 (4) | 3 (3,4) | 1 (7,1) | 0,45 |
| Nº de bifurcaciones tratadas en la misma intervención: | ||||
| 0 | 67 (66,3) | 58 (66,7) | 9 (64,3) | 1 |
| 1 | 31 (30,7) | 27 (31) | 4 (28,6) | 1 |
| 2 | 3 (3) | 2 (2,3) | 1 (7,1) | 0,36 |
| Tratamiento del tronco común izquierdo | 25 (24,8) | 20 (23) | 5 (35,7) | 0,33 |
| Nº de stents | 2 [1-3] | 2 [1-3] | 2 [1-3] | 0,75 |
| Longitud de los stent, mm | 52 [31-88] | 51 [30-91] | 57 [36-73] | 0,95 |
| Perforación | 3 (3) | 3 (3,4) | 0 (0) | 1 |
| Uso del BCIA | 1 (1) | 0 (0) | 1 (7,1) | 0,14 |
| Uso de Rotablator | 3 (3) | 1 (1,1) | 2 (14,3) | 0,05 |
| Otras características de la intervención | ||||
| Abordaje radial | 88 (87,1) | 75 (86,2) | 13 (92,9) | 0,69 |
| Abordaje femoral | 27 (26,7) | 21 (24,1) | 6 (42,9) | 0,19 |
| Operador | ||||
| L | 52 (51,5) | 47 (54) | 5 (35,7) | 0,20 |
| A | 30 (29,7) | 26 (29,9) | 4 (28,6) | 1 |
| B | 4 (4) | 3 (3,4) | 1 (7,1) | 0,46 |
| V | 13 (12,9) | 10 (11,5) | 3 (21,4) | 0,38 |
| S | 2 (1,9) | 1 (1,1) | 1 (7,1) | 0,26 |
| Tipo de medio de contraste: | ||||
| Iomeprol 350 | 9 (8,9) | 7 (8) | 2 (14,3) | 0,61 |
| Iohexol 350 | 13 (12,9) | 11 (12,6) | 2 (14,3) | 1 |
| Iodixanol 320 | 79 (78,2) | 69 (79,3) | 10 (71,4) | 0,50 |
| Dosis de medio de contraste administrado, ml | 242 [189-300] | 240 [188-306] | 258 [195-277] | 0,95 |
| Dosis total de medio de contraste [administrado + ahorrado], ml | 355 ± 110 | 354 ± 79 | 356 ± 106 | 0,95 |
| Uso de IVUS | 24 (23,8) | 23 (26,4) | 1 (7,1) | 0,18 |
|
Los datos expresan n (%), media ± desviación estándar o mediana [primer cuartil-tercer cuartil]. BCIA: balón de contrapulsación intra-aórtico; CABG: cirugía de revascularización coronaria; DRA-IC: daño renal agudo inducido por contraste; IVUS: ecocardiografía intravascular; OTC: oclusión coronaria total crónica. |
||||
Tabla 3. Características de laboratorio, instrumentales, clínicas y puntuación obtenida en la escala de Mehran de casos y controles en el grupo emparejado
| Características | Sin DyeVert (n = 49) |
Con DyeVert (n = 49) |
p | Diferencia media estandarizada |
|---|---|---|---|---|
| Características de laboratorio e instrumentales | ||||
| TFGe, ml/min | 53 ± 18 | 51 ± 18 | 0,70 | 0,11 |
| HCT | 37,8 ± 4,1 | 38,2 ± 4,9 | 0,68 | 0,08 |
| FE | 50 [40-55] | 50 [35-55] | 0,68 | 0,13 |
| IRA [TFGe < 60 ml/min/1,73 m2] | 36 (73,5) | 34 (69,4) | 0,82 | 0,09 |
| Anemia [HCT < 39 en varones y < 36 en mujeres] | 27 (55,1) | 24 (49) | 0,69 | 0,12 |
| Características clínicas | ||||
| Edad, años | 75 ± 9 | 75 ± 9 | 0,96 | 0,01 |
| Edad > 75 años | 26 (53,1) | 24 (49) | 0,84 | 0,08 |
| Sexo varón | 38 (77,6) | 41 (83,7) | 0,61 | 0,15 |
| Sobrepeso [índice de masa corporal ≥ 25] | 22 (44,9) | 24 (49) | 0,84 | 0,08 |
| Hipertensión | 33 (67,3) | 37 (75,5) | 0,50 | 0,19 |
| Diabetes | 19 (38,8) | 20 (40,8) | 0,1 | 0,04 |
| Dislipemia | 28 (57,1) | 32 (65,3) | 0,53 | 0,17 |
| Fumador actual | 11 (22,4) | 10 (20,4) | 0,1 | 0,05 |
| Exfumador | 16 (32,7) | 18 (36,7) | 0,83 | 0,09 |
| ICC [clase funcional NYHA ≥ 3 y/o antecedentes de edema pulmonar] | 15 (30,6) | 15 (30,6) | 0,1 | < 0,01 |
| Presentación de síndrome coronario agudo | 27 (55,1) | 25 (51) | 0,84 | 0,08 |
| Hipotensión [presión sistólica < 80 mmHg durante ≥ 1 h con necesidad de tratamiento inotrópico] | 2 (4,1) | 2 (4,1) | 0,1 | < 0,01 |
| Puntuación obtenida en la escala de Mehran | ||||
| Clase de riesgo DRA-IC según la escala de Mehran: | ||||
| Bajo | 12 (24,5) | 10 (20,4) | 0,63 | 0,09 |
| Moderado | 12 (24,5) | 15 (30,6) | 0,50 | 0,14 |
| Alto | 13 (26,5) | 15 (30,6) | 0,65 | 0,09 |
| Muy alta | 12 (24,5) | 9 (18,4) | 0,46 | 0,16 |
| Puntuación obtenida en la escala de Mehran, puntos | 11 ± 6 | 11 ± 6 | 0,86 | 0,04 |
|
Los datos expresan n (%), media ± desviación estándar o mediana [primer cuartil-tercer cuartil]. DRA-IC: daño renal agudo inducido por contraste; FE: fracción de eyección; HCT: hematocrito; ICC: insuficiencia cardiaca congestiva; IRA: insuficiencia renal aguda; NYHA: New York Heart Association; TFGe: tasa de filtración glomerular estimada. |
||||
Tabla 4. Características de la intervención de casos y controles en el grupo emparejado
| Características | Sin DyeVert (n = 49) |
Con DyeVert (n = 49) |
p | Diferencia media estandarizada |
|---|---|---|---|---|
| Características de la intervención (complejidad angiografía/ICP/complicaciones) | ||||
| CABG previa | 8 (16,3) | 6 (12,2) | 0,56 | 0,10 |
| OTC [obstrucción completa de 1 coronaria de, como mínimo, 3 meses de evolución] | 6 (12,2) | 8 (16,3) | 0,77 | 0,13 |
| Nº de vasos tratados en la misma intervención: | ||||
| 1 | 32 (65,3) | 29 (59,2) | 0,53 | 0,12 |
| 2 | 15 (30,6) | 17 (34,7) | 0,67 | 0,08 |
| 3 | 2 (4,1) | 3 (6,1) | 0,1 | 0,10 |
| Nº bifurcaciones tratadas en la misma intervención: | ||||
| 0 | 33 (67,3) | 31 (63,3) | 0,67 | 0,09 |
| 1 | 15 (30,6) | 16 (32,7) | 0,83 | 0,04 |
| 2 | 1 (2,1) | 2 (4) | 0,1 | 0,12 |
| Tratamiento del tronco común izquierdo | 12 (24,5) | 13 (26,5) | 0,1 | 0,05 |
| Nº de stents | 2 [1-3] | 2 [1-3] | 0,30 | 0,15 |
| Longitud de los stents, mm | 46 [30-85] | 52 [33-97] | 0,41 | 0,13 |
| Perforación | 2 (4,1) | 1 (2) | 0,1 | 0,12 |
| Uso de BCIA | 0 (0) | 1 (2) | 0,1 | 0,20 |
| Uso de Rotablator | 0 (0) | 2 (4,1) | 0,49 | 0,24 |
| Características de la intervención (otras) | ||||
| Abordaje radial | 41 (83,7) | 45 (91,8) | 0,35 | 0,24 |
| Abordaje femoral | 11 (22,4) | 15 (30,6) | 0,49 | 0,18 |
| Operador: | ||||
| L | 24 (49) | 24 (49) | 0,1 | < 0,01 |
| A | 17 (34,7) | 17 (34,7) | 0,1 | < 0,01 |
| B | 5 (10,2) | 3 (6,1) | 0,71 | 0,20 |
| V | 3 (6,1) | 5 (10,2) | 0,71 | 0,12 |
| Tipo de medio de contraste: | ||||
| Iomeprol 350 | 7 (14,3) | 4 (8,2) | 0,34 | 0,21 |
| Iohexol 350 | 9 (18,4) | 10 (20,4) | 0,80 | 0,06 |
| Iodixanol 320 | 33 (67,3) | 35 (71,4) | 0,66 | 0,10 |
| Uso de IVUS | 10 (20,4) | 11 (22,4) | 0,1 | 0,05 |
|
Los datos expresan n (%), media ± desviación estándar o mediana [primer cuartil-tercer cuartil]. BCIA: balón de contrapulsación intra-aórtico; CABG: cirugía de revascularización coronaria; DRA-IC: daño renal agudo inducido por contraste; IVUS: ecocardiografía intravascular; OTC: oclusión coronaria total crónica. |
||||
La calidad de las imágenes se evaluó por los operadores durante las intervenciones. Cuando la calidad de estas no era la adecuada, se permitió la exclusión del dispositivo de la línea del MC durante el menor tiempo posible.
El DRA se definió como una subida de los niveles de creatinina sérica ≥ 0,3 mg/dl dentro de las 48 horas posteriores a la administración del MC con respecto a los valores basales obtenidos antes de la inyección del MC. Se tomaron nuevas mediciones a las 48 horas en aquellos pacientes con empeoramiento de la función renal; para su prevención, se hidrató a todos los pacientes con una solución intravenosa de cloruro de sodio al 0,9% a una velocidad de infusión de 1 o 0,5 ml/kg/h, según corresponda. La gravedad del DRA se definió según las fases establecidas por el grupo de consenso Kidney Disease: Improving Global Outcome (KDIGO).
La presente investigación se realizó en cumplimiento de las recomendaciones en materia de investigación clínica (Declaración de Helsinki de la Asociación Médica Mundial, octubre de 2013) y fue aprobada por un comité de ética. Se obtuvo el consentimiento informado correspondiente de todos los participantes que está disponible para su consulta.
Objetivos
En el grupo de casos, se valoraron los siguientes parámetros: a) la cantidad de VMC ahorrado con el uso del DyeVert y la calidad de las imágenes; b) la tasa y gravedad del DRA-IC, así como la tasa intrahospitalaria de mortalidad por cualquier causa; c) las diferencias de laboratorio, instrumentales, clínicas y de la intervención en los 2 subgrupos definidos según la incidencia del DRA y d) los predictores independientes de DRA-IC.
En la población general de los grupos de casos y control, se realizó un estudio de emparejamiento por puntuación de propensión (EPP) para obtener un grupo de pacientes lo bastante equilibrado (grupo emparejado), en el cual se evaluaron: a) las diferencias en el VMC y b) la tasa y gravedad del DRA-IC.
Análisis estadístico
Las variables categóricas se expresaron como el número y el porcentaje de pacientes, los datos continuos paramétricos como media ± desviación estándar y los continuos no paramétricos como mediana [cuartil inferior y superior]; para evaluar la normalidad, se utilizó la prueba de Kolmogorov. Las variables categóricas de los pacientes se compararon con la prueba de X2 (con corrección de Yates a efectos de continuidad en el caso de variables con solo 2 categorías) o la prueba exacta de Fisher, según corresponda. Se empleó la prueba t de Student no emparejada para las variables continuas paramétricas y la prueba U de Mann-Whitney para las variables continuas no paramétricas; en el grupo emparejado se utilizaron las mismas pruebas. En el análisis univariado, los valores p < 0,05 se consideraron significativos a nivel estadístico. Para establecer los predictores independientes del DRA, se realizó un análisis de regresión logística multivariado. Las variables se seleccionaron según su significación en el análisis univariado. El método elegido fue la eliminación de variables hacia atrás de 20 iteraciones. La multicolinealidad se evaluó empleando valores de tolerancia y el factor de inflación de la varianza (FIV). Se empleó el área bajo la curva (AUC) receiver operating characteristic (ROC) para establecer los valores de corte óptimos de los predictores independientes para el diagnóstico del DRA. Para realizar el EPP, el algoritmo empleado fue la proporción 1:1 usando la técnica del vecino más próximo con un calibrador de tamaño ± 0,2. Los análisis estadísticos se realizaron utilizando el paquete de software estadístico SPSS para Windows, versión 29, con la implementación de R 4.2 para la realización del EPP.
RESULTADOS
Análisis en el grupo de casos
Se trató de ICP con el sistema DyeVert Power XT a un total de 101 pacientes (media de edad de 74 [68-80] años; varones, el 79.2%; IRA = 72,3%) .
En la población general del grupo de casos, los valores medios del hematocrito (HCT) fueron de 38,6 ± 4,9%, la mediana de la FE = 50% [35-55%] y la puntuación media obtenida en la escala de Mehran, 11 ± 5 puntos.
Se estableció la presencia de insuficiencia cardiaca congestiva (ICC), la categoría de riesgo muy alto del DRA-IC de Mehran y la categoría de riesgo bajo del DRA-IC en la escala de Mehran en 37 (36,6%), 17 (16,8%) y 24 pacientes (23,8%), respectivamente (tabla 1).
Se inscribió a un total de 20 pacientes (19,8%) con CABG previa, 12 (11,9%) de los cuales presentaban OTC, 34 (33,7%) bifurcaciones, 25 (24.8%) enfermedad de tronco común izquierdo y 44 (43.6%) enfermedad multivaso. El VMC administrado fue 242 ml (189-300), el VMC total, 355 ± 110 ml y el VMC ahorrado, 114 ± 42 ml, con una media de VMC total del 32% (tabla 2). En casi todos los pacientes (n = 96, el 95% de los pacientes), la calidad de las imágenes fue adecuada, si bien se excluyó el dispositivo para que esta fuese adecuada durante el menor tiempo posible en 5 pacientes. Sin estas exclusiones, el VMC ahorrado habría sido algo mayor y con cambios sin importancia en la comparativa con los controles: el 33% del total, un valor derivado de pacientes sin exclusiones (n = 96).
Catorce pacientes (13,9%) desarrollaron DRA-IC (AKI-KDIGO 1, 2, 3: 6,9, 3 y 4%, respectivamente). Los resultados del análisis univariado para la población general y según la incidencia del DRA-IC en el grupo de casos se detallan en la tabla 1, tabla 2 y figura 1.
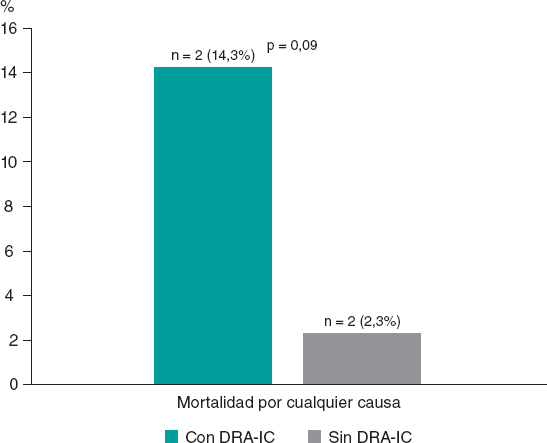
Figura 1. Tasa de mortalidad intrahospitalaria por cualquier causa en función de la aparición del DRA-IC en el grupo de casos. DRA-IC: daño renal agudo inducido por contraste.
Comparado con los que no desarrollaron DRA-IC, los pacientes del subgrupo DRA-IC presentaban valores de HCT más bajos (35,5 ± 4,8 frente a 39,1 ± 4,8; p = 0,01), una FE más baja (30 [28-36] frente a 50 [40-55]; p < 0,001) y una puntuación media en la escala de Mehran más alta (15 ± 4 frente a 10 ± 5; p < 0,001).
Además, los primeros solían presentar más habitualmente ICC [12 (85,7%) frente a 25 (28,7%); p < 0,001] y una categoría de riesgo muy alto de DRA-IC en la escala de Mehran (7 [50%] frente a 10 [11,5%], p = 0,02) y con menor frecuencia, una categoría de riesgo bajo de DRA-IC en la escala de Mehran [0 (0%) frente a 24 (27,6%); p = 0,04].
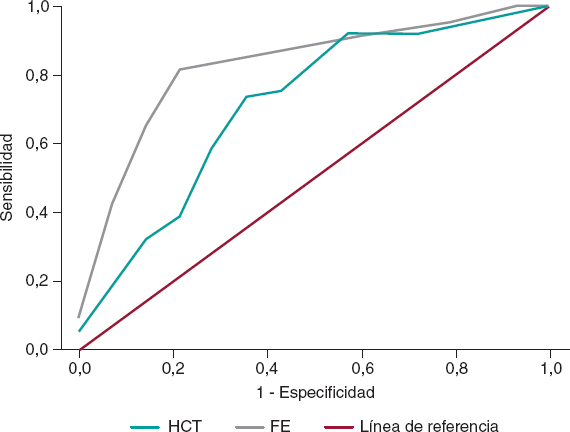
No se encontraron diferencias significativas en las demás características de laboratorio, instrumentales o clínicas, así como tampoco en las variables de la intervención entre los 2 subgrupos; en concreto, el MC fue algo mayor en los pacientes con DRA-IC: 258 [195-277] frente a 240 ml [188-306]; total, 356 ± 106 frente a 354 ± 79 ml; p = 0,95 para las 2 variables administradas. En los análisis multivariables, los predictores independientes de DRA-IC fueron el HCT (OR = 0,86, IC95%, 0,74-0,99; p = 0,04) y la FE (OR = 0,88, IC95%, 0,82-0,95; p = 0,001); la precisión porcentual en la clasificación del modelo fue del 88% y los valores de tolerancia y FIV (0,99 y 1,01, respectivamente) no mostraron multicolinealidad. La curva ROC del HCT arrojó los siguientes valores: un área bajo la curva (AUC) de 0,71 y un IC95% de 0,56-0,87; p = 0,01; el valor de corte del 36,3% fue el que mejor sensibilidad (72%) y especificidad (71%) tuvo para el resultado final (figura 2). La curva ROC de la FE arrojó los siguientes valores: un AUC de 0,83 con un IC95% de 0,72-0,94; p = 0,001; aquí el valor de corte del 37% fue el que mejor sensibilidad (82%) y especificidad (79%) tuvo (figura 2); por lo tanto, nuestro mejor predictor fue una FE < 40%.
Figura 2. Las curvas ROC muestran la capacidad diagnóstica del HCT y la FE a la hora de diagnosticar el DRA-IC en el grupo de casos. DRA-IC: daño renal agudo inducido por contraste; FE: fracción de eyección; HCT: hematocrito.
En total, hubo 4 muertes intrahospitalarias por cualquier causa, 2 en cada subgrupo (subgrupos con y sin DRA-IC) tal y como se detalla en la figura 1.
Análisis en el grupo emparejado
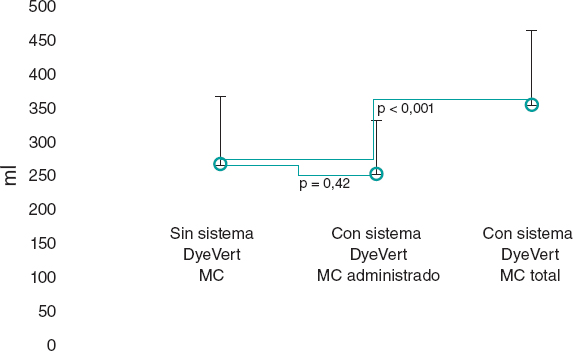
Tras el proceso de emparejamiento, quedaron 49 pacientes en los grupos de control (sin DyeVert) y casos (con DyeVert) sin un desequilibrio significativo (es decir, con diferencias medias estandarizadas < ± 0,25) tal y como se observa en la tabla 3 y tabla 4. La figura 3, por su parte, revela que la cantidad de MC administrado fue algo menor en el grupo con el sistema DyeVert que en el grupo sin el DyeVert, aunque no fue una diferencia significativa (252 ± 80 frente a 267 ± 101 ml; p = 0,42), por su parte, el VMC total fue mucho mayor en el grupo con el sistema DyeVert (354 ± 110 frente a 267 ± 101 ml; p < 0,001). La incidencia del DRA-IC fue algo menor en el grupo de casos que en el de control (14,3 frente al 16,3%; p = 0,99) con etapas algo más avanzadas de DRA en los controles (tabla 1 del material adicional), no obstante, sin significación estadística.
Figura 3. Medio de contraste empleado en casos y controles en el grupo emparejado. MC: medio de contraste; los puntos azules representan los valores medios y las líneas verticales negras las desviaciones estándar.
DISCUSIÓN
En el grupo de casos, el sistema DyeVert Power XT ahorró un 32% de MC y la calidad de las imágenes fue la adecuada en casi todos los casos; los únicos predictores independientes del DRA-IC fueron el HCT y la FE.
En el grupo emparejado, la cantidad total de MC fue mayor en los casos que en los controles. Tras la desviación provocada por el dispositivo, la cantidad de MC administrada fue algo menor en los casos que en los controles, aunque carente de significación estadística. La menor incidencia del DRA-IC tampoco fue significativa.
El sistema DyeVert es un dispositivo de segunda generación diseñado para reducir la cantidad de MC administrado a los pacientes durante la realización de angiografías. La primera generación fue el sistema AVERT (Osprey Medical Inc), que confirmó un descenso relativo del VMC en torno al 23% en pacientes tratados de ICP frente a los controles. No obstante, el uso de este dispositivo no redujo la incidencia del DRA9. Aunque el DyeVert Power XT se usa con inyecciones automáticas, son pocos los datos que existen a este respecto, tan solo 2 estudios de 2610 y 9 pacientes, respectivamente, sin grupo de control. Se tienen más datos sobre las inyecciones manuales (1.696 pacientes en 15 estudios). Los 17 estudios se analizaron colectivamente en un metanálisis realizado por Tarantini et al.12
En ese metanálisis, el ahorro medio de VMC en el grupo con el sistema DyeVert fue informado por 7 estudios observacionales situándose entre el 34 y el 47% del VMC total; el valor estimado conjunto fue del 39,5% con los sistemas de inyección manual de MC; se debe mencionar que el valor más bajo (34%) se obtuvo con el sistema DyeVert Power XT. Se halló un valor similar en el grupo de casos con el sistema DyeVert. Estos valores más bajos que los de los sistemas manuales podrían estar asociados a las diferentes presiones generadas durante la inyección automática de contraste.
En nuestro análisis del grupo de casos, el VMC no se correlacionó de manera significativa con la aparición del DRA-IC que, en cambio, sí fue anticipada por los valores más bajos de HCT y de la FE, los cuales son factores de riesgo conocidos, tal y como confirman las puntuaciones obtenidas en la escala de Mehran2,4. La FE también fue un predictor independiente en el estudio de Briguori et al.13 Nuestros hallazgos confirman la importancia de identificar primero las variables (por ejemplo, las puntuaciones obtenidas en las escalas de Mehran o Mehran 2)2,4 que clasifican a aquellos pacientes de mayor riesgo de desarrollar DRA-IC para aplicar las estrategias preventivas adecuadas. En el presente estudio, estos pacientes fueron identificados por el HCT y la FE razón por la cual estas variables, sobre todo la FE, podrían ser predictores más importantes que el VMC que suele emplearse durante una ICP en la población general. En las puntuaciones citadas anteriormente, el VMC fue, también, un predictor independiente del DRA-IC razón por la cual seguir usando el valor más bajo posible de VMC sigue siendo importante, sobre todo, en pacientes de mayor riesgo. Comparado con los controles, el sistema DyeVert reduce, potencialmente, la NIC dependiendo de su eficacia, algo que se estudió tanto en el metaanálisis mencionado anteriormente como en el presente estudio.
En el metaanálisis, aproximadamente la mitad de los estudios incluyeron controles a efectos comparativos. Por regla general, el MC administrado fue menor en los pacientes en quienes se usó el sistema DyeVert que en los controles. En estos casos, la diferencia estuvo entre 22 y 50 ml12 siendo las diferencias más altas descritas por los estudios de Tajti et al. (200 [153-256] frente a 250 [170-303] ml; p = 0,04) y Briguori et al. (99 ± 50 frente a 130 ± 50 ml; p < 0,001)13,14. El VMC administrado solo fue algo mayor (diferencia de 2 ml) en el grupo con el sistema DyeVert en el estudio de Bunney et al.15 El análisis conjunto mostró un descenso significativo del VMC administrado con el uso de DyeVert comparado con el grupo de control. Se debe mencionar que los detalles sobre CABG previas, OTC y tratamiento del tronco común izquierdo solo se informaron en un trabajo14 y el número de vasos tratados, en otro13. El tratamiento de bifurcaciones y los diferentes operadores no se informaron. Todas estas características de la intervención que podrían influir en la cantidad de MC administrado durante una ICP sí se incluyeron en nuestro estudio, en el que empleamos un grupo emparejado bien equilibrado en las características estudiadas.
En nuestro grupo emparejado, se administró menos MC en el grupo de casos que en el de control, aunque esta diferencia fue mínima y no significativa; por otro lado, el MC total (también denominado «intentado» en el metanálisis) administrado fue mucho mayor en el grupo de casos que en el de control. En este sentido, el beneficio neto práctico del dispositivo en términos de MC ahorrado fue bajo. En nuestro trabajo, las características de la intervención tales como la complejidad de esta que podrían provocar discrepancias en las inyecciones del MC estuvieron equilibradas en el grupo emparejado. Según estos hallazgos, creemos que el grupo de control requirió inyecciones de contraste más prolongadas o más inyecciones de contraste (y, en consecuencia, más MC total) para lograr imágenes de buena calidad. En estudios anteriores, se logró una buena calidad de imagen con el DyeVert en el 98% de los casos12, un valor similar al nuestro. No obstante, esos estudios no abordaron la necesidad de realizar inyecciones prolongadas y más MC total, comparado con los controles, para mantener una buena calidad de imagen cuando se emplea el sistema DyeVert. Hay pocos datos disponibles sobre el MC total, aun así, estudios publicados sobre esta cuestión indican que el MC total fue mayor en aquellos pacientes en quienes se usó el sistema DyeVert que en los controles (Briguori et al., valor de p casi significativo; Kutschman et al., valor de p no informado)12,13,16.
El descenso en la incidencia del DRA-IC del presente estudio no fue significativo a nivel estadístico. En el metanálisis, el riesgo relativo conjunto de DRA-IC asociado al uso del sistema DyeVert fue de 0,60 (IC95%, 0,40-0,90; p = 0.01), tal y como informaron los resultados de 5 estudios. Además, en un resumen reciente que no se incluyó en el metanálisis, los valores posoperatorios de TFGe de pacientes tratados de coronariografía o angiografía periférica fueron mucho más estables en el grupo con el sistema DyeVert que en los controles17.
El análisis de los 5 estudios mencionados anteriormente por separado reveló que, a nivel general, nuestros resultados son coincidente; de hecho, el riesgo relativo fue mucho menor en solo 1 estudio del análisis no conjunto13.
El tipo de MC administrado no se asoció a la aparición de DRA-IC; tal y como se recomienda18, se emplearon agentes de contraste iso-osmolares (iodixanol 320) o de baja osmolaridad (iomeprol 350 o iohexol 350) para evitar la NIC. Ante la presencia de evidencias más favorables19, preferimos utilizar el agente isoosmolar y reservar los otros agentes para pacientes de bajo riesgo.
Limitaciones del estudio
Nuestro estudio presenta algunas limitaciones. En primer lugar, el tamaño de la muestra fue relativamente pequeño. En segundo lugar, el diseño del estudio fue de un único centro, observacional y retrospectivo, aunque se realizó un emparejamiento por puntuación de propensión (EPP) para minimizar los posibles sesgos de confusión. En tercer lugar, se excluyó a todos aquellos pacientes que no cumplieron los criterios de inclusión que eran, por lo general, de riesgo bajo de desarrollar DRA-IC. En este sentido, nuestros resultados han de extrapolarse con cautela ya que los pacientes analizados podrían no ser representativos de la población general. En este trabajo, la variable de sexo no se tuvo en cuenta según de las guías SAGER.
CONCLUSIONES
El sistema DyeVert Power XT ahorró un 32% de MC, pero solo el HCT y la FE fueron predictores independientes del DRA-IC; la FE < 40% fue el principal predictor. En este sentido, estas variables, sobre todo la FE, podrían ser más importantes que el VMC que suele usarse durante la ICP en la población general.
Con este sistema la ICP requirió más VMC que en los controles para lograr una calidad de imagen adecuada. En este sentido, después de que el dispositivo ahorrara MC, la cantidad de MC administrado fue solo ligeramente inferior que el MC administrado en los controles (diferencia media de 15 ml), una diferencia que no fue significativa a nivel estadístico. Así pués, el beneficio práctico neto del sistema fue bajo. La menor incidencia del DRA-IC descrita (del 14,3 frente al 16,3%) tampoco fue significativa a nivel estadístico.
Se necesitan estudios futuros que nos ayuden a confirmar estos resultados.
FINANCIACIÓN
Ninguna.
RESPONSABILIDADES ÉTICAS
El trabajo ha sido aprobado por un Comité de Ética/Centro. Se obtuvo y archivó el consentimiento informado previo de los pacientes para la publicación de sus casos. En este trabajo, la variable del sexo no se ha tenido en cuenta de acuerdo con las guías SAGER.
DECLARACIÓN SOBRE EL USO DE INTELIGENCIA ARTIFICIAL
No se empleó ningún sistema de inteligencia artificial para la realización de nuestro estudio.
CONTRIBUCIÓN DE LOS AUTORES
F. Vergni, M. Arioti y M. Leoncini contribuyeron al diseño del estidio. F. Vergni, M. Arioti, V. Boasi, F.A. Sánchez, M. Leoncini y F. Ferrari colaboraron en la recogida de datos. F. Vergni analizó los datos. F. Vergni, M. Arioti, V. Boasi, F.A. Sánchez, M. Leoncini y F. Ferrari contribuyeron a la interpretación de los mismos. F. Vergni y M. Arioti contribuyeron a la redacción del trabaj y, por último, F. Vergni, M. Arioti, V. Boasi, F.A. Sánchez, M. Leoncini y F. Ferrari revisaron el trabajo y aprobaron su versión final a efectos de publicación.
CONFLICTO DE INTERESES
Ninguno.
¿QUÉ SE SABE DEL TEMA?
- El sistema DyeVert Power XT (que se emplea junto a la inyección automática de contraste) solo se ha evaluado en otros 2 estudios en un total de 35 pacientes analizados sin grupo de control y no durante la realización de una ICP.
¿QUÉ APORTA DE NUEVO?
- Nuestro estudio investigó el dispositivo en una población más grande (n = 101) y durante la realización de una ICP. Además, se incluyó a un grupo de control y se empleó un análisis de emparejamiento por puntuación de propensión para obtener un grupo de pacientes lo bastante equilibrado respecto a las características de laboratorio, instrumentales, clínicas y de la intervención; además, entre estas últimas, se incluyó el tratamiento de bifurcaciones coronarias y las diferencias entre operadores, que no fueron informados en estudios previos. Todas estas características podrían influir en los resultados (la ocurrencia de DRA-IC) o el VMC administrado, razón por la cual su inclusión es importante a la hora de valorar el uso de un dispositivo para ahorrar MC.
BIBLIOGRAFíA
1. Lun Z, Liu L, Chen G, et al. The global incidence and mortality of contrast-associated acute kidney injury following coronary angiography:a meta-analysis of 1.2 million patients. J Nephrol. 2021;34:1479-1489.
2. Mehran R, Aymong ED, Nikolsky E, et al. A simple risk score for prediction of contrast-induced nephropathy after percutaneous coronary intervention:development and initial validation. J Am Coll Cardiol. 2004;44:1393-1399.
3. Azzalini L, Spagnoli V, Ly HQ. Contrast-induced nephropathy:from pathophysiology to preventive strategies. Can J Cardiol. 2016;32:247-255.
4. Mehran R, Owen R, Chiarito M, et al. A contemporary simple risk score for prediction of contrast-associated acute kidney injury after percutaneous coronary intervention:derivation and validation from an observational registry. Lancet. 2021;398:1974-1983.
5. Almendarez M, Gurm HS, Mariani J Jr, et al. Procedural strategies to reduce the incidence of contrast-induced acute kidney injury during percutaneous coronary intervention. JACC Cardiovasc Interv. 2019;12:1877-1888.
6. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
7. Desch S, Fuernau G, Pöss J, et al. Impact of a novel contrast reduction system on contrast savings in coronary angiography –the DyeVert randomised controlled trial. Int J Cardiol. 2018;257:50-53.
8. Zimin VN, Jones MR, Richmond IT, et al. A feasibility study of the DyeVerttm plus contrast reduction system to reduce contrast media volumes in percutaneous coronary procedures using optical coherence tomography. Cardiovasc Revasc Med. 2021;30:40-46.
9. Mehran R, Faggioni M, Chandrasekhar J, et al. Effect of a contrast modulation system on contrast media use and the rate of acute kidney injury after coronary angiography. JACC Cardiovasc Interv. 2018;11:1601-1610.
10. Amoroso G, Christian J, Christopher A. First European experience using a novel contrast reduction system during coronary angiography with automated contrast injection. [Abstract]. Eurointervention. 2020;16(Suppl. AC):Euro20A-POS426.
11. Bruno RR, Nia AM, Wolff G, et al. Early clinical experiences with a novel contrast volume reduction system during invasive coronary angiography. Int J Cardiol Heart Vasc. 2019;23:100377.
12. Tarantini G, Prasad A, Rathore S, et al. DyeVert Contrast Reduction System Use in Patients Undergoing Coronary and/or Peripheral Angiography:A Systematic Literature Review and Meta-Analysis. Front Med (Lausanne). 2022;9:841876.
13. Briguori C, Golino M, Porchetta N, et al. Impact of a contrast media volume control device on acute kidney injury rate in patients with acute coronary syndrome. Catheter Cardiovasc Interv. 2021;98:76-84.
14. Tajti P, Xenogiannis I, Hall A, et al. Use of the DyeVert system in chronic total occlusion percutaneous coronary intervention. J Invasive Cardiol. 2019;31:253-299.
15. Bunney R, Saenger E, Shah C, et al. Contemporary use of contrast dye reduction technology in a tertiary academic hospital:patient characteristics and acute kidney injury outcomes following percutaneous coronary interventions. In:Acc 2019. 1st Quality Summit;2019 March 13-15;New Orleans, United States.
16. Kutschman R, Davison L, Beyer J. Comprehensive clinical quality initiative for reducing acute kidney injury in at-risk patients undergoing diagnostic coronary angiogram and/or percutaneous coronary interventions. In:Scai 2019. 42nd Scientific Sessions;2019 May 19-22;Las Vegas, United States.
17. Olubowale O, Ur Rahman E, U Okoro K, et al. The DyeVert contrast reduction system and contrast induced nephropathy:is it any better?J Am Coll Cardiol. 2022;79(Suppl 9):S903.
18. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
19. Zhao F, Lei R, Yang SK, et al. Comparative effect of iso-osmolar versus low-osmolar contrast media on the incidence of contrast-induced acute kidney injury in diabetic patients:a systematic review and meta-analysis. Cancer Imaging. 2019;19:38.