RESUMEN
Introducción y objetivos: Las publicaciones sugieren que los armazones vasculares bioabsorbibles (AVB) conllevan un exceso de complicaciones trombóticas. Se describen los resultados en la vida real y a largo plazo de una serie de pacientes a los que se implantó un AVB Absorb (Abbott Vascular, EE.UU.).
Métodos: Se analizaron 213 pacientes consecutivos que recibieron al menos un AVB entre mayo de 2012 y diciembre de 2016. El objetivo principal del estudio fue la incidencia de fracaso del vaso diana, un evento compuesto que incluye infarto de miocardio, revascularización del vaso diana y muerte cardiaca.
Resultados: El 75% de los pacientes eran varones (edad media, 61,4 años). La causa más común de ingreso fue el infarto sin elevación del ST (53,52%). La mediana de seguimiento fue de 44 meses [28 meses]. La incidencia del evento primario fue del 6,57% durante los primeros 24 meses y del 7,98% al final del seguimiento. Respecto al dispositivo, hubo 6 casos (2,81%) de trombosis (definitiva, probable o posible) y 10 casos (4,69%) de reestenosis. Los pacientes con antecedentes de diabetes mellitus (HR = 1,72; IC95%, 1,01-2,95; p = 0,05) o con anticoagulación oral crónica (HR = 5,71; IC95%, 1,12-28,94; p = 0,04) tuvieron mayor riesgo de fracaso del vaso diana.
Conclusiones: En esta serie de pacientes, la incidencia de fracaso del vaso diana fue comparable a la descrita previamente en ensayos clínicos aleatorizados. Los eventos adversos fueron más frecuentes en los primeros 2 años de seguimiento y en presencia de mayor comorbilidad cardiovascular.
Palabras clave: Absorb. Armazon vascular bioabsorbible. Angioplastia coronaria.
ABSTRACT
Introduction and objectives: Recent publications suggest that bioresorbable vascular scaffolds (BVS) are associated with an excess of thrombotic complications. We present the real-world, long-term results of a series of patients who received the BVS Absorb (Abbott Vascular, United States).
Methods: A total of 213 consecutive patients who received at least 1 BVS between May 2012 and December 2016 were analyzed. The main objective of the study was the rate of target vessel failure, a composite endpoint of infarction or target vessel revascularization and cardiac death.
Results: Seventy-five per cent of the patients were men (mean age, 61.4 years). The most common cause for admission was non-ST-elevation myocardial infarction (53.52%). The median follow-up was 44 months [28 months], the rate of the primary endpoint was 6.57% for the first 24 months and 7.98% at the end of the follow-up. Regarding the device, there were 6 cases (2.81%) of thrombosis (definitive, probable or possible) and 10 cases (4.69%) of restenosis. Patients with a past medical history of diabetes mellitus (HR, 1.72; 95%CI, 1.01-2.95; P = .05) and/or chronic oral anticoagulation (HR, 5.71; 95%CI, 1.12-28.94; P = .04) had a higher risk of target vessel failure.
Conclusions: In this series of patients, the rate of target vessel failure was similar to the one previously described by randomized clinical trials. Events were more common during the first 2 years of follow-up and in the presence of greater cardiovascular comorbidity.
Keywords: Absorb. Bioresorbable scaffolds. Coronary angioplasty.
Abreviaturas AVB: armazon vascular bioabsorbible. IAM: infarto agudo de miocardio. SFA: stent farmacoactivo.
INTRODUCCIÓN
Los armazones vasculares bioabsorbibles (AVB) liberadores de fármacos se presentaron inicialmente como un avance tecnológico para superar las limitaciones y los efectos adversos asociados al stent metálico permanente, sobre todo el desarrollo de neoateroesclerosis, que conlleva riesgo de trombosis (0,2% por año) y de revascularización secundaria (2-3% por año)1-3.
La implantación de un AVB era un enfoque innovador del tratamiento de la ateroesclerosis coronaria, que libera a la arteria de una jaula metálica permanente y permite restaurar la arquitectura del vaso, conservando incluso su motilidad parietal y su respuesta a estímulos generados por el flujo coronario (shear stress). Entre los numerosos dispositivos AVB que se han desarrollado, el Absorb (Abbott Vascular, EE.UU.), un andamio polimérico con un grosor de strut de 157 µm que libera everolimus, fue uno de los primeros en comercializarse en España, y contó con varios ensayos clínicos aleatorizados4-8. Los excelentes resultados iniciales motivaron un amplio uso de este dispositivo para diversas indicaciones clínicas9,10. El AVB Absorb fue aprobado por la Food and Drug Administration y obtuvo la marca CE en enero de 201111.
Sin embargo, a raíz de un estudio iniciado por el grupo de investigación AIDA12,13, los datos a medio y largo plazo sobre Absorb fueron decepcionantes, ya que mostraron una tasa más alta de trombosis tardía del armazón en comparación con XIENCE (Abbott Vascular, EE.UU.) (3,5 frente a 0,9%; hazard ratio [HR] = 3,87; intervalo de confianza del 95% [IC95%], 1,78-8,42; p < 0,001), un stent metálico farmacoactivo (SFA) que libera everolimus14,15. Posteriormente, el fabricante del AVB Absorb detuvo la producción del dispositivo y, de acuerdo con la agencia europea reguladora, lo retiró del mercado; no obstante, algunos de estos dispositivos están aprobados y permanecen disponibles para su empleo en Europa16.
Debido a que el uso del AVB Absorb fue amplio en distintos escenarios clínicos durante la fase inicial de su comercialización, hace más de 7 años, hoy se dispone de seguimientos a largo plazo. El objetivo del presente estudio es describir la incidencia de eventos adversos a largo plazo en una serie de pacientes a los que se implantó un AVB Absorb en diferentes escenarios clínicos de nuestro registro multicéntrico17.
MÉTODOS
Población, diseño y definiciones
Se analizan los casos en que se realizó una angioplastia coronaria transluminal percutánea con al menos un AVB Absorb, entre mayo de 2012 y diciembre de 2016, en 3 hospitales17. El implante se realizó según el criterio del cardiólogo intervencionista responsable del cateterismo.
El objetivo primario compuesto del estudio fue la incidencia de fracaso del vaso diana, un evento compuesto de revascularización del vaso diana, infarto agudo de miocardio (IAM) por el vaso diana y muerte cardiaca. El objetivo secundario fue la incidencia del objetivo clínico global, que incluye los siguientes eventos adversos: muerte por cualquier causa, infarto de miocardio y todas las nuevas revascularizaciones coronarias (incluyendo las de vasos no diana).
Se revisó el registro de la unidad de cardiología intervencionista de nuestra red hospitalaria (revisión periódica cada 6-12 meses en la consulta de seguimiento de la unidad de cardiología intervencionista o por el cardiólogo del área sanitaria) y se completó el seguimiento por teléfono.
Análisis estadístico
Los resultados se expresan como media ± desviación estándar para las variables cuantitativas y como porcentajes para las cualitativas. Los pacientes también se agruparon según tuvieran fracaso del vaso coronario diana o no; los promedios entre grupos se compararon mediante la prueba t de Student, y los porcentajes mediante la prueba de χ2. Se realizó un análisis de Kaplan-Meier para estimar la probabilidad de supervivencia libre de fracaso del vaso diana, así como de trombosis y de reestenosis del AVB. Finalmente, mediante regresión de Cox multivariable se analizó la relación de función de supervivencia ajustada por distintas variables definidas a priori: sexo, edad, factores de riesgo cardiovascular, antecedentes médicos, presentación clínica, tamaño y longitud del AVB implantado, solapamiento de al menos 2 AVB y uso de imagen intracoronaria (tomografía de coherencia óptica [OCT] o ecocardiografía intravascular [IVUS]). El nivel de significación estadística para todas las pruebas fue p ≤ 0,05 bilateral. Los datos se analizaron con el programa Stata IC 14 (StataCorp, EE.UU.).
RESULTADOS
Población del estudio
Se incluyeron 213 pacientes consecutivos que recibieron el implante de al menos 1 AVB Absorb entre mayo de 2012 y diciembre de 2016. En la tabla 1 se detallan las características clínicas basales. La mayoría de los participantes fueron varones (75,12%), con una edad media de 61,40 ± 12,74 años y con alta prevalencia de dislipemia (62,44%) y tabaquismo (65,26%). El 23,94% tenían diabetes mellitus y el 21,60% antecedentes de intervencionismo coronario percutáneo. La presentación clínica más frecuente en el momento de la inclusión fue el síndrome coronario agudo sin elevación del segmento ST (53,52%).
Tabla 1. Características clínicas basales de los pacientes y diferencias según la presencia del objetivo primario
| Características | Pacientes que recibieron AVB (n = 213) | Pacientes con AVB y fracaso del vaso diana (n = 17) | Pacientes con AVB sin fracaso del vaso diana (n = 196) | p |
|---|---|---|---|---|
| Edad (años) | 61,40 ± 12,74 | 66,71 ± 9,62 | 61,14 ± 12,98 | 0,07 |
| Sexo (varón) | 160 (75,12) | 12 (70,59) | 148 (75,51) | 0,65 |
| Factores de riesgo | ||||
| Diabetes mellitus | 51 (23,94) | 7 (41,18) | 44 (22,45) | 0,06 |
| Hipertensión | 118 (55,40) | 11 (64,71) | 107 (54,59) | 0,42 |
| Dislipemia | 133 (62,44) | 13 (76,47) | 120 (61,22) | 0,21 |
| Tabaquismo activo | 139 (65,26) | 10 (58,82) | 129 (65,82) | 0,56 |
| Antecedentes | ||||
| Insuficiencia renal crónica | 8 (3,76) | 1 (5,88) | 7 (3,57) | 0,63 |
| FEVI < 30% | 5 (4,5) | 1 (5,88) | 4 (2,04) | 0,55 |
| Ictus o AIT previos | 9 (4,2) | 3 (17,65) | 6 (3,06) | 0,01 |
| Anticoagulación oral crónica | 10 (4,69) | 3 (17,65) | 7 (3,57) | 0,01 |
| Enfermedad vascular periférica | 13 (6,10) | 1 (5,88) | 12 (6,12) | 0,96 |
| Infarto de miocardio previo | 31 (14,55) | 1 (5,88) | 30 (15,31) | 0,29 |
| ICP previa | 46 (21,60) | 4 (23,53) | 42 (21,43) | 0,84 |
| Cirugía de revascularización coronaria previa | 7 (3,29) | 2 (11,76) | 5 (2,55) | 0,04 |
| Presentación clínica | ||||
| SCACEST | 31 (14,55) | 4 (23,53) | 27 (13,78) | 0,25 |
| SCASEST tipo IAM no Q | 77 (36,15) | 6 (35,29) | 71 (36,22) | 0,66 |
| SCASEST tipo angina inestable | 37 (17,37) | 3 (17,65) | 34 (17,35) | 0,88 |
| Angina estable o isquemia documentada | 68 (31,4) | 4 (23,53) | 64 (32,65) | 0,52 |
|
AIT: accidente isquémico transitorio; AVB: armazón vascular bioabsorbible; FEVI: fracción de eyección del ventrículo izquierdo; IAM: infarto agudo de miocardio; ICP: intervencionismo coronario percutáneo; SCACEST: síndrome coronario agudo con elevación del segmento ST; SCASEST: síndrome coronario agudo sin elevación del segmento ST. Los datos expresan n (%) o media ± desviación estándar. |
||||
Procedimiento índice de implante del armazón vascular bioabsorbible
En la tabla 2 se especifican las características del procedimiento índice de los pacientes. Se trataron 233 lesiones coronarias, con un promedio de 1,3 ± 0,3 lesiones por paciente. El implante fue exitoso en el 99,5% de los casos y resultó fallido en 1 paciente por la dificultad para progresar el dispositivo a través de la lesión, que requirió el implante de un SFA, por lo que se excluyó del análisis. Se realizó predilatación en el 89,3% de los casos y posdilatación en el 33,5%. Se empleó imagen intracoronaria (OCT o IVUS) para optimizar el implante del AVB en 86 pacientes (40,38%).
Tabla 2. Características del procedimiento índice y tratamiento
| Características | Pacientes que recibieron AVB (n = 213) |
|---|---|
| Lesiones tratadas por paciente | 1,3 ± 0,3 |
| Número de dispositivos por paciente | 1,2 ± 0,4 |
| Longitud total del dispositivo por paciente (mm) | 21,5 ± 13,5 |
| Diámetro mínimo del dispositivo por paciente (mm) | 2,75 ± 0,25 |
| Implante del dispositivo | |
| Al menos 1 AVB | 212 (99,5) |
| Solo AVB | 204 (95,8) |
| Solapamiento con al menos 2 AVB | 20 (9,39) |
| Cualquier SFA | 8 (3,8) |
| Tras fallo del implante de AVB | 1 (0,5) |
| Tiempo del procedimiento (min) | 44 ± 23 |
| Contraste yodado utilizado por procedimiento (ml) | 161 ± 72 |
| Predilatación de la primera lesión tratada | 189 (88,7) |
| Éxito del procedimiento | 212 (99,5) |
| Lesiones tratadas | |
| Número total | 233 |
| Predilatación | 208 (89,3) |
| Posdilatación | 78 (33,5) |
| Balón de posdilatación 0,5 mm más que AVB | 21 (9,86) |
| Número total de dispositivos implantados | 261 |
| Número total de dispositivos por lesión | 1,12 ± 0,4 |
| Imagen intracoronaria en el implante | |
| OCT o IVUS | 86 (40,38) |
|
AVB: armazón vascular bioabsorbible; IVUS: ecocardiografía intravascular; OCT: tomografía de coherencia óptica; SFA: stent farmacoactivo. Los datos expresan n (%) o media ± desviación estándar. |
|
Seguimiento clínico
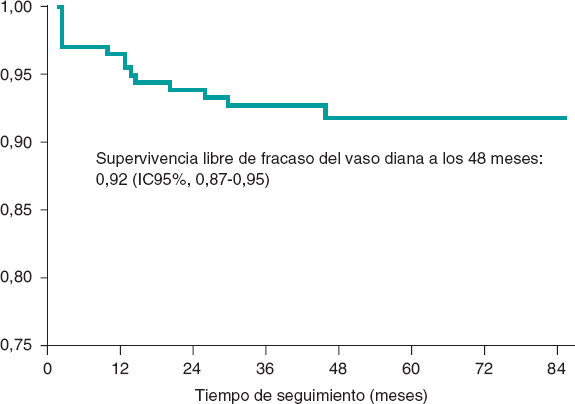
La mediana de seguimiento fue de 44 meses [28 meses], con un tiempo mínimo inferior a 1 mes. El objetivo primario compuesto de incidencia de fracaso del vaso diana fue del 6,57% a los 24 meses (tabla 3) y del 7,98% al final del seguimiento. En la figura 1 se muestra la curva de supervivencia libre de fracaso del vaso diana; a los 48 meses fue de 0,92 (IC95%, 0,87-0,95; p = 0,02 ). Respecto al objetivo secundario, la incidencia global fue del 11,74% a los 24 meses (tabla 3) y del 17,84% al final del seguimiento.
Tabla 3. Eventos adversos hasta los 2 años de seguimiento
| Evento adverso | Pacientes que recibieron AVB Seguimiento a 2 años (n = 213) |
|---|---|
| Eventos clínicos | |
| Muerte por cualquier causa | 5 (2,34) |
| Cardiaca | 3 (1,41) |
| No cardiaca | 2 (0,94) |
| Todos los infartos de miocardio | 6 (2,82) |
| Durante el procedimiento índice | 2 (0,94) |
| No durante el procedimiento índice | 4 (1,88) |
| Vaso diana | 3 (1,41) |
| No vaso diana | 1 (0,47) |
| Muerte o infarto de miocardio | 11 (5,16) |
| Cualquier revascularización | 18 (8,46) |
| Vaso diana | 11 (5,16) |
| Lesión diana | 11 (5,16) |
| Trombosis del dispositivo | 3 (1,41) |
| Reestenosis del dispositivo | 8 (3,76) |
| Cualquier otro vaso | 7 (3,29) |
| Objetivo compuesto | |
| Fracaso del vaso diana | 14 (6,57) |
| Objetivo clínico global | 25 (11,74) |
| Trombosis del dispositivo | |
| Definitivo | 3 (1,41) |
| Probable | 2 (0,94) |
| Posible | 1 (0,47) |
|
AVB: armazón vascular bioabsorbible. Los datos expresan n (%). |
|
Figura 1. Curva de supervivencia de Kaplan-Meier para fracaso del vaso diana.
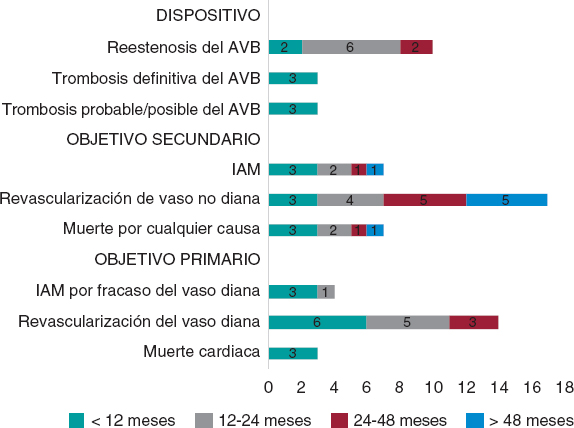
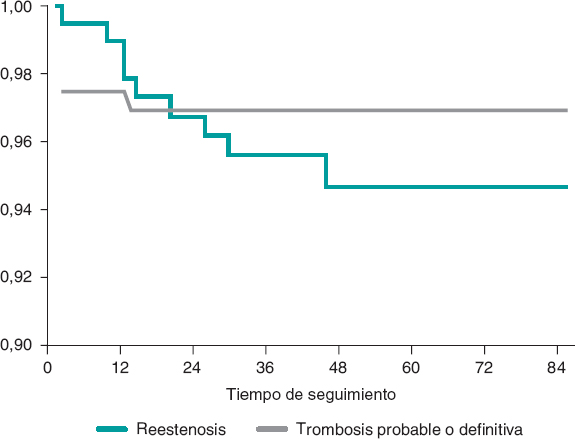
La figura 2 muestra la incidencia de todos los eventos adversos según el momento de presentación. Respecto al objetivo primario, hubo 3 (1,41%) casos de muerte cardiaca, 4 (1,87%) de IAM por el vaso diana y 14 (6,57%) de revascularización del vaso diana. Respecto al objetivo secundario, hubo 7 (3,29%) casos de muerte por cualquier causa, 7 (3,29%) de IAM y 31 (14,56%) de cualquier revascularización coronaria. Finalmente, en cuanto al dispositivo, hubo 6 (2,81%) casos de trombosis (definitiva, probable y posible), todos en los primeros 12 meses. La doble terapia antiagregante plaquetaria se mantuvo al menos durante 12 meses en 157 (73,7%) pacientes, y 1 paciente con trombosis definitiva tardía recibió terapia antitrombótica doble (acenocumarol y clopidogrel). Asimismo, hubo 10 (4,69%) casos de reestenosis del AVB, que se produjeron en los primeros 48 meses de seguimiento (figura 3).
Figura 2. Gráfica de barras de eventos adversos según el tiempo de presentación tras el procedimiento índice. AVB: armazón vascular bioabsorbible; IAM: infarto agudo de miocardio.
Figura 3. Curvas de supervivencia de Kaplan-Meier para reestenosis y trombosis del armazón vascular bioabsorbible.
Los pacientes con fracaso del vaso diana tuvieron mayor prevalencia de enfermedad cerebrovascular (17,65 frente a 3,06%; p = 0,01), anticoagulación oral crónica (17,65 frente a 3,57%; p = 0,01) y cirugía de revascularización coronaria previa (11,76 frente a 2,55%; p = 0,04). Asimismo, hubo una tendencia hacia una mayor prevalencia de diabetes mellitus en este grupo (41,18 frente a 22,45%; p = 0,06) (tabla 1).
En el análisis de regresión de Cox multivariable, el antecedente de diabetes mellitus (HR = 1,72; IC95%, 1,01-2,95; p = 0,05) y la anticoagulación oral crónica (HR = 5,71; IC95%, 1,12-28,94; p = 0,04) se identificaron como factores de riesgo para fracaso del vaso diana durante el seguimiento. Por otro lado, el uso de imagen intracoronaria (OCT o IVUS) durante el implante del AVB tuvo una clara tendencia a la significación como factor protector (HR = 0,33; IC95%, 0,10-1,07; p = 0,06) (tabla 4).
Tabla 4. Factores asociados con fracaso del vaso diana: análisis de regresión de Cox
| Análisis univariable | Análisis multivariable | |||||
|---|---|---|---|---|---|---|
| HR | IC95% | p | HR | IC95% | p | |
| Antecedentes médicos | ||||||
| Diabetes mellitus | 1,72 | 1,04-2,86 | 0,04 | 1,72 | 1,01-2,95 | 0,05 |
| Ictus o AIT previos | 6,28 | 1,76-22,31 | 0,01 | 1,94 | 0,40-9,23 | 0,40 |
| Anticoagulación oral crónica | 5,34 | 1,51-18,97 | 0,01 | 5,71 | 1,12-28,95 | 0,04 |
| Uso de imagen intracoronaria durante el implante | ||||||
| OCT o IVUS | 0,32 | 0,11-1,03 | 0,06 | 0,33 | 0,10-1,06 | 0,06 |
|
AIT: accidente isquémico transitorio; HR: hazard ratio; IC95%: intervalo de confianza del 95%; IVUS: ecocardiografía intravascular; OCT: tomografía de coherencia óptica. |
||||||
DISCUSIÓN
En el presente estudio se analizó una serie consecutiva de pacientes que recibió el implante de al menos 1 AVB en un entorno de alto volumen y en condiciones de vida real. El objetivo primario compuesto de fracaso del vaso diana y el objetivo secundario compuesto clínico global fueron comparables a lo observado en algunos ensayos clínicos aleatorizados previos de intervencionismo coronario percutáneo18-22.
Respecto al ensayo clínico AIDA20, destaca la menor incidencia de IAM por fracaso del vaso diana en nuestra serie. Las características clínicas basales y la presentación clínica de los pacientes de nuestro estudio fueron similares a las de la población del ensayo clínico AIDA, pero respecto al procedimiento índice destaca un menor uso de posdilatación en nuestra serie. Se ha descrito que la posdilatación no aporta un beneficio adicional al implante de un AVB en el escenario clínico de un síndrome coronario agudo con elevación del segmento ST, y además, en caso de ser excesiva, podría incluso resultar deletérea al desestructurar o romper un armazón que no es metálico23. A pesar de ello, el registro GHOST-EU24 demostró que la estrategia de PSP (predilatación, dimensionamiento y posdilatación) fue un predictor de eventos cardiovasculares.
La selección apropiada de la lesión desempeña un papel crucial para el rendimiento clínico del AVB. La mayoría de los pacientes de esta serie presentaban síndrome coronario agudo. Es plausible que los pacientes con IAM puedan obtener un mayor beneficio del tratamiento con AVB18. Primero, los pacientes con síndrome coronario agudo (con o sin elevación del segmento ST) suelen tener un trombo visible más a menudo en los segmentos proximales y una morfología de la lesión menos compleja, con placas de fibroateroma de capa fina, así como menos lesiones calcificadas. Segundo, la terapia antitrombótica agresiva tras un síndrome coronario agudo puede mitigar la incidencia de complicaciones trombóticas.
Trombosis del armazón vascular bioabsorbible
Algunos estudios han detectado un aumento en la incidencia de trombosis de los AVB respecto a los SFA de nueva generación25,26, sobre todo en su uso fuera de indicación27. En nuestra serie, la trombosis del dispositivo definitiva o probable ocurrió en un porcentaje similar al previamente descrito12. Se han propuesto varios mecanismos para explicar la trombosis del AVB, incluidos la disección del borde, la fractura de struts, la malaposición y el tamaño insuficiente del AVB28. En nuestra serie hubo 2 casos de trombosis definitiva subaguda, y en la coronariografía se comprobó mediante OCT la presencia de algún mecanismo estructural (infraexpansión o malaposición) que lo favoreció. La presentación temprana en el seguimiento es acorde con lo descrito previamente29.
Asimismo, identificamos que el uso de imagen intracoronaria (OCT o IVUS) durante el implante del AVB tuvo una clara tendencia a la significación para ser un factor protector del fracaso del vaso coronario diana, como demostraron Caixeta et al.30 en un registro internacional de 1.933 pacientes. La optimización del implante con técnicas de imagen intracoronaria que aseguren la correcta aposición del AVB, la ausencia de infraexpansión y la adecuada cobertura de la lesión es una recomendación apropiada31.
Probablemente el principal inconveniente del AVB Absorb sea el grosor y la anchura de los struts (157 × 190,5 µm en los AVB de 2,5 y 3,0 mm, y 157 × 216 µm en el de 3,5 mm), lo cual podría hacer que este dispositivo sea más trombogénico, en especial cuando la aposición no es adecuada o la expansión no es completa. En la actualidad, los stents ultrafinos farmacoactivos (struts de grosor < 70 µm) han reducido el riesgo a 1 año de fracaso de lesión diana en comparación con los SFA contemporáneos de segunda generación, gracias a un menor número de IAM y de trombosis del stent32. En relación con ello, el AVB MeRes100 (Meril Life Sciences Pvt. Ltd., India), liberador de sirolimus y con un menor grosor de strut (100 µm), ha demostrado eficacia sostenida y seguridad en el seguimiento a 2 y 3 años33.
La resistencia a la terapia antiplaquetaria también puede ser una causa importante de trombosis del AVB34. Tanto el ácido acetilsalicílico como el clopidogrel son fármacos antiplaquetarios eficaces para la prevención secundaria de eventos cardiovasculares, pero su eficacia clínica varía entre individuos35. En nuestra serie, la mayoría de los pacientes mantuvieron una doble terapia antiagregante plaquetaria al menos durante 12 meses, y hubo 1 caso de trombosis tardía con terapia antitrombótica doble (acenocumarol y clopidogrel). Este último paciente, debido a su alto riesgo hemorrágico, recibió terapia antiagregante plaquetaria doble durante los primeros 3 meses; desconocemos el cociente internacional normalizado en el momento de la complicación y no descartamos la posibilidad de resistencia al fármaco antiplaquetario. No obstante, la potencial asociación entre la trombosis del AVB y la anticoagulación oral se ha descrito previamente36. Sabemos que la elección y la duración de la terapia antiplaquetaria tras el implante del AVB Absorb resultó difícil37, en particular en los pacientes anticoagulados, porque constituyen una población con comorbilidad y riesgo cardiovascular elevado. Nuestros datos apuntan a que el implante del AVB Absorb en pacientes con alto riesgo de hemorragia (incluidos los anticoagulados) probablemente deba ser desaconsejado, de acuerdo con el documento de consenso de la Sociedad Europea de Cardiología y la Asociación Europea para Cirugía Cardiotorácica, que no recomienda el uso del AVB Absorb en los pacientes que no toleran una duración prolongada de doble antiagregación plaquetaria o que requieren anticoagulación oral16.
Reestenosis del armazón vascular bioabsorbible
La causa más frecuente de revascularización de la lesión diana fue la reestenosis del stent en los primeros 48 meses de seguimiento. Los mecanismos implicados en la reestenosis de los dispositivos vasculares bioabsorbibles que pueden concurrir en un mismo paciente son diversos38,39. Su menor fuerza radial intrínseca y su posible desestructuración con un implante agresivo pueden explicar algunas recurrencias precoces. En este estudio, el implante agresivo fue poco frecuente, ya que se realizó posdilatación con un balón de hasta 0,5 mm más que el AVB solo en el 9,86% de los casos. Además, la posdilatación no se asoció a reestenosis durante el seguimiento. También se ha postulado que la reabsorción lenta del dispositivo en estudio puede asociarse a una alteración espacial importante, con pérdida de alineamiento de sus elementos estructurales, lo que favorece la reestenosis40,41. La desaparición completa de los AVB de la pared vascular no se consigue hasta pasados aproximadamente 3 años6, y la gran mayoría de los casos de reestenosis del dispositivo sucedieron en los primeros 2 años de seguimiento.
Los resultados de nuestro estudio también demuestran una asociación entre los antecedentes de diabetes mellitus y anticoagulación oral crónica y el desarrollo de fracaso del vaso diana. Se sabe que dichos antecedentes elevan la morbimortalidad cardiovascular, y que las puntuaciones de las escalas CHADS2 y CHA2DS2-VASc pueden utilizarse para estimar el riesgo de eventos clínicos adversos en los pacientes con síndrome coronario agudo42. En este sentido, los pacientes con antecedentes de diabetes mellitus, anticoagulación oral crónica y enfermedad coronaria parten de una puntuación CHA2DS2-VASc de 4, es decir, de alto riesgo para eventos clínicos adversos.
Limitaciones
El sesgo de selección fue inevitable porque, según el criterio del operador, la valoración clínica que pudo influir en la decisión de implantar un AVB podría no deducirse de la base de datos, lo cual es un problema habitual en estudios observacionales de esta naturaleza. No obstante, el estudio refleja un enfoque pragmático del uso de este dispositivo en la vida real.
CONCLUSIONES
En esta serie de pacientes en los que se implantó el AVB Absorb, el objetivo compuesto de fracaso del vaso diana y el objetivo compuesto clínico global fueron comparables a lo previamente descrito en los ensayos clínicos aleatorizados. Los eventos adversos fueron más frecuentes los primeros 2 años de seguimiento, en caso de mayor comorbilidad cardiovascular y sin imagen intracoronaria (OCT o IVUS) durante el implante. Aunque el AVB investigado ya no está comercialmente disponible, hay otros dispositivos bioabsorbibles en diversas etapas de desarrollo16.
FINANCIACIÓN
R. Mori-Junco recibió el training grant 2018 de la Sociedad Europea de Cardiología (APP000019660). L. Furuya-Kanamori recibe financiación del Australian National Health and Medical Research Council Early Career Fellowships (APP1158469).
CONFLICTO DE INTERESES
Los autores declaran la ausencia de conflicto de intereses.
¿QUÉ SE SABE DEL TEMA?
- El implante de un AVB es un enfoque innovador del tratamiento de la ateroesclerosis coronaria, que libera a la arteria coronaria de una jaula metálica permanente y permite restaurar la arquitectura del vaso.
- Sin embargo, el AVB Absorb presenta una mayor tasa de complicaciones trombóticas en comparación con los SFA contemporáneos, motivo por el cual fue retirado del mercado.
¿QUÉ APORTA DE NUEVO?
- En nuestra red de cardiología intervencionista, el implante del AVB Absorb presentó una tasa de fracaso del vaso diana comparable a lo descrito previamente en los ensayos clínicos aleatorizados.
- El fracaso del vaso diana sucedió sobre todo durante los primeros 24 meses, en pacientes con diabetes mellitus o con anticoagulación oral crónica. El uso de imagen intracoronaria durante el implante mostró una tendencia a ser un factor protector.
- Nuestros resultados ayudarán a la selección apropiada de los pacientes para el implante de un AVB disponible en la actualidad y de la técnica del implante.
BIBLIOGRAFÍA
1. Smits PC, Vlachojannis GJ, McFadden EP, et al. Final 5-Year Follow-Up of a Randomized Controlled Trial of Everolimus- and Paclitaxel-Eluting Stents for Coronary Revascularization in Daily Practice:The COMPARE Trial (A Trial of Everolimus-Eluting Stents and Paclitaxel Stents for Coronary Revascularization in Daily Practice). JACC Cardiovasc Interv. 2015;8:1157-1165.
2. Byrne RA, Stone GW, Ormiston J, Kastrati A. Coronary balloon angioplasty, stents, and scaffolds. Lancet. 2017;390:781-792.
3. Ellis SG, Riaz H. Bioresorbable stents:The future of interventional cardiology?Cleve Clin J Med. 2016;83:S18-S23.
4. Ellis SG, Kereiakes DJ, Metzger DC, et al. Everolimus-Eluting Bioresorbable Scaffolds for Coronary Artery Disease. N Engl J Med. 2015;373:1905-1915.
5. Ormiston JA, Serruys PW, Regar E, et al. A bioabsorbable everolimus-eluting coronary stent system for patients with single de-novo coronary artery lesions (ABSORB):a prospective open-label trial. Lancet. 2008;371:899-907.
6. Serruys PW, Garcia-Garcia HM, Onuma Y. From metallic cages to transient bioresorbable scaffolds:change in paradigm of coronary revascularization in the upcoming decade?Eur Heart J. 2012;33:16-25.
7. Serruys PW, Katagiri Y, Sotomi Y, et al. Arterial Remodeling After Bioresorbable Scaffolds and Metallic Stents. J Am Coll Cardiol. 2017;70:60-74.
8. Serruys PW, Chevalier B, Sotomi Y, et al. Comparison of an everolimus-eluting bioresorbable scaffold with an everolimus-eluting metallic stent for the treatment of coronary artery stenosis (ABSORB II):a 3 year, randomised, controlled, single-blind, multicentre clinical trial. Lancet. 2016;388:2479-2491.
9. Rampat R, Mayo T, Hildick-Smith D, Cockburn J. A randomized trial comparing two stent sizing strategies in coronary bifurcation treatment with bioresorbable vascular scaffolds –The Absorb Bifurcation Coronary (ABC) trial. Cardiovasc Revascularization Med. 2019;20:43-49.
10. Mitomo S, Naganuma T, Fujino Y, et al. Bioresorbable Vascular Scaffolds for the Treatment of Chronic Total Occlusions. Circ Cardiovasc Interv. 2017;10:e004265.
11. Abbott Laboratories. Abbott Receives CE Mark Approval for World's First Drug Eluting Bioresorbable Vascular Scaffold for Treatment of Coronary Artery Disease. Disponible en: https://www.prnewswire.com/news-releases/abbott-receives-ce-mark-approval-for-worlds-first-drug-eluting-bioresorbable-vascular-scaffold-for-treatment-of-coronary-artery-disease-113197364.html. Consultado 25 Ago 2019.
12. Wykrzykowska JJ, Kraak RP, Hofma SH, et al. Bioresorbable Scaffolds versus Metallic Stents in Routine PCI. N Engl J Med. 2017;376:2319-2328.
13. Kerkmeijer LSM, Tijssen RYG, Hofma SH, et al. Comparison of an everolimus-eluting bioresorbable scaffold with an everolimus-eluting metallic stent in routine PCI:three-year clinical outcomes from the AIDA trial. EuroIntervention. 2019;15:603-606.
14. Stone GW, Gao R, Kimura T, et al. 1-year outcomes with the Absorb bioresorbable scaffold in patients with coronary artery disease:a patient-level, pooled meta-analysis. Lancet. 2016;387:1277-1289.
15. Katsikis A, Serruys PW. Bioresorbable scaffolds versus metallic stents in routine PCI:the plot thickens. J Thorac Dis. 2017;9:2296-2300.
16. Byrne RA, Stefanini GG, Capodanno D, et al. Report of an ESC-EAPCI Task Force on the evaluation and use of bioresorbable scaffolds for percutaneous coronary intervention:executive summary. Eur Heart J. 2018;39:1591-1601.
17. Nuñez Gil IJ, Bas M, Fernández-Ortiz A, et al. Long term experience with a novel interventional cardiology network model:Learned lessons. J Hosp Adm. 2016;5:87-94.
18. Byrne RA, Alfonso F, Schneider S, et al. Prospective, randomized trial of bioresorbable scaffolds vs. everolimus-eluting stents in patients undergoing coronary stenting for myocardial infarction:The Intracoronary Scaffold Assessment a Randomized evaluation of Absorb in Myocardial Infarction (ISAR-Absorb MI) trial. Eur Heart J. 2019;40:167-176.
19. Capodanno D, Gori T, Nef H, et al. Percutaneous coronary intervention with everolimus-eluting bioresorbable vascular scaffolds in routine clinical practice:Early and midterm outcomes from the European multicentre GHOST-EU registry. EuroIntervention. 2015;10:1144-1153.
20. Tijssen RYG, Kraak RP, Hofma SH, et al. Complete two-year follow-up with formal non-inferiority testing on primary outcomes of the AIDA trial comparing the Absorb bioresorbable scaffold with the XIENCE drug-eluting metallic stent in routine PCI. EuroIntervention. 2018;14:e426-e433.
21. Chevalier B, Onuma Y, Boven AJ Van. Randomised comparison of a bioresorbable everolimus- eluting scaffold with a metallic everolimus-eluting stent for ischaemic heart disease caused by de novo native coronary artery lesions:the 2-year clinical outcomes of the ABSORB II trial. EuroIntervention. 2016;12:1102-1107.
22. Alvarez M, Applegate RJ. Early and Late Bioresorbable Vascular Scaffold Thrombosis:Size Matters. JACC Cardiovasc Interv. 2017;10:2372-2374.
23. Yamaji K, Brugaletta S, SabatéM, et al. Effect of Post-Dilatation Following Primary PCI With Everolimus-Eluting Bioresorbable Scaffold Versus Everolimus-Eluting Metallic Stent Implantation. JACC Cardiovasc Interv. 2017;10:1867-1877.
24. Ortega-Paz L, Capodanno D, Gori T, et al. Predilation, sizing and post-dilation scoring in patients undergoing everolimus-eluting bioresorbable scaffold implantation for prediction of cardiac adverse events:Development and internal validation of the PSP score. EuroIntervention. 2017;12:2110-2117.
25. Lipinski MJ, Escarcega RO, Baker NC, et al. Scaffold Thrombosis After Percutaneous Coronary Intervention With ABSORB Bioresorbable Vascular Scaffold. JACC Cardiovasc Interv. 2016;9:12-24.
26. Alfonso F, Cuesta J. Very Late Bioresorbable Vascular Scaffold Thrombosis:Smoke or Fire?JACC Cardiovasc Interv. 2017;10:38-41.
27. Miyazaki T, Ruparelia N, Kawamoto H, Figini F, Latib A, Colombo A. Clinical outcomes following “off-label“versus “established“indications of bioresorbable scaffolds for the treatment of coronary artery disease in a real-world population. EuroIntervention. 2016;11:1475-1478.
28. Puricel S, Cuculi F, Weissner M, et al. Bioresorbable Coronary Scaffold Thrombosis. J Am Coll Cardiol. 2016;67:921-931.
29. Brugaletta S, Gori T, Low AF, et al. Absorb bioresorbable vascular scaffold versus everolimus-eluting metallic stent in ST-segment elevation myocardial infarction:1-year results of a propensity score matching comparison:the BVS-EXAMINATION Study (bioresorbable vascular scaffold - a clinical evaluation of everolimus eluting coronary stents in the treatment of patients with ST-segment elevation myocardial infarction). JACC Cardiovasc Interv. 2015;8:189-197.
30. Caixeta A, Campos CM, Felix C, et al. Predictors of long-term adverse events after Absorb bioresorbable vascular scaffold implantation:a 1,933-patient pooled analysis from international registries. EuroIntervention. 2019; 15:623-630.
31. IJsselmuiden AJJ, Zwaan EM, Oemrawsingh RM, et al. Appropriate use criteria for optical coherence tomography guidance in percutaneous coronary interventions:Recommendations of the working group of interventional cardiology of the Netherlands Society of Cardiology. Neth Heart J. 2018;26:473-483.
32. Bangalore S, Toklu B, Patel N, Feit F, Stone GW. Newer-Generation Ultrathin Strut Drug-Eluting Stents Versus Older Second-Generation Thicker Strut Drug-Eluting Stents for Coronary Artery Disease. Circulation. 2018; 138:2216-2226.
33. Seth A, Onuma Y, Chandra P, et al. Three-year clinical and two-year multimodality imaging outcomes of a thin-strut sirolimus-eluting bioresorbable vascular scaffold:MeRes-1 trial. EuroIntervention. 2019;15:607-614.
34. Fernández-Rodríguez D, Brugaletta S, Otsuki S, SabatéM. Acute Absorb bioresorbable vascular scaffold thrombosis in ST-segment elevation myocardial infarction:to stent or not to stent?EuroIntervention. 2014;10:600;discussion 600.
35. Tantry US, Navarese EP, Bliden KP, Gurbel PA. Acetylsalicylic acid and clopidogrel hyporesponsiveness following acute coronary syndromes. Kardiol Pol. 2018;76:1312-1319.
36. Cayla G, Koning R, Fajadet J, et al. Percutaneous coronary interventions with the Absorb Bioresorbable vascular scaffold in real life:1-year results from the FRANCE ABSORB registry. Arch Cardiovasc Dis. 2019;112: 113-123.
37. Valgimigli M, Bueno H, Byrne RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. Eur Heart J. 2018;39:213-260.
38. Núñez-Gil IJ, Echavarría M, Escaned J, Biagioni C, Feltes G, Fernández- Ortiz A. Bioresorbable stent restenosis:new devices, novel situations. J Invasive Cardiol. 2014;26:E164-6.
39. Longo G, Granata F, Capodanno D, et al. Anatomical features and management of bioresorbable vascular scaffolds failure:A case series from the GHOST registry. Catheter Cardiovasc Interv. 2015;85:1150-1161.
40. Nakatani S, Onuma Y, Ishibashi Y, et al. Early (before 6 months), late (6-12 months) and very late (after 12 months) angiographic scaffold restenosis in the ABSORB Cohort B trial. EuroIntervention. 2015;10:1288-1298.
41. Räber L, Brugaletta S, Yamaji K, et al. Very Late Scaffold Thrombosis. J Am Coll Cardiol. 2015;66:1901-1914.
42. Chua S-K, Lo H-M, Chiu C-Z, Shyu K-G. Use of CHADS2 and CHA2DS2-VASc scores to predict subsequent myocardial infarction, stroke, and death in patients with acute coronary syndrome:data from Taiwan acute coronary syndrome full spectrum registry. PLoS One. 2014;9:e111167.