RESUMEN
La calcificación coronaria es probablemente el mayor determinante de un mal resultado de la angioplastia y se asocia a mayores tasas de eventos adversos. En la actualidad existen distintas técnicas de modificación de la placa basadas en balones o en dispositivos específicos. El conocimiento de sus características y su uso adecuado son aspectos clave para el tratamiento óptimo de las lesiones calcificadas. Este artículo de posicionamiento, promovido desde la Asociación de Cardiología Intervencionista de la Sociedad Española de Cardiología (ACI-SEC), describe las técnicas de modificación de la placa existentes en la actualidad y propone un algoritmo para el tratamiento de la lesión calcificada.
Palabras clave: Lesiones coronarias calcificadas. Técnicas de modificación de la placa. Imagen intracoronaria.
Abstract
Coronary artery calcification is probably the main determinant of the poor outcome of percutaneous coronary interventions and is associated with higher rates of adverse events. There are currently different balloon or specific device-based plaque modification techniques available. Knowing their characteristics and proper use is key for the optimal treatment of calcified lesions. This position paper—promoted by the Interventional Cardiology Association of the Spanish Society of Cardiology (ACI-SEC)—describes existing plaque modification techniques currently available and proposes an algorithm for the management of calcified lesions.
Keywords: Calcified coronary lesions. Plaque modification techniques. Intracoronary imaging modalities.
Abreviaturas
AO: aterectomía orbitacional. AR: aterectomía rotacional. BC: balón de corte. BS: balón de scoring. ELCA: angioplastia coronaria con láser excimer. LIC: litotricia intracoronaria.IMPLICACIONES DE LA CALCIFICACIÓN EN EL INTERVENCIONISMO CORONARIO PERCUTÁNEO
La calcificación vascular es un proceso íntimamente ligado a la ateroesclerosis. Se puede producir en la capa media (fundamentalmente en arterias periféricas) o en la capa íntima (arterias coronarias). En el contexto de la ateroesclerosis coronaria aparece en fases intermedias o avanzadas de la evolución de la placa por conversión de células musculares lisas a fenotipos osteoblásticos e infiltración de la placa de ateroma por macrófagos que eliminan las células musculares lisas apoptóticas y que contienen vesículas calcificadas1. La calcificación de las placas de ateroma puede tomar diversas formas, que probablemente corresponden a diferentes estadios de la misma enfermedad: microcalcificaciones (< 15 μ), calcificaciones puntiformes (< 90° de arco de circunferencia), hojas o láminas de calcio (> 90° de arco o > 3 mm de longitud) y nódulos de calcio1.
Los principales factores de riesgo asociados a la calcificación coronaria son la edad, la raza caucásica, la diabetes mellitus y la enfermedad renal crónica1.
La prevalencia de la calcificación coronaria es variable según la población estudiada y el método diagnóstico2. La definición angiográfica clásica de calcificación moderada se refiere a radioopacidades observadas durante el movimiento cardiaco, y la de calcificación grave a radioopacidades observadas sin necesidad de movimiento cardiaco, habitualmente a ambos lados de la luz arterial. La prevalencia de calcificación moderada o grave oscila entre el 18 y el 60%3,4.
La calcificación dificulta el intervencionismo coronario percutáneo (ICP) por varios motivos: a) la resistencia al avance de los dispositivos, en especial cuando se encuentra en combinación con tortuosidad (en último extremo, lesiones «no cruzables»); b) la reducida distensibilidad de la placa, que requerirá mayor presión en los balones de dilatación o dispositivos de modificación de la placa (lesiones «no dilatables»), y c) la dificultad para el avance del stent y para su expansión5. Otros problemas serían la malaposición y el daño del polímero que pueden conducir a una liberación no homogénea del fármaco antiproliferativo. Todo ello hace que la calcificación sea uno de los mayores determinantes de la puntuación SYNTAX6 y que se asocie con un peor resultado del ICP y con mayores tasas de eventos adversos en el seguimiento, incluyendo mortalidad en pacientes con lesiones gravemente calcificadas7. Adicionalmente, incrementa la tasa de complicaciones del procedimiento, relacionadas tanto con la propia calcificación como con las herramientas necesarias para su tratamiento: disección coronaria, pérdida de ramas laterales, atrapamiento del material de ICP, distorsión del stent o incluso pérdida de este, y la temida perforación coronaria que es especialmente grave dada la dificultad para avanzar el material de sellado8.
Para evitar estos problemas y sus implicaciones pronósticas se han desarrollado numerosos dispositivos de modificación de la placa, cuyo uso apropiado es esencial para realizar un ICP seguro y eficaz en lesiones calcificadas.
Este artículo de posicionamiento, promovido por la Asociación de Cardiología Intervencionista de la Sociedad Española de Cardiología (ACI-SEC), que ha contado con distintos profesionales expertos en este ámbito, describe las técnicas de modificación de la placa disponibles en nuestro medio y propone un algoritmo de manejo de la lesión calcificada.
TÉCNICAS DE IMAGEN INTRACORONARIA PARA LA EVALUACIÓN DE LESIONES CALCIFICADAS
Las técnicas de imagen intracoronaria desempeñan un papel fundamental en la evaluación de las lesiones calcificadas. El uso de tomografía de coherencia óptica (OCT) o ecografía intravascular (IVUS) puede ser muy útil para mejorar la detección y la evaluación del calcio, para la selección de la técnica de modificación de la placa y para optimizar el resultado, en especial en relación con la expansión del stent.
Detección y evaluación de la calcificación
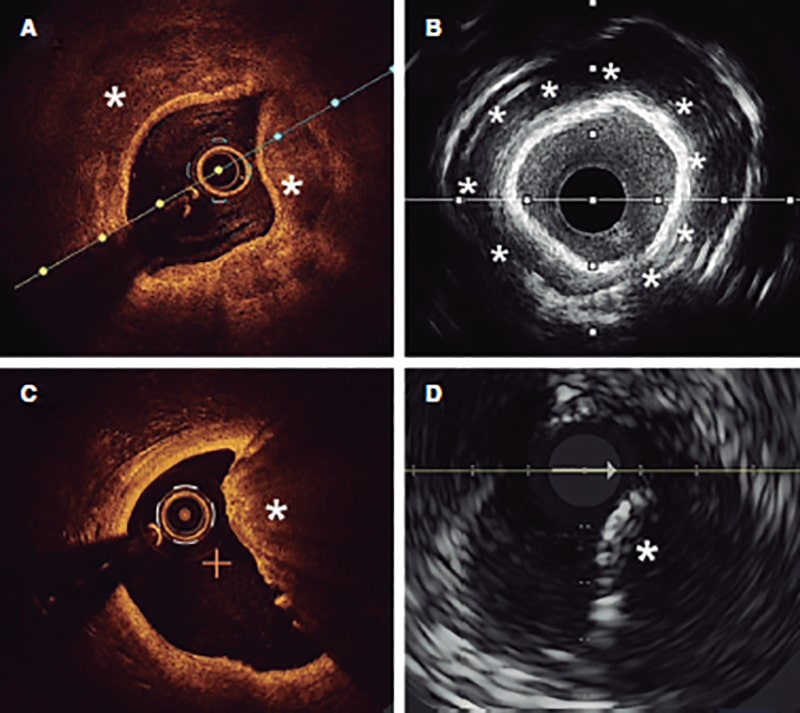
La angiografía es una técnica con una sensibilidad limitada para la detección de calcio. Tanto el IVUS como la OCT tienen mayores sensibilidad y especificidad, y permiten, a diferencia de la angiografía, evaluar las características y la extensión de la calcificación, que son aspectos fundamentales para determinar las opciones de tratamiento2,9. La tabla 1 muestra las diferencias de las 2 técnicas en cuanto a la detección del calcio. La diferencia fundamental entre ambas técnicas de imagen es que, dado que el calcio produce sombra posterior en el IVUS, no es posible evaluar de manera adecuada su grosor. Como marcador alternativo, la presencia de reverberaciones en el IVUS se ha asociado con la presencia de calcio más fino (< 0,5 mm). En la OCT, el calcio parietal no produce sombra posterior y, por tanto, se puede evaluar su grosor con precisión. El calcio nodular, sin embargo, produce sombra tanto en el IVUS como en la OCT (figura 1).
Tabla 1. Técnicas de imagen intracoronaria para la caracterización de lesiones calcificadas
| Técnica de imagen | Sensibilidad | Especificidad | Patrón calcio | Arco calcio | Longitud calcio | Grosor calcio | Desventajas |
|---|---|---|---|---|---|---|---|
| OCT | ++++ | ++++ | Calcio parietal: estructura de baja reflectividad con bordes bien delimitados sin sombra posterior (figura 1A) Nódulo de calcio: estructura protruyente en la luz con sombra posterior (figura 1C) |
Permite cuantificarlo | Permite cuantificarlo | Se puede medir | Requiere eliminar la sangre de la luz del vaso para obtener imágenes. Esto podría incrementar el volumen de contraste en comparación con el IVUS No permite una adecuada visualización de lesiones ostiales |
| IVUS | +++++ | ++++ | Calcio parietal: estructura hiperecogénica con sombra posterior (figura 1B) Nódulo de calcio: estructura protruyente en la luz con sombra posterior (figura 1D) |
Permite cuantificarlo | Permite cuantificarlo | No se puede medir debido a la sombra posterior Las reverberaciones son un marcador de calcio fino (< 0,5 mm) |
La sombra posterior dificulta la evaluación del grosor del calcio En el IVUS de 20 MHz. la limitada resolución y el artefacto de campo cercano pueden dificultar la definición de la profundidad del calcio respecto al lumen en lesiones graves |
|
IVUS: ecografía intravascular; OCT: tomografía de coherencia óptica. |
|||||||
Figura 1. Evaluación del calcio con ecocardiografía intravascular (IVUS) y tomografía de coherencia óptica (OCT). A: calcio parietal en OCT, estructura de baja reflectividad con bordes bien delimitados (asterisco). B: calcio parietal en IVUS, estructura hiperecogénica con sombra posterior. C: nódulo de calcio en OCT, estructura protruyente en la luz con sombra posterior. D: nódulo de calcio en IVUS, estructura que protruye en la luz con sombra posterior.
Con ambas técnicas se han desarrollado escalas de puntuación (tabla 2) que incorporan las características de la calcificación que se han asociado a infraexpansión del stent. La primera escala desarrollada con OCT incluye 3 parámetros: arco del calcio > 180° (2 puntos), longitud del calcio > 5 mm (1 punto) y grosor del calcio > 0,5 mm (1 punto). Aquellas lesiones con una puntuación > 2 tienen riesgo de infraexpansión del stent si no se realiza una adecuada preparación de la placa5. Con IVUS se ha desarrollado una escala similar que utiliza 4 criterios: arco del calcio > 270° con más de 5 mm de longitud (1 punto), arco del calcio > 360° (1 punto), presencia de nódulo calcificado (1 punto) y vaso adyacente < 3,5 mm (1 punto). Una puntuación ≥ 2 indica la necesidad de realizar una técnica de modificación de la placa previa a la implantación del stent10.
Tabla 2. Escalas de puntuación del calcio coronario basadas en tomografía de coherencia óptica y ecografía intravascular
| OCT | IVUS | |||
|---|---|---|---|---|
| Puntos | Puntos | |||
| Máximo arco de calcio | ≤ 180° | 0 | ≤ 270° | 0 |
| > 180° (> 50%* circunferencia) |
2 | 270° y > 5 mm longitud | 1 | |
| 360° | 1 | |||
| Máximo grosor de calcio | ≤ 0,5 mm | 0 | ||
| > 0,5* mm | 1 | |||
| Longitud de calcio | ≤ 5 mm | 0 | ||
| > 5* mm | 1 | |||
| Tipo de calcio | No nodular | 0 | ||
| Nódulo | 1 | |||
| Diámetro del vaso | ≥ 3,5 mm | 0 | ||
| < 3,5 mm | 1 | |||
|
IVUS: ecografía intravascular; OCT: tomografía de coherencia óptica. |
||||
Selección de las técnicas de modificación de la placa basada en la imagen intracoronaria
Las características del calcio evaluado por imagen intracoronaria pueden ayudar a seleccionar la técnica de modificación de la placa más adecuada. Este aspecto se desarrolla en profundidad en el último apartado del documento, pero en general aquellas lesiones en las que el calcio no tenga criterios de riesgo de infraexpansión se podrán tratar utilizando balones de alta presión o balones modificados (scoring o cutting), y cuando sí existan esos criterios será necesario aplicar técnicas de modificación de la placa más avanzadas. Además de estos criterios, también habrá que tener en cuenta la profundidad del calcio, dado que algunas técnicas actúan fundamentalmente en la porción superficial y no profunda de la placa.
Optimización de la implantación del stent basada en la imagen intracoronaria
Tanto el IVUS como la OCT permiten determinar si se ha obtenido una adecuada expansión del stent. Este aspecto es en especial relevante en las lesiones calcificadas, que son las que más se asocian a infraexpansión, y esta es el parámetro más fuertemente relacionado con el fracaso del stent11. La correcta aposición y la ausencia de disección o hematoma significativo en los bordes, así como una adecuada cobertura de la lesión, son los otros parámetros de optimización por la imagen que deben evaluarse tras la implantación de un stent12.
TÉCNICAS INDEPENDIENTES DE BALÓN
Aterectomía rotacional
La aterectomía rotacional (AR) es una técnica que utiliza una oliva metálica recubierta de cristales de diamante en su tercio distal que rota a alta velocidad y realiza un corte diferencial al avanzar por el vaso (figura 2A), pulverizando el tejido calcificado a la vez que preserva el tejido elástico adyacente13.
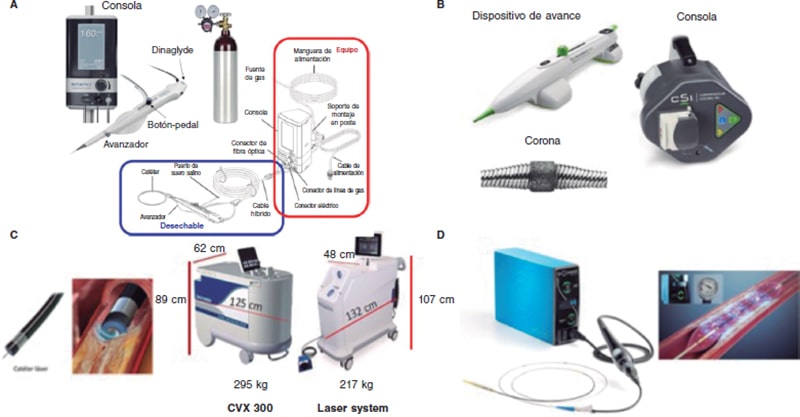
Figura 2. Dispositivos de modificación de la placa. A: dispositivo de aterectomía rotacional. B: dispositivo de aterectomía orbitacional. C: dispositivo de láser coronario con los dos modelos de consola existentes. D: dispositivo de litotricia intravascular. (Modificada con permiso de Cubero-Gallego et al.13)
Surgió hace más de 30 años en un intento de facilitar el tratamiento de las lesiones coronarias mediante la reducción de la carga de placa. El entusiasmo inicial comportó un gran uso de la AR en diversos contextos, no sustentado por estudios científicos. Esto se tradujo en resultados subóptimos14 que derivaron en una reducción de su empleo para casos muy seleccionados. Durante todos estos años, la AR ha evolucionado con mejoras tecnológicas, de la técnica en sí y en la selección de los pacientes.
Actualmente está disponible el sistema ROTAPRO (Boston Scientific, Estados Unidos), que facilita la técnica al haber sustituido el pedal de la versión inicial por un botón ubicado en la parte superior del avanzador de la oliva. Hay otro botón en el lateral del avanzador que permite cambiar al modo dynaglide (rotación a bajas revoluciones, recomendable para introducir y extraer la oliva). La consola es más pequeña y con pantalla digital. Existen olivas de entre 1,25 y 2,5 mm compatibles con catéteres de 6-8 Fr en función de su tamaño. La oliva se avanza sobre una guía específica de 0,009 pulgadas (0,014 en la parte radioopaca), de la que existen 2 versiones (RotaWire Floppy y RotaWire Extra-Support) que se utilizan dependiendo de las características de la placa y del soporte necesario13.
La principal indicación son las lesiones gravemente calcificadas no cruzables o no dilatables con balón. Probablemente, el escenario óptimo es una lesión calcificada concéntrica con un área luminal mínima menor que la oliva. Las lesiones excéntricas y anguladas son menos favorables, ya que conllevan un incremento del riesgo de complicaciones13,15. Se puede realizar como estrategia primaria o de rescate tras un «fallo de balón»; la estrategia primaria se ha asociado con una reducción de la duración del procedimiento, de la radiación y del contraste, y posiblemente con un ahorro de material15.
También ha evolucionado el objetivo de la AR, pasando del antiguo concepto de retirar cuanta más placa mejor (debulking) al más moderno de modificar la placa y «facilitar» el ICP. Esto ha hecho evolucionar las recomendaciones técnicas para realizar la AR. Las recomendaciones actuales se describen en la tabla 3.
Tabla 3. Recomendaciones para el empleo seguro de la aterectomía rotacional
| Acceso arterial | Depende del tamaño máximo de oliva que se vaya a emplear. En la actualidad, el más empleado es el radial porque permite el uso de olivas de hasta 1,75 mm (si el catéter es de 6 Fr) o 2,15 mm (si el catéter es de 7 Fr) |
| Catéter guía | Se aconsejan los de curva simple de alto soporte |
| Guía | El posicionamiento de la guía de manera directa suele ser factible, aunque se puede utilizar una guía convencional y realizar el intercambio mediante microcatéter o balón coaxial En función de las características de la lesión, puede optarse por RotaWire Floppy o Extrasupport |
| Tamaño de la oliva | Es recomendable el empleo de olivas pequeñas para mantener una proporción oliva/arteria ≤ 0,5. La oliva más empleada es la de 1,5 mm. En algunos casos es aconsejable el incremento progresivo del tamaño de la oliva |
| Velocidad de rotablación | Selección de velocidades de rotablación < 180.000 rpm, idealmente entre 135.000 y 150.000 rpm. Reservar las altas velocidades para casos en los que la oliva no es capaz de cruzar pese a una técnica óptima. Prestar especial atención a evitar caídas > 5.000 rpm durante la rotablación |
| Tiempo de ablación | Una menor duración de los periodos de ablación (idealmente ≤ 15 s) reduce el riesgo de complicaciones (bloqueo auriculoventricular, enlentecimiento del flujo) |
| Movimientos de ablación | Movimientos graduales, continuos, de avance y retroceso (pecking) |
| Solución de lavado | Debe usarse solución salina heparinizada con vasodilatadores/espasmolíticos (verapamilo, nitratos) |
| Marcapasos | El uso de olivas de menor diámetro y de velocidades más bajas, y el posicionamiento de la oliva con el modo dinaglyde, han reducido sustancialmente el número de bloqueos auriculoventriculares transitorios durante la rotablación En casos seleccionados, sobre todo en la coronaria derecha o la circunfleja dominante, podría valorarse el empleo preventivo de atropina intravenosa o el implante de un marcapasos transitorio |
La complicación más frecuente es el fenómeno de slow/no-flow, aunque su incidencia ha disminuido hasta un 2,6%17. Se produce por embolización de residuos en la microcirculación y existe más riesgo en lesiones largas en las que se realizan pasadas múltiples y prolongadas con olivas grandes, sin pausas adecuadas entre ellas, y cuando existe mal vaso distal. En caso de tratar la coronaria derecha o las circunflejas dominantes, puede asociarse a trastornos de conducción transitorios. Más infrecuentes son las complicaciones graves como el atrapamiento de la oliva, la perforación y la disección coronaria13. La gravedad de la lesión, las angulaciones marcadas y el uso de olivas muy pequeñas son factores predisponentes para el atrapamiento de la oliva. La tortuosidad, así como la falta de coaxialidad del catéter guía en el tratamiento de lesiones ostiales, pueden favorecer la ocurrencia de disecciones y perforaciones coronarias.
Aunque la AR ha demostrado facilitar el ICP con una mayor tasa de éxito que la angioplastia con balón, no se ha comprobado un claro beneficio clínico18-21.
Para analizar sus resultados hay que destacar que la AR se ha usado en pacientes de mayor riesgo clínico y con lesiones más complejas22. Otro aspecto que debe considerarse es el gran porcentaje de casos en los que está técnica se ha empleado como rescate (12-50%)20,21,23, por lo que es de suponer que sin AR no se habrían podido realizar o tendrían peores resultados. Aunque hay estudios en marcha para determinar las ventajas de la AR electiva o de rescate, la correcta evaluación del paciente y de la lesión coronaria debería inclinarnos a aumentar su uso electivo, o más precoz, con un potencial impacto beneficioso en los resultados24.
En conclusión, la AR realizada conforme a las recomendaciones actuales es segura y eficaz. Debería contarse con ella entre las diversas herramientas disponibles en nuestros laboratorios de cardiología intervencionista y asegurar la formación de todo el personal para su correcto uso.
Aterectomía orbitacional
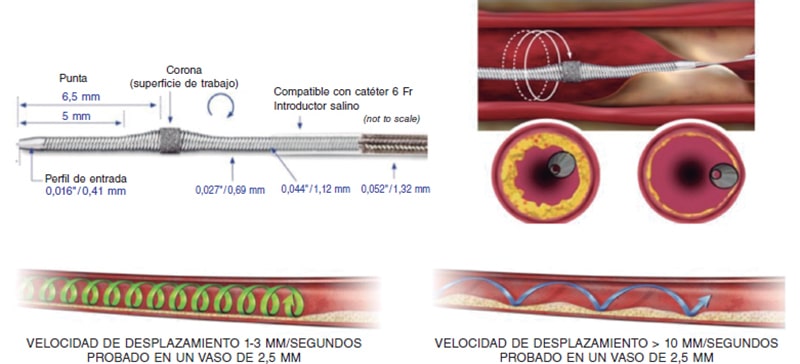
El dispositivo Diamonback-360 (OAS) (Cardiovascular Systems, Estados Unidos) consiste en una corona orbital bidireccional diamantada que utiliza una combinación de fuerza centrífuga (creando órbitas elípticas) y rozamiento de la superficie para modificar la placa calcificada y aumentar la distensibilidad (figura 2B). Además, con el impacto pulsátil de la corona al incrementar la velocidad, puede crear microfracturas que modifican el calcio profundo (figura 2B y figura 3). Debido a esto, una sola corona de 1,25 mm puede tratar vasos desde 2,5 hasta 4 mm.
Figura 3. Características del catéter de aterectomía orbitacional y sus efectos. (Modificada con permiso de Cardiovascular Systems25.)
En comparación con el resto de las técnicas de modificación de la placa, la aterectomía orbitacional (AO) es la que más tarde se ha introducido en nuestro país y aún es escasa la experiencia con ella.
Su principal indicación es el tratamiento de lesiones calcificadas no dilatables26.
El procedimiento de preparación es muy similar al de la AR, pero es necesaria una guía específica, la Viper-Wire (0,012 pulgadas (0,014 la parte radiopaca). La corona se avanza con el sistema Glide-Assist (rotación a bajas revoluciones) hasta posicionarse cerca de la lesión. Otra característica diferencial del dispositivo es la posibilidad de realizar la ablación de manera anterógrada y retrógrada. A diferencia de la AR, la velocidad de avance del dispositivo debe ser muy lenta (1-3 mm/s) para asegurar un buen resultado del procedimiento y disminuir las complicaciones17,26. El mecanismo de acción de la AO consiste en una rotación elíptica de la corona, que consigue un aumento progresivo del diámetro orbital a medida que se aumenta la velocidad de rotación de 80.000 a 120.000 rpm. Se recomiendan ciclos ≤ 30 s (existe una señal sonora de aviso para terminar el ciclo) con pausas de 20-30 s entre ellos, que pueden duplicarse si ha habido mala tolerancia hemodinámica26. Es necesaria la infusión continua de una solución lubricante para ayudar a minimizar las lesiones térmicas durante la AO; además, se administran aproximadamente 18 ml/min de líquido para ayudar a refrigerar el dispositivo y a eliminar los residuos, disminuyendo así la isquemia y la embolización distal13,26,27.
Las complicaciones son similares a las descritas para la AR. No obstante, la aplicación retrógrada disminuye la probabilidad de atrapamiento de la corona y puede reducir el riesgo de disección o perforación en lesiones anguladas u ostiales. La incidencia de perforación es del 0,7-2%28,29. Los residuos que se producen con la AO teóricamente son de menor tamaño que los producidos con la AR, y esto, unido a que la corona no impide el flujo coronario durante la aterectomía, reduce el riesgo de fenómeno de slow/no-reflow, así como la lesión térmica endotelial27. Sin embargo, no son raros los trastornos de la conducción transitorios cuando se trata la coronaria derecha o la circunfleja dominante.
La evidencia actual se basa en los estudios ORBIT I30 y ORBIT II28, en los que la AO obtuvo buenos resultados en cuanto a éxito del procedimiento (94 y 89%, respectivamente), con tasas de eventos cardiovasculares adversos mayores (MACE) del 23,5% y de revascularización de la lesión diana del 7,8% a los 3 años31. Posteriormente se realizó el estudio COAST29, en el que se utilizó el nuevo sistema MicroCrown. En él se incluyeron 100 pacientes, con una tasa de éxito del procedimiento del 85% y una tasa de MACE del 22,2% al año de seguimiento. Estamos en espera de los resultados del estudio ECLIPSE, que aleatorizará 2.000 pacientes con calcificación grave para ser tratados con AO o con predilatación con balón antes del implante de un stent farmacoactivo.
En resumen, la AO es una técnica de modificación del calcio complementaria al resto con potenciales ventajas técnicas, como tener un solo tamaño de corona compatible con 6 Fr para tratar todas las lesiones y la posibilidad de aplicación en retroceso. Aunque faltan datos de estudios comparativos, su elección dependerá del perfil del paciente y de la lesión que se vaya a tratar, siendo la imagen intracoronaria un aspecto esencial.
Láser Excimer
La angioplastia coronaria con láser Excimer (ELCA) se basa en un láser de cloruro de xenón que genera pulsos cortos de luz ultravioleta de 308 nm que penetran solo 50 µm, y esto lo hace más seguro en comparación con los antiguos láseres infrarrojos de onda continua. Modifica la placa mediante un triple mecanismo: fotoquímico (rotura de enlaces moleculares), fototérmico (vaporización tisular) y fotocinético (expansión y colapso de la burbuja de la punta del catéter durante su avance). Los fragmentos liberados son < 10 μm, lo cual minimiza la afectación microvascular al ser absorbidos por el sistema reticuloendotelial.
El sistema actual es el CVX-300 Laser System (Philips), aunque ya existe uno de nueva generación, el LAS-100 Laser System (Philips), que lo sustituirá próximamente (figura 2C). Existen diferentes tamaños de catéteres (0,9, 1,4, 1,7 y 2,0 mm) (tabla 4), cuya selección depende del tipo de lesión y del tamaño del vaso (ratio catéter/diámetro del vaso: 0,5-0,6), siendo el más usado el de 0,9 mm por su menor perfil y porque alcanza mayor fluencia (80 mJ/mm2), tasa de repetición de pulso (80 Hz) y duración de la aplicación (10 s con 5 s de reposo), aumentando las probabilidades de éxito en placas fibrocalcificadas32,33.
Tabla 4. Características de los catéteres de angioplastia coronaria con láser Excimer
| 0,9 mm-X 80 | 1,4 mm | 1,7 mm | 2 mm | |
|---|---|---|---|---|
| Catéter guía compatible | 6 Fr | 6/7 Fr | 7 Fr | 8 Fr |
| Diámetro mínimo del vaso (mm) | 2 | 2,2 | 2,5 | 3 |
| Energía (mJ/mm2) | 30-80 | 30-60 | 30-60 | 30-60 |
| Frecuencia (Hz) | 25-80 | 25-40 | 25-40 | 25-40 |
| Tiempo de aplicación/pausa (s) | 10/5 | 5/10 | 5/10 | 5/10 |
Antes de su uso es necesario primero calibrar la consola y luego el catéter. En ambos momentos, todos los profesionales y el paciente deben usar gafas protectoras para evitar daños oculares. Posteriormente, se introduce a través de cualquier guía coronaria de 0,014 pulgadas hasta alcanzar la lesión; existe un sistema monorraíl que facilita su avance. La energía se libera a través del extremo distal del catéter mientras se avanza muy lentamente (0,5 mm/s) para modificar la placa; también se puede aplicar en retirada. Es importante optimizar el soporte para asegurar el avance del catéter. No existe un límite de pulsos y tiene mayor efecto cuantos más se usen, aunque también comporta un mayor riesgo de complicaciones. Algunos autores sugieren un máximo de 12 aplicaciones33. Es conveniente valorar el estado del vaso tras cada aplicación. En cuanto a la selección de los parámetros, tradicionalmente se iniciaba a 45 mJ/mm2 y 25 Hz, pero cada vez más operadores optan por unas mayores energía y frecuencia iniciales, sobre todo para tratar lesiones resistentes o calcificadas33.
Antes y durante las aplicaciones se recomienda lavar el vaso de sangre y contraste con una infusión de solución salina fisiológica (1-3 ml/s). En lesiones resistentes, con calcificación grave o stents infraexpandidos, puede requerirse una mayor energía. Esta puede alcanzarse no lavando la sangre con solución salina fisiológica o incluso administrando contraste durante las aplicaciones («técnica de explosión»). Esta técnica alcanza la máxima potencia, pero incrementa el riesgo de complicaciones. Algunos autores33 la recomiendan como primera opción en lesiones no trombóticas, aunque parece prudente reservarla para lesiones resistentes a ELCA con infusión salina.
Las indicaciones de la ELCA se han clasificado tradicionalmente en dos grupos: lesiones «trombóticas» (no abordadas en este documento) y lesiones «calcificadas» (no trombóticas, como reestenosis en el interior del stent, oclusiones crónicas, lesiones calcificadas, etc.). Estas últimas pueden dividirse en lesiones no cruzables y no dilatables, en las que a continuación se describe la utilidad de la ELCA.
Lesiones no cruzables
La principal ventaja del láser es su compatibilidad con cualquier guía coronaria. Así, las lesiones no cruzables con balón/microcatéter constituyen su principal indicación17. En un registro multicéntrico de lesiones no cruzables, el éxito del procedimiento fue del 87,3%, con un 0,8% de disecciones con afectación del flujo y ninguna perforación34. La calcificación grave se ha asociado a mayor probabilidad de fallo de la técnica34, ya que parece que la ablación la realiza fundamentalmente en los tejidos que hay entre el calcio35. Sin embargo, la utilización de ELCA con contraste podría incrementar el éxito en estas lesiones33.
Lesiones no dilatables
Aunque el éxito de la ELCA en lesiones no dilatables es alto36, habitualmente no es el tratamiento de primera línea. Dentro de estas lesiones, un escenario interesante son las lesiones en el interior del stent (reestenosis o infraexpansión). En la infraexpansión aguda, la ELCA podría ser el tratamiento de elección. Permite modificar el tejido resistente detrás del stent sin alterar su arquitectura. Su utilización con contraste podría ser más segura por el efecto «protector» del stent. Se han publicado casos aislados y series pequeñas con tasas de éxito superiores al 95% y pocas complicaciones37.
Es una técnica segura cuando se realiza según las recomendaciones. La disección coronaria es la complicación más frecuente (5%), aunque es poco habitual que sea limitante de flujo (1%). La frecuencia de perforación coronaria es < 1%38, y la embolización distal y las arritmias ventriculares son excepcionales39.
En conclusión, la ELCA es una técnica especialmente útil en lesiones no cruzables debido a su compatibilidad con cualquier guía de angioplastia. También ha demostrado su eficacia en lesiones no dilatables, incluidas las lesiones en el interior del stent. Sin embargo, aún falta información sobre su eficacia en lesiones calcificadas.
TÉCNICAS DEPENDIENTES DE BALÓN
Balones de corte y de scoring
Los balones de corte (BC) son dispositivos de modificación de la placa que aparecieron como una alternativa a los antiguos balones de angioplastia coronaria40. Su objetivo es lograr una rotura controlada de la placa (con incisiones en el tejido fibrocálcico) (figura 4), facilitando la expansión de los balones, minimizando el daño de la íntima y disminuyendo la reestenosis18,41.
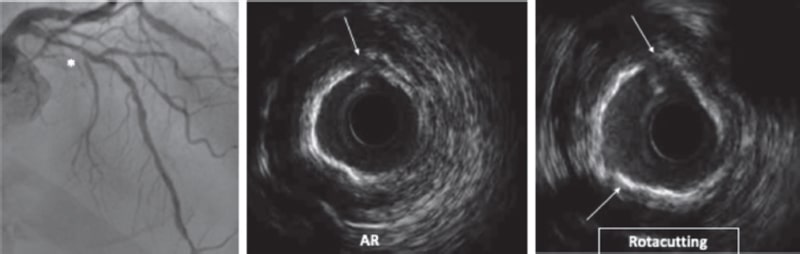
Figura 4. Técnica Rotacutting. Efecto de la aterectomía rotacional (AR) y del balón de corte (Rotacutting) posterior con mayor modificación de la placa y área luminal mínima.
Existen dos tipos: el BC y el balón de scoring (BS). Se ha descrito su uso en diferentes escenarios, como reestenosis en el interior del stent, lesiones aortoostiales, bifurcaciones y vaso pequeño asociado a uso de balón farmacoactivo42.
Las principales limitaciones de los BC son sus peores navegabilidad y perfil de cruce en comparación con los balones convencionales, aunque en los últimos años han mejorado estos aspectos. Los BS tienen una mejor navegabilidad que los antiguos BC.
La complicación más temida es la rotura coronaria, pero no se ha demostrado un incremento significativo con su uso.
La principal diferencia entre los dispositivos disponibles radica en sus diferentes elementos externos de aterotomía, que se describen a continuación (figura 5).
Figura 5. Características de balones modificados. A: balón de corte (Boston Scientific, Estados Unidos). B: WOLVERINE (Boston Scientific, Estados Unidos). C: AngioSculpt (Spectranetics, Estados Unidos). D: Scoreflex (OrbusNeich, Hong Kong ). E: Grip (Acrostak, Suiza). F: NSE-Alpha (B. Braun, Alemania). G: Naviscore (iVascular, España).
Cutting Balloon Flextome
El Cutting Balloon Flextome (Boston Scientific, Estados Unidos) consiste en un balón NC (no distensible) con 3 microcuchillas montadas longitudinalmente sobre la superficie. No ha demostrado superioridad sobre los balones convencionales en lesiones A/B, por lo que su uso se limita solo a lesiones complejas17 y calcificadas43.
WOLVERINE
El Wolverine (Boston Scientific, Estados Unidos) es la evolución del anterior, con mejor perfil de cruce, mayor flexibilidad y punta más visible.
AngioSculpt
El AngioSculpt (Spectranetics, Estados Unidos) consiste en un balón semidistensible con bajo perfil de cruce, rodeado de forma helicoidal por 3 filamentos de nitinol que aseguran el anclaje del balón, con menor riesgo de disección o perforación17. Es un dispositivo más flexible y tiene una mejor navegabilidad que el antiguo BC44, con buenos resultados en comparación con la dilatación con balón semidistensible45.
Scoreflex
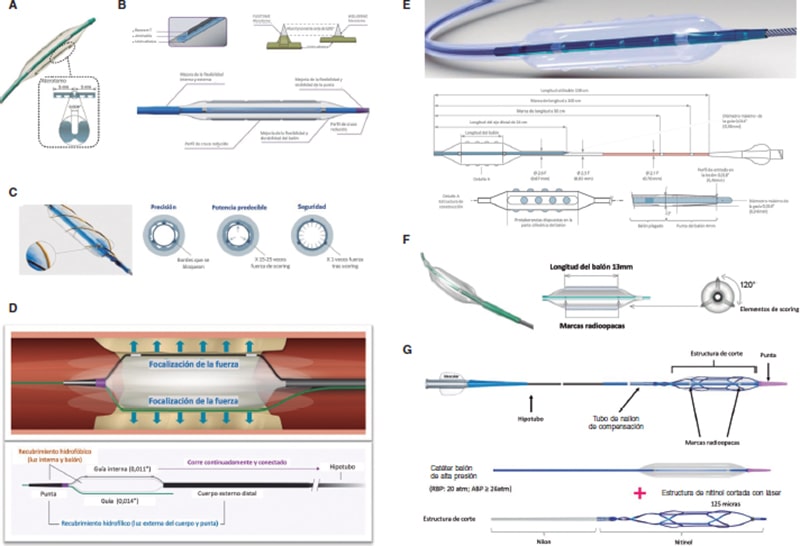
El Scoreflex (OrbusNeich, Hong Kong) es un BS compuesto por un balón NC con un sistema de doble alambre de nitinol que facilita la modificación controlada de la placa a baja presión. Tiene un bajo perfil y posee una combinación de revestimiento hidrófilo e hidrófobo que minimiza la fricción durante el cruce de la lesión.
Grip
El Grip (Acrostak, Suiza) es un balón de alta presión con 4 hileras de 3 o 4 protuberancias cada una. Permite dilatar hasta 22 atm. Tiene una punta cónica en dos versiones: Grip, con punta corta de 2 mm, y Grip TT, con punta larga de 4 mm para una mayor navegabilidad en anatomías tortuosas. Tiene un recubrimiento hidrolubricado en la punta y en el catéter (no en el balón), lo que facilita su anclaje en la lesión a la vez que su navegabilidad hasta esta.
NSE Alpha
El NSE Alpha (B. Braun, Alemania) es un BS con 3 elementos de scoring de nailon y una sección triangular de corte unidos solo en ambos extremos del balón y dispuestos en 120°. Destacan su flexibilidad y navegabilidad, con buenos resultados en lesiones de novo y en reestenosis en el interior del stent18.
NaviscoreTM
El NaviscoreTM (iVascular, España) es un BS con un diseño que combina los beneficios del BS y del BC. Consiste en un balón de alta presión con filamentos de nitinol de unas 125 µm de grosor. Los filamentos tienen una orientación axial que permite una mayor capacidad de cruce y más flexibilidad, además de una modificación de la placa en angulación de 90° con menos riesgo de perforación. El recubrimiento hidrófilo del catéter permite mejorar su navegabilidad.
En conclusión, los BC y los BS son dispositivos de modificación de la placa útiles en lesiones no dilatables cuando la calcificación no es muy grave. Su principal ventaja es su facilidad de uso, al ser una técnica con balón compatible con guías de angioplastia convencionales.
Balones de muy alta presión
El balón NC de muy alta presión (BMAP) OPN (SIS medical, Suiza) es un balón de doble capa que permite una expansión homogénea, a muy alta presión, sin aumentar su diámetro. Está disponible con diámetros de 2 a 4 mm y presión de rotura de 35 atm, aunque testado en fábrica hasta 45 atm (tabla 5)46.
Tabla 5. Distensibilidad del balón de muy alta presión OPN NC
| Presión (atm) | OPN NC 2,0 (mm) | OPN NC 2,5 (mm) | OPN NC 3,0 (mm) | OPN NC 3,5 (mm) | OPN NC 4,0 (mm) |
|---|---|---|---|---|---|
| 10 | 2,0 | 2,5 | 3,0 | 3,5 | 4,0 |
| 20 | 2,1 | 2,6 | 3,14 | 3,67 | 4,19 |
| 30 | 2,18 | 2,7 | 3,29 | 3,85 | 4,37 |
| 35 | 2,2 | 2,77 | 3,36 | 3,91 | 4,41 |
|
NC: no distensible. |
|||||
El BMAP lleva usándose más de 10 años y ha demostrado ser seguro y eficaz hasta 40 atm en lesiones gravemente calcificadas tras el fallo de otros dispositivos y en la infraexpansión del stent, con tasas de éxito del 75-100% sin evidencia de disección, perforación ni rotura del balón en pequeñas series de casos47. Comparado con el balón NC convencional en lesiones no dilatables, ha demostrado obtener un diámetro luminal mínimo y una ganancia aguda mayores, con menor estenosis residual48.
En el mayor registro hasta la fecha se incluyeron 326 pacientes con lesiones no dilatables en los que se usó el BMAP tras el fallo de un balón NC. Los pacientes se dividieron en dos grupos: los que respondieron con presiones de 30-40 atm y los que respondieron con presiones > 40 atm. El éxito del procedimiento se alcanzó en el 96,6% de los pacientes. El 53% respondieron a presiones de 30-40 atm, mientras que el 47% restante lo hicieron a presiones > 40 atm. A 180 de los pacientes se le realizó imagen intracoronaria, y de estos, 106 presentaron calcificación > 270°. En este subgrupo de pacientes, la presión requerida para una óptima expansión fue > 40 atm en el 78,3% de los casos. Tres pacientes (0,9%) presentaron roturas coronarias, que fueron resueltas con inflados prolongados o implante de stents cubiertos. En los 3 casos, la rotura ocurrió en la predilatación y se asoció a la rotura del balón, con presiones de 30-40 atm, lo cual sugiere que la perforación no parece estar relacionada con la presión de inflado sino con las características de la placa o con la estimación del tamaño del vaso, que en los 3 casos fue por angiografía49.
En el año 2021 se publicó el estudio ISAR-CAL50, en el que se aleatorizaron 70 pacientes con lesiones coronarias gravemente calcificadas y predilatación fallida con balón NC para ser tratados con BS o con BMAP. El objetivo principal fue comparar la expansión del stent por OCT. No hubo diferencias en el porcentaje de expansión del stent, pero sí en objetivos secundarios angiográficos como la mejoría del diámetro luminal mínimo y la estenosis residual, a favor del BMAP50.
Por último, las oclusiones crónicas son el máximo exponente de lesiones calcificadas y complejas. En el estudio PLACCTON, el uso de BMAP, tanto de forma aislada como combinado con otras técnicas de modificación de la placa, resultó seguro y eficaz en casos seleccionados de oclusiones crónicas51.
En conclusión, el BMAP es una alternativa segura y eficaz en lesiones calcificadas no dilatables. Faltan estudios aleatorizados que nos permitan definir mejor la estrategia para el uso de dicho dispositivo y del resto de las técnicas de modificación de la placa.
Litotricia intracoronaria
El sistema de litotricia intracoronaria (LIC) está formado por un catéter balón específico (Shockwave Medical, Estados Unidos) que se conecta a un generador portátil recargable (figura 2D). El generador produce pulsos de energía que se transmiten a unos emisores situados en el interior del balón. Los pulsos se emiten a una frecuencia de 1 por segundo, hasta un máximo de 10 pulsos por aplicación. Cada catéter balón puede administrar un máximo de 80 pulsos. El catéter consiste en un balón semidistensible de recambio rápido con un perfil de cruce de 0,042 pulgadas que es compatible con cualquier guía de 0,014 pulgadas y con catéteres guía de 6 Fr.
Su principal indicación son las lesiones calcificadas no dilatables.
Se recomienda una relación 1:1 entre el diámetro del vaso y el del balón. Una vez posicionado en la lesión, el balón se hincha a 4 atm para asegurar un buen contacto entre la superficie del balón y la pared vascular, que facilite la transmisión de la energía. El balón tiene en su interior 2 emisores que reciben una descarga eléctrica proveniente del generador, con lo que se vaporiza el líquido que hay en su interior y se generan ondas sónicas que provocan un efecto local. Cada pulso libera el equivalente a 50 atm.
Estas ondas atraviesan el tejido blando causando microfracturas selectivas del calcio a nivel de las capas íntima y media. Tras la emisión de pulsos y la correspondiente modificación del calcio, el balón se infla hasta 6 atm para maximizar la ganancia luminal. El catéter balón está disponible con una longitud única de 12 mm y con diámetros de 2,5, 3,0, 3,5 y 4,0 mm52.
La mayor evidencia disponible proviene del estudio Disrupt-CAD III, un registro prospectivo que evaluó la eficacia y la seguridad de la LIC en 431 pacientes con lesiones calcificadas. La incidencia de MACE (muerte, infarto o revascularización de la lesión diana) a 30 días fue del 7,8% y la efectividad (éxito del procedimiento con estenosis en el interior del stent < 50%) fue del 92,4%. En este estudio no se incluyeron pacientes con infarto agudo de miocardio ni con lesiones complejas53. Recientemente se han publicado los resultados del seguimiento a 12 meses, en el que se objetivó una incidencia de MACE del 13,8%, con una tasa de trombosis del stent del 1,1%54.
La base del tratamiento con balón de LIC es una fractura controlada del calcio coronario. En un subestudio con OCT del Disrupt-CAD II tras la LIC se observaron fracturas en el calcio en el 79% de las lesiones55, frente a un 67% de las lesiones en el estudio Disrupt-CAD III53.
A pesar de que el uso del balón de LIC se ha extendido en todo el mundo, todavía hay poca información sobre la seguridad y la eficacia de su uso en contextos complejos (síndrome coronario agudo, oclusiones crónicas, bifurcaciones o lesiones aortoostiales), y muchas veces esta se limita a casos aislados o series cortas52. Las principales limitaciones del sistema son una capacidad de cruce reducida en estenosis graves calcificadas o tortuosas y su dificultad de uso en lesiones difusas o multivaso (por el número limitado de pulsos por catéter y el diferente calibre de los vasos a tratar).
Un estudio ha valorado el uso del dispositivo en stents infraexpandidos por calcificación coronaria grave, y ha objetivado un éxito angiográfico de hasta el 73%, inferior al 95% observado en lesiones nativas56, probablemente porque sea aún más difícil expandir una lesión calcificada cuando el stent ya está implantado. Por ello, con independencia de la técnica usada, es recomendable no implantar el stent hasta haber preparado adecuadamente la lesión. Además, la aplicación de litotricia en este contexto, en especial sobre stents recién implantados, podría producir daños estructurales en el polímero57. Otro registro multicéntrico ha mostrado un éxito del dispositivo del 92,3% en este tipo de lesiones58. Faltan datos a medio y largo plazo sobre la seguridad de esta técnica en dicho escenario.
Se ha descrito el uso combinado de balón de LIC con otros dispositivos modificadores de la placa, como AR59, AO60 o ELCA61, y parece una estrategia muy atractiva en casos en los que no se consiga llegar con el balón de LIC hasta la lesión diana.
En conclusión, la LIC ha tenido un crecimiento exponencial en el tratamiento de las lesiones calcificadas no dilatables, por su seguridad, eficacia y corta curva de aprendizaje. Sin embargo, falta información sobre su uso en escenarios complejos y sus resultados en comparación con otras técnicas de modificación de la placa.
TÉCNICAS COMBINADAS
No hay mucha evidencia sobre la combinación de dispositivos o de técnicas de modificación de la placa en lesiones gravemente calcificadas.
La realización de AR seguida de BC (RotaCutting) (figura 4) o de litotricia (RotaTripsy) (figura 6) se ha descrito como técnica complementaria, segura y eficaz62-64. En ambos casos, el concepto es similar. La AR afecta principalmente al calcio superficial, pero no al más profundo, y en ocasiones es insuficiente para preparar adecuadamente la placa. Por otro lado, el BC o la litotricia podrían complementar la acción de la AR en la modificación de la placa. Sin embargo, si la lesión calcificada determina una estenosis muy grave, puede ser difícil alcanzar con estos balones la lesión diana. En su uso combinado, la AR modifica el calcio superficial creando un túnel que permite avanzar el BC o el balón de litotricia, que una vez posicionado completa la modificación de la placa. Como diferencias entre ambas técnicas, hay que tener en cuenta que el BC puede ayudar a la fractura del calcio si no existe una calcificación muy grave. La técnica RotaTripsy59,63 puede ser más eficaz para lesiones gravemente calcificadas con calcio grueso, pero tiene un mayor coste. Con un concepto similar, se ha descrito la combinación de AO con litotricia, con buenos resultados60.
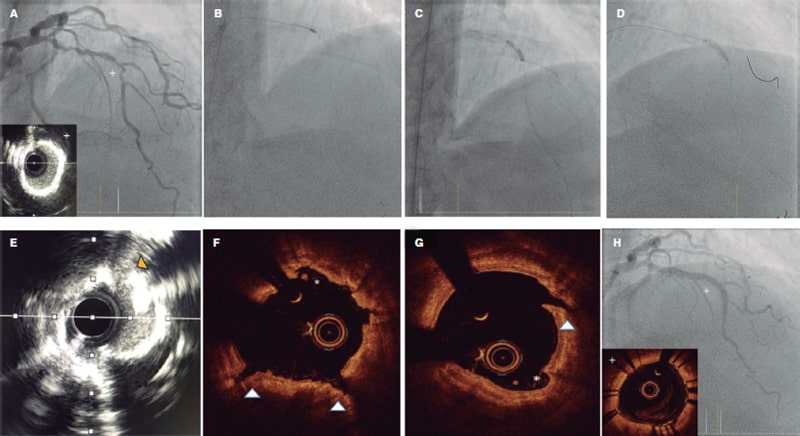
Figura 6. Técnica Rotatripsy. A: estenosis grave muy calcificada en la arteria descendente anterior. Ecografía intravascular (IVUS) que muestra calcificación de 360°. B: aterectomía rotacional (AR) (oliva de 1,5 mm). C: infraexpansión de balón no distensible de 3 mm tras la AR. D: litotricia intracoronaria con balón de 3 mm con adecuada expansión a 6 atm tras 50 pulsos. E-G: IVUS y tomografía de coherencia óptica que muestran el efecto combinado de la AR y la litotricia con múltiples zonas de «limado/disección» intimal provocados por la AR (asteriscos) y fracturas intimales y profundas producidas por la litotricia. H: resultado final tras el implante de un stent.
La AR también se ha combinado con ELCA (técnica RASER)65. El láser puede ser la única opción en lesiones verdaderamente no cruzables para facilitar el avance de un microcatéter y así realizar el intercambio por la RotaWire y completar el ICP. Esto podría aplicarse de forma similar combinando el láser con la AO.
Se ha descrito la combinación de ELCA y litotricia (técnica ELCATripsy) para casos en los que la AR o la AO no son recomendables, como lesiones cercanas o a nivel de stents recientemente implantados. En estos casos, el láser podría crear un túnel que facilite el avance del balón de litotricia sin riesgo de dañar el stent recién implantado61.
ALGORITMO PARA EL TRATAMIENTO ÓPTIMO DE LAS LESIONES CORONARIAS CALCIFICADAS
Para la elección de la estrategia de modificación de la placa hay que conocer las particularidades de las distintas técnicas, así como sus indicaciones y sus riesgos (tabla 6). Además, hay que tener en cuenta el perfil clínico del paciente, las características de la lesión, los medios disponibles y las capacidades del operador. En algunos casos complejos, puede ser razonable no realizar el ICP ad hoc para planificarlo adecuadamente e incluso realizar la angioplastia entre dos operadores expertos.
Tabla 6. Comparación de las distintas técnicas de modificación de la placa
| Técnicas que no utilizan balón | Técnicas que utilizan balóna | ||||||
|---|---|---|---|---|---|---|---|
| AR | AO | ELCA | BC | BS | BMAP | LIC | |
| Características técnicas | |||||||
| Descripción de la tecnología | Oliva con punta diamantada que rota a alta velocidad | Corona diamantada con rotación elíptica | Energía ultravioleta con efectos fotoquímico, fototérmico y fotocinético | Balón NC con microcuchillas longitudinales | Balón SC con elementos de scoring en la superficie | Balón NC de doble capa que permite muy alta presión | Balón SC que emite energía mecánica pulsátil |
| Mecanismo de acción | Corte diferencial/abrasión anterógrada Efecto adicional derivado de la vibración de la corona (+) |
Lijado diferencial/abrasión anterógrada y retrógrada Efecto adicional derivado de la vibración dela corona (+++) |
Fotoablación/vaporización | Corte superficial de la placa | Corte superficial de la placa | Inflado a 35-40 atm | Litotricia/fragmentación del calcio |
| Tamaños de dispositivos | Oliva de 1,25-2,5 mm | Corona de 1,25 mm | Catéteres de 0,9-2 mm | 2-4 mm | 1,47-4 mm | 1,5-4 mm | 2,5-4 mm |
| Catéter guía compatible* | 6 Fr; 1,25 y 1,5 mm 7 Fr; 1,75 mm 8 Fr; 2,0 y 2,15 mm 9 Fr; 2,25 y 2,38 mm 10 Fr; 2,50 mm |
6 Fr | 6 Fr; 0,9 y 1,4 mm 7 Fr; 1,7 mm 8 Fr; 2,0 mm |
6 Fr | 6 Fr (algunos con 5 Fr) | 6 Fr | 6 Fr |
| Tipo de guía compatible | RotaWire 0,009 pulgadas (0,014 la parte radiopaca) | ViperWire 0,012 pulgadas (0,014 la parte radiopaca) | Cualquier guía de 0,014 pulgadas | Cualquier guía de 0,014 pulgadas | Cualquier guía de 0,014 pulgadas | Cualquier guía de 0,014 pulgadas | Cualquier guía de 0,014 pulgadas |
| Tipo de consola/sistema | Pequeña sin pedal (RotaPro) | Pequeña sin pedal | Grande con pedal | – | – | – | Pequeña sin pedal |
| Indicaciones y efectos | |||||||
| Indicación principal | Modificación de la placa (lesiones calcificadas no dilatables o solo cruzables por microcatéter) | Modificación de la placa (lesiones calcificadas no dilatables o solo cruzables por microcatéter) | Modificación de la placa (lesiones no cruzables, lesiones no dilatables en el interior del stent) | RIS | RIS | Optimización de la expansión del stent | Modificación de la placa calcificada |
| Efecto sobre calcio intimal o profundo | Intimal | Intimal y profundo | Intimal y profundo | Intimal | Intimal | Intimal | Intimal y profundo |
| RIS | Sí | Sí | Sí | Sí | Sí | Sí | Sí |
| Infraexpansión de stent | Solo crónica | Solo crónica | Aguda o crónica | – | – | Aguda o crónica | Solo recomendable en crónica |
| Ventajas | Útil en lesiones no cruzables con balón Mayor disponibilidad que AO/ELCA |
Posibilidad de aplicación retrógrada (útil en lesiones anguladas/ostiales) Una sola corona para todos los casos compatible con 6 Fr |
No necesidad de guía específica Catéter de 0,9 (el más frecuente) compatible con 6 Fr Elección en lesiones no cruzables con balón y microcatéter Permite guía en ramas laterales |
Curva de aprendizaje corta Compatible con guías de 0,014 pulgadas y 6 Fr Permite guía en ramas laterales Menor coste |
Curva de aprendizaje corta Compatible con guías de 0,014 pulgadas y 6 Fr Permite guía en ramas laterales Menor coste |
Curva de aprendizaje corta Compatible con guías de 0,014 pulgadas y 6 Fr Permite guía en ramas laterales Menor coste. |
Curva de aprendizaje corta Compatible con guías de 0,014 pulgadas y 6 Fr Permite guía en ramas laterales |
| Desventajas | Curva de aprendizaje larga Necesidad de guía específica Necesidad de catéter guía de gran Fr para olivas grandes |
Curva de aprendizaje larga Necesidad de guía específica Peor capacidad de cruce en lesiones no cruzables con balón Se requiere un lubricante específico que está contraindicado en pacientes alérgicos al huevo y la soja |
Curva de aprendizaje intermedia Consola voluminosa y necesidad de calentamiento y calibrado |
Limitada capacidad de cruce No útil en calcificación muy grave |
No útil en calcificación muy grave | Limitada capacidad de cruce | Limitada capacidad de cruce Límite de pulsos por catéter |
| Complicaciones | |||||||
| Perforación/disección mayor | Moderado | Moderado | Moderado | Bajo/moderado | Bajo/moderado | Bajo/moderado | Bajo |
| Slow/no-flow | Moderado | Moderado | Bajo | Bajo | Bajo | Bajo | Bajo |
| Bloqueo auriculoventricular | Moderado en CD/CX dominantes | Moderado en CD/CX dominantes | Bajo | Bajo | Bajo | Bajo | Bajo |
| Atrapamiento | Moderado (mayor con oliva de 1,25 mm y en lesiones graves y anguladas) | Bajo | Bajo | Bajo | Bajo | Bajo (no infrecuente atrapamiento sobre la guía; valorar una segunda guía paralela) | Bajo |
| Recomendaciones técnicas | Velocidad 135.000-180.000 Relación dispositivo/vaso ≤ 0,6 Movimientos de pecking Ciclos cortos con pausas entre ellos Evitar lesiones anguladas |
Velocidad 80.000-120.000 Movimiento continuo lento de avance y retroceso (útil en anguladas y ostiales) Ciclos cortos con pausas más largas entre ellos si deterioro hemodinámico Evitar anterógrado en lesiones anguladas |
Relación dispositivo/vaso ≤ 0,6 Movimiento continuo lento de avance (también aplicable en retroceso) Aplicación durante inyección de solución salina Aplicación sin lavar con solución salina o con inyección de contraste en casos seleccionados Evitar lesiones anguladas |
Balón 1:1 dimensionamiento del vaso Inflado y desinflado lento y gradual Rotar el balón seguido de inflados repetidos puede aumentar el número de incisiones |
Balón 1:1: dimensionamiento del vaso Inflado y desinflado lento y gradual |
Balón 1:1: dimensionamiento del vaso Inflado y desinflado lento y gradual |
Balón 1:1: dimensionamiento del vaso Purgado óptimo de aire del balón Secuencia de inflado a 4 atm, aplicación de 10 pulsos e inflado a 6 atm Desinflado gradual tras pitido en consola Al menos 20 pulsos en cada lesión |
|
AO: aterectomía orbitacional; AR: aterectomía rotacional; BC: balón de corte; BMAP: balón de muy alta presión; BS: balón de scoring; CD: arteria coronaria derecha; CX: arteria circunfleja; ELCA: angioplastia coronaria con láser Excimer; LIC: litotricia intracoronaria; NC: no distensible; RIS: reestenosis en el interior del stent; SC: semidistensible. |
|||||||
La evidencia actual proveniente de estudios comparativos o de ensayos clínicos que permita elegir entre las distintas técnicas de modificación de la placa es muy limitada66,67 (tabla 7). Por este motivo, aunque se han propuesto distintos algoritmos sobre el tipo de calcio y la técnica de modificación de la placa a elegir67, no existen indicaciones claras en las guías de práctica clínica. Hay estudios en marcha que podrán aportar más información en el futuro.
Tabla 7. Principales estudios sobre técnicas de modificación de la placa
| Estudio (año) | Diseño y tamaño muestral | Tipo de lesión | Resultados principales |
|---|---|---|---|
| Aterectomía rotacional | |||
| ROTAXUS20,24 (2013) | ECA de 240 p (120 AR, 120 TE) | Calcificación moderada-grave | – Éxito de la estrategia: AR 92,5% y TE 83,3%; p = 0,03 – Ganancia luminal aguda: AR 1,56 mm y TE 1,44; p < 0,01 – No diferencias significativas en disección, perforaciones y flujo lento/ausencia de flujo – Pérdida luminal en el stent a 9 meses: AR 0,44 mm y TE 0,31 mm; p = 0,04 – MACE a 9 meses: AR 24,2% y TE 28,3%; p = 0,46. – MACE a 2 años: AR 29,4% y TE: 34,3%; p = 0,47 |
| PREPARE CALC21 (2018) | ECA: 200 p AR vs. BM (de corte o de scoring) |
Calcificación grave | – Éxito de la estrategia: AR 98% y BM 81%; p = 0,0001 – No diferencias significativas en disección, perforaciones y flujo lento/ausencia de flujo – Pérdida luminal a 9 meses: AR 0,22 mm y BM 0,16 mm; p = 0,21 – RLD a 9 meses: AR 2% y BM 7%; p = 0,17 – No diferencias significativas a 9 meses en mortalidad ni trombosis de stent |
| Aterectomía orbitacional | |||
| ORBIT I30 (2013) | EPNA de 50 p | Calcificación (leve a grave) | – Éxito del procedimiento (estenosis residual < 20% tras stent): 94% – Tasa de MACE a 6 meses: 8% – Disección: 12% – Perforación: 2% |
| ORBIT II28,31 (2014) | EPNA de 443 p | Calcificación grave | – Éxito del procedimiento (estenosis < 50% tras implante de stent sin MACE intrahospitalarios): 98,6% – Disección grave: 2,3% – Perforación: 0,9% – Flujo lento/ausencia de flujo: 0,2% – MACE a 30 días y 3 años: 10,4% y 23,5%, respectivamente |
| COAST29 (2020) | EPNA de 100 p | Calcificación grave | – Éxito del procedimiento (estenosis < 50% tras implante del stent sin MACE intrahospitalarios): 85% – Disección: 2% – Perforación: 2% – Flujo lento/ausencia de flujo: 2% – MACE a 30 días y 1 año: 15% y 22,2%, respectivamente |
| ELCA | |||
| Fernandez et al.36 (2013) | Observacional 58 p | – Fallo de balón (lesiones no cruzables o no dilatables) tratados con ELCA ± AR – Calcificación > moderada 82,1% |
– Éxito del procedimiento (estenosis < 20% tras stent sin disección limitante de flujo ni perforación tipo II o III): 91% – Éxito de ELCA aislado en 76,1%, ELCA tras fallo de AR 6,8% y ELCA + AR 8,6% – Solo 1 caso de éxito de AR cuando falló ELCA – Cuatro complicaciones relacionadas con el procedimiento (flujo lento transitorio, oclusión de rama lateral y 2 perforaciones). |
| ELLEMENT37 (2014) | Observacional 28 p | – Infraexpansión de stent tratada con ELCA de alta energía con contraste tras fallo de balón NC – Calcificación 89,3% |
– Éxito de láser (incremento ≥ 1 mm2 de AMS con IVUS o ≥ 20% DLM por angiografía coronaria cuantitativa tras la predilatación con balón NC que falló antes de ELCA): 96,4% – Infarto periprocedimiento: 7,1%, – Flujo lento transitorio: 3,6% |
| LEONARDO68 (2015) | Observacional 100 p | – Fallo de balón en lesiones complejas – Calcificación 57% |
– Éxito del procedimiento (estenosis < 50% tras implante de stent): 91,7% – Ninguna perforación, disección, oclusión de rama lateral significativa, espasmo ni ausencia de flujo |
| LAVA69 (2018) | Observacional 130 lesiones | – Lesiones no cruzables con balón: 43,8% – Lesiones no dilatables con balón: 40,8% – Calcificación moderada o grave: 62% – RIS: 37% |
– Éxito del procedimiento: 88,8% (93,8% en no dilatables y 83,7% en no cruzables) – Perforación: 1,78% – Infarto periprocedimiento: 0,86% |
| Ojeda et al.34 (2020) | Observacional 126 lesiones | – Lesiones no cruzables con balón – Calcificación ≥ moderada: 62,7% – Oclusión crónica: 46% |
– Éxito técnico (estenosis residual < 30% y TIMI 3): 90,5% – Éxito del procedimiento (éxito técnico sin eventos adversos intrahospitalarios): 87,3% – Calcificación grave asociada a fallo de ELCA |
| Balones modificados (balones de corte o de scoring) y BMAP | |||
| ISAR-CALC50 | ECA de 74 p (BMAP vs. BS) | Lesiones calcificadas graves no dilatables con balón | – Expansión del stent por OCT similar con BMAP y BS (0,72 ± 0,12 frente a 0,68 ± 0,13; p = 0,22) – BMAP mayor incremento de DLM (2,83 ± 0,34 mm frente a 2,65 ± 0,36 mm; p = 0,03) y menor estenosis (11,6 ± 4,8% frente a 14,4 ± 5,6%; p = 0,02) – No diferencias en cuanto a éxito del procedimiento |
| Litotricia intracoronaria | |||
| DISRUPT CAD III53,54 | EPNA 431 p | Calcificación grave | – Éxito del procedimiento (estenosis residual < 50% sin MACE intrahospitalarios): 92,4% – Infarto periprocedimiento: 6,8% – Disección grave: 0,3% – Perforación: 0,3% – Flujo lento o ausencia de flujo: 0% – RLD a 30 días: 1,3% – Trombosis de stent: 0,8% – MACE a 1 año: 13,8% |
|
AMS: área mínima del stent; AR: aterectomía rotacional; BM: balón modificado; BMAP: balón de muy alta presión; NC: no distensible; BS: balón de scoring; DLM: diámetro luminal mínimo; ECA: ensayo controlado aleatorizado; ELCA: angioplastia coronaria con láser Excimer; EPNA: estudio prospectivo no aleatorizado; IVUS: ecografía intravascular; MACE: eventos cardiovasculares adversos mayores; OCT: tomografía de coherencia óptica; p: pacientes; RIS: reestenosis en el interior del stent; RLD: revascularización de la lesión diana; TE: tratamiento estándar; TIMI: Thrombolysis In Myocardial Infarction. |
|||
En caso de que exista una calcificación angiográfica ligera y la expansión de balones sea adecuada, puede no ser necesaria una mayor preparación de la placa previamente al implante del stent. Sin embargo, cuando la calcificación angiográfica es moderada o grave, las técnicas de imagen intracoronaria son recomendables por su gran utilidad para planificar la intervención y optimizar los resultados (figura 7).
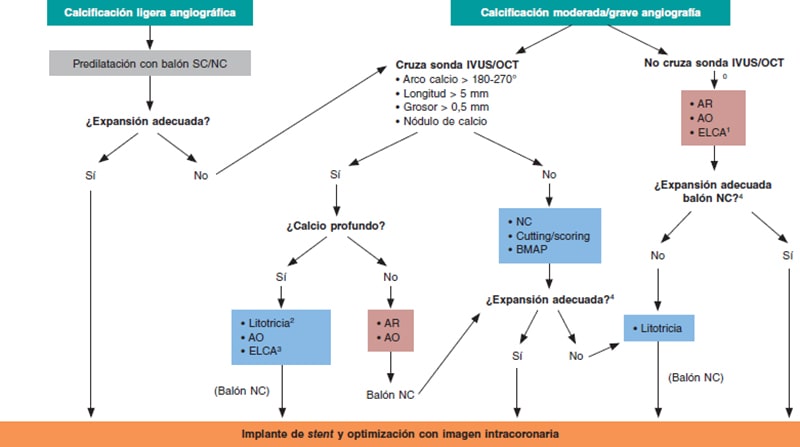
Figura 7. Figura central. Algoritmo de modificación de la placa calcificada. AO: aterectomía orbitacional; AR: aterectomía rotacional; BMAP: balón de muy alta presión; ELCA: angioplastia coronaria con láser Excimer; NC: no distensible; SC: semidistensible.
0: se puede intentar la predilatación con balones de bajo perfil, que en ocasiones permite la valoración inicial con imagen intravascular.
1: de elección si no cruza un microcatéter.
2: si no cruza un balón de litotricia, puede predilatarse con balón o combinar otras técnicas (Rotatripsy, Elcatripsy, Orbital-tripsy).
3: actualmente preferible a la litotricia en caso de infraexpansión aguda del stent.
4: además de la expansión angiográfica final del balón NC, la imagen intracoronaria es útil para comprobar el efecto de las técnicas realizadas en la modificación de la placa.
En general, es útil aplicar la «regla del 5»: aquellas lesiones en las que el calcio ocupa < 50% de la circunferencia (180°), no se extiende longitudinalmente > 5 mm y no tiene > 0,5 mm de grosor, se podrán tratar de manera adecuada utilizando balones de alta presión o balones modificados (BC o BS).
Cuando no se cumplan estos criterios o se visualicen nódulos de calcio, será necesario aplicar técnicas de modificación de la placa más avanzadas. Para la selección de cada técnica, además de la extensión circunferencial, longitudinal y el grosor, tiene también importancia la profundidad del calcio, dado que algunas técnicas, como la AR, actúan fundamentalmente en la porción superficial y no profunda de la placa.
Las lesiones con una calcificación significativa tan estenótica que no permita el cruce de la sonda de IVUS o de OCT, probablemente precisen AR/AO o láser (que podría ser de elección en caso de que la lesión no sea cruzable ni siquiera por un microcatéter que permita el intercambio por las guías específicas de AR/AO). Otra alternativa es intentar una predilatación con balones de bajo perfil, que en ocasiones permite la valoración inicial con imagen intravascular que guíe la toma de decisiones, como ya se ha mencionado.
La expansión del balón tras la realización de estas técnicas nos orientará sobre la adecuada preparación de la placa. Además, la imagen intracoronaria es muy útil para confirmar una adecuada modificación del calcio que permita la expansión del stent. Los efectos de las distintas técnicas, como la presencia de fracturas (con balón o litotricia), el limado superficial del calcio (con AR) o ambos efectos (con AO)70, pueden ser visibles con imagen intracoronaria (figura 6). Tras el uso de ELCA se han descrito fracturas superficiales y profundas, si bien sus efectos pueden no ser visibles con OCT y, al igual que con la LIC, esto no implica que la placa no haya sido modificada.
En función del tipo de lesión y de los efectos producidos por estas técnicas, puede ser necesaria la combinación de más de una de ellas para asegurar el implante óptimo del stent y unos resultados clínicos favorables.
CONCLUSIONES
La calcificación coronaria es probablemente el mayor determinante de un mal resultado del ICP y de revascularización percutánea incompleta, y se asocia a mayores tasas de eventos adversos. Las técnicas de imagen intracoronaria desempeñan un papel fundamental en la comprensión de las lesiones calcificadas, para seleccionar la técnica de modificación de la placa y optimizar el resultado del ICP. El conocimiento de las distintas técnicas de modificación de la placa es esencial para el tratamiento óptimo de las lesiones calcificadas. En espera de estudios comparativos entre ellas, es razonable seleccionar la técnica en función del tipo de lesión, y en ocasiones es necesario combinarlas para asegurar el implante óptimo del stent y unos resultados clínicos favorables.
FINANCIACIÓN
No ha habido financiación.
CONTRIBUCIÓN DE LOS AUTORES
Redacción del documento: A. Jurado-Román, A. Gómez-Menchero, N. Gonzalo, J. Martín-Moreiras, R. Ocaranza, Soledad Ojeda, J. Palazuelos, O. Rodríguez-Leor, P. Salinas, B. Vaquerizo, X. Freixa y A.B. Cid-Álvarez. Diseño, coordinación, revisión de la versión final y envío del documento: A. Jurado-Román.
CONFLICTO DE INTERESES
S. Ojeda es editora asociada de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. A. Jurado-Román, X. Freixa y A.B. Cid-Álvarez forman parte de la junta directiva de la ACI-SEC.
BIBLIOGRAFÍA
1. Mori H, Torii S, Kutyna M, Sakamoto A, Finn AV, Virmani R. Coronary Artery Calcification and its Progression: What Does it Really Mean? JACC Cardiovasc Imaging. 2018;11:127-142.
2. Wang X, Matsumura M, Mintz GS, et al. In Vivo Calcium Detection by Comparing Optical Coherence Tomography, Intravascular Ultrasound, and Angiography. JACC Cardiovasc Imaging. 2017;10:869-879.
3. Copeland-Halperin RS, Baber U, Aquino M, et al. Prevalence, correlates, and impact of coronary calcification on adverse events following PCI with newer-generation DES: Findings from a large multiethnic registry. Catheter Cardiovasc Interv. 2018;91:859-866.
4. Sharma SK, Bolduan RW, Patel MR, et al. Impact of calcification on percutaneous coronary intervention: MACE-Trial 1-year results. Catheter Cardiovasc Interv. 2019;94:187-194.
5. Fujino A, Mintz GS, Matsumura M, et al. A new optical coherence tomography-based calcium scoring system to predict stent underexpansion. EuroIntervention. 2018;13:e2182-e2189.
6. Serruys PW, Morice MC, Kappetein AP, et al. Percutaneous coronary intervention versus coronary-artery bypass grafting for severe coronary artery disease. N Engl J Med. 2009;360:961-972.
7. Kawashima H, Serruys PW, Hara H, et al. 10-Year All-Cause Mortality Following Percutaneous or Surgical Revascularization in Patients With Heavy Calcification. JACC Cardiovasc Interv. 2022;15:193-204.
8. Hendry C, Fraser D, Eichhofer J, et al. Coronary perforation in the drug-eluting stent era: incidence, risk factors, management and outcome: the UK experience. EuroIntervention. 2012;8:79-86.
9. Mintz GS, Popma JJ, Pichard AD, et al. Patterns of calcification in coronary artery disease. A statistical analysis of intravascular ultrasound and coronary angiography in 1155 lesions. Circulation. 1995;91:1959-1965.
10. Zhang M, Matsumura M, Usui E, et al. Intravascular Ultrasound-Derived Calcium Score to Predict Stent Expansion in Severely Calcified Lesions. Circ Cardiovasc Interv. 2021; e010296.
11. Stefanini GG, Alfonso F, Barbato E, et al. Management of Myocardial Revascularization Failure: An Expert Consensus Document of the EAPCI. EuroIntervention. 2020;16:e875-e890.
12. Räber L, Mintz GS, Koskinas KC, et al. Clinical use of intracoronary imaging. Part 1: guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. EuroIntervention. 2018;14:656-677.
13. Cubero-Gallego H, Tizón-Marcos H, Vaquerizo B. Opciones actuales para el tratamiento de las lesiones calcificadas. REC Interv Cardiol. 2020;2:129-139.
14. Hellig F, Pandie S, Barbato E, Colombo A, Heyndrickx JR. Rotational atherectomy. En: PCR - EAPCI Textbook 2015, Part III. Europa Digital & Publishing; 2015.
15. Sharma SK, Tomey MI, Teirstein PS, et al. North American Expert Review of Rotational Atherectomy. Circ Cardiovasc Interv. 2019;12:e007448.
16. Barbato E, Carrié D, Dardas P, et al. European expert consensus on rotational atherectomy. EuroIntervention. 2015;11:30-36.
17. De Maria GL, Scarsini R, Banning AP. Management of Calcific Coronary Artery Lesions: Is it Time to Change Our Interventional Therapeutic Approach? JACC Cardiovasc Interv. 2019;12:1465-1478.
18. Bittl JA, Chew DP, Topol EJ, Kong DF, Califf RM. Meta-analysis of randomized trials of percutaneous transluminal coronary angioplasty versus atherectomy, cutting balloon atherotomy, or laser angioplasty. J Am Coll Cardiol. 2004;43:936-942.
19. Safian RD, Feldman T, Muller DW, et al. Coronary angioplasty and Rotablator atherectomy trial (CARAT): immediate and late results of a prospective multicenter randomized trial. Catheter Cardiovasc Interv. 2001;53:213-220.
20. Abdel-Wahab M, Richardt G, Joachim Büttner H, et al. High-speed rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions: the randomized ROTAXUS (Rotational Atherectomy Prior to Taxus Stent Treatment for Complex Native Coronary Artery Disease) trial. JACC Cardiovasc Interv. 2013;6:10-19.
21. Abdel-Wahab M, Toelg R, Byrne RA, et al. High-Speed Rotational Atherectomy Versus Modified Balloons Prior to Drug-Eluting Stent Implantation in Severely Calcified Coronary Lesions. Circ Cardiovasc Interv. 2018;11:e007415.
22. Iannaccone M, Piazza F, Boccuzzi GG, et al. ROTational AThErectomy in acute coronary syndrome: early and midterm outcomes from a multicentre registry. EuroIntervention. 2016;12:1457-1464.
23. Kawamoto H, Latib A, Ruparelia N, et al. In-hospital and midterm clinical outcomes of rotational atherectomy followed by stent implantation: the ROTATE multicentre registry. EuroIntervention. 2016;12:1448-1456.
24. de Waha S, Allali A, Büttner HJ, et al. Rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions: Two-year clinical outcome of the randomized ROTAXUS trial. Catheter Cardiovasc Interv. 2016;87:691-700.
25. Cardiovascular System (CSI). Diamondback 360 Coronary Orbital Atherectomy System. Disponible en: https://csi360.com/diamondback-coronary-orbital-atherectomy-system/. Consultado 27 sep 2022.
26. Shlofmitz E, Shlofmitz R, Lee MS. Orbital Atherectomy: A Comprehensive Review. Interv Cardiol Clin. 2019;8:161-171.
27. Yamamoto MH, Maehara A, Karimi Galougahi K, et al. Mechanisms of Orbital Versus Rotational Atherectomy Plaque Modification in Severely Calcified Lesions Assessed by Optical Coherence Tomography. JACC Cardiovasc Interv. 2017;10:2584-2586.
28. Chambers JW, Feldman RL, Himmelstein SI, et al. Pivotal trial to evaluate the safety and efficacy of the orbital atherectomy system in treating de novo, severely calcified coronary lesions (ORBIT II). JACC Cardiovasc Interv. 2014;7:510-518.
29. Redfors B, Sharma SK, Saito S, et al. Novel Micro Crown Orbital Atherectomy for Severe Lesion Calcification: Coronary Orbital Atherectomy System Study (COAST). Circ Cardiovasc Interv. 2020;13:e008993.
30. Parikh K, Chandra P, Choksi N, Khanna P, Chambers J. Safety and feasibility of orbital atherectomy for the treatment of calcified coronary lesions: the ORBIT I trial. Catheter Cardiovasc Interv. 2013;81:1134-1139.
31. Lee M, Généreux P, Shlofmitz R, et al. Orbital atherectomy for treating de novo, severely calcified coronary lesions: 3-year results of the pivotal ORBIT II trial. Cardiovasc Revasc Med. 2017;18:261-264.
32. Tsutsui RS, Sammour Y, Kalra A, et al. Excimer Laser Atherectomy in Percutaneous Coronary Intervention: A Contemporary Review. Cardiovasc Revasc Med. 2021;25:75-85.
33. Golino L, Caiazzo G, Calabrò P, et al. Excimer laser technology in percutaneous coronary interventions: Cardiovascular laser society’s position paper. Int J Cardiol. 2022;350:19-26.
34. Ojeda S, Azzalini L, Suárez de Lezo J, et al. Excimer laser coronary atherectomy for uncrossable coronary lesions. A multicenter registry. Catheter Cardiovasc Interv. 2021;98:1241-1249.
35. Mintz GS, Kovach JA, Javier SP, et al. Mechanisms of lumen enlargement after excimer laser coronary angioplasty. An intravascular ultrasound study. Circulation. 1995;92:3408-3414.
36. Fernandez JP, Hobson AR, McKenzie D, et al. Beyond the balloon: excimer coronary laser atherectomy used alone or in combination with rotational atherectomy in the treatment of chronic total occlusions, non-crossable and non-expansible coronary lesions. EuroIntervention. 2013;9:243-250.
37. Latib A, Takagi K, Chizzola G, et al. Excimer Laser LEsion modification to expand non-dilatable stents: the ELLEMENT registry. Cardiovasc Revasc Med. 2014;15:8-12.
38. Sintek M, Coverstone E, Bach R, et al. Excimer Laser Coronary Angioplasty in Coronary Lesions: Use and Safety From the NCDR/CATH PCI Registry. Circ Cardiovasc Interv. 2021;14(7):e010061.
39. Protty MB, Hussain HI, Gallagher S, et al. Excimer laser coronary atherectomy during complex PCI: An analysis of 1,471 laser cases from the British Cardiovascular Intervention Society database. Catheter Cardiovasc Interv. 2021;97:E653-E660.
40. Unterberg C, Buchwald AB, Barath P, Schmidt T, Kreuzer H, Wiegand V. Cutting balloon coronary angioplasty -- initial clinical experience. Clin Cardiol. 1993;16:660-664.
41. Barath P, Fishbein MC, Vari S, Forrester JS. Cutting balloon: a novel approach to percutaneous angioplasty. Am J Cardiol. 1991;68:1249-1252.
42. Bonaventura K, Schwefer M, Yusof AKM, et al. Systematic Scoring Balloon Lesion Preparation for Drug-Coated Balloon Angioplasty in Clinical Routine: Results of the PASSWORD Observational Study. Adv Ther. 2020;37:2210-2223.
43. Okura H, Hayase M, Shimodozono S, et al. Mechanisms of acute lumen gain following cutting balloon angioplasty in calcified and noncalcified lesions: an intravascular ultrasound study. Catheter Cardiovasc Interv. 2002;57:429-436.
44. Barbato E, Shlofmitz E, Milkas A, Shlofmitz R, Azzalini L, Colombo A. State of the art: evolving concepts in the treatment of heavily calcified and undilatable coronary stenoses - from debulking to plaque modification, a 40-year-long journey. EuroIntervention. 2017;13:696-705.
45. de Ribamar Costa JJ, Mintz GS, Carlier SG, et al. Nonrandomized comparison of coronary stenting under intravascular ultrasound guidance of direct stenting without predilation versus conventional predilation with a semi-compliant balloon versus predilation with a new scoring balloon. Am J Cardiol. 2007;100:812-817.
46. Felekos I, Karamasis GV, Pavlidis AN. When everything else fails: High-pressure balloon for undilatable lesions. Cardiovasc Revasc Med. 2018;19:306-313.
47. Díaz JF, Gómez-Menchero A, Cardenal R, Sánchez-González C, Sanghvi A. Extremely high-pressure dilation with a new noncompliant balloon. Tex Heart Inst J. 2012;39:635-638.
48. Secco GG, Ghione M, Mattesini A, et al. Very high-pressure dilatation for undilatable coronary lesions: indications and results with a new dedicated balloon. EuroIntervention. 2016;12:359-365.
49. Secco GG, Buettner A, Parisi R, et al. Clinical Experience with Very High-Pressure Dilatation for Resistant Coronary Lesions. Cardiovasc Revasc Med. 2019;20:1083-1087.
50. Rheude T, Rai H, Richardt G, et al. Super high-pressure balloon versus scoring balloon to prepare severely calcified coronary lesions: the ISAR-CALC randomised trial. EuroIntervention. 2021;17:481-488.
51. Delgado-Arana JR, Rumoroso JR, Regueiro A, et al. Plaque modification in calcified chronic total occlusions: the PLACCTON study. Rev Esp Cardiol. 2022;75:213-222.
52. Vilalta del Olmo V, Rodríguez-Leor O, Redondo A, et al. Intracoronary lithotripsy in a high-risk real-world population. First experience in severely calcified, complex coronary lesions. REC Interv Cardiol. 2020;2:76-81.
53. Hill JM, Kereiakes DJ, Shlofmitz RA, et al. Intravascular Lithotripsy for Treatment of Severely Calcified Coronary Artery Disease. J Am Coll Cardiol. 2020;76:2635-2646.
54. Kereiakes DJ, Hill JM, Shlofmitz RA, et al. Intravascular Lithotripsy for Treatment of Severely Calcified Coronary Lesions: 1-Year Results From the Disrupt CAD III Study. J Soc Cardiovasc Angiogr Interv. 2022. https://doi.org/10.1016/j.jscai.2021.100001.
55. Ali ZA, Nef H, Escaned J, et al. Safety and Effectiveness of Coronary Intravascular Lithotripsy for Treatment of Severely Calcified Coronary Stenoses: The Disrupt CAD II Study. Circ Cardiovasc Interv. 2019;12:e008434.
56. Pham V, Bonnet M, Varenne O, et al. In-stent use of Intravascular Coronary Lithotripsy for restenosis and stent underexpansion, a multicenter experience. Can J Cardiol. 2022;10:1474-1475.
57. Achim A, Alampi C, Krivoshei L, Leibundgut G. In vitro effect of intravascular lithotripsy on the polymer of a drug-eluting stent. EuroIntervention. 2022;18:e333-e334.
58. Tovar Forero MN, Sardella G, Salvi N, et al. Coronary lithotripsy for the treatment of underexpanded stents; the international & multicentre CRUNCH registry. EuroIntervention. 2022;18:574-581.
59. Gonzálvez-García A, Jiménez-Valero S, Galeote G, Moreno R, López de Sá E, Jurado-Román A. “RotaTripsy”: Combination of Rotational Atherectomy and Intravascular Lithotripsy in Heavily Calcified Coronary Lesions: A Case Series. Cardiovasc Revasc Med. 2022;35:179-184.
60. Yarusi BB, Jagadeesan VS, Hussain S, et al. Combined Coronary Orbital Atherectomy and Intravascular Lithotripsy for the Treatment of Severely Calcified Coronary Stenoses: The First Case Series. J Invasive Cardiol. 2022;34:E210-E217.
61. Jurado-Román A, García A, Moreno R. ELCA-Tripsy: Combination of Laser and Lithotripsy for Severely Calcified Lesions. J Invasive Cardiol. 2021;33:E754-E755.
62. Amemiya K, Yamamoto MH, Maehara A, et al. Effect of cutting balloon after rotational atherectomy in severely calcified coronary artery lesions as assessed by optical coherence tomography. Catheter Cardiovasc Interv. 2019;94:936-944.
63. Jurado-Román A, Gonzálvez A, Galeote G, Jiménez-Valero S, Moreno R. RotaTripsy: Combination of Rotational Atherectomy and Intravascular Lithotripsy for the Treatment of Severely Calcified Lesions. JACC Cardiovasc Interv. 2019;12:e127-e129.
64. Chen G, Zrenner B, Pyxaras SA. Combined Rotational Atherectomy and Intravascular Lithotripsy for the Treatment of Severely Calcified in-Stent Neoatherosclerosis: A Mini-Review. Cardiovasc Revasc Med. 2019;20:819-821.
65. Protty MB, Gallagher S, Farooq V, et al. Combined use of rotational and excimer lASER coronary atherectomy (RASER) during complex coronary angioplasty - An analysis of cases (2006-2016) from the British Cardiovascular Intervention Society database. Catheter Cardiovasc Interv. 2021;97:E911-E918.
66. McInerney A, Escaned J, Gonzalo N. Calcified coronary artery disease: pathophysiology, intracoronary imaging assessment, and plaque modification techniques. REC Interv Cardiol. 2022;4:216-227.
67. Bulluck H, McEntegart M. Contemporary tools and devices for coronary calcium modification. JRSM Cardiovasc Dis. 2022. https://doi.org/10.1177/20480040221089760.
68. Ambrosini V, Sorropago G, Laurenzano E, et al. Early outcome of high energy Laser (Excimer) facilitated coronary angioplasty ON hARD and complex calcified and balloOn-resistant coronary lesions: LEONARDO Study. Cardiovasc Revasc Med. 2015;16:141-146.
69. Karacsonyi J, Armstrong EJ, Truong HTD, et al. Contemporary Use of Laser During Percutaneous Coronary Interventions: Insights from the Laser Veterans Affairs (LAVA) Multicenter Registry. J Invasive Cardiol. 2018;30:195-201.
70. Yamamoto MH, Maehara A, Kim SS, et al. Effect of orbital atherectomy in calcified coronary artery lesions as assessed by optical coherence tomography. Catheter Cardiovasc Interv. 2019;93:1211-1218.