¿QUÉ SE SABE DE LA RESERVA FRACCIONAL DE FLUJO TRAS UN IMPLANTE DE STENT?
La presentación del concepto de reserva fraccional de flujo (RFF) a mediados de la década de 1990 trasladó la fisiología coronaria de la ciencia experimental al uso rutinario en la sala de hemodinámica1-3. Además de contribuir a comprender mejor mecanismos fisiológicos básicos tales como la autorregulación, la vasodilatación compensatoria y la reserva del flujo coronario presentados 20 años antes por Gould et al.4, no cabe duda de que la RFF ha cambiado nuestra interpretación de los angiogramas coronarios y ha tenido una enorme influencia tanto en el proceso de toma de decisiones como en los resultados de los pacientes3,5,6. Esto ha llevado a adoptar la RFF como único índice fisiológico con una indicación de uso clase I A en las guías de práctica clínica publicadas por las sociedades cardiológicas más importantes del mundo7,8.
La RFF nos ha enseñado que la coronariografía y las imágenes anatómicas que se obtienen en la sala de hemodinámica solo ofrecen medidas moderadamente fiables de la importancia funcional que tienen la enfermedad coronaria y la isquemia miocárdica. Existen, además, pruebas innegables de que el proceso de toma de decisiones basado en mediciones funcionales da mejores resultados que solo la angiografía3,5,6.
En cambio, la interpretación de la RFF tras una intervención coronaria sigue siendo ambigua. Básicamente, deberíamos ser conscientes de que el estado de una coronaria cambia inmediatamente después de realizar una intervención coronaria percutánea (ICP) y es más propenso a una mayor variabilidad que una situación de cardiopatía isquémica estable crónica. Un resultado excelente de una ICP realizada hoy puede cambiar rápidamente en cuestión de horas por la formación de trombos, disecciones progresivas o cualquier otra complicación imprevista. Por eso los valores de RFF tomados inmediatamente después de realizar una ICP se deben interpretar con cautela. Además, si bien el umbral de una RFF isquémica (0,80) en la angina estable se ha establecido con claridad, los valores de RFF durante los primeros días, semanas o meses después de una ICP pueden cambiar rápidamente debido al proceso de curación de la propia coronaria, a la aparición de hiperplasia íntima, formación de trombos, etc. Esto quiere decir que, por definición, la RFF que se obtiene tras una ICP es más dinámica y que unos valores de RFF adecuados obtenidos inmediatamente después de una ICP deberían estar muy por encima de 0,80 para compensar cualquier cambio intravascular que pudiese occurrir a corto plazo.
Por eso no sorprende ver valores de RFF de, al menos, 0,90 en la literatura médica sugestivos de un resultado aceptable de una ICP9,10. Dicho esto, al mismo tiempo, deberíamos ser conscientes de que la mayoría de los valores de RFF de los primeros estudios realizados tras un implante de stent se obtuvieron de pacientes con estenosis focal y sin mucha enfermedad difusa. Parece plausible pensar que, en presencia de enfermedad difusa en una coronaria, probablemente no se alcancen valores de RFF ≥ 0,90 con solo un implante de stent en una estenosis focal.
Con toda probabilidad, en estos casos, el registro de retirada de la presión hiperémica (monitorizado o no) o una sofisticada variedad llamada gradiente de retirada de presión hiperémica darán mejor cuenta del resultado funcional tras un implante de stent. También revelarán si los restantes gradientes dentro de la coronaria se deben a un implante suboptimo del stent o a enfermedad difus11.
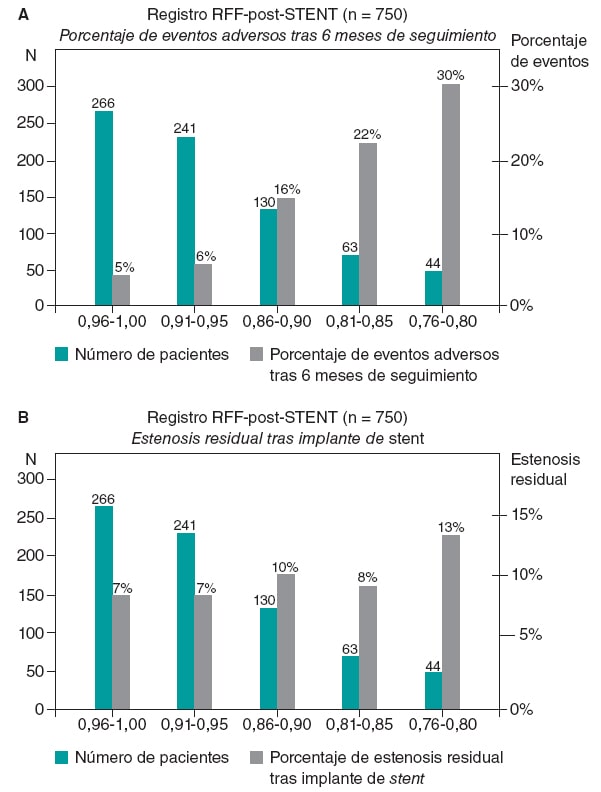
A pesar de estas limitaciones, la existencia de una clara correlación entre los valores de RFF obtenidos inmediatamente después de una ICP y los resultados a largo plazo es innegable. Dicha correlación se describió por primera vez en el Registro RFF-post-STENT de 750 pacientes que confirmó la existencia de una correlación inversa entre los valores de RFF obtenidos inmediatamente después de una ICP y la incidencia de reestenosis tras 6 meses de seguimiento (figura 1). Esta correlación inversa entre unos valores altos de RFF tras un implante de stent y el riesgo a medio plazo de reestenosis ha quedado confirmado desde entonces12. Aun así, sique sin quedar claro si unos valores de RFF subóptimos tras un implante de stent se deben a un problema focal en el segmento implantado o a la presencia de enfermedad difusa en algún otro punto de la coronaria. El registro de retirada de la presión hiperémica y el gradiente de retirada de presión hiperémica han demostrado que un gradiente de presión considerable en el stent suele estar asociado a un implante inadecuado de este, tal y como evidencian la ecografía intravascular o la tomografía de coherencia óptica.
Figura 1. Superioridad de la prueba funcional frente a, solo, la angiografía para predecir los resultados tras un implante de stent. A: correlación entre la reserva fraccional de flujo (RFF) tras implante de stent y el índice de eventos adversos tras 6 meses de seguimiento en 750 pacientes del registro RFF-post-STENT. B: correlación entre la angiografía realizada tras el implante de stent y la incidencia de eventos adversos tras 6 meses de seguimiento. Reproducido con permiso de Pijls et al.9
PREDICTORES DE LA RFF POSOPERATORIA ASOCIADOS A PACIENTE Y VASO
Llegados a este punto, el estudio realizado por van Zandvoort et al. y recientemente publicado en REC: Interventional Cardiology pone las cosas en perspectiva10. En este estudio, un extenso registro de 1.000 pacientes consecutivos de 1 centro cardiológico de alto volumen, la RFF se midió sistemáticamente tras una ICP realizada con éxito según la angiografía sin intención de realizar ninguna otra intervención adicional en caso de obtener valores de RFF inesperadamente bajos. Se debería alabar a los autores por su adherencia a este protocolo. Después, se determinaron las características de cada paciente y vaso asignándoles los valores de RFF obtenidos tras la intervención. Si tenemos en cuenta que este estudio no ofreció información sobre los resultados y que las relaciones no fueron causales per se, sino asociativas, se pueden extraer importantes lecciones.
En primer lugar, el implante de stent fue un predictor muy potente de valores de RFF más bajos en la descendente anterior (DA). En DA completamente normales, los valores de RFF no varían de los que se obtienen en otras arterias (y son muy cercanos a 1,00)13. No obstante, incluso en casos de enfermedad leve, los valores de RFF que se obtienen en la DA suelen ser más patológicos que los de otras arterias. Esto se explica por el hecho de que el territorio de perfusión de la DA es extenso. Una de las principales ventajas de la RFF con respecto a otras metodologías que solo abordan 1 lesión coronaria es que el valor de RFF no solo evalúa la estenosis propiamente dicha, sino también la extensión del territorio de perfusión. En presencia de una estenosis similar (con similares características en la angiografía, ecografía intravascular o tomografía de coherencia óptica) localizada en una coronaria con un territorio de perfusión más extenso, los valores de RFF serán más bajos. En este sentido, la RFF es, en realidad, el nexo entre gravedad de la estenosis, flujo coronario, extensión del territorio de perfusión miocárdica e isquemia miocárdica14. Como tal, es factible que tras una ICP realizada con éxito, los valores de RFF de la DA sean algo más bajos que los de otras coronarias.
Una segunda e interesante observación es que la RFF calculada tras un implante de stent aparentemente con éxito suele ser más alta en mujeres que en varones. Van Zandvoort et al. sugieren que podría deberse a que la enfermedad microvascular tiene un papel más predominante en las mujeres que en los varones. También, a que la generación de un gradiente hiperémico dentro de la arteria coronaria epicárdica podría verse mitigada por la presencia de enfermedad microvascular10. Para confirmar este punto, se necesitan más estudios detallados sobre microvasculatura coronaria. Durante muchos años, evaluar la enfermedad microvascular de forma verdaderamente cuantitativa ha sido muy difícil de determinar. No obstante, una metodología desarrollada recientemente ha cambiado todo esto15.
VALORACIÓN SIMULTÁNEA DE ENFERMEDAD EPICÁRDICA Y MICROVASCULAR
Recientemente se ha presentado una técnica para medir el flujo coronario absoluto y la resistencia microvascular como una contribución a la medición de la RFF. La técnica se basa en la infusión continua de una solución salina a un ritmo bajo acompañada de termodilución. La técnica es sencilla, elegante, precisa e independiente del hemodinamista15.
En resumen, inmediatamente después de calcular la RFF, se avanza un catéter de infusión específicamente diseñado (Rayflow, Hexacath, Francia) sobre una guía de presión y se coloca dentro del stent (para estudiar la resistencia microvascular del territorio distal al stent). Luego, se inicia la infusión de una solución salina a un ritmo bajo y se mide el flujo coronario absoluto, en ml/min, en la región de interés usando la siguiente ecuación:
Q = Qi × T/Ti × 1,08
donde Q es el flujo sanguíneo del territorio miocárdico distal al stent, Qi es el ritmo de infusión de la solución salina (ml/min), Ti es la temperatura de la solución salina infundida (°C) y T es la temperatura de la coronaria distal tras mezclar la sangre con la solución salina. T y Ti se expresan como la diferencia con respecto a la temperatura corporal.
Los valores del flujo sanguíneo en condiciones de reposo se obtienen con ritmos de infusión de entre 8 y 10 ml/min y los valores hiperémicos máximos con ritmos de infusión de 20 ml/min pues a ese ritmo la propia solución salina induce un estado de hiperemia máxima en cuestión de segundos (figura 2; datos no publicados).
Figura 2. Ejemplo de flujo coronario absoluto y medición de la resistencia microvascular en descendente anterior tras medición rutinaria de la reserva fraccional de flujo. En la figura superior, la presión aórtica (Pa) y presión coronaria distal (Pd) se muestran en colores in rojo y verde, respectivamente. La línea azul representa la temperatura coronaria como una diferencia con respecto a la temperatura corporal (T = 0). Tras iniciar la infusión de 20 ml/min de una solución salina (Qi), a temperatura ambiente, a través de un catéter de infusión dedicado, el estado de hiperemia máxima se alcanza en cuestión de segundos. Después, tras una mezcla completa de sangre y solución salina, se alcanza una temperatura T coronaria distal en estado estacionario de 0,32 ºC por debajo de la temperatura corporal. Tras retirar el sensor de presión/temperatura de la punta del catéter de infusión, la temperatura de infusión (Ti) obtenida es de 4,11 ºC por debajo de la temperatura corporal. El flujo absoluto (Q) de la coronaria se calculó empleando la ecuación mostrada en este artículo (274 ml/min). Ahora solo resta calcular la resistencia microvascular a partir de la relación Pd/Q, lo que equivale a 297 unidades Wood, un valor normal para el territorio miocárdico anterior. Como también se conoce la reserva fraccional de flujo, el valor de referencia normal del flujo coronario también se puede calcular. Todos los parámetros se muestran online gracias a un software dedicado (Coroventis, Suecia).
Inmediatamente después de medir simultáneamente la presión coronaria distal y los valores de flujo sanguíneo, se calcula la resistencia microvascular cuantitativa Rµ (unidades Wood). Del mismo modo, se puede calcular, independientemente, la enfermedad epicárdica (indicada por la RFF) y microvascular (indicada por Rµ). La hipótesis de van Zandvoort et al. de que los valores de RFF más altos tras una ICP se asocian a una resistencia microvascular más alta en mujeres pueden validarse, de forma elegante, de esta forma.
¿CUÁL ES LA MEJOR TÉCNICA PARA MEDIR LOS VALORES DE RFF TRAS UNA ICP?
En el estudio realizado por Zandvoort et al., los valores de RFF medidos tras la ICP solo se describen someramente10. Los autores no hablan de si realizaron registros de retirada de la presión hiperémica u otras técnicas para valorar toda la coronaria. También se debe mencionar que para medir la presión intracoronaria no se empleó una guía de presión sino el sistema Navvus (ACIST Medical Systems, Eden Prairie, MN, Estados Unidos). Se sabe que este sistema sobrevalora los gradientes de presión e infravalora ligeramente la RFF en casos de enfermedad mínima o moderamente en casos de enfermedad más grave16. Además, este sistema no ha sido validado contra las guías de presión que se emplean habitualmente en vasos post-ICP.
En cualquier caso, las mediciones se tomaron meticulosamente con adenosina IV a un ritmo de infusión de 140 µg/kg/min y se pudieron calcular de un modo sencillo y fiable los valores de RFF en condiciones estables. Se debe mencionar que de los 1.000 pacientes estudiados solo 2 eran intolerantes a la adenosina, lo cual quiere decir que tuvo que interrumpirse la infusión de adenosina por la aparición de dolor torácico inocuo compatible con angina inducido por la adenosina. Esto pone de manifiesto el perfil de seguridad de las infusiones de adenosina IV tal y como se ha venido observando en cientos de miles de pacientes y en otros tantos estudios.
En futuros estudios sobre el significado e interpretación de los valores de RFF post-ICP, sería recomendable llevar a cabo registros de retirada de la presión hiperémica, tal y como se ha expuesto al principio de este artículo, incluso emplear la técnica más sofisticada presentada por Collet et al. (denominada gradiente de retirada de presión hiperémica) para una evaluación integral del vaso tras una ICP11. Obviamente, todos los análisis de presiones realizados dentro de la coronaria con el implante de stent deberían realizarse en estado de hiperemia máxima pues los gradientes en reposo obtenidos dentro de la arteria son entre 2 y 3 veces más pequeños. En consecuencia, la relación señal-ruido de un registro de retirada en reposo es entre 2 y 3 veces menos sensible.
En conclusión, aunque no se presentaron datos de resultados lo cual, por cierto, no fue el objetivo del estudio, el interesante ensayo clínico de Zandvoort et al.10 ilustra sobre la existencia de interesantes predictores asociados a paciente y vaso y su relación con las mediciones posoperatorias de la RFF. También adelanta la necesidad de realizar futuros estudios fisiológicos que aclaren los diferentes factores implicados empleando nuevos métodos de investigación en materia de circulación coronaria tales como los gradientes de retirada de presión hiperémica y las mediciones objetivas de la resistencia microvascular cuantitativa (Rµ).
FINANCIACIÓN
No se ha recibido ningún tipo de financiación para este artículo.
CONFLICTO DE INTERESES
N.H.J. Pijls ha recibido fondos de investigación institucionales de Abbott y Hexacath. Es, también, consultor de Abbott, Opsens y General Electric y accionista minoritario de Philips, GE, ASML y Heartflow. L.X. van Nunen no declara ningún conflicto de intereses.
BIBLIOGRAFÍA
1. Pijls NH, van Son JA, Kirkeeide RL, De Bruyne B, Gould KL. Experimental basis of determining maximum coronary, myocardial, and collateral blood flow by pressure measurements for assessing functional stenosis severity before and after percutaneous transluminal coronary angioplasty. Circulation. 1993;87:1354-1367.
2. Pijls NH, De Bruyne B, Peels K, et al. Measurement of fractional flow reserve to assess the functional severity of coronary-artery stenoses. N Engl J Med. 1996;334:1703-1708.
3. Tonino PA, De Bruyne B, Pijls NH, et al. Fractional flow reserve versus angiography for guiding percutaneous coronary intervention. N Engl J Med. 2009;360:213-224.
4. Gould KL, Lipscomb K, Hamilton GW. Physiologic basis for assessing critical coronary stenosis. Instantaneous flow response and regional distribution during coronary hyperemia as measures of coronary flow reserve. Am J Cardiol. 1974;33:87-94.
5. De Bruyne B, Fearon WF, Pijls NH, et al. Fractional flow reserve-guided PCI for stable coronary artery disease. N Engl J Med. 2014;371:1208-1217.
6. Zimmermann FM, Omerovic E, Fournier S, et al. Fractional flow reserve-guided percutaneous coronary intervention vs. medical therapy for patients with stable coronary lesions:meta-analysis of individual patient data. Eur Heart J. 2019;40:180-186.
7. Knuuti J, Wijns W, Saraste A, et al. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41:407-477.
8. Patel MR, Calhoon JH, Dehmer GJ, et al. ACC/AATS/AHA/ASE/ASNC/SCAI/SCCT/STS 2017 Appropriate Use Criteria for Coronary Revascularization in Patients With Stable Ischemic Heart Disease:A Report of the American College of Cardiology Appropriate Use Criteria Task Force, American Association for T. J Am Coll Cardiol. 2017;69:2212-2241.
9. Pijls NH, Klauss V, Siebert U, et al. Coronary Pressure Measurement After Stenting Predicts Adverse Events at Follow-Up. Circulation. 2002;105:2950-2954.
10. van Zandvoort LJC, Masdjedi K, Neleman T, et al. Predictors of postprocedural fractional flow reserve:insights from the FFR-SEARCH study. REC Interv Cardiol. 2021;3:91-97.
11. Collet C, Sonck J, Vandeloo B, et al. Measurement of Hyperemic Pullback Pressure Gradients to Characterize Patterns of Coronary Atherosclerosis. J Am Coll Cardiol. 2019;74:1772-1784.
12. Rimac G, Fearon WF, De Bruyne B, et al. Clinical value of post-percutaneous coronary intervention fractional flow reserve value:A systematic review and meta-analysis. Am Heart J. 2017;183:1-9.
13. Pijls NH, Van Gelder B, Van der Voort P, et al. Fractional flow reserve. A useful index to evaluate the influence of an epicardial coronary stenosis on myocardial blood flow. Circulation. 1995;92:3183-3193.
14. De Bruyne B, Hersbach F, Pijls NH, et al. Abnormal epicardial coronary resistance in patients with diffuse atherosclerosis but 'Normal'coronary angiography. Circulation. 2001;104:2401-2406.
15. Xaplanteris P, Fournier S, Keulards DC, et al. Catheter-Based Measurements of Absolute Coronary Blood Flow and Microvascular Resistance:Feasibility, Safety, and Reproducibility in Humans. Circ Cardiovasc Interv. 2018;11:e006194.
16. Wijntjens GW, van de Hoef TP, Kraak RP, et al. The IMPACT Study (Influence of Sensor-Equipped Microcatheters on Coronary Hemodynamics and the Accuracy of Physiological Indices of Functional Stenosis Severity). Circ Cardiovasc Interv. 2016;9:e004645.