RESUMEN
La angioplastia primaria está reconocida como la mejor estrategia de reperfusión en el infarto de miocardio con elevación del segmento ST. No obstante, la mejor estrategia para el tratamiento de las lesiones coronarias significativas en arterias no relacionadas con el infarto no se había estudiado convenientemente. Hasta la fecha se habían realizado varios estudios aleatorizados pero con objetivos de beneficio clínico de gravedad menor o «blandos» y pocos pacientes. Por primera vez, el estudio COMPLETE proporciona evidencia científica sólida sobre la estrategia terapéutica en pacientes con infarto de miocardio con elevación del segmento ST y enfermedad multivaso. Este estudio, que incluyó a más de 4.000 pacientes, ha demostrado que la revascularización completa reduce significativamente el riesgo combinado de mortalidad o infarto de miocardio.
Palabras clave: IAMCEST. Revascularización coronaria percutánea. Estudio COMPLETE.
ABSTRACT
Primary angioplasty is now clearly established as the best reperfusion strategy for patients with ST-segment elevation myocardial infarction (STEMI), but the best strategy for significant stenosis at non-culprit vessels has not been adequately studied. Several randomized trials have been previously performed, but all of them with soft primary endpoints and consequently a low number of patients. The COMPLETE trial, for the first time, provides us with solid scientific evidence about what we should do in patients with STEMI and multi-vessel disease. This study included more than 4000 patients and has shown that complete revascularization reduces significantly the risk of cardiovascular death or myocardial infarction.
Keywords: STEMI. Percutaneous coronary revascularization. COMPLETE trial.
Abreviaturas: IAMCEST: infarto agudo de miocardio con elevación del segmento ST.
Los sólidos resultados del estudio COMPLETE1 publicado recientemente demuestran claramente que la revascularización de lesiones no culpables después de una angioplastia primaria en el tratamiento del infarto agudo de miocardio con elevación del segmento ST (IAMCEST) mejora los resultados a largo plazo. Algo que ahora ha quedado claro y probablemente se acepte como una estrategia general; uno de los últimos pasos de un largo viaje (figura 1). Todo empezó hace mucho, cuando el tratamiento de los infartos agudos de miocardio, cada vez mejor y más agresivo, consiguió mejorar el pronóstico a corto y largo plazo reduciendo los índices de mortalidad a niveles inimaginables hace tan solo unos años. Érase una vez que, basándose en hallazgos anatomopatológicos, se pensaba equivocadamente que las oclusiones coronarias durante un infarto agudo de miocardio se debían a la necrosis miocárdica y no al revés. Habría que esperar a la década de 1980 para que se confirmara que abrir la coronaria culpable obstruida mejoraba los resultados. Revascularizar lo antes posible también era importante, obviamente todo ello acompañado de un mejor tratamiento médico, una reorganización de la estrategia y una mucho mejor prevención secundaria inmediatamente después de sufrir un episodio agudo2-4.
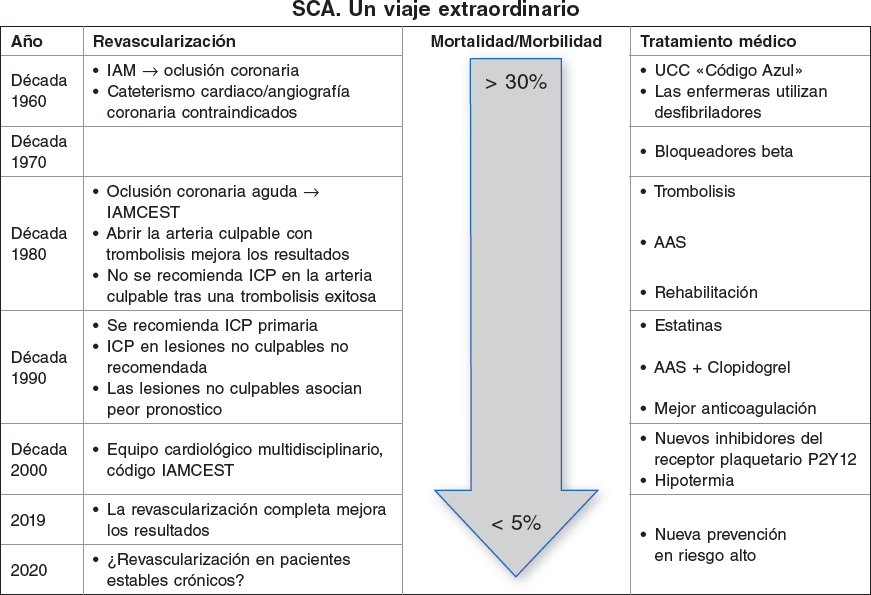
Figura 1. Evolución de la revascularización, tratamientos médicos y resultados en el tratamiento del IAMCEST. AAS: ácido acetilsalicílico; IAM: infarto agudo de miocardio; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; SCA: síndrome coronario agudo; UCC: unidad de cuidados coronarios.
Hasta la fecha, todos los avances en revascularización han girado en torno al vaso culpable (una exitosa y duradera recanalización inmediata del mismo), aunque los intentos que se han hecho sobre vasos enfermos no culpables han arrojado resultados dudosos.
El estudio COMPLETE comparó una estrategia de revascularización solo del vaso culpable con la revascularización completa en pacientes IAMCEST con otras estenosis coronarias significativas identificadas durante la realización de la angioplastia primaria. El estudio incluyó a 4.041 pacientes durante un seguimiento mediano de 3 años. Se observaron incidencias significativamente menores para el primer objetivo coprimario de muerte cardiovascular o infarto de miocardio y para el segundo objetivo coprimario de muerte cardiovascular, infarto de miocardio o revascularización motivada por la isquemia en el grupo que recibió revascularización completa comparado con aquel en el que solo se revascularizó la arteria culpable. Este beneficio favorable a la revascularización completa se observó poco después de la inclusión en el estudio y se hizo más evidente durante el seguimiento a 3 años (figura 2). Estas observaciones coinciden en los distintos subgrupos. Hubo un aumento pequeño y no significativo de las hemorragias mayores y el fracaso renal agudo inducido por contraste. El beneficio se vio condicionado principalmente por un significativo descenso del infarto de miocardio y la revascularización motivada por la isquemia.
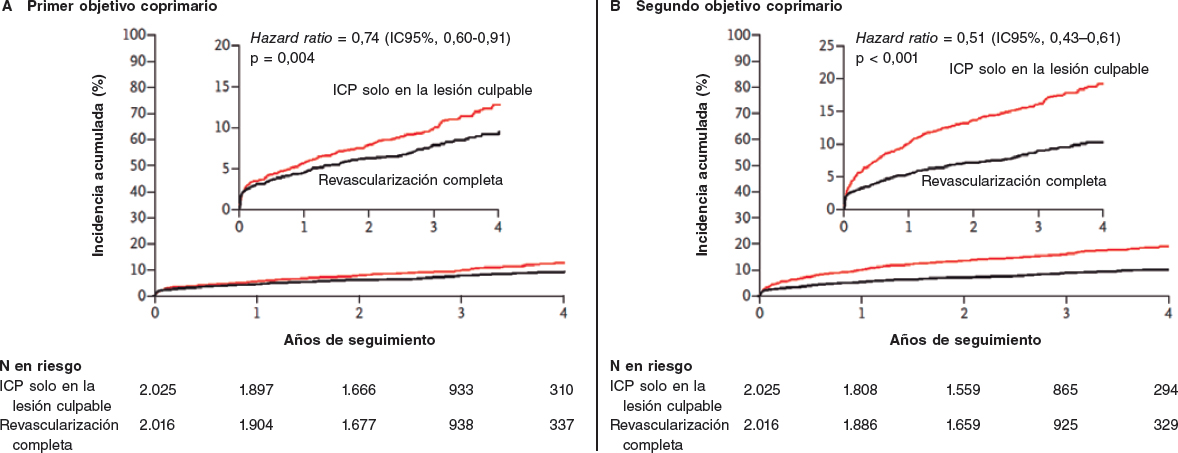
Figura 2. Principales resultados del estudio COMPLETE. Curvas de Kaplan-Meier para el primer (muerte por causas cardiovasculares o nuevo infarto de miocardio) y segundo objetivos coprimarios (muerte por causas cardiovasculares, nuevo infarto de miocardio o revascularización motivada por la isquemia). IC: intervalo de confianza; ICP: intervención coronaria percutánea. Reproducido de Mehta et al.1 con permiso.
Estudios previos con objetivos de beneficio más blandos no demostraron que la revascularización completa fuera beneficiosa en la muerte o en el infarto de miocardio, aunque es cierto que el número de pacientes de estos estudios era muy pequeño5-10, de los 69 pacientes del HELP-AMI6 hasta los 885 del COMPARE-ACUTE8, ambos representativos de una pequeña fracción del número de pacientes incluidos en el COMPLETE.
Como la mayoría de los estudios, el COMPLETE plantea algunas cuestiones prácticas. En primer lugar, ¿es este beneficio clínicamente significativo? El estudio arroja resultados sólidos, pero no confirma descensos de la mortalidad cardiovascular, la insuficiencia cardiaca y la mortalidad por cualquier causa. Se acepta que la enfermedad multivaso es un factor de riesgo claro de mortalidad tras un IAMCEST11; no obstante, los criterios de inclusión y sobre todo de exclusión del estudio COMPLETE seleccionaron a un grupo de pacientes de bajo riesgo. La tasa de mortalidad cardiovascular fue solo del 1% anual y es casi imposible demostrar un descenso de la mortalidad en esta población. Sin embargo, sí se observó un descenso significativo del infarto de miocardio (del 2,8 al 1,9% anual), la angina inestable (del 2,2 al 1,2% anual) y la revascularización motivada por la isquemia (del 2,8 al 0,5% anual) sin más complicaciones mayores. Todo esto servirá para convencer a cardiólogos intervencionistas y clínicos a que tengan muy en cuenta esta estrategia. Es evidente que se siguió la recomendación de las guías de práctica clínica sobre prevención secundaria, pero este es un campo que avanza con rapidez12, complementando las estrategias de revascularización y minimizando el papel relativo que tiene cada componente.
En segundo lugar, ¿la revascularización debe ser completa en todos los pacientes? La respuesta es sí en todos los casos que cumplen los criterios de inclusión y no los de exclusión del estudio COMPLETE (tabla 1), pero no en pacientes con enfermedad de pequeños vasos, estenosis coronaria epicárdica no significativa, antecedentes de cirugía de derivación coronaria y otros. No debemos olvidar que el estudio COMPLETE excluyó a pacientes en shock cardiogénico, pacientes en quienes se ha confirmado que la revascularización completa rutinaria es perjudicial13. Si todos los pacientes que cumplen los criterios del estudio COMPLETE deben someterse a revascularización completa ya es más difícil de responder. Identificar a los pacientes de mayor riesgo según sus características clínicas y proporcionar información adicional sobre su anatomía coronaria y en particular sobre la estabilidad de la placa, permitiría seleccionar a la población de pacientes que más se beneficiaría. Probablemente pueda extraerse esta información de la base de datos del estudio.
Tabla 1. Elegibilidad de los pacientes del estudio COMPLETE. Principales criterios de inclusión y exclusión
| Criterios de inclusión |
|---|
| IAMCEST |
| Éxito de la ICP en la lesión culpable |
| Al menos 1 lesión no culpable |
| Diámetro de la lesión no culpable ≥ 2,5 mm |
| Estenosis de la lesión no culpable > 70% o |
| 50–60% de estenosis y RFF ≤ 0,8 |
| Revascularización inmediata y nunca 72 h después de la ICP índice |
| Criterios de exclusión |
| Revascularización quirúrgica programada |
| Antecedentes de cirugía de derivación coronaria |
IAMCEST: infarto agudo de miocardio con elevación del segmento ST; ICP: intervención coronaria percutánea; RFF: reserva fraccional del flujo. |
En tercer lugar, una cuestión clave está relacionada con la cronología de la revascularización completa. El estudio COMPLETE recomendó una revascularización en etapas y no un único procedimiento. No obstante, algunos estudios han evaluado la revascularización completa en un único procedimiento en pacientes con IAMCEST y con enfermedad multivaso con buenos datos de seguridad y de eficacia7,10. La revascularización completa en un único procedimiento redujo los eventos cardiovasculares en comparación con la revascularización en etapas en pacientes con IAMSEST14. En la actualidad, el estudio The BioVasc (NCT03621501) está realizando una comparativa entre el procedimiento único y en etapas en pacientes tanto IAMCEST como IAMSEST. Según el estudio COMPLETE, la revascularización completa debe realizarse durante la hospitalización inicial, aunque no ofrece datos sobre la revascularización en un único procedimiento.
Por último, se plantea la cuestión ¿puede la revascularización mejorar los resultados de la cardiopatía isquémica estable? Esto está fuera del ámbito de actuación del COMPLETE, y hasta la fecha existe una base de evidencia muy débil al respecto, en el mejor de los casos se ha observado solo un beneficio marginal para la revascularización15. El estudio ISCHEMIA16, actualmente en fase de seguimiento, compara el beneficio de revascularización más tratamiento médico frente a solo tratamiento médico en más de 5.000 pacientes y sus resultados se publicarán muy pronto. No cabe duda de que los resultados serán clave para mejorar la estrategia del tratamiento invasivo de la cardiopatía isquémica estable. ¿Será beneficiosa la revascularización completa en pacientes con síndromes coronarios agudos sin elevación del segmento ST? Es probable, aunque no lo sabemos ni se han realizado estudios sobre esta cuestión.
Mientras tanto, no lo dude, hay que considerar que los pacientes IAMCEST tratados con una angioplastia primaria son buenos candidatos a recibir revascularización completa dentro de las 72 horas anteriores al alta hospitalaria.
CONFLICTO DE INTERESES
J. López-Sendón ha recibido subvenciones de McMaster University (Hamilton, Ontario, Canadá) durante la realización del estudio. J. López-Sendón y R. Moreno son coautores del artículo al que hace referencia este trabajo. R. Moreno es editor asociado de REC: Interventional Cardiology; se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito.
BIBLIOGRAFÍA
1. Mehta SR, Wood, DA. Storey RF, et al.;for the COMPLETE Trial Steering Committee and Investigators. Complete revascularization with multivessel PCI for myocardial Infarction. N Engl J Med. 2019. https://www.nejm.org/doi/10.1056/NEJMoa1907775.
2. González-Juanatey JR, Agra Bermejo R, López-Sendón J. Una historia resumida. Impacto de los avances en cardiopatía isquémica. Rev Esp Cardiol. 2017;17(Suppl A):2-6.
3. Ibañez B, James S, Agewall S, et al.;, for the Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology. 2017 ESC Guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation. Eur Heart J. 2018:39:119-177.
4. Neumann FJ, Sousa-Uva M, Ahlsson A, et al.;for the The Task Force on myocardial revascularization of the European Society of Cardiology (ESC) and European Association for Cardio-Thoracic Surgery (EACTS) 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
5. Moreno R, Mehta SR. Nonculprit Vessel Intervention:Let's COMPLETE the Evidence. Rev Esp Cardiol. 2017;70:418–420.
6. Di Mario C, Sansa M, Airoldi F, et al. Single vs multivessel treatment during primary angioplasty:results of the multicenter randomized HEpacoat for cuLPrit or multi vessel stenting for Acute Myocardial Infarction (HELP-AMI) study. Int J Cardiovasc Intervent. 2004;6:128-133.
7. ald DS, Morris JK, Wald NJ, et al. PRAMI Investigators. Randomized trial of preventive angioplasty in myocardial infarction. N Engl J Med. 2013;369: 1115-1123.
8. Engstrøm T, Kelbæk H, Helqvist S, et al.;for the DANAMI-3—PRIMULTI Investigators. Complete revascularisation versus treatment of the culprit lesion only in patients with ST-segment elevation myocardial infarction and multivessel disease (DANAMI-3—PRIMULTI):an open-label, randomised controlled trial. Lancet. 2015;386:665-671.
9. Smits PC, Abdel-Wahab M, et al. for the Compare-Acute Investigators. Fractional Flow Reserve–Guided Multivessel Angioplasty in Myocardial Infarction. N Engl J Med. 2017;376:1234-1244.
10. Politi L, Sgura F, Rossi R, et al. A randomised trial of target-vessel versus multi-vessel revascularisation in ST-elevation myocardial infarction:Major adverse cardiac events during long-term follow-up. Heart. 2010;96:662-667.
11. Moreno R, García E, Elízaga J, et al. Results of primary angioplasty in patients with multivessel disease. Rev Esp Cardiol. 1998;51:547-555.
12. Knuuti J, Wijns W, SarasteA, et al.;for the Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology. 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes:The Task Force for the diagnosis and management of chronic coronary syndromes of the European Society of Cardiology (ESC). Eur Heart J. 2019. https://doi.org/10.1093/eurheartj/ehz425.
13. Thiele H, Akin I, Sandri M, et al.;CULPRIT-SHOCK Investigators. PCI Strategies in Patients with Acute Myocardial Infarction and Cardiogenic Shock. N Engl J Med. 2017;377:2419-2432.
14. Sardella G, Lucisano L, Garbo R, et al. Single-staged compared with multi-staged PCI in multivessel NSTEMI patients:the SMILE trial. J Am Coll Cardiol. 2016;67:264-272.
15. Stergiuopoulos K, Boden WE, Hartinhan P, et al. Percutaneous Coronary Intervention Outcomes in Patients With Stable Obstructive Coronary Artery Disease and Myocardial IschemiaA Collaborative Meta-analysis of Contemporary Randomized Clinical Trials. JAMA Intern Med. 2014;174:232-240.
16. Hochman JS, Reynolds HR, Bangalore S, et al.;for the ISCHEMIA Research Group. Baseline characteristics and risk profiles of participants in the ISCHEMIA randomized clinical trial. JAMA Cardiol. 2019;4:273-286
Corresponding author: Servicio de Cardiología, Hospital Universitario La Paz, P.º de la Castellana 261, 28046 Madrid, España.
Correo electrónico: jlopezsendon@gmail.com (J. López-Sendón).
RESUMEN
En la última década, el reemplazo valvular aórtico transcatéter (TAVR, por sus siglas en inglés) se ha convertido en el tratamiento preferente para los pacientes con estenosis aórtica grave y con alto o incluso moderado riesgo quirúrgico. En consecuencia, esta nueva tecnología ha sido evaluada en sujetos de bajo riesgo quirúrgico. En el estudio PARTNER 3 se aleatorizó a 1.000 pacientes (puntuación media de la Society of Thoracic Surgeons, 1,9%; edad media, 73 años) para ser sometidos a TAVR con una válvula balón expandible o a reemplazo quirúrgico de válvula aórtica, y se halló que la TAVR fue superior en términos del objetivo final compuesto de muerte, ictus y reingreso a 1 año. En el ensayo Evolut Low Risk, en el que 1.468 pacientes fueron aleatorizados a TAVR con una prótesis autoexpandible o cirugía, la TAVR no fue inferior a esta última en términos del criterio de valoración principal compuesto de muerte o accidente cerebrovascular discapacitante a los 24 meses. Si bien el seguimiento a 1-2 años disponible no responde a la pregunta sobre la durabilidad de las válvulas transcatéter, estos resultados cambiarán nuestra práctica clínica diaria.
Palabras clave: Reemplazo de válvula aórtica transcatéter. Riesgo quirúrgico bajo. Ensayo aleatorizado.
ABSTRACT
Over the last decade, transcatheter aortic valve replacement (TAVR) has become the preferred treatment for patients with severe aortic stenosis at increased risk for surgery. Consequently, this new technology has been recently tested in low-risk subjects. The PARTNER 3 trial randomized 1000 patients (mean Society of Thoracic Surgeons score, 1.9%; mean age, 73 years) to undergo TAVR with a balloon-expandable valve or surgical aortic valve replacement showing that TAVR was superior in terms of the composite endpoint of death, stroke and re-hospitalization at 1 year. In the Evolut Low Risk trial that randomized 1468 patients with the use of a self-expandable prosthesis, TAVR was non-inferior to surgery for the primary composite endpoint of death or disabling stroke at 24 months. While the available 1-year follow up does not answer the question of transcatheter valves durability, these results will definitely change our everyday clinical practice.
Keywords: Transcatheter aortic valve replacement. Low surgical risk. Randomized trial.
Abbreviations: EAo: estenosis aórtica; FPV: fuga paravalvular; SAVR: reemplazo quirúrgico de válvula aórtica; TAVI: implante percutáneo de válvula aórtica.
La angioplastia coronaria percutánea tardó aproximadamente 30 años, desde la primera experiencia capitaneada por Andreas Gruentzig en 1977, en alcanzar la indicación clase I en las guías de práctica clínica sobre el manejo de la revascularización miocárdica del tronco coronario izquierdo/enfermedad arterial coronaria de 3 vasos y en reemplazar a la cirugía de revascularización coronaria en el manejo de la mayoría de pacientes con enfermedad arterial coronaria. Algo parecido ha ocurrido con el implante percutáneo de válvula aórtica (TAVI), realizado por primera vez hace 17 años en un paciente de riesgo prohibitivo con estenosis valvular aórtica (EAo) grave, hasta la llegada del ensayo aleatorizado contemporáneo de TAVI comparado con recambio valvular aórtico quirúrgico (SAVR) en una población de bajo riesgo quirúrgico. Ha sido un camino jalonado por importantes avances técnicos en prótesis válvulares cardiacas percutáneas, por la creciente experiencia de los intervencionistas y por ensayos aleatorizados rigurosamente diseñados. De hecho, el TAVI demostró por primera vez ser superior al tratamiento médico en pacientes considerados inoperables1,2, y confirmó no ser inferior al SAVR en pacientes de riesgo alto3,4 e intermedio5,6. De hecho, cuando se realiza por vía transfemoral, el TAVI demostró ser superior al SAVR7. Así que el momento parecía propicio para poner a prueba esta disruptiva tecnología en pacientes de bajo riesgo, que suponen el 80% de los pacientes que hasta la fecha se someten a intervenciones SAVR8,9.
El ensayo PARTNER 310 es un estudio aleatorizado y multicéntrico que comparó las intervenciones de TAVI y SAVR para el tratamiento de la EAo sintomática grave en pacientes de bajo riesgo quirúrgico (puntuaciones < 4% en la escala de la Society of Thoracic Surgeons [STS]. Este ensayo aleatorizó a 1.000 pacientes de bajo riesgo (puntuación media en la escala STS del 1,9%) de 71 centros (el 98% de los pacientes se inscribieron en los Estados Unidos) a someterse a TAVI transfemoral con la prótesis válvular expandible por balón SAPIEN 3 (Edwards Lifesciences, Irvine, California, Estados Unidos), o a SAVR. El objetivo primario fue un compuesto de mortalidad por cualquier causa, accidente cerebrovascular y rehospitalización por insuficiencia cardiaca al año. El ensayo se diseñó para poner a prueba tanto la no inferioridad (con un margen preespecificado de 6 puntos porcentuales) como la superioridad del TAVI en la población tratada. Se observó un descenso del 46% en el índice del objetivo primario compuesto al cabo de 1 año para TAVI frente a SAVR que cumplió los criterios tanto de no inferioridad (8,5 frente al 15,1%; diferencia absoluta: -6,6%; intervalo de confianza del 95% [IC95%], de -10,8 a -2,5; p < 0,001) como de superioridad (hazard ratio [HR]: 0,54; IC95%, 0,37-0,79; p = 0,001). Aún después de excluir las rehospitalizaciones por insuficiencia cardiaca, el componente más débil del objetivo compuesto, el TAVI obtuvo mejores resultados que la cirugía (mortalidad o accidente cerebrovascular del 1,8 frente al 4,9%; efecto del tratamiento: 0,36; IC95%, 0,17-0,79). También se valoraron jerárquicamente varios objetivos secundarios preespecificados que arrojaron índices mucho más bajos de accidente cerebrovascular (0,6 frente al 2,4%; p = 0,02), mortalidad o accidente cerebrovasculare (1,0 frente al 3,3%; p = 0,01), hemorragia mayor o con peligro para la vida (3,6 frente al 24,5%; p < 0,001) y fibrilación auricular de nueva aparición (5,0 frente al 39,5%; p < 0,001) en el grupo TAVI. No se observaron diferencias significativas en las fugas paravalvulares (FPV) moderadas o graves (0,8 frente al 0%), en la necesidad de implantar marcapasos permanentes (6,5 frente al 4,0%) ni en las complicaciones vasculares mayores (2,2 frente al 1,5%) entre ambas poblaciones.
Otro estudio aleatorizado realizado en pacientes de bajo riesgo con EAo, el ensayo Evolut Low Risk11, confirmó la no inferioridad del TAVI con una protesis valvular autoexpandible (Evoult R and Pro, Evolut Medtronic Inc., Minneapolis, Minnesota, Estados Unidos) comparado con la cirugía en el objetivo primario compuesto de mortalidad por cualquier causa o accidente cerebrovascular discapacitante a los 24 meses11. La tasa de incidencia estimada a los 24 meses del objetivo primario fue del 5,3% en el grupo TAVI frente al 6,7% en el grupo quirúrgico (diferencia: –1,4 puntos porcentuales; intervalo creíble bayesiano al 95% para la diferencia: de –4,9 a 2,1; probabilidad posterior de no inferioridad > 0,999). En este estudio, el TAVI no resultó superior a SAVR, aunque arrojó índices numéricamente más bajos para los resultados clínicos más importantes (los resultados principales de ambos estudios se muestran en la tabla 1). En resumen, los pacientes sometidos a TAVI arrojaron tasas de incidencia más bajas de accidentes cerebrovasculares discapacitantes, complicaciones hemorrágicas, daño renal agudo y fibrilación auricular y una tasa de incidencia más alta de FPV moderadas/graves e implante de marcapasos. Aunque una comparativa entre los dos ensayos resulta difícil habida cuenta de las diferencias en el diseño estadístico y objetivos de ambos (algo que supera el objetivo de este manuscrito), sí es importante resaltar que ambos estudios apuntaron en la misma dirección sugiriendo un efecto de clase de TAVI en esta población de bajo riesgo.
Estos estudios son un hito de la cardiología intervencionista y, por ende, de la medicina moderna por dos razones. En primer lugar, porque son el último escalón en la escala de riesgo quirúrgico para TAVI, demostrando de una vez por todas que el abordaje transcatéter de la EAo grave ofrece resultados similares (si no superiores) a los de SAVR con independencia del riesgo quirúrgico. En segundo lugar, y más importante si cabe, porque se trata de los dos primeros ensayos aleatorizados que ponen a prueba el abordaje transcatéter de la EAo en una población más joven con mayor esperanza de vida. La media de edad de la población del estudio fue de 73-74 años, con apenas el 10% de los participantes del estudio con una edad < 65 años en el ensayo PARTNER 3. Antes de la llegada de estos estudios, la media de edad de los pacientes tratados con TAVI estaba por encima de los 80 años (figura 1)8. Centrándonos en el PARTNER 3, en esta población de pacientes más jóvenes y sanos, el grupo de control quirúrgico tuvo muy buenos resultados, arrojando índices de mortalidad a los 30 días de apenas el 1,1% y tasas de accidentes cerebrovasculares discapacitantes a los 30 días del 0,4% (un 2% de accidentes cerebrovasculares no discapacitantes). En cualquier caso, el grupo TAVI arrojó índices de mortalidad a los 30 días todavía más bajos (0,4%) sin tasas de accidentes cerebrovasculares discapacitantes (un 0,6% de accidentes cerebrovasculares no discapacitantes). A este respecto, el índice extremadamente bajo de accidentes cerebrovasculares observado en el grupo TAVI cuestiona la necesidad de un uso rutinario de dispositivos de protección frente a embolias cerebrales. La mortalidad por cualquier causa al cabo de 1 año también fue extremadamente baja en ambos grupos comparado con anteriores ensayos PARTNER. Si analizamos los datos con detenimiento, está claro que casi todas las pocas muertes que se produjeron tuvieron alguna causa cardiaca (observándose una tasa de mortalidad cardiaca del 0,8% en el grupo TAVI frente a un 2% en el grupo SAVR). Este hallazgo es nuevo si lo comparamos con anteriores estudios TAVI en los que la mortalidad cardiaca suponía menos del 60% de las muertes al cabo de 1 año, lo cual, con toda probabilidad, se debe a la menor edad y baja prevalencia de comorbilidades de la población del PARTNER 3.
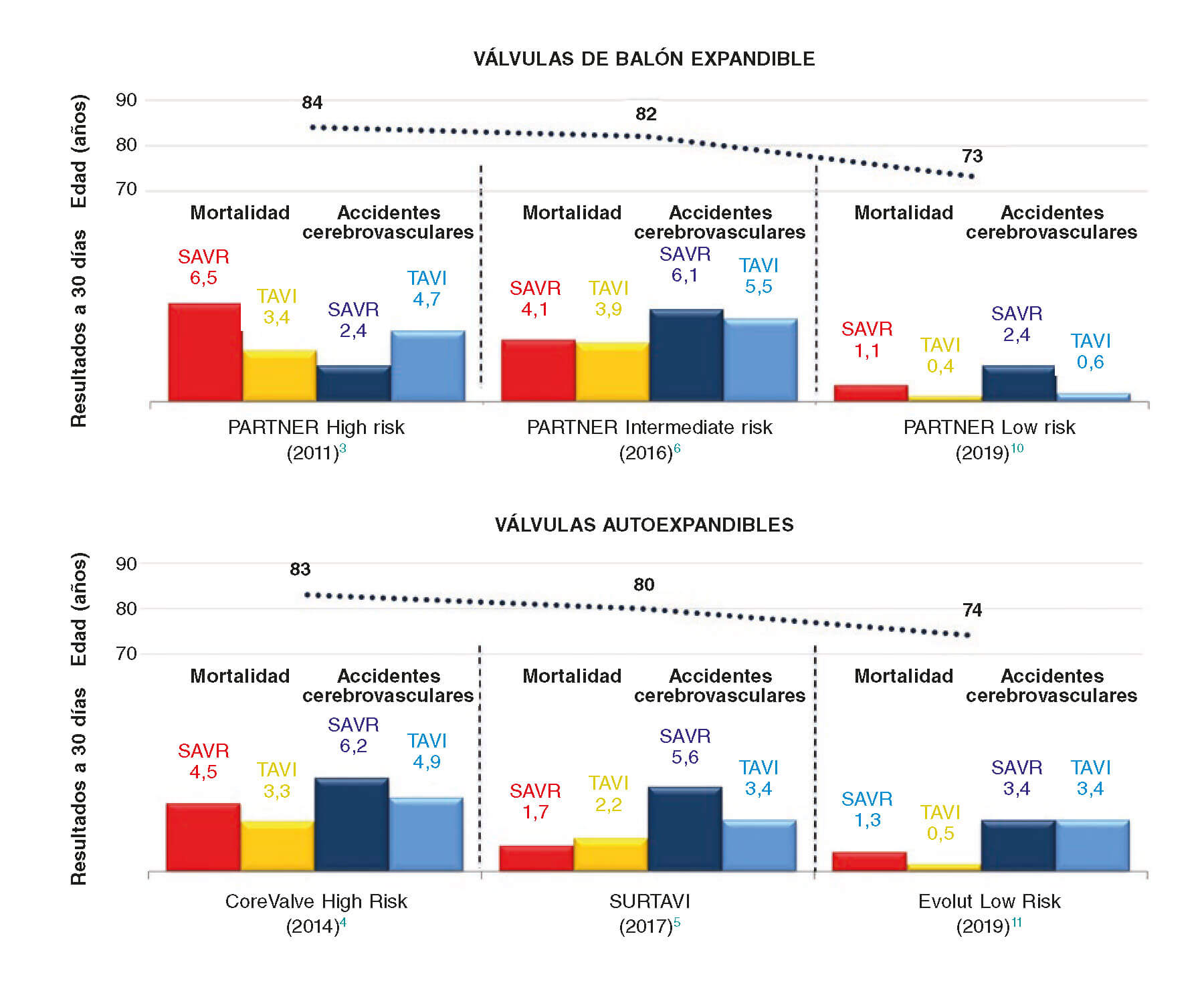
Figura 1. Mortalidad a 30 días y tasas de accidentes cerebrovasculares en dos importantes ensayos sobre implante transcatéter de prótesis valvular aórtica (TAVI) frente a recambio valvular aórtico quirúrgico (SAVR) en todo el espectro de riesgo quirúrgico. Cabe destacar que la media de edad de la población del estudio se redujo significativamente en los ensayos clínicos PARTNER 3 (PARTNER Low Risk) y Evolut Low Risk.
Otro hallazgo sorprendente de este estudio fue que anteriores problemas del TAVI tales como las complicaciones vasculares, la necesidad de implante de marcapasos y los índices de FPV moderadas/graves fueron tan bajos como los de SAVR. Esto probablemente se deba a los importantísimos avances técnicos de las prótesis valvulares para TAVI de última generación12 (con la llegada de las faldas externas de sellado y un menor calibre de la vaina introductora), a las metódicas valoraciones preoperatorias realizadas mediante tomografía computarizada (reduciéndose, por tanto, el dimensionamiento de la prótesis) y a la mayor experiencia de los intervencionistas (con resultado de implantes más precisos). Este descenso de las complicaciones perioperatorias, sumado a la adopción de abordajes mínimamente invasivos (solo un tercio de las intervenciones TAVI se realizaron bajo anestesia general, y la mayoría ni siquiera precisó de ingreso en la unidad de cuidados intensivos) resultó en hospitalizaciones más cortas para los pacientes TAVI (3,0 frente a 7,0 días) y en índices más altos de altas hospitalarias y autocuidado (el 95,8 frente al 73,1%) comparado con SAVR. Así pues, tanto el estado funcional como la calidad de vida a los 30 días fueron mejores entre pacientes TAVI.
En lo que respecta a los hallazgos ecocardiográficos, aunque la FPV moderada/grave fue similar en los 2 grupos, TAVI arrojó índices mucho más altos de FPV leve que la cirugía (del 28,7% frente al 2,9%). Habría que señalar que se desconoce el impacto que tienen las FPV leves en los resultados a largo plazo de pacientes más jóvenes. Además, los pacientes TAVI presentaban áreas valvulares aórticas medias más bajas y gradientes transvalvulares más altos a los 30 días que los pacientes SAVR (1,7 frente a 1,8 cm2 y 12,8 frente a 11,2 mmHg, respectivamente). Este hallazgo no descrito en ninguno de los anteriores ensayos PARTNER probablemente se deba al mayor uso de bioprótesis más grandes en el grupo quirúrgico (el 80% de las prótesis medían ≥ 23 mm). No obstante, todavía está por ver si la mayor área valvular del grupo quirúrgico se traducirá en beneficios hemodinámicos o clínicos en un seguimiento a más largo plazo. Cabe destacar que, en el ensayo Evolut Low Risk, a los 12 meses los pacientes sometidos a TAVI con una prótesis valvular supraanular autoexpandible presentaron gradientes valvulares aórticos más bajos (8,6 frente a 11,2 mmHg) y áreas efectivas del orificio más grandes (2,3 frente a 2,0 cm2) que los pacientes del grupo quirúrgico.
Tabla 1. Resumen de las características basales y resultados de pacientes con estenosis valvular aórtica inscritos en los ensayos aleatorizados PARTNER 3 y Evolut Low Risk
| PARTNER 3 | Evolut Low Risk | |||||
|---|---|---|---|---|---|---|
| TAVI (n = 496) | SAVR (n = 454) | Efecto del tratamiento [IC95%] | TAVI (n = 725) | SAVR (n = 678) | Diferencia [IC95%] | |
| Características basales | ||||||
| Edad (años) | 73,3±5,8 | 73,6±6,1 | – | 74,1±5,8 | 74,1±5,8 | – |
| Puntuación en la escala STS (%) | 1,9±0,7 | 1,9±0,6 | – | 1,9±0,7 | 1,9±0,7 | – |
| Sexo varón (%) | 67,5 | 71,1 | – | 64,0 | 66,2 | – |
| FEVI media (%) | 65,7±9,0 | 66,2±8,6 | – | 61,7±7,9 | 61,9±7,7 | – |
| Clase III-IV según NYHA (%) | 31,2 | 23,8 | – | 25,1 | 28,4 | – |
| Objetivo primario | ||||||
| Mortalidad por cualquier causa, accidente cerebrovascular o rehospitalizaciones por insuficiencia cardiaca al cabo de 1 año (%) | 8,5 | 15,1 | 0,54 [0,37-0,79] | – | – | – |
| Mortalidad por cualquier causa o accidente cerebrovascular discapacitante al cabo de 2 años (%) | – | – | – | 5,3 | 6,7 | –1,4 [–4,9- 2,1] |
| Resultados a 30 días | ||||||
| Mortalidad por cualquier causa (%) | 0,4 | 1,1 | 0,37 [0,07-1,88] | 0,5 | 1,3 | –0,8 [–1,9- 0,2] |
| Mortalidad cardiaca (%) | 0,4 | 0,9 | 0,46 [0,08-2,49] | 0,5 | 1,3 | –0,8 [–1,9- 0,2] |
| Accidente cerebrovascular discapacitante (%) | 0 | 0,4 | ND | 0,5 | 1,7 | –1,2 [–2,4- -0,2] |
| Hemorragia mayor o con peligro para la vida (%) | 1,2 | 11,9 | 0,09 [0,04-0,22] | 2,4 | 7,5 | –5,1 [–7,5- -2,9] |
| Complicaciones vascular mayores (%) | 2,2 | 1,5 | 1,44 [0,56-3,73] | 3,8 | 3,2 | 0,6 [–1,4- 2,5] |
| Daño renal agudo en fase II-III (%) | 0,4 | 1,8 | ND | 0,9 | 2,8 | –1,8 [–3,4- –0,5] |
| Fibrilación auricular de nueva aparición (%) | 5,0 | 39,5 | 0,10 [0,06-0,16] | 7,7 | 35,4 | –27,7 [–31,8- –23,6] |
| Implante de un nuevo marcapasos (%) | 6,5 | 4,0 | 1,66 [0,93-2,96] | 17,4 | 6,1 | 11,3 [8,0-14,7] |
| Fuga paravalvular moderada/grave (%) | 0,8 | 0 | ND | 3,4 | 0,4 | – |
| Área valvular aórtica media (cm2) | 1,7±0,02 | 1,8±0,02 | –0,1 [–0,1- 0] | 2,2±0,06 | 2,0±0,06 | – |
| Gradiente valvular aórtico medio (mmHg) | 12,8 | 11,2 | 1,5 [0,9-2,0] | 3,4 | 0,4 | – |
| Resultados a 1 año | ||||||
| Mortalidad por cualquier causa (%) | 1,0 | 2,5 | 0,41 [0,14-1,17] | 2,4 | 3,0 | –0,6 (–2,6-1,3) |
| Mortalidad cardiaca (%) | 0,8 | 2,0 | 0,40 [0,12-1,30] | 1,7 | 2,6 | –0,9 (−2,7- 0,7) |
| Accidente cerebrovascular discapacitante (%) | 0,2 | 0,9 | 0,22 [0,03-2,00] | 0,8 | 2,4 | –1,6 (–3,1- –0,3) |
| Rehospitalizaciones por insuficiencia cardiaca (%) | 7,3 | 11,0 | 0,65 [0,42-1,00] | 3,2 | 6,5 | –3,4 (–5,9- –1,0) |
FEVI: fracción de eyección del ventrículo izquierdo; IC95%: intervalo de confianza del 95%; NYHA: New York Heart Association; SAVR: recambio valvular aórtico quirúrgico; STS: Society of Thoracic Surgeons; TAVI: implante transcatéter de prótesis valvular aórtica. | ||||||
La principal limitación de estos estudios es que el seguimiento a corto plazo no responde a la incógnita de la durabilidad de la prótesis valvular del TAVI, algo de importancia capital cuando tratamos sujetos más jóvenes de bajo riesgo. Sorprende que los datos disponibles a largo plazo (seguimiento de hasta 8 años)13,14 no parecen revelar signo alguno de deterioro valvular precoz. Aunque esto sigue siendo motivo de preocupación para muchos médicos, hemos de decir que muchas de las bioprótesis quirúrgicas que se utilizan hoy en día en todo el mundo tienen incluso menos datos a largo plazo que los disponibles para las percutaneas. Para abordar esta cuestión, el protocolo del estudio incluye una evaluación anual de hasta 10 años, al menos, después del primer procedimiento, que, finalmente, arrojará luz sobre el rendimiento hemodinámico a largo plazo (en lo que a la disfunción de la válvula bioprotésica y las tasas de fracaso se refiere) de las válvulas cardiacas percutáneas y quirúrgicas. Por si esto fuera poco, un subanálisis mediante angiografía por tomografía computarizada del ensayo PARTNER 3 analizará la disfunción válvula-velos y la trombosis valvular asintomática. Sobre esta cuestión, al cabo de 1 año, cinco pacientes del grupo TAVI y un único paciente del grupo quirúrgico presentaban evidencias indicativas de trombosis valvular.
Cabe destacar que los hallazgos de estos estudios no deben extrapolarse a todos los pacientes con EAo de bajo riesgo quirúrgico. Por ejemplo, los pacientes con válvula aórtica bicúspide, representativos de una porción importante de sujetos más jóvenes con EAo, fueron excluidos del análisis principalmente por problemas relacionados con la presencia de un anillo elíptico o calcificaciones asimétricas de los velos que, posiblemente, acarrearon la expansión excéntrica de la prótesis e índices más altos de FPV y riesgo de rotura anular)15,16. En un reciente análisis de emparejamiento por puntuación de la propensión del registro STS/TVT, el procedimiento TAVI en válvula bicúspide frente a tricúspide se asoció a un mayor riesgo de lesión aórtica y de conversión a cirugía a corazón abierto (si bien la tasa global fue < 1,0%), aunque la supervivencia a los 30 días y 1 año fue parecida. Llegados a este punto, es necesario realizar un ensayo aleatorizado y dedicado de pacientes con EAo bicúspide. Estos estudios también excluyeron a pacientes con vías transfemorales no aptas, EAo con gradiente y flujo bajos, enfermedad arterial coronaria grave (puntuación en la escala SYNTAX > 32) y ausencia de síntomas17. Por último, los pacientes reclutados fueron intervenidos por operadores experimentados en centros que habitualmente gestionan volúmenes altos de casos. En este sentido, los bajos índices de eventos descritos podrían no ser reproducibles en centros más pequeños con médicos menos experimentados.
Los estudios PARTNER 3 y Evolut Low Risk tendrán profundas implicaciones para la práctica clínica y, con toda probabilidad, generarán una indicación clase I de TAVI, también, en sujetos de bajo riesgo en las guías de práctica clínica internacionales de próxima publicación. Las opciones de tratamiento en pacientes con EAo asintomática grave ya no deberían basarse, solo, en el riesgo quirúrgico sino en consideraciones clínicas y anatómicas y en la propia preferencia de los pacientes. A menos que haya una característica anatómica clara que decante la balanza a favor del procedimiento SAVR (como, por ejemplo, una válvula aórtica bicúspide, una puntuación alta en la escala SYNTAX o un abordaje transfemoral inviable), a partir de ahora cada paciente que vaya a someterse a una intervención SAVR con una válvula bioprotésica, deberá ser informado de la posibilidad de optar por el procedimiento TAVI. Quizá dentro de no mucho tiempo, el implante transcatéter de prótesis valvular aórtica se convierta en el tratamiento preferido para la mayoría de pacientes con EAo y provoque el largamente esperado cambio de paradigma: en lugar de preguntarnos si un paciente es candidato a un procedimiento TAVI, tendremos que justificar que es candidato a la cirugía. Habrá que esperar a los datos de durabilidad a largo plazo, pero parece que la intervención SAVR va camino de convertirse en una especie en peligro de extinción.
CONFLICTO DE INTERESES
G. Tarantini ha recibido remuneración económica por su labor como conferenciante de Edwards Lifesciences, Medtronic, Boston Scientifics, Abbott. L. Nai Fovino no declaró conflicto de interés alguno en relación con este artículo.
BIBLIOGRAFÍA
1. Leon MB, Smith CR, Mack M, et al. Transcatheter aortic-valve implantation for aortic stenosis in patients who cannot undergo surgery. N Engl J Med. 2010;363:1597-1607.
2. Popma JJ, Adams DH, Reardon MJ, et al. Transcatheter aortic valve replacement using a self-expanding bioprosthesis in patients with severe aortic stenosis at extreme risk for surgery. J Am Coll Cardiol. 2014;63:1972-1981.
3. Smith CR, Leon MB, Mack MJ, et al. Transcatheter versus surgical aortic-valve replacement in high-risk patients. N Engl J Med. 2011;364:2187-2198.
4. Adams DH, Popma JJ, Reardon MJ, et al. Transcatheter aortic-valve replacement with a self-expanding prosthesis. N Engl J Med. 2014;370:1790-1798.
5. Reardon MJ, Van Mieghem NM, Popma JJ, et al. Surgical or Transcatheter Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2017;376:1321-1331.
6. Leon MB, Smith CR, Mack MJ, et al. Transcatheter or Surgical Aortic-Valve Replacement in Intermediate-Risk Patients. N Engl J Med. 2016;374:1609-1620.
7. Thourani VH, Kodali S, Makkar RR, et al. Transcatheter aortic valve replacement versus surgical valve replacement in intermediate-risk patients:a propensity score analysis. Lancet. 2016;387:2218-2225.
8. Tarantini G, Nai Fovino L, Gersh BJ. Transcatheter aortic valve implantation in lower-risk patients:what is the perspective?Eur Heart J. 2018;39:658-666.
9. Tarantini G, Lefèvre T, Terkelsen CJ, et al. One-Year Outcomes of a European Transcatheter Aortic Valve Implantation Cohort According to Surgical Risk. Circ Cardiovasc Interv. 2019;12:e006724.
10. Mack MJ, Leon MB, Thourani VH, et al.;PARTNER 3 Investigators. Transcatheter Aortic-Valve Replacement with a Balloon-Expandable Valve in Low-Risk Patients. N Engl J Med. 2019;380:1695-1705.
11. Popma JJ, Deeb GM, Yakubov SJ, et al.;Evolut Low Risk Trial Investigators. Transcatheter Aortic-Valve Replacement with a Self-Expanding Valve in Low-Risk Patients. N Engl J Med. 2019;380:1706-1715.
12. Nai Fovino L, Badawy MRA, Fraccaro C, et al. Transfemoral aortic valve implantation with new-generation devices:the repositionable Lotus versus the balloon-expandable Edwards Sapien 3 valve. J Cardiovasc Med (Hagerstown). 2018;19:655-663.
13. Barbanti M, Costa G, Zappulla P, et al. Incidence of Long-Term Structural Valve Dysfunction and Bioprosthetic Valve Failure After Transcatheter Aortic Valve Replacement. J Am Heart Assoc. 2018;7:e008440.
14. Tarantini G, Purita PAM, D'Onofrio A, et al. Long-term outcomes and prosthesis performance after transcatheter aortic valve replacement:results of self-expandable and balloon-expandable transcatheter heart valves. Ann Cardiothorac Surg. 2017;6:473-483.
15. Tarantini G, Basso C, Fovino LN, Fraccaro C, Thiene G, Rizzo S. Left ventricular outflow tract rupture during transcatheter aortic valve implantation:anatomic evidence of the vulnerable area. Cardiovasc Pathol. 2017;29:7-10.
16. Tarantini G, Fabris T, Cardaioli F, Nai Fovino L. Coronary access after transcatheter aortic valve replacement in bicuspid aortic valve:lights and shades. JACC Cardiovasc Interv. 2019. http://doi.org/10.1016/j.jcin.2019.03.031.
17. Tarantini G, Nai Fovino L, Tellaroli P, Fabris T, Iliceto S. Asymptomatic Severe Aortic Stenosis and Noncardiac Surgery. Am J Cardiol. 2016;117:486-488.
Autor para correspondencia: Department of Cardiac, Thoracic and Vascular Science, Padova University Hospital, Via Giustiniani 2, 35128 Padova, Italia.
Correo electrónico: giuseppe.tarantini.1@gmail.com (G. Tarantini).
Resumen
El uso de ácido acetilsalicílico en combinación con un inhibidor del receptor P2Y12, es decir, es decir, la doble terapia antiplaquetaria, representa la piedra angular del tratamiento para los pacientes en los que se implanta un stent coronario. El uso de inhibidores P2Y12 de nueva generación (prasugrel y ticagrelor), caracterizados por efectos antiplaquetarios más potentes y mejores resultados clínicos en comparación con clopidogrel, se recomienda en pacientes de alto riesgo, como aquellos con un síndrome coronario agudo. Sin embargo, este beneficio es a expensas de un aumento del riesgo de sangrado que se acumula con la duración del tratamiento. Dada la adversa repercusión pronóstica, incluido el aumento de la mortalidad, asociada al sangrado, han surgido una serie de estrategias destinadas a reducir el riesgo de este evento adverso a la vez que se preserva la eficacia. Entre estos, retirar el ácido acetilsalicílico representa una línea de investigación clínica. La justificación farmacológica de dicha estrategia se basa en el papel central de la v.a de inhibici.n de P2Y12 en la activación de plaquetas y su contribución a la amplificación de los procesos trombóticos. Por lo tanto, se ha planteado la hipótesis de que, en presencia de un potente bloqueo del receptor P2Y12, el ácido acetilsalicílico puede ofrecer una contribución mínima para la reducción de las complicaciones trombóticas, pero de hecho contribuye al aumento de las complicaciones hemorrágicas. Una serie de ensayos clínicos actualmente en curso cuestionan el dogma del ácido acetilsalicílico como una terapia de base obligatoria en pacientes tratados con stents coronarios.
Palabras clave: Ácido acetilsalicílico. Ticagrelor. Stent. Trombosis
Abstract
The use of aspirin in combination with a P2Y12 receptor inhibitor, also known as dual antiplatelet therapy, is at the cornerstone of treatment for patients undergoing coronary stenting. The use of newer generation P2Y12 inhibitors (ie, prasugrel and ticagrelor), characterized by more potent antiplatelet effects and better clinical outcomes compared to clopidogrel, are recommended in highrisk patients, such as those with an acute coronary syndrome. However, this occurs at the expense of increased bleeding that accumulates with the duration of treatment. Given the poor prognostic implication, including an increased mortality rate associated with bleeding, a number of strategies aimed at reducing the risk of this adverse event while preserving efficacy have emerged. Among these, withdrawing aspirin represents an ongoing line of clinical investigation. The pharmacological reason behind such strategy relies on the central role played by the metabolic pathway of P2Y12 receptor inhibitors on platelet activation and its contribution amplifying thrombotic processes. Thus, it has been hypothesized that in the presence of a powerful P2Y12 receptor blockade, aspirin may offer minimal contribution when it comes to reducing thrombotic complications, but rather contribute to increased bleeding complications. A number of ongoing clinical investigations are currently challenging the dogma of aspirin as a mandatory background therapy in patients undergoing coronary stenting.
Keywords: Aspirin. Ticagrelor. Stent. Thrombosis
Abreviaturas: AAS: ácido acetilsalicílico EC: enfermedad coronaria ICP: intervención coronaria percutánea SCA: síndrome coronario agudo TAPD: tratamiento antiagregante plaquetario doble
El ácido acetilsalicílico (AAS) es la piedra angular del tratamiento de pacientes con manifestaciones clínicas de enfermedad coronaria (EC)1. Sin embargo, el alto índice de episodios isquémicos recurrentes a pesar del tratamiento con AAS ha llevado, inevitablemente, a explorar los efectos asociados al uso de terapias antitrombóticas adyuvantes, sobre todo, en entornos de alto riesgo. Entre estas, el uso adyuvante de inhibidores orales del P2Y12 ha demostrado ser fundamental tanto en pacientes con síndrome coronario agudo (SCA) como en pacientes sometidos a intervenciones coronarias percutáneas (ICP) con implante de stent2. La combinación de AAS e inhibidor del P2Y12, también conocido como tratamiento antiagregante plaquetario doble (TAPD), ha sido el tratamiento estándar por excelencia de pacientes con SCA/ICP y forma parte, desde hace casi dos décadas, de las guías clínicas de uso diario3. Clopidogrel es el inhibidor del P2Y12 más usado. A pesar de su eficacia demostrada, varios estudios han revelado una amplia variabilidad en los perfiles individuales de respuesta al clopidogrel, y son muchos los pacientes que sufren efectos inhibitorios plaquetarios no buscados4. Cabe destacar que varios estudios han confirmado que estos sujetos corren, también mayor riesgo de sufrir episodios isquémicos, sobre todo, trombosis del stent5. Esto ha llevado a desarrollar inhibidores del P2Y12 tales como prasugrel y ticagrelor, que se caracterizan por tener un efecto antiagregante plaquetario más potente y fiable2. Comparados con el clopidogrel, ambos agentes han demostrado ser capaces de reducir, ostensiblemente, las re-currencias isquémicas de pacientes que sufren SCA, incluida trombosis del stent, a costa de un mayor riesgo de sangrado2. En ausencia de contraindicaciones, las guías de práctica clínica abogan por el uso de prasugrel o ticagrelor en detrimento de clopidogrel3.
Aunque se han llevado a cabo pocos estudios comparativos directos a gran escala entre prasugrel y ticagrelor, este último parece tener un perfil de seguridad algo más favorable que el prasugrel en lo que a la posibilidad de provocar hemorragias se refiere2. Estas observaciones pueden atribuirse a los distintos perfiles farmacológicos de estos agentes, ya que el ticagrelor es un inhibidor reversible del receptor P2Y12 y el prasugrel un agente irreversible1. Además, en pacientes con SCA, el ticagrelor se asocia a una menor mortalidad cardiovascular que el clopidogrel, un hallazgo que no se ha observado al comparar prasugrel y clopidogrel1. Estos hallazgos se han atribuido, aunque jamás se ha demostrado una relación causal, a efectos del ticagrelor en lugares distintos de su diana terapéutica (como en la inhibición del transportador de nucleósidos equilibrador tipo 1 [ENT-1], que acarrea niveles más altos de adenosina). En líneas generales, estas observaciones, al igual que otros muchos escenarios clínicos de SCA en los que el ticagrelor ha demostrado ser beneficioso, han fomentado el uso de ticagrelor en detrimento del prasugrel. En cualquier caso, sigue preocupando el riesgo hemorrágico asociado a cursos más largos de TAPD de AAS y ticagrelor7. Hemos de dejar constancia, no obstante, de que la ocurrencia de complicaciones hemorrágicas, incluso durante la fase de mantenimiento de TAPD, acarrea importantes implicaciones pronósticos incluida una mayor mortalidad8. Estas observaciones han generado una serie de investigaciones encaminadas a identificar estrategias asociadas a un menor riesgo hemorrágico sin un efecto negativo en la eficacia. Algunas de estas estrategias son acortar la duración del TAPD, ir reduciendo, paulatinamente, el tratamiento antiagregante plaquetario y retirar el AAS9-12. De hecho, la evolución del diseño de los stents nos ofrece ya plataformas (menos trombogénicas) que han posibilitado investigaciones en este campo10.
El uso de estrategias sin AAS post-ICP se ha puesto a prueba prospectivamente en ensayos aleatorizados de pacientes con fibrilación auricular sometidos a ICP y que precisan tratamiento anticoagulante13. Estos estudios han demostrado reiteradamente que retirar el AAS cuanto antes y promover un abordaje de tratamiento antitrombótico doble (principalmente clopidrogrel más un anticoagulante oral) reduce notablemente la tasa de hemorragias sin efecto negativo en la eficacia. En consecuencia, una estrategia de tratamiento antitrombótico doble es lo que se recomienda, hoy en día, tras realizar una ICP13,14. La razón de considerar una estrategia sin AAS en pacientes sometidos a ICP que no precisan tratamiento anticoagulante oral se debe, en buena medida, al muy efectivo grado de inhibición del P2Y12 que se alcanza con ticagrelor15. Cabe destacar que la vía de señalización del receptor P2Y12 juega un papel esencial tanto en la activación plaquetaria como en la amplificación de los procesos trombóticos (figura 1)16. Estudios in vitro también han venido a confirmar que el uso de AAS ofrece efectos farmacodinámicos limitados en presencia de un bloqueo efectivo del receptor P2Y12 (figura 2)17. A la luz de la bien establecida asociación que existe entre el AAS y las hemorragias, sobre todo las gastrointestinales, se ha planteado la hipótesis de que suspender el tratamiento con AAS tras la fase de mayor riesgo trombótico (1-3 meses post-ICP) podría reducir el riesgo de complicaciones hemorrágicas sin efecto negativo alguno sobre la eficacia9. También se ha sugerido que, a la luz del impacto nocivo que ejercen las hemorragias sobre los resultados clínicos, una estrategia sin AAS, mejoraría la eficacia18.
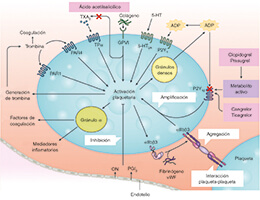
Figura 1. Mecanismos de activación plaquetaria. La activación plaquetaria se inicia mediante agonistas solubles como la trombina, el tromboxano A2 (TXA2), la 5-hidroxitriptamina 5-HT), el adenosín difosfato (ADP [mediante interacción con el receptor purinérgico P2Y12) y el adenosín trifosfato (ATP) y mediante ligandos de adhesión como el colágeno y el factor de von Villebrand (vWF). Como consecuencia, la densa secreción granular de los agonistas plaquetarios y la secreción de TXA2, resultante de la activación de la fosfolipasa A2, amplifican la activación plaquetaria y respuestas asociadas. El receptor purinérgico P2Y12 juega un papel fundamental en la amplificación de la activación plaquetaria, que también se ve apoyado por una señalización de fuera hacia adentro vía integrina αIIbβ3 (el receptor de la glucoproteína IIb/IIIa). De ahí que el bloqueo conjunto de P2Y12 e integrina αIIbβ3 tenga efectos sumativos tanto en la activación plaquetaria como en las respuestas plaquetarias asociadas. 5-HT2A: receptores 5-HT2A; GPVI: glucoproteína plaquetaria IV; ON: óxido nítrico; PAR: receptor activado por proteasas; PGI2: receptor de la prostaciclina; TPα: isoforma α del receptor TXA2. Adaptado de Capodanno et al9. con permiso de Springer Nature Ltd.
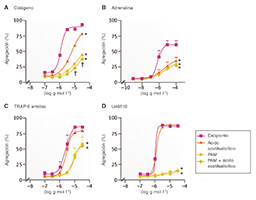
Figura 2. Ante un potente bloqueo del receptor P2Y12, el ácido acetilsalicílico ofrece poca inhibición adicional de la agregación plaqueta- ria. En estos estudios, la agregación plaquetaria se indujo a través de cuatro agonistas plaquetarios distintos: colágeno 0,1–30,0 μg/ml (parte A), adrenalina 0,001–100,0 μmol/l (parte B), antagonista sintético TRAP-6 amida (H-Ser–Phe–Leu–Leu–Arg–Asn–NH2) del receptor activado por la proteasa 1 (PAR1) 0,1–30,0 μmol/l (parte C) y tromboxano A2 miméticó U46619 0,1–30,0 μmol/l en presencia de ácido acetilsalicílico 30,0 μmol/l y/o del metabolito activo de prasugrel (PAM) 3,0 μmol/L (part d). Los datos se expresaron en medias ± desvia- ciones estándar de las respuestas medias calculadas mediante agregometría en microplaca de 96 pocillos en plasma rico en plaquetas obtenido mediante centrifugación de sangre citrada y preparado por cuatro técnicos distintos. *p 0,05 para la diferencia del vehículo mediante análisis de la varianza de dos factores (ANOVA) y prueba post hoc de Bonferroni. †p 0,05 para la diferencia entre PAM y PAM más ácido acetilsalicílico. Los símbolos que aparecen al final de las líneas expresan diferencias en conjuntos o grupos; los que aparecen en puntos determinados expresan diferencias particulares. Adaptado de Capodanno et al9. con permiso de Springer Nature Ltd.
El GLOBAL LEADERS fue un ensayo de superioridad que se llevó a cabo en 15.968 pacientes sometidos a ICP con stents liberadores de biolimus A9 y se diseñó para valorar si un régimen antitrombótico de un mes con AAS y 24 meses con ticagrelor mejoraba el objetivo compuesto de mortalidad por todas las causas o nuevo infarto de miocardio con onda Q frente a un curso convencional, de 12 meses de duración, de TAPD, seguido de monoterapia con AAS19. En cualquier caso, y a pesar de que se observó una cierta tendencia hacia un beneficio de la monoterapia con inhibidores del P2Y12, el ensayo no logró cumplir su objetivo primario (una estrategia experimental del 3,81% frente a una estrategia de referencia del 4,37%; razón de tasas de incidencia 0,87; IC95% 0,75-1,01; p = 0,073). Tampoco se observó diferencia alguna en el objetivo de seguridad de hemorragias tipo 3 o 5 según los criterios establecidos por el Bleeding Academic Research Consortium (BARC). Antes de interpretar el ensayo GLOBAL LEADERS, merece la pena hacer unas cuantas consideraciones. En primer lugar, se trata de uno de los estudios más extensos jamás llevado a cabo sobre ICP con una nueva plataforma de stent farmacoactivo y aunque no cumplió su objetivo primario, no hubo ninguna señal de alerta asociada a una retirada precoz (un mes después de la ICP) del AAS. Estas observaciones avalan otros estudios que se están llevando a cabo en la actualidad y que evalúan estrategias sin AAS post-ICP y apoyan los hallazgos de las investigaciones farmacodinámicas sobre la eficacia mantenida que ofrece la monoterapia con inhibidores del P2Y12. También vale la pena reseñar que a los 12 meses, se observó una diferencia relevante desde el punto de vista estadístico entre los grupos. Diferencia que no se mantuvo tras 2 años de seguimiento. Conviene destacar que, durante el primer año del ensayo, se llevó a cabo una comparativa entre 2 regímenes TAPD durante el primer mes, seguido de o bien monoterapia con ticagrelor o bien TAPD hasta completar el año. En cambio, entre los meses 12 y 24, una comparativa llevada a cabo entre ticagrelor y AAS no arrojó diferencia alguna y terminó por diluir el efecto global del tratamiento de la estrategia experimental. Se sugirió también como posible factor contribuyente una menor adhesión al tratamiento aleatorizado. De hecho, un estudio con una muestra más grande probablemente hubiese sido lo suficientemente relevante desde el punto de vista estadístico y se hubiese mostrado favorable a la monoterapia con inhibidores del P2Y12 a los 2 años. En segundo lugar, la inclusión de pacientes con EC estable (el 53% de la población total del estudio) quizá ha podido diluir el posible beneficio del estudio. De hecho, se observó una interacción significativa favorable a los pacientes con SCA, para las hemorragias tipo 3 o 5 según los criterios del BARC (p = 0,007). Es más, ampliar el estudio hasta los 24 meses e incluir pacientes con EC estable sin beneficios establecidos derivados del uso de ticagrelor podría explicar la falta de diferencias observada en el objetivo primario de seguridad de hemorragias. En tercer lugar, es discutible si el objetivo primario (mortalidad por todas las causas e infarto de miocardio con onda Q) elegido para este estudio fue, o no, demasiado ambicioso. Aunque la selección de estos objetivos se hizo específicamente para facilitar la evaluación de episodios, la inclusión de otros objetivos tradicionales habría facilitado, más si cabe, la detección de diferencias entre los distintos grupos de tratamiento. Si bien en este ensayo no se adjudicaron recurrencias isquémicas no mortales ni episodios hemorrágicos, el estudio GLASSY valorará la superioridad de la estrategia de tratamiento experimental sobre el tratamiento estándar en más de 7.000 pacientes en un objetivo compuesto de episodios isquémicos mortales y no mortales y episodios hemorrágicos20.
El TWILIGHT es un ensayo de superioridad a doble ciego que está llevando a cabo una comparativa del perfil de eficacia y seguridad del tratamiento antiagregante plaquetario con ticagrelor más placebo frente a un curso TAPD continuado con AAS y ticagrelor en 9.000 pacientes de alto riesgo en tratamiento con TAPD y sin eventos tres meses después de ser sometidos a una ICP y tratados con stents farmacoactivos disponibles en el mercado21. Hay diferencias esenciales entre el TWILIGHT y el GLOBAL LEADERS. El primer lugar, el diseño doble ciego (AAS frente a placebo), una de las fortalezas del estudio, pretendía eliminar la posibilidad de reportar sesgos. En segundo lugar, el objetivo primario se centra en la seguridad (hemorragias tipo 2, 3 o 5 según los criterios del BARC a los 12 meses), un objetivo más plausible de alcanzar tras retirar el tratamiento con AAS. La no inferioridad del TAPD para los episodios isquémicos también está siendo objeto de estudio. En tercer lugar, la población del estudio está enriquecida con factores de riesgo clínico y angiográfico que aumentan el episodio anticipado y, a su vez, la probabilidad de detectar el efecto del tratamiento. Este estudio ha terminado, recientemente, la fase de inscripción y los primeros resultados se esperan para el segundo trimestre de 2019. En la actualidad, se están llevando a cabo otros estudios que arrojarán más luz sobre el posible papel que juega la monoterapia con inhibidores del P2Y12 como alternativa a la inhibición plaquetaria a largo plazo en pacientes sometidos a ICP (tabla 1).
Tabla 1. Ensayos en curso de estrategias sin AAS en pacientes sometidos a intervenciones coronarias percutáneas
| Estudio | n | Población | Grupos de tratamiento | Indicador de resultado primario |
| TWILIGHT (NCT02270242) | 9.000 | ICP de alto riesgo en tratamiento con ticagrelor, sin episodios a los 3 meses | Placebo durante 12 meses frente a AAS durante 12 meses | Hemorragias a los 12 meses |
| TICO (NCT02494895) | 3.056 | SCA-ICP | TAPD durante 3 meses más ticagrelor durante 9 meses frente a TAPD durante 12 meses | MACCE a los 12 meses, hemorragias mayores a los 12 meses |
| SMART CHOICE (NCT02079194) | 3.000 | ICP | TAPD durante 3 meses seguido de clopidogrel durante 9 meses frente a TAPD durante 12 meses | Muerte, IM o ACV a los 12 meses, hemorragias mayores a los 12 meses |
| SHORT-DAPT 2 (NCT02619760) | 3.045 | ICP | TAPD durante 1 mes seguido de clopidogrel durante 59 meses frente a TAPD durante 12 meses seguido de AAS durante 48 meses | NACE a los 12 meses |
| ASET (NCT03469856) | 200 | ICP | Monoterapia con prasugrel | Muerta cardiaca, IM del vaso diana (espontáneo > 48 h) o trombosis definitiva del stent Hemorragias tipo 3 o 4 según criterios BARC |
| AUGUSTUS (NCT02415400) | 4.600 | Fibrilación auricular en tratamiento con anticoagulación oral con SCA o ICP | AAS durante 6 meses frente a placebo durante 6 meses | Hemorragias mayores o clínicamente relevantes a los 6 meses |
| ENTRUST-AF PCI (NCT02866175) | 1.500 | Fibrilación auricular en tratamiento con anticoagulación oral e ICP | Edoxaban y clopidogrel o ticagrelor durante 12 meses frente a un antagonista de la vitamina K durante 12 meses más TAPD durante 1-12 meses | Hemorragias mayores o clínicamente relevantes a los 12 meses |
AAS: ácido acetilsalicílico; ICP: intervención coronaria percutánea; IM: infarto de miocardio; MACCE: episodios cardiacos y cerebrovasculares adversos mayores; n: número de pacientes; NACE: episodios adversos clínicos netos; SCA: síndrome coronario agudo; TAPD: tratamiento antiagregante plaquetario doble; TAS: tratamiento antiagregante simple. | ||||
En resumen, los avances hechos en fármacoterapia intervencionista con la llegada de agentes antitrombóticos con efectos farmacodinámicos más efectivos ponen en jaque al abordaje estándar de tratamiento consistente en AAS como tratamiento de base. La cada vez mayor aceptación de lo importante que es reducir las complicaciones hemorrágicas ha puesto en duda si, en un arsenal terapéutico más moderno de tratamientos antitrombóticos, el AAS sigue siendo insustituible. El uso a largo plazo del AAS no es indispensable como ya ha quedado demostrado en ámbitos como pacientes en tratamiento con anticoagulantes orales, además las evidencias de que disponemos hoy en día revelan que, en presencia de un bloqueo efectivo de otras importantes vías de señalización plaquetaria, retirar el tratamiento con AAS es inocuo. De este modo, lo que hace no muchos años habría sido un mito, es decir, la posibilidad de prescindir del AAS a largo plazo tras el implante de un stent coronario, hoy en día ya no está tan alejado de la realidad. Si seremos, o no, capaces de abandonar el dogma del uso obligatorio a largo pazo del AAS dependerá de los hallazgos que hagan los estudios que se están llevando a cabo en la actualidad en este campo.
Conflicto de intereses
D. Caponanno declara haber recibido honorarios de Bayer y AstraZeneca. R. Mehran declara haber recibido honorarios por su labor como asesora para Abbott Vascular, Abiomed, Boston Scientific, BristolMyers Squibb, Cardiovascular Systems, Elixir, Medscape, Shanghai BraccoSine Pharmaceutical, The Medicines Company, y honorarios como miembro del comité ejecutivo de Janssen Pharmaceuticals y Osprey Medical. También declara que su centro recibe financiación de AstraZeneca, Bayer, Beth Israel Deaconess, Bristol-Myers Squibb, Cardiokinetix, Claret Medical, CSL Behring, Eli Lilly/DSI, Medtronic, Novartis Pharmaceuticals, OrbusNeich, Spectranetics y Watermark Research Partners. D.J. Angiolillo declara haber recibido: a) honorarios por su labor de asesor para Amgen, Aralez, AstraZeneca, Bayer, Biosensors, Boehringer Ingelheim, BristolMyers Squibb, Chiesi, Daiichi-Sankyo, Eli Lilly, Haemonetics, Janssen, Merck, PLx Pharma, Pfizer, Sanofi y The Medicines Company; b) honorarios por su labor como asesor y por su participación como revisor para CeloNova y St Jude Medical; también ha recibido subvenciones institucionales de Amgen, AstraZeneca, Bayer, Biosensors, CeloNova, CSL Behring, Daiichi-Sankyo, Eisai, Eli-Lilly, Gilead, Janssen, Matsutani Chemical Industry Co., Merck, Novartis, Osprey Medical y Renal Guard Solutions. Además, ha recibido financiación de la Fundación Scott R. MacKenzie y la concesión del Premio a las Ciencias Clínicas y Traslacionales de NIH/NCATS a la Universidad de Florida, UL1 TR000064 y NIH/NHGRI U01 HG007269, fuera del trabajo enviado.
Bibliografía
1. Angiolillo DJ. The Evolution of Antiplatelet Therapy in the Treatment of Acute Coronary Syndromes. Drugs. 2012;72:2087-2116.
2. Franchi F, Angiolillo DJ. Novel antiplatelet agents in acute coronary syndrome. Nat Rev Cardiol. 2015;12:30-47.
3. Capodanno D, Alfonso F, Levine GN, Valgimigli M., Angiolillo DJ. Dual Antiplatelet Therapy: Appraisal of the ACC/AHA and ESC Focused Updates. J Am Coll Cardiol. 2018;72:103-19.
4. Angiolillo DJ, Fernandez-Ortiz A, Bernardo E, et al. Variability in Individual Responsiveness to Clopidogrel. J Am Coll Cardiol. 2007;49: 1505-1516.
5. Tantry US, Bonello L, Aradi D, et al. Consensus and update on the definition of on-treatment platelet reactivity to adenosine diphosphate associated with ischemia and bleeding. J Am Coll Cardiol. 2013;62:2261-2273.
6. Cattaneo M, Schulz R, Nylander S. Adenosine-Mediated Effects of Ticagrelor J Am Coll Cardiol. 2014;63:2503-2509.
7. Becker RC, Bassand JP, Budaj A, et al. Bleeding complications with the P2Y12 receptor antagonists clopidogrel and ticagrelor in the PLATelet inhibition and patient Outcomes (PLATO) trial. Eur Heart J. 2011;32:2933-2944.
8. Généreux P, Giustino G, Witzenbichler B, et al. Incidence, Predictors, and Impact of Post-Discharge Bleeding After Percutaneous Coronary IIntervention. J Am Coll Cardiol. 2015;66:1036-1045.
9. Capodanno D, Mehran R, Valgimigli M, et al. Aspirin-free strategies in cardiovascular disease and cardioembolic stroke prevention. Nat Rev Cardiol. 2018;15:480-496.
10. Moon JY, Franchi F, Rollini F, Angiolillo DJ. The quest for safer antithrombotic treatment regimens in patients with coronary artery disease: new strategies and paradigm shifts. Expert Rev Hematol. 2018;11:5-12.
11. Angiolillo DJ, Rollini F, Storey RF, et al. International Expert Consensus on Switching Platelet P2Y12 Receptor-Inhibiting Therapies. Circulation. 2017; 136:1955-1975.
12. Moon JY, Franchi F, Rollini F, Angiolillo DJ. Evolution of Coronary Stent Technology and Implications for Duration of Dual Antiplatelet Therapy. Prog Cardiovasc Dis. 2018;60:478-490.
13. Angiolillo DJ, Goodman SG, Bhatt DL, et al. Antithrombotic Therapy in Patients with Atrial Fibrillation Treated with Oral Anticoagulation Undergoing Percutaneous Coronary Intervention: A North American Perspective 2018 Update. Circulation. 2018;138:527-536.
14. Lip GYH, Collet JP, Haude M, et al. 2018 Joint European consensus document on the management of antithrombotic therapy in atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing percutaneous cardiovascular interventions: a joint consensus document of the European Heart Rhythm Association (EHRA), European Society of Cardiology Working Group on Thrombosis, European Association of Percutaneous Cardiovascular Interventions (EAPCI), and European Association of Acute Cardiac Care (ACCA) endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS), Latin America Heart Rhythm Society (LAHRS), and Cardiac Arrhythmia Society of Southern Africa (CASSA). Europace. 2018. http://doi.org/10.1093/europace/euy174.
15. Rollini F, Franchi F, Cho JR, et al. A head-to-head pharmacodynamic comparison of prasugrel vs ticagrelor after switching from clopidogrel in patients with coronary artery disease: results of a prospective randomized study. Eur Heart J. 2016;37:2722-2730.
16. Storey RF. Biology and pharmacology of the platelet P2Y12 receptor. Curr Pharm Des. 2006;12:1255-1259.
17. Armstrong PCJ, Leadbeater PD, Chan MV, et al. In the presence of strong P2Y12 receptor blockade, aspirin provides little additional inhibition of platelet aggregation. J Thromb Haemost. 2011;9:552-561.
18. Vranckx P, Valgimigli M, Windecker S, et al. Long-term ticagrelor monotherapy versus standard dual antiplatelet therapy followed by aspirin monotherapy in patients undergoing biolimus-eluting stent implantation: rationale and design of the GLOBAL LEADERS trial. EuroIntervention. 2016; 12:1239-1245.
19. Vranckx P, Valgimigli M, Jüni P, et al. Ticagrelor plus aspirin for 1 month, followed by ticagrelor monotherapy for 23 months vs aspirin plus clopidogrel or ticagrelor for 12 months, followed by aspirin monotherapy for 12 months after implantation of a drug-eluting stent: a multicentre, open-label, randomised superiority trial. Lancet. 2018;392:940-949.
20. GLOBAL LEADERS Adjudication Sub-Study (GLASSY). https://clinicaltrials.gov/ct2/show/NCT03231059. Consultado 15 Nov 2018.
21. Baber U, Dangas G, Cohen DJ, et al. Ticagrelor with aspirin or alone in high-risk patients after coronary intervention: Rationale and design of the TWILIGHT study. Am Heart J. 2016;182:125-134.
Correo electrónico: dominick.angiolillo@jax.ufl.edu (D.J. Angiolillo).

