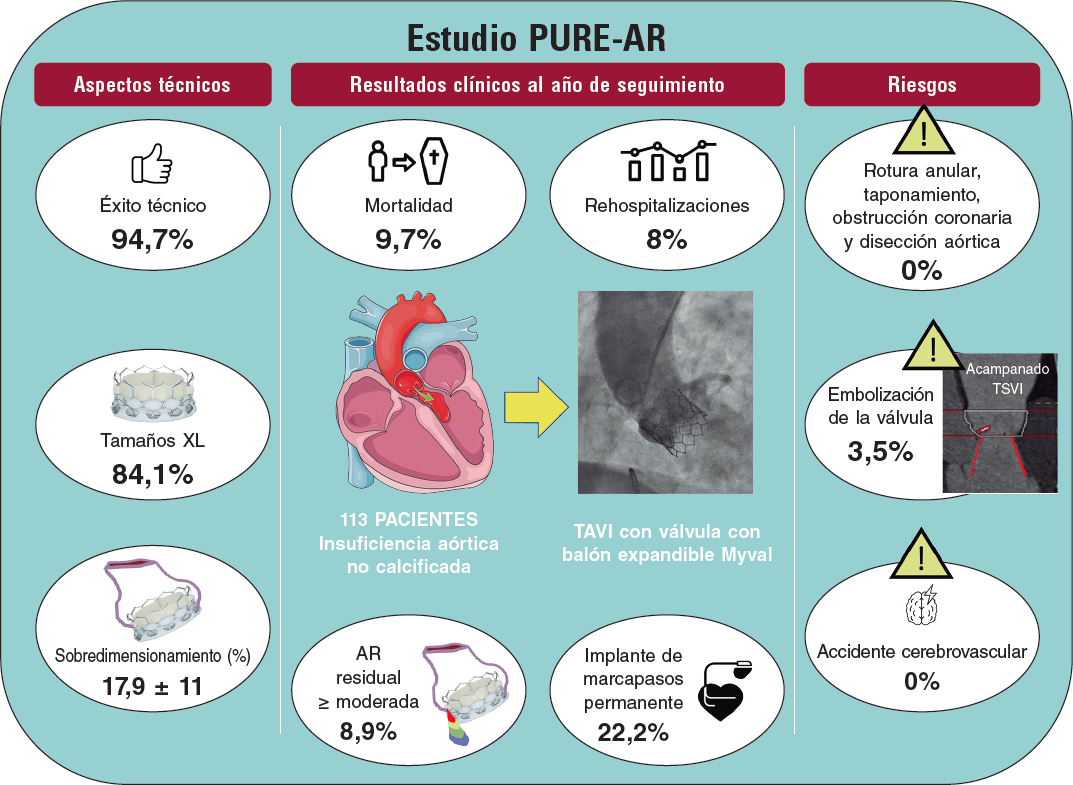
CÓMO LO HARÍA
Los autores presentan un interesante e inusual caso de drenaje venoso pulmonar anómalo parcial (DVPAP) descubierto de manera incidental en un paciente de 56 años a raíz de un estudio por disnea y angina de moderados esfuerzos.
El DVPAP es una malformación congénita que puede aparecer asociada a defectos del tabique interauricular (en un 10-15% de los casos) o de forma aislada. Puede ser unilateral o bilateral. Si se localiza en el lado derecho, el DVPAP suele desembocar en la vena cava superior (a veces directamente en la aurícula derecha o en la vena cava inferior) y es frecuente su asociación con una comunicación interauricular de tipo seno venoso. Cuando el DVPAP se encuentra en el lado izquierdo, lo más habitual es el drenaje de una vena pulmonar superior izquierda (VPSI) directamente en la vena innominada izquierda a través de una vena vertical (VV) anómala. Más raro es encontrar un DVPAP bilateral.
En muchos pacientes el diagnóstico se realiza de forma casual, pues suelen estar asintomáticos, sobre todo si no hay otros defectos cardiacos congénitos asociados. En función del grado de cortocircuito izquierda-derecha se puede producir dilatación de las cavidades derechas, y en algunos casos incluso desarrollo de hipertensión pulmonar por remodelado del lecho vascular pulmonar. Clásicamente, el tratamiento de esta afección requiere una intervención quirúrgica para reconducir el flujo pulmonar a las cavidades izquierdas, ya sea mediante la creación de un deflector («bafle») intracardiaco o mediante el reimplante de la vena pulmonar en la aurícula izquierda. Los resultados son buenos en centros experimentados, pues muchos de estos procedimientos se llevan a cabo en la edad pediátrica1.
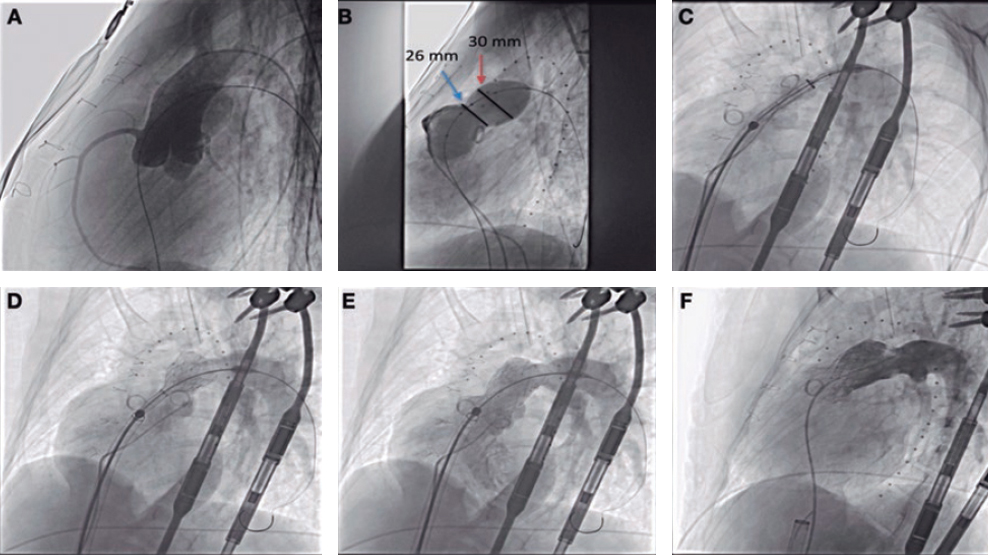
En el caso en cuestión existe una particularidad anatómica que condiciona la actitud terapéutica: el DVPAP de la VPSI es doble. Es decir, por un lado, drena correctamente en la aurícula izquierda, y por otro, se comunica con la vena innominada izquierda a través de la VV, como se puede observar en las imágenes y las reconstrucciones de la tomografía computarizada (TC) multicorte. A estos hallazgos anatómicos se suma la información obtenida en el ecocardiograma, que muestra dilatación de las cavidades derechas, disfunción biventricular añadida y datos de hipertensión pulmonar grave.
En este contexto, se recomienda completar el estudio con la realización de un cateterismo completo para evaluar las presiones y las resistencias pulmonares, y para descartar la presencia de enfermedad coronaria significativa en este paciente en particular.
En aquellos pacientes con indicación de reparación quirúrgica por un DVPAP, las guías de la Sociedad Europea de Cardiología de 2020 recomiendan calcular las resistencias vasculares pulmonares2. Si estas son < 5 unidades Wood, la intervención es segura y se asocia a una mejoría en la clase funcional y a un descenso en las presiones pulmonares. El criterio de una presión sistólica pulmonar < 50% de la presión sistémica también se puede utilizar, siempre que las resistencias pulmonares sean menores de un tercio respecto a las resistencias sistémicas.
El DVPAP con doble drenaje de la VPSI es inusual. Su peculiaridad reside en que permite la posibilidad de realizar un procedimiento percutáneo para reconducir el flujo de la VPSI hacia la aurícula izquierda mediante la oclusión del conducto que comunica con la circulación venosa sistémica (en general, la VV)3. Esto permite eliminar el cortocircuito izquierda-derecha y normalizar el flujo de retorno de la VPSI, y evita los inconvenientes y las potenciales complicaciones de la cirugía cardiaca. En el caso que se presenta, el riesgo quirúrgico es muy elevado por la disfunción biventricular, la presencia de hipertensión pulmonar grave y la enfermedad coronaria grave de 3 vasos, que se podría revascularizar en un segundo tiempo. Por tanto, la opción percutánea resulta muy atractiva.
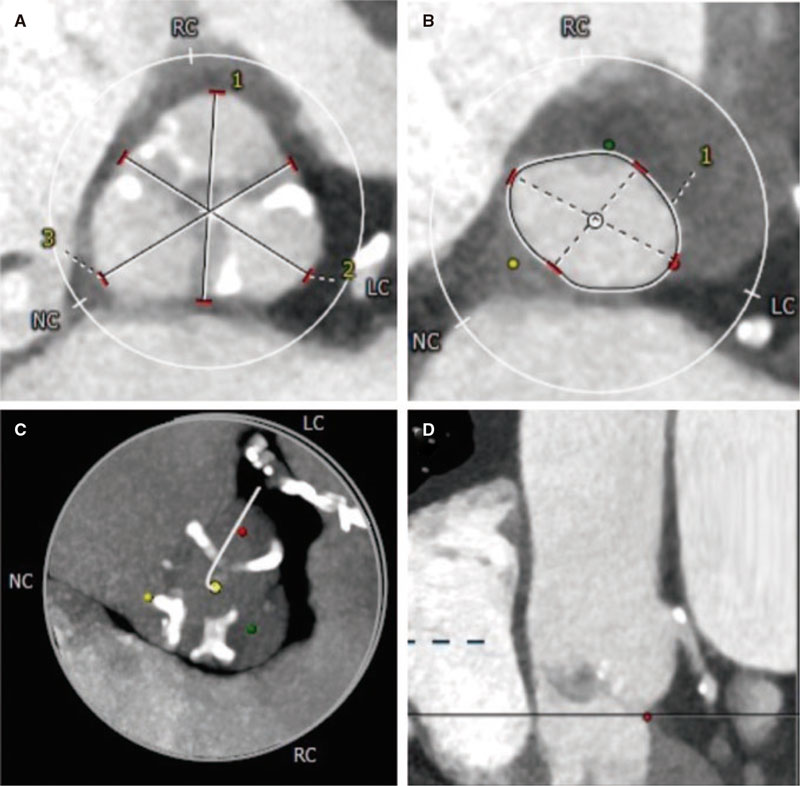
Desde el punto de vista técnico, se requiere un acceso venoso para llegar a la vena innominada izquierda y acceder a través de la VV y la VPSI al interior de la aurícula izquierda. Se puede utilizar una vena femoral o la vena yugular interna izquierda. El acceso a través de la VV suele hacerse con una guía hidrófila larga (260 cm, 0,035 pulgadas) sobre un catéter con curva Judkins derecho o curva específica tipo mamaria. Una vez se ha avanzado el catéter al interior de la aurícula izquierda, se intercambia la guía hidrófila por una guía de alto soporte (260 cm, 0,035 pulgadas) para sobre ella avanzar un sistema de liberación del calibre adecuado al dispositivo seleccionado.
El procedimiento se puede realizar sin anestesia general, solo con sedación, pues no es necesario utilizar ecografía transesofágica. Sin embargo, es importante disponer de un buen estudio radiológico previo, en el que la angiografía por TC ocupa un lugar esencial.
La realización de angiografías selectivas en la VV, incluso con la posibilidad de ocluir temporalmente la VPSI con un balón de medición tipo Amplatzer para evitar un rápido lavado del contraste, permitirá elegir el tamaño de dispositivo adecuado para que se ancle de forma correcta (con cierta compresión) y así evitar una posible embolización. Por su especial diseño y múltiples medidas, el Amplatzer Vascular Plug-II (Abbott, EE.UU.) sería mi primera opción. Como alternativa, se podría considerar un dispositivo de cierre de ductus tipo Amplatzer Duct Occluder (ADO)-I, cuyo diseño también se puede adaptar a esta variante anatómica.
El seguimiento tras la intervención debe incluir un ecocardiograma a los 3-6 meses para valorar el remodelado inverso de las cavidades derechas y la presión sistólica pulmonar. Es recomendable una angiografía por TC torácica a los 6 meses para confirmar la completa oclusión del cortocircuito y la correcta posición del dispositivo en la VV.
FINANCIACIÓN
No hay financiación.
CONFLICTO DE INTERESES
No existen conflictos de intereses en relación con este artículo.
BIBLIOGRAFÍA
1. Alsoufi B, Cai S, Van Arsdell GS, Williams WG, Caldarone CA, Coles JG. Outcomes after surgical treatment of children with partial anomalous pulmonary venous connection. Ann Thorac Surg. 2007;84:2020-2026.
2. Baumgartner H, De Backer J, Babu-Narayan SV, Budts W, Chessa M, Diller GP, et al. ESC Scientific Document Group. 2020 ESC Guidelines for the management of adult congenital heart disease. Eur Heart J. 2021;42:563-645.
3. Al-Muhaya MA, Alkodami AA, Khoshhal S, Najjar AHA, Al-Mutairi M, Abdelrehim AR. Transcatheter occlusion of the vertical vein in a partial anomalous pulmonary venous connection with dual drainage, case series with literature review. Int J Cardiol Heart Vasc. 2021;37:100889.