RESUMEN
Introducción y objetivos: La embolia coronaria de origen sistémico representa uno de los mecanismos de infarto agudo de miocardio de causa no aterosclerótica. Sin embargo, el perfil epidemiológico, clínico y angiográfico de esta entidad no ha sido aún bien definido. Nuestro objetivo fue describir las características clínicas y angiográficas y el pronóstico de los síndromes coronarios agudos (SCA) de origen embólico (SCA-E), compararlos con aquellos debidos a aterosclerosis (SCA-A) e identificar predictores clínicos de SCA-E.
Métodos: Todos los pacientes con SCA atendidos en un hospital terciario entre 2003 y 2018 se clasificaron en SCA-E (n = 40) o SCA-A (n = 4.989) e incluidos de forma prospectiva en un registro multipropósito.
Resultados: Entre los pacientes con SCA-E existía mayor proporción de jóvenes (27,5 frente a 9,6% tenían menos de 45 años, p < 0,001), mujeres (42,5 frente a 22,5%, p = 0,003), fibrilación auricular (FA) (40,0 frente a 5,3%, p < 0,001), neoplasias activas (17,5 frente a 6,9%, p = 0,009), cirugía valvular previa (12,5 frente a 0,5%, p < 0,001) y una mayor proporción de los mismos se encontraba en tratamiento con warfarina (27,5 frente a 2,9%, p < 0,001). El vaso responsable con mayor frecuencia fue la descendente anterior en ambos grupos. En todos los pacientes con SCA-A se llevó a cabo una intervención coronaria percutánea, frente al 75,0% de los pacientes con SCA-E (p < 0,001), la cual se completó con éxito en el 99,1% y el 80,0% de los casos, respectivamente. La mortalidad por todas las causas en el grupo de SCA-E fue del 15,0% frente al 4,0% en el grupo control (p < 0,001). Se llevó a cabo un análisis multivariante para estudiar predictores independientes de SCA-E, identificando la FA, la cirugía valvular previa, la presencia de una neoplasia activa, una menor edad y el sexo femenino.
Conclusiones: Los SCA-E y los SCA-A presentan características clínicas y angiográficas diferentes. La FA, la cirugía valvular previa, la presencia de una neoplasia activa, ser más joven y el sexo femenino son predictores independientes de SCA-E.
Palabras clave: Embolia coronaria. Fibrilación auricular. Síndrome coronario agudo. Infarto de miocardio.
ABSTRACT
Introduction and objectives: Systemic coronary artery embolism is one of the mechanisms of acute myocardial infarction of nonatherosclerotic origin. However, the epidemiological, clinical, and angiographic profile of this entity has not been properly established yet. Our objective was to describe the clinical characteristics, angiographic features, and prognosis of acute coronary syndromes (ACS) due to systemic embolism (ACS-E), compare them to those due to coronary atherosclerosis (ACS-A), and identify predictive clinical factors of ACS-E.
Methods: All consecutive patients with ACS—admitted to a tertiary hospital from 2003 through 2018—were classified as ACS-E (n = 40) or ACS-A (n = 4989), and prospectively recruited on a multipurpose database.
Results: Patients with ACS-E were younger (27.5% vs 9.6% were < 45 years old, P < .001), more often women (42.5% vs 22.5%, P = .003), and had higher rates of atrial fibrillation (AF) (40.0% vs 5.3%, P < .001), previous stroke (15.0% vs 3.6%, P < .001), active neoplasms (17.5% vs 6.9%, P =.009), and previous valvular surgery (12.5% vs 0.5%, P < .001). Also, a higher proportion of them were on warfarin (27.5% vs 2.9%, P < .001). The most frequent culprit vessel was the left anterior descending coronary artery in both groups. A percutaneous coronary intervention was attempted in all patients with ACS-A, and in 75.0% of those with ACS-E (P < .001) being successful in 99.1% and 80.0%, respectively. The in-hospital all-cause mortality rate was 15.0% regarding ACS-E, and 4.0% in the control group (P < .001). A multivariate analysis was performed to study the independent predictors of ACS-E, identify AF, previous valvular surgery, and active neoplasms, younger age, and female sex.
Conclusions: ACS-E and ACS-A have different clinical and angiographic characteristics. Atrial fibrillation, previous valvular surgery, active neoplasms, younger age, and female sex were all independent predictors of ACS-E.
Keywords: Coronary artery embolism. Atrial fibrillation. Acute coronary syndrome. Myocardial infarction.
Abreviaturas FA: fibrilación auricular. IAM: infarto agudo de miocardio. IAMCEST: infarto agudo de miocardio con elevación del segmento ST. SCA: síndrome coronario agudo. SCA-A: síndrome coronario agudo de origen ateroesclerótico. SCA-E: síndrome coronario agudo de origen embólico.
INTRODUCCIÓN
La embolia coronaria sistémica es uno de los mecanismos del infarto agudo de miocardio (IAM) de origen no ateroesclerótico y supone entre el 3 y el 14% de todos los síndromes coronarios agudos (SCA) según las autopsias y estudios angiográficos realizados. No obstante, a día de hoy, todavía se desconoce la verdadera prevalencia de esta entidad por lo incierto de su diagnóstico en el contexto agudo1,2.
La fibrilación auricular (FA), las miocardiopatías, valvulopatías, malignidades y endocarditis infecciosas están todas ellas asociadas al SCA de origen embólico (SCA-E)1,3. No obstante, el perfil epidemiológico, clínico y angiográfico de esta entidad todavía no se ha establecido convenientemente.
Nuestro objetivo fue describir las características clínicas y angiográficas, así como el manejo terapéutico y el pronóstico del SCA-E frente al SCA de origen ateroesclerótico (SCA-A) e identificar los factores clínicos predictivos del SCA-E.
MÉTODOS
Población del estudio
Se estudió a todos los pacientes consecutivos con SCA, ingresados en un hospital terciario entre enero de 2003 y diciembre de 2018, clasificados como SCA-E o SCA-A, incluidos prospectivamente en una base de datos multicéntrica. El protocolo fue aprobado por el comité de ética local (código interno: 22/137-E); se prescindió del consentimiento informado de los pacientes al exigirse solo el análisis de los datos obtenidos durante la práctica clínica estándar.
El IAM se definió como niveles elevados de troponina cardiaca (lesión miocárdica) con evidencia clínica de isquemia miocárdica aguda incluidos síntomas, nuevos cambios isquémicos en el electrocardiograma, desarrollo de ondas Q patológicas en el electrocardiograma, nuevas alteraciones regionales de la motilidad de la pared en un patrón compatible con etiología isquémica o identificación angiográfica de trombo coronario4. A todos los pacientes se les realizaron pruebas diagnósticas que incluyeron historias clínicas detalladas y exámenes físicos, electrocardiogramas seriados, análisis de sangre, ecocardiografías transtorácicas y coronariografías invasivas. Las técnicas de imágen intracoronarias tales como la tomografía de coherencia óptica o la ecocardiografía intravascular quedaron a criterio del operador.
Se llegó al diagnóstico de SCA-E a partir de evidencias angiográficas de trombosis coronaria sin componentes ateroescleróticos, embolia coronaria multisitio concomitante o embolización sistémica concomitante excluidos los trombos en el ventrículo izquierdo por IAM1. Solo se tuvieron en cuenta las embolias ocurridas en coronarias principales. Se excluyó sistemáticamente a los pacientes con los siguientes hallazgos angiográficos: a) presencia de ateroesclerosis a nivel de la lesión culpable, b) evidencia de estenosis coronaria > 25% fuera de la lesión culpable, c) rotura de la placa o erosión coronaria a nivel de la lesión culpable en las imágenes intravasculares, d) ectasia coronaria y e) otras causas del IAM no ateroesclerótico (vasoespasmo, disección coronaria espontánea).
La evaluación angiográfica del sitio culpable la hicieron 2 operadores expertos para descartar a) la presencia de trombo (definido como un defecto de relleno no calcificado confirmado tras la administración de contraste), b) la presencia de estenosis angiográfica y c) los signos de ateroesclerosis (por ejemplo, la calcificación de la pared vascular). El resto del angiograma se analizó en busca de estenosis o ateroesclerosis angiográficas.
Eventos clínicos
Los datos epidemiológicos, las características clínicas y angiográficas, el tratamiento y los resultados se recopilaron prospectivamente a medida que se incluía y se analizaba retrospectivamente a los pacientes. El seguimiento a largo plazo del SCA-E se llevó a cabo manteniendo bajo vigilancia toda embolia sistémica recurrente (incluido el accidente cerebrovascular cardiogénico), así como la ocurrencia de eventos cardiovasculares y cerebrovasculares adversos mayores incluida la muerte cardiovascular, el infarto de miocardio, nuevas intervenciones coronarias percutáneas (ICP), las hospitalizaciones por insuficiencia cardiaca o accidente cerebrovascular más de 30 días después del ingreso por SCA-E.
Lo primero que hicimos en este estudio fue llevar a cabo una descripción detallada de los episodios de SCA-E seguido de una comparativa con el SCA-A para identificar posibles peculiaridades y predictores clínicos.
Análisis estadístico
Las variables cuantitativas se expresaron como mediana y rango intercuartílico [RIC] o como media y desviación estándar. La valoración de la normalidad y la igualdad de las varianzas para los datos continuos se llevó a cabo mediante la prueba de Shapiro-Wilk y de Levene, respectivamente. Posteriormente, se hizo una comparativa de las variables continuas mediante la prueba t de Student, la de permutaciones de Fisher-Pittman o la de las medianas, según procediera en cada momento. Las variables categóricas se expresaron como frecuencias y porcentajes.
Las variables en las que se observaron diferencias estadísticamente significativas en el modelo univariado y aquellas clínicamente relevantes se introdujeron en un análisis multivariado mediante regresión logística escalonada para identificar los predictores del SCA-E.
Todas las pruebas fueron bilaterales y las diferencias se consideraron estadísticamente significativas con valores p < 0,05. Los análisis estadísticos se realizaron empleando el paquete de software estadístico Stata/IC12.1 (StataCorp, College Station, Estados Unidos).
RESULTADOS
Durante el periodo del estudio, se incluyó a 5.029 pacientes con SCA. Tras aplicar los criterios diagnósticos descritos, 40 pacientes (0,8%) fueron clasificados como SCA-E y 4.989 (99,2%) como SCA-A.
Población con síndrome coronario agudo de origen embólico
Respecto a los pacientes con SCA-E, 17 eran mujeres (42,5%) y la media de edad de la población, 60,3 años. Dos pacientes (5,0%) tenían una historia clínica de angina de esfuerzo, 4 (10,0%) eran portadores de una válvula protésica y 2 (5,0%) y 1 (2,5%) presentaban insuficiencia mitral grave no corregida y estenosis aórtica grave, respectivamente. La fracción de eyección del ventrículo izquierdo media era del 55,0 ± 12,3% y 16 pacientes (40,0%) tenían alguna forma de FA. Además, 1 paciente (2,5%) fue diagnosticado de endocarditis infecciosa en la válvula aórtica justo después de ser ingresado por SCA. En lo referente a otras patologías, 7 pacientes (17,5%) presentaban neoplasias activas active y 3 (7,5%) insuficiencia renal crónica. La información sobre otras características basales se muestra en la tabla 1 del material adicional.
Un total de 32 pacientes (80,0%) presentaban infarto de miocardio con elevación del segmento ST (IAMCEST), 3 de los cuales recibieron tratamiento fibrinolítico y 2, además, ICP de rescate. Se trató a 28 pacientes (70,0%) con ICP primaria y a los 12 restantes (30,0%) con cateterismo cardiaco en otro escenario. El vaso culpable más habitual fue la descendente anterior (DA) en 13 casos (32,5%) seguido de la coronaria derecha (n = 10; 25,0%) y la circunfleja izquierda (n = 9; 22,5%). Además, los segmentos proximales (n = 12; 30,0%) y medios (n = 12; 30,0%) de los vasos fueron los más comprometidos de todos (tabla 2 del material adicional).
Según la coronariografía, 25 pacientes (62,5%) presentaban un grado de flujo TIMI 0 (Thrombolysis in Myocardial Infarction) antes de franquear la guía. Un total de 29 casos (72,5%) recibieron tratamiento de tromboaspiración y 7 angioplastia con balón. Ningún paciente recibió implantes de stents, pero se observó un grado de flujo TIMI 3 en 32 casos (77,5%) tras la ICP (tabla 3 del material adicional). Con respecto a las imágenes intracoronarias obtenidas durante la ICP, se realizaron tomografías de coherencia óptica y ecocardiografías intravasculares antes y después de la intervención en 3 (7,5%) y 1 (2,5%) pacientes, respectivamente. El tratamiento antitrombótico durante la presentación y tras la ICP se muestra en la tabla 4 del material adicional.
Comparativa entre el síndrome coronario agudo de origen embólico y el síndrome coronario agudo de origen ateroesclerótico
Características basales
Comparado con el grupo SCA-A, hubo muchos más pacientes menores de 45 y mayores de 80 años en el grupo SCA-E. También hubo muchas más mujeres (42,5 frente al 22.5%; p = 0,003). En estos pacientes, los factores de riesgo cardiovascular fueron menos prevalentes que en el grupo SCA-A, aunque solo se observaron diferencias estadísticamente significativas asociadas a la dislipemia. Muchos más pacientes con SCA-E presentaban neoplasias activas, FA, accidentes cerebrovasculares previos y habían sido tratados de cirugías cardiacas valvulares. Además, el 27,5% de los pacientes del grupo SCA-E tomaban warfarina (p < 0,001) en el momento de la presentación clínica mientras que los pacientes con SCA-A solían tener una historia clínica de angina (34,0 frente al 5,0%; p < 0,001). Las diferencias entre los distintos grupos con respecto a otras patologías se muestran en la tabla 1.
Tabla 1. Características epidemiológicas y clínicas basales
| SCA-A n = 4,989 | SCA-E n = 40 | p | |
|---|---|---|---|
| Edad (años) | 63,0 ± 13,4 | 60,3 ± 18,7 | 0,129 |
| Edad < 45 años | 480 (9,6) | 11 (27,5) | < 0,001 |
| Edad > 80 años | 559 (11,2) | 9 (22,5) | 0,025 |
| Sexo femenino | 1120 (22,5) | 17 (42,5) | 0,003 |
| Diabetes | 1087 (21,8) | 4 (10,0) | 0,070 |
| Hipertensión | 2632 (52,8) | 16 (40,0) | 0,108 |
| Dislipemia | 2192 (43,9) | 11 (27,5) | 0,037 |
| Tabaquismo | 3101 (62,2) | 22 (55,0) | 0,353 |
| IMC | 27,6 ± 4,1 | 27,1 ± 4,2 | 0,424 |
| Insuficiencia renal crónica | 239 (4,8) | 3 (7,5) | 0,425 |
| Enfermedad vascular periférica | 241 (4,8) | 1 (2,5) | 0,493 |
| Accidente cerebrovascular | 181 (3,6) | 6 (15,0) | < 0,001 |
| Neoplasia activa | 343 (6,9) | 7 (17,5) | 0,009 |
| FA | 262 (5,3) | 16 (40,0) | < 0,001 |
| Tratamiento con warfarina | 143 (2,9) | 11 (27,5) | < 0,001 |
| Cirugía cardiaca valvular previa | 25 (0,5) | 5 (12,5) | < 0,001 |
| Historia clínica de angina | 1698 (34,0) | 2 (5,0) | < 0,001 |
FA: fibrilación auricular; IAMCEST: infarto agudo de miocardio con elevación del segmento ST; IAMSEST: infarto agudo de miocardio sin elevación del segmento ST; IMC: índice de masa corporal; SCA-A: síndrome coronario agudo de origen ateroesclerótico; SCA-E: síndrome coronario agudo de origen embólico. | |||
Características y resultados clínicos y angiográficos
Respecto a los episodios de SCA, no se observaron diferencias en la presentación como IAMCEST entre los grupos (SCA-E, 80,0% frente a SCA-A, 67,0%; p = 0,082). No obstante, en los pacientes con SCA-A pasó mucho más tiempo entre el diagnóstico de SCA y la coronariografía (1,16 ± 0,8 frente a 0,81 ± 0,5 horas; p = 0,003). No se observaron diferencias asociadas a la incidencia del shock cardiogénico.
La presencia de otras estenosis moderadas o graves, al margen de la estenosis culpable, fue mucho más habitual en pacientes con SCA-A (tabla 2). La ICP se intentó en todos los pacientes con SCA-A y en el 75,0% de aquellos con SCA-E (p < 0,001) con éxito en el 99,1% y 80,0%, respectivamente. En cambio, se empleó tratamiento adyuvante con inhibidores de la GP IIb/IIIa en el 55,0% de los pacientes con SCA-E y en el 36,0% de los pacientes con SCA-A (p = 0,020).
Tabla 2. Distribución de las lesiones
| SCA-A n = 4.989 | SCA-E n = 40 | p | |
|---|---|---|---|
| Lesiones culpables | |||
| TC | 113 (2,3%) | 1 (2,5%) | 0,921 |
| DA | 2274 (45,6%) | 15 (37,5%) | 0,108 |
| CXI | 1064 (21,3%) | 11 (27,5%) | 0,344 |
| CD | 1902 (38,1%) | 10 (25,0%) | 0,125 |
| Número de vasos con lesiones moderadas (> 50%) | 1,6 ± 0,0 | 0,8 ± 0,1 | < 0,001 |
| Número de vasos con lesiones graves (> 70%) | 1,3 ± 0,0 | 0,8 ± 0,1 | < 0,001 |
CD: coronaria derecha; CXI: arteria circunfleja izquierda; DA: descendente anterior; ICP: intervención coronaria percutánea; SCA-A: síndrome coronario agudo de origen ateroesclerótico; SCA-E: síndrome coronario agudo de origen embólico; TC: tronco común de la coronaria izquierda. | |||
Las complicaciones ocurridas durante la ICP y las hospitalizaciones del grupo SCA-E se muestran en la tabla 3 e incluyen la muerte, que sobrevino en 5 pacientes (12,5%) por insuficiencia cardiaca/shock cardiogénico y por encefalopatía anóxica tras parada cardiaca en otro caso. Se realizó una coronariografía de control en 14 casos (40,0%) con persistencia del compromiso del vaso culpable en 2 (14,3%). La mediana de seguimiento tras el episodio fue de 5.8 ± 4.8 años. Tres días después de la tromboaspiración de emergencia por oclusión de la DA, una mujer de 51 años con leucemia mieloide aguda presentó signos de SCA-E recurrente con nuevo compromiso de DA y rama marginal. No se identificaron embolias recurrentes en ningún otro territorio sistémico en ninguno de los casos. No obstante, durante el seguimiento, se informó de la aparición de eventos cardiovasculares y cerebrovasculares adversos mayores en 13 pacientes con SCA-E (38,2%) con resultado de muerte en 12 de ellos (35,3%) atribuida a causas cardiovasculares en 6 casos (50,0%) (tabla 3). La supervivencia total libre de eventos cardiovasculares y cerebrovasculares adversos mayores durante la hospitalización y el seguimiento se calculó utilizando las curvas de Kaplan-Meier (figura 1).
Tabla 3. Complicaciones durante ICP, ingreso y seguimiento de pacientes con SCA-E
| Durante la ICP | |
| Parada cardiaca | 3 (7,5) |
| Flujo lento/falta de flujo miocárdico | 8 (20,0) |
| Perforación | 1 (2,5) |
| Embolizacióna | 15 (37,5) |
| Disección coronaria | 0 (0) |
| Perforación coronaria | 1 (2,5) |
| Taponamiento cardiaco | 0 (0) |
| Durante el ingreso | |
| Complicaciones vascularesb | 2 (5.0) |
| Insuficiencia cardiaca | 12 (30.0) |
| Complicaciones arrítmicasc | 7 (17.5) |
| Complicaciones extracardiacasd | 9 (22.5) |
| Muerte | 6 (15.0) |
| Durante el seguimiento | |
| MACCE | 13 (38,2) |
| IAM | 4 (11,8) |
| Nueva ICP | 2 (5,9) |
| Accidente cerebrovascular | 2 (5,9) |
| Hospitalización | 11 (32,4) |
| Insuficiencia cardiaca | 11 (32,4) |
| NYHA | |
| I | 24 (70,6) |
| II | 6 (17,6) |
| III | 1 (2,9) |
| IV | 4 (11,8) |
| Embolia sistémica | 0 (0) |
| Embolia pulmonar | 1 (2,9) |
| Muertee | 12 (35,3) |
IAM: infarto agudo de miocardio; ICP intervención coronaria percutánea; MACCE: eventos cardiovasculares y cerebrovasculares adversos mayores; NYHA: New York Heart Association Functional Classification. a En 2 casos, l embolización del material trombótico alcanzó un vaso distinto al culpable. b 1 caso de seudoaneurisma femoral y seudoaneurisma radial, respectivamente a tratamiento conservador. c 4 casos de bradiarritmia y 3 casos de taquiarritmia. d 8 casos de infección y 1 caso de accidente cerebrovascular coexistente con hemorragia subaracnoidea. e Debido a la insuficiencia cardiaca descrita en 5 casos, a la arritmia ventricular en el contexto de un IAM y a 1 caso de fallo multiorgánico por neoplasia pulmonar avanzada en un caso distinto. En los demás pacientes, no se pudo determinar la causa de la muerte. | |
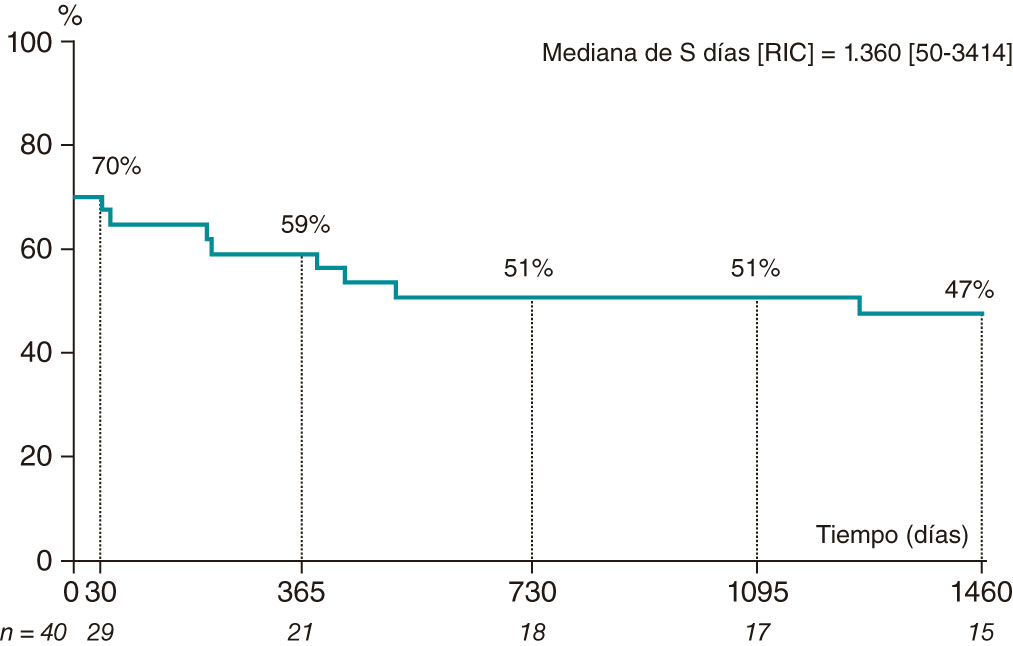
Figure 1. Supervivencia libre de MACCE durante el ingreso y tras 4 años de seguimiento en pacientes con SCA-E. MACCE: eventos cardiovasculares y cerebrovasculares adversos mayores; RIC: rango intercuartílico; S: seguimiento; SCA-E: síndrome coronario agudo de origen embólico.
El índice de mortalidad intrahospitalaria por cualquier causa fue del 15,0% en el grupo SCA-E y del 4,0% en el grupo de control (p < 0,001).
Predictores de síndrome coronario agudo de origen embólico
Para determinar los predictores clínicos del SCA-E, se realizó un análisis multivariado que incluyó variables con diferencias estadísticamente significativas en el modelo univariado y aquellas consideradas clínicamente relevantes. La edad, el sexo femenino, la presencia de neoplasia activa, la existencia de cirugías cardiacas valvulares previas y una historia clínica de FA se identificaron como factores predictivos independientes del SCA-E (tabla 4, figura 2).
Tabla 4. Análisis multivariado para identificar a los predictores clínicos del síndrome coronario agudo de origen embólico
| Variables* | OR ajustado (IC95%) | p |
|---|---|---|
| Edad (años) | 0,95 (0,92-0,97) | < 0,001 |
| Sexo femenino | 2,80 (1,37-5,65) | 0,007 |
| Dislipemia | 0,45 (0,22-0,93) | 0,024 |
| Neoplasia activa | 3,37 (1,33-8,54) | 0,019 |
| Cirugía cardiaca valvular previa | 4,28 (1,19-15,5) | 0,038 |
| Historia clínica de angina | 0,17 (0,05-0,55) | < 0,001 |
| FA | 16,10 (7,23-35,9) | < 0,001 |
FA: fibrilación auricular; IC95%; intervalo de confianza del 95%; OR: odds ratio. * Las variables del modelo univariado introducido en el análisis fueron: edad, diabetes, dislipemia, accidente cerebrovascular, neoplasia activa, cirugía cardiaca valvular previa, historia clínica de angina, FA y tratamiento crónico con anticoagulantes orales. | ||
Figure 2. Predictores clínicos independientes de SCA-E. SCA-E: síndrome coronario agudo de origen embólico.
DISCUSIÓN
Los principales hallazgos de nuestro estudio son: a) la prevalencia del SCA-E en pacientes ingresados por IAM fue baja (0,8%); b) el índice de mortalidad intrahospitalaria fue más alto en pacientes con SCA-E que en pacientes con SCA de origen ateroesclerótico y c) menor edad, el sexo femenino, la presencia de neoplasia activa, las cirugías cardiacas valvulares previas y la FA se identificaron como predictores del SCA-E.
La embolia coronaria sistémica es uno de los mecanismos subyacentes del IAM de origen no ateroesclerótico4. Las primeras autopsias realizadas han confirmado una prevalencia de las embolias coronarias en pacientes con IAM del 13%5 aunque estudios posteriores en el ámbito clínico sitúan dicha prevalencia en torno al 3%1. La baja prevalencia descrita en nuestra serie (0,8%) podría deberse a los estrictos criterios diagnósticos empleados que excluyeron a pacientes con estenosis coronarias > 25% fuera de la lesión culpable y a las embolias debidas a coronarias secundarias. No obstante, sigue sin saberse cuál es la verdadera ocurrencia del SCA-E puesto que los signos de presentación iniciales son indistinguibles del SCA-A6.
Además, la limitada incidencia de embolias coronarias frente a otros territorios vasculares también podría deberse a características anatómicas y fisiológicas intrínsecas tales como diferencias en el calibre aórtico, el ángulo agudo en el que las coronarias se originan en el seno de Valsalva7 y la posición de los ostium coronarios detrás de las cúspides de las valvas durante la sístole3,8.
Aunque algunas series que comparan SCA-A frente a SCA-E no han descrito diferencias de sexo en lo que a los cuadros de STEMI se refiere2, en nuestro estudio, la proporción de mujeres fue mucho mayor en el grupo de pacientes con SCA-E (43 frente al 22%; p = 0,003). Asimismo, Shibata et al. hallaron índices del 40 frente al 29% (p = 0,087)1. Además, según los citados autores, la prevalencia de los factores tradicionales de riesgo cardiovascular fue menor en el grupo embólico de nuestra cohorte, aunque solo se observaron diferencias estadísticamente significativas asociadas a la dislipemia (27,5 frente al 43,9%; p = 0,037).
En lo que respecta al compromiso de las coronarias, la DA fue el vaso más afectado tanto en el grupo SCA-E como en el SCA-A (tabla 3). Asimismo, una autopsia confirmó que las embolias coronarias se dan con una frecuencia hasta 4 veces mayor en la DA que en la coronaria derecha y en la DA que en la circunfleja izquiera5. Además, en una reciente revisión sistemática que incluyó 129 casos clínicos y series de casos de embolias coronarias, Lacey et al. confirmaron que la DA fue el vaso más afectado de todos (45,3%)6. No obstante, tales diferencias observadas en la distribución de los vasos coronarios culpables podrían explicarse por el sesgo asociado a que las arterias con territorios más grandes son más propensas a ser objeto de autopsias1 y casos clínicos.
Respecto al tratamiento intervencionista empleado, en nuestro es-tudio, 30 pacientes (75,0%) del grupo SCA-E recibieron tromboaspiración seguido de angioplastia con balón en 8 casos. Ningún paciente de este grupo recibió tratamiento con implante de stent. Shibata et al. realizaron tromboaspiración inicial en el 96,6% de los pacientes embólicos tratados de ICP seguido de angioplastia con balón en el 14,3% de los casos e implante de stent en el 17,9%1. La tromboaspiración ha demostrado ser una opción viable para tratar los IAM con evidencia angiográfica de trombo, incluidos los casos asociados a embolias coronarias9. No obstante, estos dispositivos podrían no ser de tanta utilidad para la aspiración de trombos más grandes debido al menor diámetro de la luz del catéter interno10. Además, en determinadas situaciones tales como arterias pequeñas u oclusiones coronarias distales, la manipulación de la guía y los fármacos antitrombóticos (incluidos los inhibidores de la glucoproteína IIb/IIIa que se usaron con mayor frecuencia en el grupo SCA-E) podrían ser la opción preferida para lograr la reperfusión2.
En nuestra serie, durante el seguimiento tras un episodio de SCA-E (5,8 ± 4,8 años), la incidencia de eventos cardiovasculares y cerebrovasculares adversos mayores entre los pacientes fue del 37,1%. No obstante, no se documentó ninguna embolia sistémica recurrente tal y como confirman otras series ya publicadas2. El índice de mortalidad intrahospitalaria por cualquier causa fue mucho mayor en pacientes con SCA-E (15 frente al 4%; p < 0,001) principalmente por causas cardiovasculares. Shibata et al. no hallaron diferencias en el índice de mortalidad a 30 días, pero sí índices mucho más altos de mortalidad cardiovascular y por cualquier causa en pacientes con SCA-E que en aquellos con SCA-A1. Asimismo, Popovic et al. observaron que el 64% de todas las muertes descritas durante el seguimiento tras 1 episodio de IAMCEST secundario a embolia coronaria fueron por causas cardiovasculares2.
Por último, tras el análisis multivariado, la FA, las cirugías valvulares cardiacas previas, las neoplasias activas, el sexo femenino y menor edad se identificaron como predictores clínicos del SCA-E. La FA se ha descrito como la patología más frecuente que predispone a la ocurrencia de embolias coronarias y se da en el 40,0% de los SCA-E analizados en nuestro estudio y en hasta el 73% de los descritos en otras series actuales1,3. No obstante, hay estudios publicados que describen que la valvulopatía, sobre todo reumática, y la endocarditis infectiva son las causas más frecuentes capaces de desencadenar un cuadro de embolia coronaria5,11. Esta disparidad podría deberse a los avances en materia de implementación de tratamientos antibióticos durante las últimas décadas y al notable aumento de la prevalencia de la FA paralelo al envejecimiento paulatino de la población1,2,12,13. Además, se ha descrito que el riesgo de IAM asociado a la FA es mucho mayor en mujeres14,15 y pacientes sin enfermedad coronaria15-18.
Por otro lado, ya ha quedado acreditado que los pacientes con neoplasias activas corren un riesgo mucho más alto de desarrollar eventos trombóticos, venosos y arteriales19. La patogénesis de la coagulopatía asociada al cáncer es compleja e incluye la interacción de muchos factores entre las comorbilidades del paciente, la malignidad específica y el tratamiento con diferentes agentes quimioterapéuticos o fármacos inmunomoduladores que suelen provocar hipercoagulabilidad, activación plaquetaria y lesiones endoteliales20. También ha quedado acreditado que la malignidad se asocia a un riesgo más alto de desarrollar FA tras una serie de interacciones a nivel fisiopatológico21,22. En nuestra serie, el 17,5% de los pacientes presentaba neoplasias activas según Popovic et al.2 que describieron una prevalencia del 15,1% mucho más alta que la descrita por Shibata et al.1 y Lacey et al.6 del 10 y 1,4%, respectivamente.
Limitaciones
Este estudio tiene varias limitaciones. En primer lugar, al tratarse de un estudio retrospectivo puede acarrear cierto grado de sesgo. En segundo lugar, la aplicación de criterios diagnósticos estrictos que excluyeron a pacientes con estenosis coronarias ≥ 25% fuera de la lesión culpable podría haber dejado fuera casos de SCA-E en pacientes con enfermedad coronaria concomitante. En tercer lugar, y a diferencia de todas las publicaciones anteriores al respecto, solo se tuvieron en cuenta las embolias ocurridas en coronarias principales, lo cual probablemente infravaloró el número de SCA-E diagnosticados. Por último, el haber incluido a pacientes durante un periodo de tiempo largo explicaría algunas de las diferencias observadas en las técnicas de tratamiento empleadas, así como en el poco uso que se hizo de las imágenes intracoronarias en nuestra serie.
CONCLUSIONES
El SCA-E y el SCA-A tienen diferentes características clínicas y angiográficas. El sexo femenino, menor edad, la historia clínica de neoplasias activas, las cirugías valvulares previas y la FA fueron predictores independientes del SCA-E. Los pacientes con SCA-E tenían un índice más alto de mortalidad intrahospitalaria, principalmente, de origen cardiovascular.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
Todos los autores contribuyeron a la idea y diseño del estudio. Tanto la preparación del material como la recogida de datos corrieron a cargo de A. Jerónimo, A. Travieso, A. McInerney, B. Hennessey y L. Marroquín. A. Jerónimo, M.J. Pérez-Vyzcaino y N. Gonzalo realizaron los análisis estadísticos. A. Jerónimo y N. Gonzalo elaboraron la versión final del manuscrito y todos los autores dieron su opinión sobre las versiones anteriores del mismo. Todos los autores leyeron y aprobaron la versión final del manuscrito.
CONFLICTO DE INTERESES
Ninguno.
¿QUÉ SE SABE DEL TEMA?
- Según las autopsias y los estudios angiográficos realizados, la embolia coronaria sistémica representa entre el 3 y el 14% de todos los SCA. No obstante, todavía se desconoce cuál es la verdadera prevalencia de esta entidad por lo incierto de su diagnóstico en el contexto agudo. FA, endocarditis infecciosa, miocardiopatías, valvulopatías y malignidades se asocian, todas ellas, al SCA-E. En cualquier caso, el perfil clínico y angiográfico de esta entidad todavía no se ha podido establecer.
¿QUÉ APORTA DE NUEVO?
- Nuestro estudio describe las características epidemiológicas, clínicas y angiográficas de pacientes con SCA-E frente a SCA-A ingresados en 1 único centro durante el mismo periodo de tiempo. A este respecto, los pacientes con SCA-E eran más jóvenes que aquellos con SCA-A, mujeres en su mayoría y con más antecedentes de FA, accidente cerebrovascular previo, cirugía valvular precia y neoplasias activas. La descendente anterior fue el vaso culpable más habitual en los 2 grupos, si bien los pacientes con SCA-A tuvieron una proporción mucho más alta de estenosis significativas. En cuanto al abordaje terapéutico con ICP se refiere, la tromboaspiración fue la estrategia más frecuente en SCA-E sin implante de stent en ninguno de los casos. Además, el índice de mortalidad intrahospitalaria por cualquier causa fue mucho mayor en pacientes con SCA-E por causas, principalmente, cardiovasculares. Una menor edad, el sexo femenino, la presencia de neoplasias activas, la existencia de cirugías valvulares cardiacas previas y la historia clínica de FA se identificaron como predictores clínicos independientes del SCA-E.
BIBLIOGRAFÍA
1. Shibata T, Kawakami S, Noguchi T, et al. Prevalence, Clinical Features, and Prognosis of Acute Myocardial Infarction Attributable to Coronary Artery Embolism. Circulation. 2015;132:241–250.
2. Popovic B, Agrinier N, Bouchahda N, et al. Coronary Embolism Among ST-Segment-Elevation Myocardial Infarction Patients: Mechanisms and Manegement. Circ Cardiovasc Interv. 2018;11:e005587.
3. Kolodgie FD, Virmani R, Finn A V, Romero ME. Embolic Myocardial Infarction as a Consequence of Atrial Fibrillation: A Prevailing Disease of the Future. Circulation. 2015;132:223–226.
4. Thygesen K, Alpert JS, Jaffe AS, et al. Fourth universal definition of myocardial infarction (2018). Eur Heart J. 2019;40:237-269.
5. Prizel KR, Hutchins GM, Bulkley BH. Coronary artery embolism and myocardial infarction. Ann Intern Med. 1978;88:155-161.
6. Lacey MJ, Raza S, Rehman H, Puri R, Bhatt DL, Kalra A. Coronary embolism: A systematic review. Cardiovasc Revasc Med. 2020;21:367-374.
7. Cheng JT, Cahill WJ, Foley EF. Coronary embolism. J Am Med Assoc. 1953;153:211-213.
8. Cheng TO. Coronary embolism. Int J Cardiol. 2009;136:1-3.
9. Kotooka N, Otsuka Y, Yasuda S, Morii I, Kawamura A, Miyazaki S. Three cases of acute myocardial infarction due to coronary embolism: treatment using a thrombus aspiration device. Jpn Heart J. 2004;45:861-866.
10. Stoel MG, von Birgelen C, Zijlstra F. Aspiration of embolized thrombus during primary percutaneous coronary intervention. Catheter Cardiovasc Interv. 2009;73:781-786.
11. Charles RG, Epstein EJ. Diagnosis of coronary embolism: A review. J R Soc Med. 1983;76:863-869.
12. Roxas CJ, Weekes AJ. Acute myocardial infarction caused by coronary embolism from infective endocarditis. J Emerg Med. 2011;40:509-514.
13. Hindricks G, Potpara T, Dagres N, et al. 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association for Cardio-Thoracic Surgery (EACTS): The Task Force for the diagnosis and management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESC. Eur Heart J. 2021;42:373-498.
14. Soliman EZ, Safford MM, Muntner P, et al. Atrial fibrillation and the risk of myocardial infarction. JAMA Intern Med. 2014;174:107-114.
15. Emdin CA, Wong CX, Hsiao AJ, et al. Atrial fibrillation as risk factor for cardiovascular disease and death in women compared with men: systematic review and meta-analysis of cohort studies. BMJ. 2016;532:h7013.
16. Ruddox V, Sandven I, Munkhaugen J et al. Atrial fibrillation and the risk for myocardial infarction, all-cause mortality and heart failure: A systematic review and meta-analysis. Eur J Prev Cardiol. 2017;24:1555-1566.
17. Guo XY, Li N, Du X, et al. Atrial fibrillation is associated with an increased risk of myocardial infarction: insights from a meta-analysis. Atherosclerosis. 2016;254:1–7.
18. Bayturan O, Puri R, Tuzcu EM, et al. Atrial fibrillation, progression of coronary atherosclerosis and myocardial infarction. Eur J Prev Cardiol. 2017;24:373–381.
19. Falanga A, Schieppati F, Russo D. Cancer Tissue Procoagulant Mechanisms and the Hypercoagulable State of Patients with Cancer. Semin Thromb Hemost. 2015;41:756-764.
20. Aronson D, Brenner B. Arterial thrombosis and cancer. Thromb Res. 2018;164 Suppl 1:S23-S28.
21. Liu F, Xu Z, Luo J, et al. Effectiveness and Safety of DOACs vs. VKAs in AF Patients With Cancer: Evidence From Randomized Clinical Trials and Observational Studies. Front Cardiovasc Med. 20215;8:766377.
22. Chu G, Versteeg HH, Verschoor AJ, et al. Atrial fibrillation and cancer - An unexplored field in cardiovascular oncology. Blood Rev. 2019;35:59-67.
* Autor para correspondencia.
Correo electrónico: nieves_gonzalo@yahoo.es (Nieves Gonzalo).