RESUMEN
Las intervenciones coronarias percutáneas en enfermedad arterial coronaria calcificada representan un desafío para el cardiólogo intervencionista. Además, los pacientes con enfermedad arterial coronaria calcificada tienden a tener peores resultados en el seguimiento a corto y largo plazo. La infraexpansión del stent es el resultado más temido cuando se realiza una intervención coronaria percutánea en estos pacientes y es un gran predictor de falla del stent. Por lo tanto, la modificación del calcio guiada por imágenes intracoronarias, es un paso importante en el tratamiento de esta enfermedad. La siguiente revisión describe el uso «paso a paso» de imágenes intracoronarias en la evaluación de la calcificación coronaria y en la selección de una técnica de modificación de calcio adecuada. Además, se describen las técnicas actuales de modificación de calcio disponibles, la evidencia para su uso, su mecanismo de acción y los resultados típicos que se observan en las imágenes intracoronarias.
Palabras clave: Calcificación coronaria. Modificación de placa calcificada. Aterectomía. Litoplastia. Tomografía coherencia óptica. Ecografía intravascular.
ABSTRACT
Calcified coronary artery disease poses a number of challenges to the interventional cardiologist when performing percutaneous coronary interventions, and patients with calcified coronary artery disease continue to have poorer outcomes at both the short and the long-term follow up. Stent underexpansion is the most feared outcome when performing percutaneous coronary interventions in these patients and is a strong predictor of stent failure. Therefore, intracoronary imaging to guide calcium modification is an important step in the treatment of this disease. The following review outlines a stepwise approach using intracoronary imaging in the assessment of coronary calcification, and in the selection of the appropriate calcium modification tool. Additionally, we describe current calcium modification techniques available, the evidence behind their use, their mechanism of action, and the typical results seen on intracoronary imaging.
Keywords: Coronary calcium. Calcium modification. Atherectomy. Lithotripsy. Optical coherence tomography. Intravascular ultrasound.
Abreviaturas AR: aterectomía rotacional. AO: aterectomía orbital. EC: enfermedad coronaria. ICP: intervención coronaria percutánea. IIV: imagen intravascular. IVUS: ecocardiografía intravascular. LIV: litotripsia intravascular. OCT: tomografía de coherencia óptica.
INTRODUCCIÓN
La estenosis coronaria calcificada es un hallazgo relativamente frecuente en el 30% de las lesiones programadas para intervención coronaria percutánea (ICP)1. La ateroesclerosis calcificada plantea una serie de dificultades durante la ICP, sobre todo la infraexpansión del stent, un potente predictor del fracaso del stent (trombosis y reestenosis)2-4. No sorprenden, pues, los resultados clínicos que se obtienen tras una ICP para tratar la enfermedad calcificada entre moderada y grave comparada con placas ateroescleróticas sin calcio1. En la actualidad, se dispone en una serie de técnicas para modificar la placa de calcio, aunque pocas comparativas directas entre ellas, lo cual complica la elección del dispositivo que se debe emplear. Entender la morfología del calcio puede contribuir a la adecuada selección del dispositivo o la técnica que mejor funcionan bajo guiado mediante imágenes intravasculares (IIV). En esta revisión, se ofrece una descripción de la valoración del calcio coronario empleando IIV, se propone el algoritmo de modificación del calcio simplificado que usamos en nuestro centro y se analiza el mecanismo de acción y la evidencia científica que avala el uso de cada una de estas técnicas.
Fisiopatología e implicaciones pronósticas del calcio coronario
La fisiopatología de la ateroesclerosis está bien documentada y empieza con lesiones vasculares y acumulación de lipoproteínas de baja densidad que atraviesan cambios oxidativos que resultan en la liberación de citocinas proinflamatorias. Estas atraen monocitos que migran hacia la íntima, se convierten en macrófagos y, por último, en células espumosas5. El subsiguiente reclutamiento de células musculares lisas de la media produce una matriz extracelular que provoca engrosamiento intimal y avance de la placa. Con el paso del tiempo y en presencia de factores de riesgo como la edad, el sexo masculino, la raza caucásica, la hipertensión, la hiperlipemia, la diabetes y la insuficiencia renal crónica, puede sobrevenir la calcificación de las placas ateroescleróticas cuya patogénesis tiene mucho en común con la osteogénesis1,5-8. Se piensa que la transformación de las células musculares lisas en un fenotipo osteoblástico es el factor de inicio motivado por exposición a la proteína morfogenética ósea 2 (BMP 2) que producen las células endoteliales cuando se ven expuestas a estresores tales como hipoxia, presión alta, flujo turbulento e inflamación9. El resultado es la pérdida de expresión de los marcadores específicos del músculo liso vascular y la expresión de genes que suelen encontrarse en los osteoblastos10. Otras vías también tienen un papel, por ejemplo, la apoptosis de células musculares lisas vasculares y la formación de vesículas de matriz calcificadas por los macrófagos6. Los primeros resultados son la deposición de microcalcificaciones que terminan por fusionarse en depósitos de calcio más grandes que adoptan una apariencia de «calcificaciones irregulares» en las IIV. El avance de estas calcificaciones resulta en placas o láminas de calcio que pueden llegar a extenderse por múltiples cuadrantes del vaso, endureciéndolo y alterando su distensibilidad11. La calcificación nodular es un importante subtipo morfológico que penetra en la luz del vaso y se forma cuando se rompen las placas de calcio6. En el pronóstico, la presencia de ateroesclerosis calcificada se vincula a peores resultados cardiovasculares12,13. Una calcificación irregular inicial representa un periodo inestable en la evolución de la enfermedad coronaria (EC) calcificada y estas lesiones suelen asociarse a rotura de la placa y al síndrome coronario agudo6,14. En cambio, las lesiones con mayor porcentaje de volumen de placa calcificada según la angiotomografía computarizada son más estables y suelen presentar menos eventos cardiovasculares agudos, pero más síndromes coronarios agudos y enfermedad multivaso6,15.
Intervención coronaria percutánea para el tratamiento de la ateroesclerosis calcificada
Las estenosis calcificadas se dan en hasta el 30% de los pacientes aptos para ICP1. La subsiguiente reducción de la distensibilidad coronaria plantea una serie de dificultades en la intervención. Una inadecuada dilatación de la lesión puede resultar en la infraexpansión del stent16, uno de los predictores más importantes de su fracaso2-4. Otras dificultades son el mayor riesgo de disección y perforación, dificultad a la hora de pasar el equipo distalmente, la afectación del polímero del stent, una cinética de liberación del fármaco alterada y, potencialmente, la deformación o pérdida del stent1,17,18. Además, los pacientes con calcificación coronaria son menos propensos a recibir revascularizaciones completas y suelen presentar resultados adversos tras una ICP. En un análisis conjunto de los estudios HORIZONS-AMI y ACUITY, la presencia de calcificación moderada o grave (valorada angiográficamente) se asoció a peores resultados al año para todos los objetivos incluida la muerte, la mortalidad cardiovascular, el infarto de miocardio y el índice total de eventos cardiovasculares adversos mayores1. Al cabo de 1 año, el riesgo de trombosis del stent aumentó en un 62% y el de revascularización de la lesión diana (RLD) en un 44% en lesiones calcificadas frente a no calcificadas. Estos hallazgos se han podido replicar en otros estudios en seguimientos a corto y largo plazo1,7,19-21. En un reciente análisis del estudio SYNTAXES, las lesiones extensamente calcificadas se asociaron a un índice de mortalidad por cualquier causa más alto al cabo de 10 años con independencia del tipo de revascularización empleada (hazard ratio, 1,79; intervalo de confianza del 95%, 1,49-2,16; p < 0,001)21. Optimizar los resultados de la ICP tiene una importancia capital y preparar la placa modificando el calcio es un paso importante en este proceso.
Técnicas de imagen para la detección del calcio
Detectar la presencia de calcio coronario previo a la ICP es importante para poder planificar la intervención pudiéndose emplear una serie de técnicas imágenes como las que se muestran en la tabla 1.14,15,22-28
Tabla 1. Resumen de las técnicas de imagen disponibles para la detección del calcio coronario
| Técnica de imágenes | Cuantificación | Sensibilidad | Especificidad | Ventajas | Desventajas |
|---|---|---|---|---|---|
Tomografía computarizada14,15,22,23 |
| ++++ | ++++ |
|
|
Coronariografía23,24,25 |
| ++ +++ en presencia de calcificación grave | +++ |
|
|
OCT25,26,27 |
| ++++ | ++++ |
|
|
IVUS25,27,28 |
| ++++ | ++++ |
|
|
IVUS: ecocardiografía intravascular; OCT: tomografía de coherencia óptica. | |||||
Técnicas de imagen no invasivas para el tratamiento de la calcificación coronaria
La angiotomografía computarizada es altamente sensible y específica para detectar placas de calcio, además de tratarse de una técnica no invasiva. También es capaz de determinar la morfología de la placa y el volumen porcentual de placa calcificada con significación pronóstica15. Su utilidad durante la planificación de la intervención adquiere mayor importancia durante la planificación de oclusiones coronarias totales crónicas, no tanto para guiar la estrategia interoperatoria.
Técnicas de imagen invasivas para el tratamiento de la calcificación coronaria
Hace tiempo que se sabe que la coronariografía invasiva tiene una sensibilidad baja pero una especificidad alta para la detección del calcio coronario. Comparada con la ecocardiografía intravascular (IVUS), su sensibilidad general es del ~ 48%, aunque puede subir hasta > 85% en presencia de calcificación grave (4 cuadrantes)24,25. En cualquier caso, el arco ha de superar los 100° en las IIV para poder detectar la placa de calcio en la angiografía, lo cual pone de manifiesto el potencial que tiene el calcio de pasar desapercibido cuando la ICP está guiada solo por angiografía25. Esta normalmente clasifica la calcificación como nula/leve, moderada o grave (tabla 1). Aunque la angiografía proporciona información valiosa para guiar la intervención sobre la tortuosidad del vaso, la angulación de las bifurcaciones, etc., sus limitaciones también están bien documentadas y los estudios han demostrado consistentemente peores resultados cuando la ICP está guiada por angiografía en lugar de por IIV29-31.
Las IIV satisfacen muchas de las carencias que presentan otras técnicas de imagen. Tanto la tomografía de coherencia óptica (OCT) como la IVUS son más sensibles a la detección del calcio que la coronariografía25. Además, ambas técnicas ofrecen información adicional para guiar y optimizar la intervención (tabla 1)27. El corregistro con la angiografía está disponible para ambas técnicas y puede reducir la curva de aprendizaje significativamente32. Aunque las ventajas que tiene la IIV sobre la angiografía han sido objeto de varios estudios, todavía no se ha publicado ningún estudio no aleatorizado que analice específicamente sus posibles beneficios en el tratamiento de la EC calcificada. No obstante, ante la complejidad de estas lesiones, parece razonable llevar a cabo la ICP guiada por IIV.
Ecocardiografía intravascular
La IVUS tiene una sensibilidad y especificidad altas (del 86,7 y 93,3%, respectivamente frente a las muestras histológicas) para la detección de calcificaciones densas, aunque es menos sensible para detectar microcalcificaciones33 y en presencia de placas fibróticas superpuestas34. El calcio refleja el ultrasonido como una señal hiperecoica brillante con una sombra posterior significativa que suele impedir que se pueda valorar el grosor de la placa de calcio (figura 1)35. Se pueden emplear marcadores indirectos del grosor de calcio tales como la presencia de reverberaciones posteriores (asociadas a placas más finas de calcio < 0,5 mm), si bien la presencia de una sombra significativa sugiere una calcificación más gruesa (> 1 mm)25. Recientemente, un sistema de puntuación específico mediante IVUS ha resultado útil para predecir la infraexpansión del stent empleando para ello 4 criterios: un arco de calcio > 270° para una longitud de ≥ 5 mm, la presencia de un arco de calcio de 360°, la presencia de nódulos calcificados y un diámetro del vaso adyacente < 3,5 mm. Una puntuación ≥ 2 sugiere que debe acometerse la modificación del calcio, razón por la cual los operadores deberían intentar medir cada uno de estos parámetros mediante pullbacks de IVUS36.
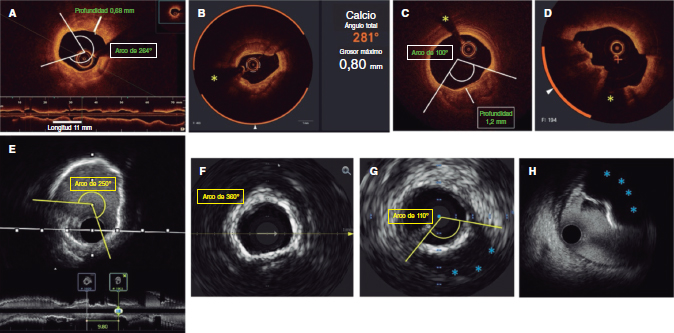
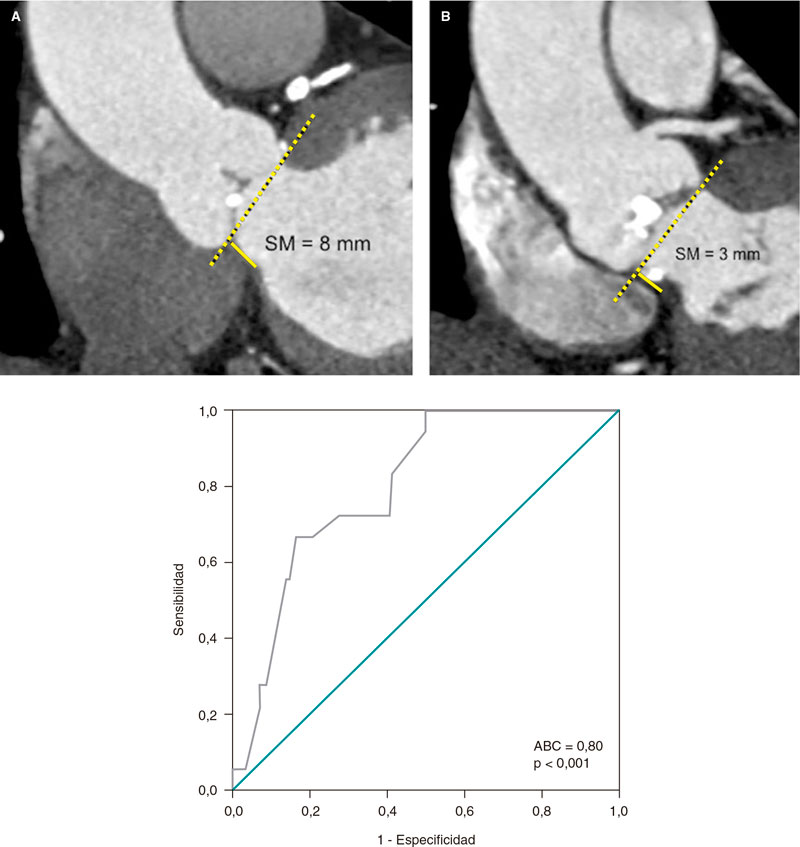
Figure 1. Morfología del calcio y mediciones mediante el empleo de imágenes intracoronarias. A: calcificación concéntrica en una tomografía de coherencia óptica (OCT); arco de calcio de 264°, profundidad de 0,68 mm y longitud de 11 mm – características de riesgo alto en la OCT para la infraexpansión del stent; se aconseja preparación de la placa. B: calcificación concéntrica; arco de calcio de 281° y profundidad de 0,8 mm. Detección automática del calcio empleando el software Ultreon; grados de calcio detectados definidos por el arco naranja que rodea la imagen de la OCT. C: calcio excéntrico en la OCT; arco de calcio < 180°. Obsérvese que los bordes bien definidos del calcio permiten poder valorar la profundidad de este (1,2 mm). D: nódulo calcificado en la OCT. Significativa sombra posterior provocada por el nódulo que evita la valoración de su borde posterior. E: calcificación concéntrica en la IVUS con un arco de calcio de 250° y una longitud de 9,8 mm. Tanto la sombra posterior como la falta de reverberaciones sugieren una placa gruesa de calcio (~1 mm). Estas características representan un riesgo alto de infraexpansión del stent. F: calcificación concéntrica en la ecocardiografía intravascular (IVUS) con un arco de calcio de 360°. G: calcificación excéntrica en la IVUS con un arco de calcio < 180°. Sombra acústica posterior significativa (asterisco azul). H: nódulo calcificado en la IVUS protruyendo hacia el interior de la luz y proyectando una significativa sombra acústica posterior (asterisco azul). El asterisco amarillo (en todas las imágenes OCT) denota el artefacto de la guía.
Tomografía de coherencia óptica
Aunque mucho más sensible que la angiografía, la OCT es menos sensible que la IVUS en la detección del calcio coronario. Wang et al. descubrieron que el ~ 6% de las lesiones con calcio detectable mediante IVUS no se veían en la OCT, lo cual se atribuía a la presencia de una placa fibrótica superpuesta25. En la OCT, el calcio se muestra como una región de baja intensidad de señal con bordes bien definidos que permiten valorar la profundidad del calcio26. Fujino et al. demostraron que un arco de calcio > 180°, una profundidad de > 0,5 mm y una longitud de > 5 mm en la OCT se asociaban a mayor riesgo de infraexpansión del stent, razón por la que -al igual que con la IVUS- los operadores deberían analizar cada uno de estos parámetros37. Recientemente ha aparecido un software de inteligencia artificial (Ultreon OCT system, Abbott, Estados Unidos) que identifica automáticamente el arco y profundidad del calcio y la lámina elástica externa para el dimensionamiento del vaso, lo cual ayuda a simplificar el análisis (figura 1).
En términos prácticos, podría resultar útil valorar el grado de calcificación coronaria en las IIV teniendo en cuenta el arco, profundidad y longitud del calcio, así como si es superficial o profundo, tal y como se muestra en la figura 1. Teniendo en cuenta el arco circunferencial, el calcio coronario se puede dividir en 3 subtipos morfológicos (figura 1): excéntrico, que se extiende por 2 o menos cuadrantes con un arco < 180°; concéntrico, con un arco > 180°, y calcificación nodular, que se presenta como una protrusión eruptiva en el interior de la luz. El calcio también se puede subdividir en superficial (localizado a < 50% de profundidad de la placa más el grosor de la media) o profundo (localizado a > 50% de profundidad de la placa más el grosor de la media)28. La longitud del calcio se debe medir en proyecciones longitudinales tanto en la IVUS como en la OCT.
Modificación de la placa calcificada
Aunque no hay ensayos clínicos que comparen las diferentes técnicas de modificación de la placa empleadas en las diferentes morfologías de calcio, el consenso sugiere que los tratamientos basados en balones son efectivos en el tratamiento de la calcificación excéntrica, que tiene una longitud corta. Aunque los tratamientos ablativos y basados en la litotripsia son más útiles para tratar la calcificación concéntrica o las lesiones calcificadas largas, la litotripsia es especialmente útil para tratar depósitos de calcio más profundos. La calcificación nodular plantea el mayor desafío de todos; no obstante, son muchos los que abogan por el uso de técnicas ablativas y datos publicados recientemente sugieren que la litotripsia podría tener un papel importante38. Las lesiones infranqueables y no dilatables pueden tratarse con la aterectomía rotacional (AR) o mediante angioplastia coronaria con láser excímer (ELCA). Aunque reconocemos la escasez de datos y la falta de ensayos comparativos directos entre las diferentes técnicas disponibles, hemos intentado resumir a título orientativo tanto esta práctica clínica como la de nuestro propio centro en un algoritmo simplificado de modificación del calcio (figura 2). La tabla 2 resume el mecanismo de acción y las especificaciones de estas técnicas. Los resultados esperados tras la modificación del calcio se muestran en la figura 3.
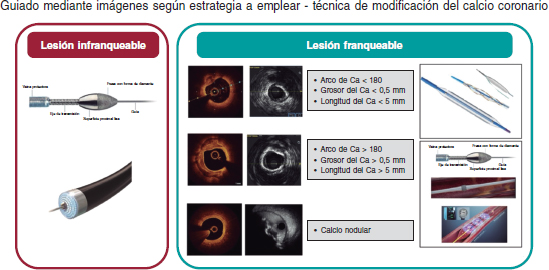
Figure 2. Algoritmo de modificación del calcio. Se aconseja la obtención de imágenes intravasculares (IIV) para valorar la lesión antes de modificar la placa. Las lesiones infranqueables, con frecuencia, requieren el uso de la aterectomía rotacional o de la angioplastia coronaria con láser excímer (ELCA). Las lesiones franqueables con calcificación excéntrica sin características de alto riesgo para la infraexpansión del stent se pueden tratar con balones no distensibles, de tallado o scoring balloons. La calcificación concéntrica o el calcio con características de alto riesgo para la infraexpansión del stent se pueden tratar mediante técnicas de aterectomía o litotripsia intravascular (LIV). Aunque el calcio nodular puede modificarse empleando técnicas de aterectomía, cada vez se tienen más evidencias de que la LIV también puede ser efectiva. La posmodificación de la placa en las IIV es clave para valorar la modificación de la placa adecuadamente. Ca: calcio.
Tabla 2. Herramientas de modificación del calcio: descripción, mecanismo de acción y especificaciones
| Balones de tallados | Scoring balloons | Balones no distensibles (NC) de alta presión | Aterectomía rotacional | Aterectomía orbital | LÁSER excímer | Litotripsia | |
|---|---|---|---|---|---|---|---|
| Descripción de la tecnología | Plataforma de balón con una serie de microcuchillas | Varias guías de nitinol envueltas en un balón semidistensible o no distensible | Balón no distensible de doble capa | Fresa recubierta de diamante capaz de realizar una aterectomía en un movimiento hacia delante | Corona recubierta de diamante montada excéntricamente capaz de realizar una aterectomía en un movimiento hacia delante y hacia atrás | Sistema concéntrico o excéntrico de fibras láser Emplea una mezcla de gases raro y halógeno que generan pulsos cortos de alta intensidad y luz UV de longitud de onda corta | Serie de emisores encerrados dentro de un sistema de liberación con balón |
| Mecanismo de acción | Incisiones controladas del calcio | Incisiones controladas del calcio | Dilatación con balón de muy alta presión con una presión máxima de inflado de 35 atm (a menudo dilatado a ~50 atm) | La rotación de la fresa a alta velocidad (140-160.000 rpm) resulta en una aterectomía diferencial del tejido fibrocalcificado Efecto adicional derivado de la vibración de la fresa (+) | La fuerza centrífuga hace que la corona orbite a altas velocidades (80 o 120.000 rpm) lo cual permite el lijado del calcio Efecto adicional derivado de la vibración de la corona (+++) | Rompe la placa empleando 3 mecanismos Fotoquímico: rompe las uniones de carbón entre moléculas Fototérmico: produce energía térmica y burbujas de vapor Fotomecánico: rompe la placa por la expansión de las burbujas de vapor La energía lumínica (fluencia) empleada oscila entre los 30 y 80 ml/mm2 La tasa de repetición de los pulsos se sitúa entre los 25 y 80 Hz | Los emisores producen chispas eléctricas que a su vez crean una burbuja de vapor que expande y propaga una onda acústica por la pared vascular Genera fuerzas compresivas y descompresivas ante la presencia de la placa de calcio provocando la rotura del mismo |
| Tamaños disponibles | Una serie de marcas disponibles en tamaños que van de 2,0 a 4,0 mm | Una serie de marcas disponibles en tamaños que van de 1,47 a 4,0 mm | Balones de 1,5 a 4,5 mm | Fresa de 1,25, 1,5, 1,75, 2,0, 2,15, 2,25, 2,38 y 2,5 mm | Corona de 1,25 mm | 0,9, 1,4, 1,7 y 2,0 mm | Diámetros de 2,5, 3,0, 3,5 y 4,0 mm Todos los tamaños son de 12 mm de largo |
| Compatibilidad con el catéter guía | 6 Fr | Los tamaños de algunos balones son compatibles con sistemas de 5 y 6 Fr | 6 Fr | 6 Fr; 1,25 y 1,5 mm 7 Fr; 1,75 mm 8 Fr; 2,0 y 2,15 mm 9 Fr; 2,25 y 2,38 mm 10 Fr; 2,50 mm | 6 Fr | 6 Fr: 0,9 y 1,4 mm 7 Fr: 1,7 mm 8 Fr: 2,0 mm | 6 Fr |
| Compatibilidad de la guía | Guías convencionales de 0,014 pulgadas | Guías convencionales de 0,014 pulgadas | Guías convencionales de 0,014 pulgadas | Se requiere una guía especializada de 0,009 o 0,014 pulgadas | Se requiere una guía especializada Viper de 0,012 o 0,014 pulgadas | Guías convencionales de 0,014 pulgadas | Guías convencionales de 0,014 pulgadas |
| Otras advertencias | Balón 1:1: dimensionamiento del vaso Rotar el balón seguido de inflados repetidos puede aumentar el número de incisiones | Balón 1:1: dimensionamiento del vaso | Balón 1:1: dimensionamiento del vaso | Ratio fresa-arteria de 0,5 a 0,6 Lubricante disponible pero no obligatorio y contraindicado en pacientes alérgicos al huevo y la soja | Se requiere un lubricante específico que está contraindicado en pacientes alérgicos al huevo y la soja | Ratio catéter-arteria de 0,5 a 0,6 Requiere de la infusión continua de una solución salina a través del catéter guía La infusión de contraste aumenta la efectividad, pero también el riesgo de daños térmicos | Balón 1:1: dimensionamiento del vaso Preparado riguroso del balón para retirar todo el air Podría hacer falta volver a retirar el aire mientras se esté usando |
| Ventajas | Fácil de usar Compatible con guías convencionales | Fácil de usar Compatible con guías convencionales | Fácil de usar Compatible con guías convencionales | Útil en lesiones no dilatables Podría ser más útil que otras tecnologías para el tratamiento del calcio nodular | Útil en lesiones no dilatables Podría ser más útil que otras tecnologías para el tratamiento del calcio nodular Permite la ablación tanto hacia delante como hacia atrás Genera partículas más pequeñas que la aterectomía rotacional | Fácil de usar Compatible con guías convencionales | Fácil de usar Compatible con guías convencionales Modifica la calcificación profunda y superficial No genera material particulado razón por la cual el riesgo de flujo lento o ausencia de flujo es menor |
| Desventajas | Podría no bastar como monoterapia Aparatoso | Podría no bastar como monoterapia Aparatoso | Aparatoso | Se requiere una guía especializada El sesgo de la guía puede resultar en una aterectomía diferencial Ablación solo en un movimiento hacia delante No permite mantener la guía en la rama lateral durante la aterectomía Genera partículas más grandes que la aterectomía rotacional La embolización distal puede resultar en un flujo lento o en la ausencia de flujo | Se requiere una guía especializada Requiere de la infusión de lubricación especializada No permite mantener la guía en la rama lateral durante la aterectomía, La embolización distal puede resultar en un flujo lento o en la ausencia de flujo | Tiempo de preparación Se necesita protección adicional UV | Aparatoso para franquear lesiones 80 pulsos por catéter podrían requerir el uso de > 1 catéter para el tratamiento de lesiones largas |
| Potenciales complicaciones | Perforación Disección Flujo lento/ausencia de flujo | Perforación Disección Flujo lento/ausencia de flujo | Perforación Disección Flujo lento/ausencia de flujo | Perforación Disección Atrapamiento de la fresa Fractura de la guía Flujo lento/ausencia de flujo Bloqueo aurículoventricular transitorio | Perforación Disección Atrapamiento de la corona Flujo lento/ausencia de flujo | Perforación Disección Lesión térmica | Perforación Disección |
Fr: french; Hz: hercios; NC: no distensible; rpm: revoluciones por minuto; UV: ultravioleta. | |||||||
Abordaje terapéutico para la calcificación excéntrica
Tecnologías especializadas basadas en balones
Las tecnologías especializadas basadas en balones se suelen emplear en calcificaciones excéntricas, aunque también resultan útiles en calcificaciones concéntricas si se emplean con otras técnicas. El balón de tallados incorpora una serie de microcuchillas montadas sobre un balón. Los scoring balloons, por su parte, incorporan un balón semidistensible alrededor del cual se envuelven varias guías de nitinol. Ambos realizan incisiones en el calcio que facilitan la dilatación vascular. La ventaja de estas tecnologías es que se anclan al calcio, no resbalan tanto (el fenómeno llamado «pepita de sandía») y por tanto evitan disecciones en áreas adyacentes. Aunque en ocasiones se emplean indistintamente, un estudio de Matsukawa et al. que empleó IIV confirmó mejor modificación del calcio y mayor ganancia luminal con balones de tallados que con scoring balloons39. Sin embargo, en lo que respecta a la calcificación grave, los balones de tallados tienen índices más bajos de éxito operatorio que la AR40. Combinar balones de tallados con otras tecnologías podría resultar útil. Estudios observacionales demuestran una mayor ganancia luminal con balones de tallados tras una AR que solo con balones convencionales o solo AR41,42.
Los balones de muy alta presión son efectivos para romper el calcio tanto de calcificaciones excéntricas como concéntricas. No suelen ser la primera opción de tratamiento y suelen emplea rse en lesiones no dilatables. Se trata de balones no distensibles de doble capa con una presión máxima de inflado de ~ 35 atm. No obstante, en la práctica suelen dilatarse a ~ 50 atm. En una serie retrospectiva de 326 lesiones consecutivas no dilatables, Secco et al. confirmaron el éxito angiográfico en > 90% de las lesiones en las que se usaron balones de alta presión OPN (OPN NC; SIS Medical AG, Suiza)43. Las lesiones calcificadas con arcos de calcio > 270° solían necesitar presiones > 40 atm. Más recientemente, el estudio ISAR-CALC aleatorizó lesiones con estenosis residuales > 30% tras el uso de balones estándar a recibir scoring balloons o balones de muy alta presión44. No se hallaron diferencias en la OCT que definieran el índice de expansión del stent entre grupos (0,72 frente a 0,68; p = 0,22) ni en el éxito angiográfico, de la intervención o de la estrategia. No obstante, los pacientes del grupo con balones de muy alta presión necesitaron menos dilataciones nuevas con balones no distensibles previas al implante de stent. También tenían diámetros luminales mínimos más grandes según valoración angiográfica y menos estenosis residual que los pacientes de la cohorte con scoring balloons. En consecuencia, los balones de muy alta presión tienen un papel importante en el tratamiento de lesiones no dilatables pero sí franqueables.
Calcificación concéntrica y nodular
Litotripsia
La litotripsia intravascular (LIV) (SHOCKWAVE Medical inc, Estados Unidos) es una técnica que se ha presentado recientemente basada en el uso de energía acústica. Incorpora un sistema de liberación con balón con una serie de emisores que generan chispas eléctricas cortas que generan a su vez una burbuja de vapor en el medio líquido del interior del balón que se dilata a 4 atm. Dicha burbuja se expande, creando una onda de presión acústica que se propaga por la pared vascular y provocan fuerzas compresivas y descompresivas ante la presencia de calcio, el cual rompen45. Cada pulso corto libera el equivalente a ~ 50 atm de presión. En la actualidad, estudios no aleatorizados han confirmado la fisurización del calcio superficial y profundo en las IIV (figura 3). Un análisis conjunto de series de estudios DISRUPT CAD ha confirmado que la intervención es un éxito (estenosis residual angiográfica ≤ 30%) en > 90% de las lesiones46. Aunque hasta la fecha, la LIV se ha empleado sobre todo para tratar el calcio concéntrico, el análisis de calcificaciones definidas angiográficamente como excéntricas o concéntricas sugiere un éxito similar en estas 2 morfologías del calcio47. Además, datos publicados recientemente no sugieren que haya diferencias en el área mínima del stent en la OCT cuando la LIV se emplea para tratar calcificaciones excéntricas, concéntricas y el calcio nodular38. Aunque todavía es una indicación fuera de ficha técnica, ya se han descrito varios casos sobre el uso de la LIV para tratar la infraexpansión del stent por calcificación grave y neoateroesclerosis calcificada48-51. El uso de la LIV en un stent recién desplegado, aunque infraexpandido, todavía no se ha descrito de forma extensa y preocupa teóricamente la posibilidad de daños al polímero del stent. Hasta la fecha, nuestra práctica ha sido emplear la LIV predominantemente en calcificaciones concéntricas, si bien estamos a la espera de nuevos datos. La figura 4 muestra un caso de modificación de la placa mediante una LIV guiada por OCT.
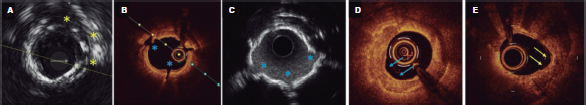
Figure 3. Morfologías de calcio y resultados de las diferentes técnicas de modificación en las imágenes intravasculares. A: discretas incisiones en la placa de calcio y rotura tras el uso de un balón de tallado (asterisco amarillo). B, C: roturas de calcio tras litotripsia intravascular en tomografía de coherencia óptica y ecocardiografía intravascular (IVUS) (asterisco azul). Adviértase cómo se ven las reverberaciones en los puntos de rotura (asterisco azul) en la IVUS ahora que las ondas acústicas pueden atravesar los puntos de rotura. D: resultados de modificación del calcio con aterectomía rotacional en 1 lesión infranqueable. Puede observarse una apariencia “hueca” con ensanchamiento luminal y forma de medialuna en algunas zonas (flecha azul). E: resultados of modificación del calcio tras aterectomía orbital. La forma de medialuna de la corona de la aterectomía orbital se aprecia en las flechas amarillas.
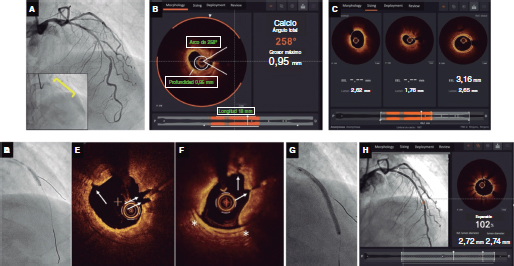
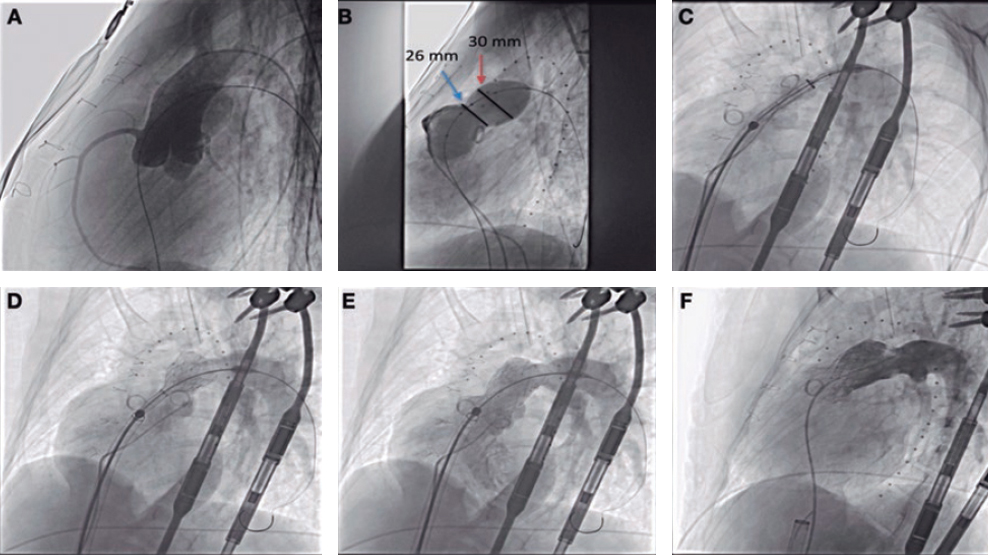
Figure 4. Ejemplo de caso que confirma la modificación del calcio tras guiado por litotripsia intravascular (LIV) con imágenes corregistradas por tomografía de coherencia óptica (OCT) empleando el software Ultreon. A: estenosis fuertemente calcificada en descendente anterior con calcio visible en la fluoroscopia (recuadro).B: la OCT confirma la presencia de calcificación concéntrica; el software Ultreon identifica automáticamente un arco de calcio de 285º, una profundidad de 0,95 mm y una longitud de 18 mm. Estos parámetros sugieren un riesgo alto de infraexpansión del stent. C: zonas de anclaje proximal y distal y longitud del stent requerido. La distancia que existe entre la lámina elástica externa de la zona de anclaje distal y la lámina elástica externa (líneas blancas punteadas detectadas automáticamente por el software Ultreon) mide 3,16 mm mientras que, proximalmente, no se puede ver la lámina elástica externa y el diámetro luminal es 2,62 mm. La longitud predicha del stent necesario es de 45 mm. D: balón de LIV de 3,0 x 12 mm (dimensionamiento 1:1). Liberación de 60 pulsos a lo largo y ancho de la lesión calcificada. E, F: rotura extensa del calcio en la OCT tras LIV (flechas blancas). También se observa 1 disección (asterisco blanco). G: implante de 1 stent farmacoactivo de 3,0 x 48 mm según dimensionamiento mediante OCT. Optimizado con un balón no distensible de 3,0 x 12 mm. F: OCT final; óptima expansión del stent (> 90%) sin mala aposición ni complicaciones (por ejemplo, disecciones) en las zonas de anclaje proximal y distal.
Aterectomía rotacional
La AR (Rotablator, Boston Scientific, Estados Unidos) incorpora una fresa con punta de diamante que rota a 140-180.000 rpm que realiza la ablación diferencial del tejido calcificado sin alterar los tejidos elásticos sanos. La ablación se realiza en un movimiento hacia delante. Se requiere una guía especializada (RotaWire Floppy o RotaWire Extra Support, Boston Scientific, Estados Unidos) y una fresa que no supere más de 0,5-0,6 veces el tamaño del vaso. Antes, se abogaba por la infusión de nitroglicerina, verapamilo o heparina para mitigar los efectos de la embolización del material trombótico y por insertar una guía para la estimulación temporal, o por la infusión de aminofilina para combatir la bradicardia sobre todo durante la AR de la coronaria derecha. No obstante, los cambios en las técnicas de AR han contribuido a reducir las complicaciones. La reducción agresiva del volumen de placa que permite la AR se ha sustituido por ciclos más cortos (de 10 y 15 segundos), movimientos de picoteo con la fresa, tamaños de fresa más pequeños y periodos de descanso para eliminar las partículas embolizadas. En ocasiones, en las IIV, el raspado y alisado del calcio adoptan forma de medialuna desde el lugar desde donde se realizó la ablación con la fresa (figura 3).
El estudio ROTAXUS aleatorizó a 240 pacientes con EC calcificada para recibir AR o tratamiento convencional previo al implante de un stent farmacoactivo52. Tanto el éxito de la intervención como la ganancia luminal (1,56 frente a 1,44 mm, p < 0,01) fueron mayores en el grupo AR durante la intervención índice. Sin embargo, se observó una mayor pérdida luminal tardía en el grupo AR a los 9 meses (0,44 frente a 0,31 mm, p = 0,04). Además, tras 2 años de seguimiento no se observaron diferencias entre los distintos grupos respecto a los eventos cardiovascular adversos graves, el infarto de miocardio, la revascularización de la lesión diana o la revascularización del vaso diana (p > 0,05 para todas las comparativas)53. El estudio PREPARE-CALC analizó la AR y la comparó con los balones modificados (de tallado o scoring balloons) en el tratamiento de la enfermedad calcificada grave. Similar a lo descrito en el estudio ROTAXUS, la estrategia tuvo más éxito en el grupo AR que en el de balones modificados (98 frente al 81%, p = 0,0001) sobre todo por la mayor capacidad de cruce del grupo con balones modificados (el 10% del grupo con balones modificados)40. No obstante, este mayor éxito en la estrategia del grupo AR no se tradujo en diferencias en los resultados clínicos ni angiográficos a los 9 meses40, lo cual se explicaría en parte porque la expansión final del stent según la OCT no varió entre los grupos (73,5 frente al 73,1% para balones modificados y AR, respectivamente; p = 0,85)54.
Cada vez se usan más combinaciones de técnicas adicionales para modificar el calcio coronario. Un estudio de 92 pacientes realizado por Tang et al. confirmó un mayor descenso del porcentaje de estenosis (del 54,5 al 36,1% frente al 55,7 al 46,9%, p < 0,001) acompañado de una mayor expansión del stent (71,7 frente al 54,5%) con la AR más un balón de tallado que con solo la AR41. Asimismo, Amemiya et al. observaron una mayor rotura de la placa de calcio y expansión del stent (78,9 frente al 66,7%, p < 0,01) en la OCT con el balón de tallado que con una angioplastia con balón tras la AR42. Además, se han descrito numerosos casos clínicos sobre el uso de LIV tras AR con un bueno efecto55,56. Serán necesarios estudios aleatorizados y observacionales más grandes que ayuden a determinar si estas (y otras) combinaciones dan mejores resultados a largo plazo. En términos prácticos y en nuestra propia práctica clínica, la AR va bien para tratar lesiones infranqueables no dilatables y calcificaciones concéntricas graves (figura 2) a menudo acompañada de otras técnicas.
Aterectomía orbital
La AO (DIAMONDBACK 360 orbital atherectomy system, Cardiovascular systems Inc., Estados Unidos) incorpora una corona recubierta de diamante que emplea la fuerza centrífuga para orbitar y provocar un lijado preferencial del calcio coronario, alejándose de zonas colindantes con tejido elástico sano. Precisa de una guía dedicada (ViperWire advance) y de la infusión de lubricante (ViperSlide both Cardiovascular systems Inc., Estados Unidos) durante la ablación. La corona de 1,25 mm orbita a 1 de las siguientes 2 configuraciones de velocidad (80 o 120.000 rpm), lo cual resulta en el ensanchamiento o estrechamiento del arco orbital. A diferencia de la AR, la AO puede realizar ablaciones moviéndose hacia delante y hacia atrás. Precisa también movimientos lentos (~ 1 mm/segundo). Los ciclos de la aterectomía deberían ser de ≤ 30 segundos con periodos de descanso para poder retirar el material trombótico. Las IIV realizadas tras una AO confirman el raspado y alisado del calcio, a menudo con un arco visible o forma de medialuna en el punto donde se realizó el lijado (figura 3). Los estudios no aleatorizados ORBIT I y II analizaron el perfil de seguridad y efectividad de la AO y confirmaron que redujo el porcentaje de estenosis por diámetro al ≤ 50% en el > 98% de las lesiones57,58. Hubo disecciones significativas en el 2,3% de los casos. No obstante, el índice de complicaciones tales como perforaciones, flujo lento y ausencia de flujo, fue < 1%58. Los 3 años de seguimiento del estudio ORBIT II revelaron una incidencia acumulada de eventos cardiovascular adversos graves y revascularización de la lesión diana del 23,5 y 7,8%, respectivamente59. El estudio prospectivo de un único grupo COAST analizó un sistema de AO modificado con una microcorona distal para mejorar la capacidad de penetración. Este sistema redujo el porcentaje de estenosis por diámetro al ≤ 50% en el > 99% de las lesiones60. En la actualidad, no se ha publicado ningún ensayo aleatorizado comparando la AO a ninguna otra forma de modificación del calcio. No obstante, un pequeño estudio de OCT sugirió que la modificación del calcio era más profunda con la AO que con la AR61 y un metanálisis de estudios observacionales no halló diferencias entre la AO y la AR en lo referente a complicaciones asociadas la intervención, ni tampoco en los eventos a los 30 días incluida la muerte, el infarto de miocardio y la revascularización del vaso diana62. No obstante, aunque hacen falta más datos, nuestra práctica clínica avala el uso de la AO en detrimento de la AR en vasos más grandes con calcificaciones concéntricas o nodulares. La figura 5 muestra un ejemplo de modificación de la placa mediante AO y la tabla 3 resume los datos de que disponemos en la actualidad para AO y AR.
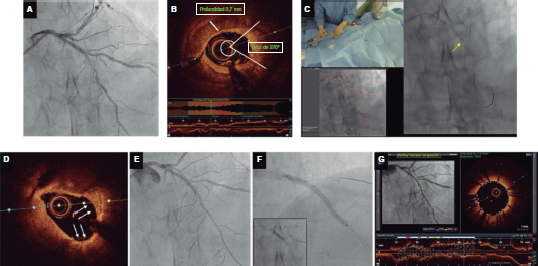
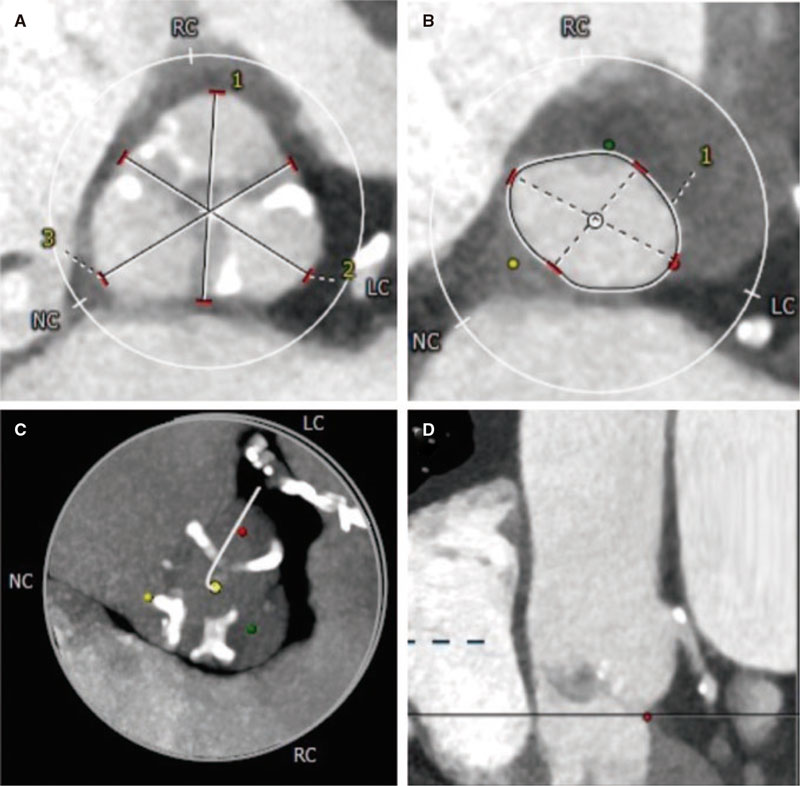
Figure 5. Modificación del calcio por aterectomía orbital guiada por imágenes corregistradas mediante tomografía de coherencia óptica (OCT). A: estenosis fuertemente calificada en segmento medio de descendente anterior. B: OCT con hallazgos de calcificación circunferencial grave; arco de calcio ~270°, profundidad de 0,7 mm y longitud > 5 mm; valores sugestivos de alto riesgo de infraexpansión del stent según criterios OCT. Diámetros luminales de referencia distales y proximales de 2,5 y 3,25 mm, respectivamente con una longitud del stent predicha de 33 mm. C: aterectomía orbital (flecha amarilla) con el sistema de aterectomía orbital DIAMONDBACK 360 y 1 corona de 1,25 mm avanzada a 1 mm/s. El lijado/la aterectomía se llevaron a cabo en movimientos hacia delante y hacia atrás. Utilización del dynamic road mapping para guiar la intervención (abajo a la izquierda). D: apariencia lisa tras aterectomía orbital. La imagen confirma que el ‘casquete’ de calcio se ha reducido enormemente gracias al efecto de lijado logrado por la aterectomía orbital (AO). Se aprecia una forma de la medialuna como efecto de la rotación de la corona (flechas blancas). E: la angiografía realizada tras la AO confirma el descenso significativo del porcentaje de estenosis por diámetro. F: implante de 1 stent farmacoactivo de 2,5 x 36 mm con optimización proximal mediante la utilización de 1 balón no distensible de 3,5 x 10 mm (recuadro). G: las imágenes OCT corregistradas finales obtenidas tras la AO y el implante de stent confirman la correcta expansión y aposición del stent sin complicaciones.
Tabla 3. Resumen de los principales estudios prospectivos que analizaron los resultados obtenidos con las técnicas de AR y AO
| Técnica | Nombre del estudio | Diseño | Número de participantes | Resultados de la intervención | Resultados a corto y medio plazo | Resultados a largo plazo |
|---|---|---|---|---|---|---|
| Aterectomía rotacional | Estudio ROTAXUS52,53 | Ensayo controlado aleatorizado | 240
Tratamiento estándar (TE) | Éxito de la estrategia
Ganancia luminal aguda
Disección
Perforación
Flujo lento/ausencia de flujo
| Resultados a los 9 meses PLT intrastent
Mortalidad
IM
RVD
MACE
RLD
| Resultados a los 2 años MACE
Muerte
Infarto de miocardio
RLD
RVD
|
| PREPARE-CALC40 | Ensayo controlado aleatorizado | 200
| Éxito de la estrategia
| Resultados a los 9 meses PLT intrastent
| ||
| Aterectomía orbital | ORBIT I57 | Ensayo prospectivo, no aleatorizado | 50 |
| MACE
| |
| ORBIT II58,59 | Estudio prospectivo, multicéntrico y no aleatorizado | 443 |
| MACE
| Resultados a los 3 años
| |
| COAST60 | Estudio prospectivo, multicéntrico y de un único grupo | 100 |
| MACE
| Resultados al año
| |
AO: aterectomía orbital; AR: aterectomía rotacional; BM: balones modificados; IM: infarto de miocardio; ER: estenosis residual; MACE: eventos cardiovasculares adversos mayores; RLD: revascularización de la lesión diana; RVD: revascularización del vaso diana; TE: tratamiento estándar; TIMI: Thrombolysis in Myocardial Infarction. Definiciones
ROTAXUS
ORBIT I
ORBIT II
COAST
| ||||||
Angioplastia coronaria con láser excímer
La angioplastia coronaria con láser excímer (ELCA) emplea una mezcla de gases raro y halógeno que genera pulsos breves de luz ultravioleta de alta intensidad y así romper la placa aterosclerótica a través de 3 mecanismos de acción: fotoquímico, rompiendo las uniones de carbón entre moléculas, fototérmico, mediante la producción de calor y burbujas de vapor que rompen las células y fotomecánico, a través de la expansión de burbujas de vapor que también rompen la placa de calcio. Tanto la fluencia (energía medida en mJ/mm2) como la frecuencia de pulso se pueden cambiar para aumentar su efectividad. Se recomienda la infusión constante de una solución salina para evitar la aparición de lesiones térmicas. Además, la longitud de onda corta (~308 nm) de luz ultravioleta reduce la profundidad de penetración para no dañar tejidos sanos. La evidencia de que disponemos del uso de la ELCA en el tratamiento de la EC calcificada es limitada. Un estudio multicéntico y prospectivo de 100 lesiones infranqueables/ no dilatables confirmó el éxito técnico del 92% de las lesiones63 si bien un estudio multicéntrico, también prospectivo, publicado recientemente confirmó el éxito en 126 lesiones infranqueables en el ~ 82% de los casos64. No obstante, la calcificación grave se asoció significativamente el fracaso de la ELCA. En cualquier caso, en un contexto de reestenosis intrastent, se observó más rotura de calcio en la OCT en el grupo tratado con ELCA que con tratamiento convencional65. Dada la falta de estudios a gran escala y teniendo en cuenta los datos disponibles hasta la fecha, a la ELCA se le asigna un papel relativamente nicho para el tratamiento de lesiones infranqueables, prefiriéndose el uso de la AR como terapia ablativa de primera línea ante esta circunstancia.
CONCLUSIONES
La EC calcificada sigue siendo un obstáculo para poder realizar, con éxito, una ICP. Además, la población envejecida sugiere que la proporción de pacientes con EC calcificada que necesitarán una ICP probablemente vaya en aumento. Su presencia se asocia no solo a peores resultados agudos sino también a más eventos adversos durante el seguimiento a largo plazo. La infraexpansión del stent es uno de los predictores más potentes del fracaso del stent y suele ocurrir en presencia de calcificación coronaria significativa. Identificar la presencia de calcio coronario es básico para poder planificar una ICP, y la IIV es una forma de lograrlo con mayor precisión. En la actualidad son muchas las tecnologías con diferentes mecanismos de acción disponibles para modificar el calcio coronario, aunque todavía nos faltan comparativas directas entre todas estas técnicas. En cualquier caso, proponemos el algoritmo simplificado para la modificación del calcio coronario basado en hallazgos en las IIV que usamos actualmente en nuestro centro. Futuros estudios deberán comparar estas técnicas para determinar cuáles son las mejores combinaciones para garantizar los mejores resultados en estos pacientes complejos.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
A. McInerney: idea, diseño y elaboración del manuscrito. J. Escaned: aportó las imágenes clínicas y participó en la fase revisión del manuscrito. N. Gonzalo: idea, diseño, elaboración y revisión crítica del manuscrito; también aportó imágenes clínicas.
CONFLICTO DE INTERESES
N. Gonzalo declara haber recibido honorarios como asesora y conferenciante de Abbott y Boston Scientific. Los demás autores no declaran ningún conflicto de intereses en relación a esta publicación.
BIBLIOGRAFÍA
1. Genereux P, Madhavan MV, Mintz GS, et al. Ischemic outcomes after coronary intervention of calcified vessels in acute coronary syndromes. Pooled analysis from the HORIZONS-AMI (Harmonizing Outcomes With Revascularization and Stents in Acute Myocardial Infarction) and ACUITY (Acute Catheterization and Urgent Intervention Triage Strategy) TRIALS. J Am Coll Cardiol. 2014;63:1845-1854.
2. Fujii K, Carlier SG, Mintz GS, et al. Stent underexpansion and residual reference segment stenosis are related to stent thrombosis after sirolimus-eluting stent implantation: an intravascular ultrasound study. J Am Coll Cardiol. 2005;45:995-998.
3. Hong MK, Mintz GS, Lee CW, et al. Intravascular ultrasound predictors of angiographic restenosis after sirolimus-eluting stent implantation. Eur Heart J. 2006;27:1305-1310.
4. Stefanini GG, Alfonso F, Barbato E, et al. Management of myocardial revascularisation failure: an expert consensus document of the EAPCI. EuroIntervention. 2020;16:e875-e890.
5. Libby P, Buring JE, Badimon L, et al. Atherosclerosis. Nat Rev Dis Primers. 2019;5:56.
6. Mori H, Torii S, Kutyna M, et al. Coronary Artery Calcification and its Progression: What Does it Really Mean? JACC Cardiovasc Imaging. 2018;11:127-142.
7. Bourantas CV, Zhang YJ, Garg S, et al. Prognostic implications of coronary calcification in patients with obstructive coronary artery disease treated by percutaneous coronary intervention: a patient-level pooled analysis of 7 contemporary stent trials. Heart. 2014;100:1158-1164.
8. Madhavan MV, Tarigopula M, Mintz GS, et al. Coronary artery calcification: pathogenesis and prognostic implications. J Am Coll Cardiol. 2014;63:1703-1714.
9. Johnson RC, Leopold JA, Loscalzo J. Vascular calcification: pathobiological mechanisms and clinical implications. Circ Res. 2006;99:1044-1059.
10. Kapustin AN, Shanahan CM. Calcium regulation of vascular smooth muscle cell-derived matrix vesicles. Trends Cardiovasc Med. 2012;22:133-137.
11. Alfonso F, Macaya C, Goicolea J, et al. Determinants of coronary compliance in patients with coronary artery disease: an intravascular ultrasound study. J Am Coll Cardiol. 1994;23:879-884.
12. Detrano R, Guerci AD, Carr JJ, et al. Coronary calcium as a predictor of coronary events in four racial or ethnic groups. N Engl J Med. 2008;358:1336-1345.
13. Vliegenthart R, Oudkerk M, Hofman A, et al. Coronary calcification improves cardiovascular risk prediction in the elderly. Circulation. 2005;112:572-577.
14. Motoyama S, Kondo T, Sarai M, et al. Multislice computed tomographic characteristics of coronary lesions in acute coronary syndromes. J Am Coll Cardiol. 2007;50:319-326.
15. Jin HY, Weir-McCall JR, Leipsic JA, et al. The Relationship Between Coronary Calcification and the Natural History of Coronary Artery Disease. JACC Cardiovasc Imaging. 2021;14:233-242.
16. Kobayashi Y, Okura H, Kume T, et al. Impact of target lesion coronary calcification on stent expansion. Circ J. 2014;78:2209-2214.
17. Genereux P, Madhavan MV, Mintz GS, et al. Relation between coronary calcium and major bleeding after percutaneous coronary intervention in acute coronary syndromes (from the Acute Catheterization and Urgent Intervention Triage Strategy and Harmonizing Outcomes With Revascularization and Stents in Acute Myocardial Infarction Trials). Am J Cardiol. 2014;113:930-935.
18. Hendry C, Fraser D, Eichhofer J, et al. Coronary Perforación in the drug-eluting stent era: incidence, risk factors, management and outcome: the UK experience. EuroIntervention. 2012;8:79-86.
19. Konigstein M, Madhavan MV, Ben-Yehuda O, et al. Incidence and predictors of target lesion failure in patients undergoing contemporary DES implantation-Individual patient data pooled analysis from 6 randomized controlled trials. Am Heart J. 2019;213:105-111.
20. Guedeney P, Claessen BE, Mehran R, et al. Coronary Calcification and Long-Term Outcomes According to Drug-Eluting Stent Generation. JACC Cardiovasc Interv. 2020;13:1417-1428.
21. Kawashima H, Serruys PW, Hara H, et al. 10-Year All-Cause Mortality Following Percutaneous or Surgical Revascularization in Patients With Heavy Calcification. JACC Cardiovasc Interv. 2022;15:193-204.
22. Knez A, Becker A, Leber A, et al. Relation of coronary calcium scores by electron beam tomography to obstructive disease in 2,115 symptomatic patients. Am J Cardiol. 2004;93:1150-1152.
23. Budoff MJ, Diamond GA, Raggi P, et al. Continuous probabilistic prediction of angiographically significant coronary artery disease using electron beam tomography. Circulation. 2002;105:1791-1796.
24. Mintz GS, Popma JJ, Pichard AD, et al. Patterns of calcification in coronary artery disease. A statistical analysis of intravascular ultrasound and coronary angiography in 1155 lesions. Circulation. 1995;91:1959-1965.
25. Wang X, Matsumura M, Mintz GS, et al. In Vivo Calcium Detection by Comparing Optical Coherence Tomography, Intravascular Ultrasound, and Angiography. JACC Cardiovasc Imaging. 2017;10:869-879.
26. Tearney GJ, Regar E, Akasaka T, et al. Consensus standards for acquisition, measurement, and reporting of intravascular optical coherence tomography studies: a report from the International Working Group for Intravascular Optical Coherence Tomography Standardization and Validation. J Am Coll Cardiol. 2012;59:1058-1072.
27. Raber L, Mintz GS, Koskinas KC, et al. Clinical use of intracoronary imaging. Part 1: guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2018;39:3281-3300.
28. Mintz GS, Nissen SE, Anderson WD, et al. American College of Cardiology Clinical Expert Consensus Document on Standards for Acquisition, Measurement and Reporting of Intravascular Ultrasound Studies (IVUS). A report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 2001;37:1478-1492.
29. Gao XF, Ge Z, Kong XQ, et al. 3-Year Outcomes of the ULTIMATE Trial Comparing Intravascular Ultrasound Versus Angiography-Guided Drug-Eluting Stent Implantation. JACC Cardiovasc Interv. 2021;14:247-257.
30. Hong SJ, Mintz GS, Ahn CM, et al. Effect of Intravascular Ultrasound-Guided Drug-Eluting Stent Implantation: 5-Year Follow-Up of the IVUS-XPL Randomized Trial. JACC Cardiovasc Interv. 2020;13:62-71.
31. Kinnaird T, Johnson T, Anderson R, et al. Intravascular Imaging and 12-Month Mortality After Unprotected Left Main Stem PCI: An Analysis From the British Cardiovascular Intervention Society Database. JACC Cardiovasc Interv. 2020;13:346-357.
32. Mc Inerney A, Escaned J, Gonzalo N. Online Co-Registration Of IVUS and OCT. Minerva Cardiol Angiol. 2021;69:641-654.
33. Pu J, Mintz GS, Biro S, et al. Insights into echo-attenuated plaques, echolucent plaques, and plaques with spotty calcification: novel findings from comparisons among intravascular ultrasound, near-infrared spectroscopy, and pathological histology in 2,294 human coronary artery segments. J Am Coll Cardiol. 2014;63:2220-2233.
34. Kim SW, Mintz GS, Lee WS, et al. DICOM-based intravascular ultrasound signal intensity analysis: an Echoplaque Medical Imaging Bench study. Coron Artery Dis. 2014;25:236-241.
35. Mintz GS. Intravascular imaging of coronary calcification and its clinical implications. JACC Cardiovasc Imaging. 2015;8:461-471.
36. Zhang M, Matsumura M, Usui E, et al. Intravascular Ultrasound-Derived Calcium Score to Predict Stent Expansion in Severely Calcified Lesions. Circ Cardiovasc Interv. 2021;14:e010296.
37. Fujino A, Mintz GS, Matsumura M, et al. A new optical coherence tomography-based calcium scoring system to predict stent underexpansion. EuroIntervention. 2018;13:e2182-e2189.
38. Ali Z, Price M, Maehara A, Lansky A. New Insights on the Consistency of Coronary IVL Data. Proceedings of Transcatheter Cardiovascular Therapeutics; 2021 05/11/2021. Disponible en: https://tct2021.crfconnect.com/ondemand/world-connect/86455. Consultado 12 Dic 2021.
39. Matsukawa R, Kozai T, Tokutome M, et al. Plaque modification using a cutting balloon is more effective for stenting of heavily calcified lesion than other scoring balloons. Cardiovasc Interv Ther. 2019;34:325-334.
40. Abdel-Wahab M, Toelg R, Byrne RA, et al. High-Speed Rotational Atherectomy Versus Modified Balloons Prior to Drug-Eluting Stent Implantation in Severely Calcified Coronary Lesions. Circ Cardiovasc Interv. 2018;11:e007415.
41. Tang Z, Bai J, Su SP, et al. Aggressive plaque modification with rotational atherectomy and cutting balloon for optimal stent expansion in calcified lesions. J Geriatr Cardiol. 2016;13:984-991.
42. Amemiya K, Yamamoto MH, Maehara A, et al. Effect of cutting balloon after rotational atherectomy in severely calcified coronary artery lesions as assessed by optical coherence tomography. Catheter Cardiovasc Interv. 2019;94:936-944.
43. Secco GG, Buettner A, Parisi R, et al. Clinical Experience with Very High-Pressure Dilatation for Resistant Coronary Lesions. Cardiovasc Revasc Med. 2019;20:1083-1087.
44. Rheude T, Rai H, Richardt G, et al. Super high-pressure balloon versus scoring balloon to prepare severely calcified coronary lesions: the ISAR-CALC randomised trial. EuroIntervention. 2021;17:481-488.
45. Kereiakes DJ, Virmani R, Hokama JY, et al. Principles of Intravascular Lithotripsy for Calcific Plaque Modification. JACC Cardiovasc Interv. 2021;14:1275-1292.
46. Kereiakes DJ, Di Mario C, Riley RF, et al. Intravascular Lithotripsy for Treatment of Calcified Coronary Lesions: Patient-Level Pooled Analysis of the Disrupt CAD Studies. JACC Cardiovasc Interv. 2021;14:1337-1348.
47. Blachutzik F, Honton B, Escaned J, et al. Safety and effectiveness of coronary intravascular lithotripsy in eccentric calcified coronary lesions: a patient-level pooled analysis from the Disrupt CAD I and CAD II Studies. Clin Res Cardiol. 2021;110:228-236.
48. Salazar C, Escaned J, Tirado G, Gonzalo N. Intravascular lithotripsy for recurrent restenosis caused by severe calcific neoatherosclerosis. EuroIntervention. 2020;16:e351-e352.
49. Salazar C, Escaned J, Tirado G, Gonzalo N. Undilatable Calcific Coronary Stenosis Causing Stent Underexpansion and Late Stent Thrombosis: A Complex Scenario Successfully Managed With Intravascular Lithotripsy. JACC Cardiovasc Interv. 2019;12:1510-1512.
50. Yeoh J, Cottens D, Cosgrove C, et al. Management of stent underexpansion using intravascular lithotripsy-Defining the utility of a novel device. Catheter Cardiovasc Interv. 2021;97:22-29.
51. Ali ZA, McEntegart M, Hill JM, Spratt JC. Intravascular lithotripsy for treatment of stent underexpansion secondary to severe coronary calcification. Eur Heart J. 2020;41:485-486.
52. Abdel-Wahab M, Richardt G, Joachim Buttner H, et al. High-speed rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions: the randomized ROTAXUS (Rotational Atherectomy Prior to Taxus Stent Treatment for Complex Native Coronary Artery Disease) trial. JACC Cardiovasc Interv. 2013;6:10-19.
53. de Waha S, Allali A, Buttner HJ, et al. Rotational atherectomy before paclitaxel-eluting stent implantation in complex calcified coronary lesions: Two-year clinical outcome of the randomized ROTAXUS trial. Catheter Cardiovasc Interv. 2016;87:691-700.
54. Hemetsberger R, Gori T, Toelg R, et al. Optical Coherence Tomography Assessment in Patients Treated With Rotational Atherectomy Versus Modified Balloons: PREPARE-CALC OCT. Circ Cardiovasc Interv. 2021;14:e009819.
55. Kaur N, Pruthvi CR, Sharma Y, Gupta H. Rotatripsy: synergistic effects of complementary technologies: a case report. Eur Heart J Case Rep. 2021;5:ytab083.
56. Gonzálvez-García A, Jiménez-Valero S, Galeote G, et al. “RotaTripsy: Combination of rotational atherectomy and intravascular lithotripsy in heavily calcified coronary lesions: A case series”. Cardiovasc Revasc Med. 2022;35:179-184.
57. Parikh K, Chandra P, Choksi N, Khanna P, Chambers J. Safety and feasibility of orbital atherectomy for the treatment of calcified coronary lesions: the ORBIT I trial. Catheter Cardiovasc Interv. 2013;81:1134-1139.
58. Chambers JW, Feldman RL, Himmelstein SI, et al. Pivotal trial to evaluate the safety and efficacy of the orbital atherectomy system in treating de novo, severely calcified coronary lesions (ORBIT II). JACC Cardiovasc Interv. 2014;7:510-518.
59. Lee M, Genereux P, Shlofmitz R, et al. Orbital atherectomy for treating de novo, severely calcified coronary lesions: 3-year results of the pivotal ORBIT II trial. Cardiovasc Revasc Med. 2017;18:261-264.
60. Redfors B, Sharma SK, Saito S, et al. Novel Micro Crown Orbital Atherectomy for Severe Lesion Calcification: Coronary Orbital Atherectomy System Study (COAST). Circ Cardiovasc Interv. 2020;13:e008993.
61. Kini AS, Vengrenyuk Y, Pena J, et al. Optical coherence tomography assessment of the mechanistic effects of rotational and orbital atherectomy in severely calcified coronary lesions. Catheter Cardiovasc Interv. 2015;86:1024-1032.
62. Goel S, Pasam RT, Chava S, et al. Orbital atherectomy versus rotational atherectomy: A systematic review and meta-analysis. Int J Cardiol. 2020;303:16-21.
63. Bilodeau L, Fretz EB, Taeymans Y, et al. Novel use of a high-energy excimer laser catheter for calcified and complex coronary artery lesions. Catheter Cardiovasc Interv. 2004;62:155-161.
64. Ojeda S, Azzalini L, Suarez de Lezo J, et al. Excimer laser coronary atherectomy for uncrossable coronary lesions. A multicenter registry. Catheter Cardiovasc Interv. 2021;98:1241-1249.
65. Lee T, Shlofmitz RA, Song L, et al. The effectiveness of excimer laser angioplasty to treat coronary in-stent restenosis with peri-stent calcium as assessed by optical coherence tomography. EuroIntervention. 2019;15:e279-e288.
* Autor para correspondencia:
Correo electrónico: nieves_gonzalo@yahoo.es (N. Gonzalo).