RESUMEN
Introducción y objetivos: El uso de balón farmacoactivo (BFA) es una estrategia efectiva en el tratamiento de la reestenosis de stents coronarios (RIS). La modificación neointimal con balón de corte (BC) o incisión junto con BFA se asocia a mejores resultados angiográficos, aunque sin impacto en eventos clínicos a medio plazo. Los resultados clínicos de esta estrategia a muy largo plazo en la vida real son desconocidos. Se evaluó la eficacia de BC junto con BFA frente a BFA estándar en un registro de pacientes de la vida real con RIS a muy largo plazo (5 años).
Métodos: Registro retrospectivo de 2 cohortes de pacientes con RIS tratados con BFA, definidas por el uso de BC. El evento primario fue la tasa de revascularización clínicamente indicada de la lesión tratada a 5 años. Se valoraron eventos secundarios según los criterios ARC-2.
Resultados: Entre enero de 2010 y diciembre de 2015 se usó BFA en 107 RIS en 91 pacientes. En 51 lesiones (46 pacientes) se utilizó BC. Ambas cohortes presentaron similares características clínicas y de procedimiento. Respecto al uso estándar de BFA, el BC consiguió una reducción numérica, pero no significativa, en la tasa de revascularización de la lesión tratada a 5 años (9,8% frente a 23,6%; odds ratio = 0,36; intervalo de confianza del 95%, 0,19-1,09; p = 0,05). El análisis de incidencia acumulada de Kaplan-Meier mostró resultados parecidos (log-rank, p = 0,05), con similar tasa de eventos a 1 año (3,9% frente a 7,1%; p = 0,68), y separación de las curvas con el tiempo. No se evidenciaron diferencias en los eventos secundarios. No hubo trombosis de stent en la cohorte.
Conclusiones: En una cohorte de la vida real, la modificación neointimal de la RIS con BC junto con BFA, en comparación con BFA estándar, logra una reducción numérica, pero no significativa, en la tasa de revascularización de la lesión tratada a 5 años. El beneficio de esta estrategia se evidencia a largo plazo y es consistente entre RIS de stent convencional y de stent farmacoactivo.
Palabras clave: Balon farmacoactivo. Reestenosis. Balon de corte.
Abstract
Introduction and objectives: Drug-eluting balloon (DEB) angioplasty is an effective technique to treat in-stent restenosis (ISR). Neointimal modification with cutting balloon (CB) or scoring balloon (SB) enhances the angiographic results of DEB, but with no benefits have been reported in the clinical endpoints at the mid-term. There is lack of information on the clinical long-term results of this strategy. We aim to compare very long-term results of CB before DEB vs standard DEB to treat real-world patients with ISR.
Methods: Retrospective cohort registry of DEB PCIs to treat ISR defined by the use of CB. The primary endpoint was clinically driven target lesion revascularization (TLR) at 5 years. The secondary endpoints were based on the ARC-2 criteria.
Results: From January 2010 to December 2015, 107 ISRs were treated with DEB in 91 patients. CBs were used in 51 lesions (46 patients). Both cohorts were well balanced regarding clinical, lesion, and procedural characteristics. Compared to standard DEBs, CBs showed lower, although statistically non-significant rates, of TLR at 5 years (9.8% vs 23.6%, OR, 0.36; 95% confidence interval 0.19 to 1.09 P = .05). The Kaplan-Meier cumulative incidence of time until TLR showed similar results (log-rank test P value = .05) with similar rates of TLR at 1 year (3.9% vs 7.1%, P = .68) as curve separation in the long-term. There were no differences in the secondary endpoints. No stent thrombosis was reported.
Conclusions: In a real-world setting, neointimal modification with CB before DEB vs standard DEB to treat ISR shows lower, although statistically non-significant rates of TLR at 5 years. This benefit has been confirmed in the long-term and is consistent with bare-metal and drug-eluting stents.
Keywords: Drug-eluting balloon. In-stent restenosis. Cutting/scoring balloon.
INTRODUCCIÓN
La reestenosis en el interior de un stent coronario (RIS) es un problema en la práctica clínica habitual del intervencionismo coronario percutáneo (ICP), y su tratamiento se asocia a tasas elevadas de necesidad de revascularización de la lesión tratada (RLT)1. Junto al implante de un nuevo stent farmacoactivo de everolimus, el ICP con balón farmacoactivo (BFA) es una estrategia de elección en el tratamiento de la RIS de stents convencionales metálicos (SM) y farmacoactivos (SFA), con indicación de clase I tras demostrar que reduce la tasa de RLT en el seguimiento sin necesidad de implantar una nueva capa de metal en la arteria2-5. Pese a ello, la RLT a largo plazo sigue teniendo una tasa elevada (hasta un 20% a 3 años)6-11 y es necesario buscar estrategias que puedan mejorar estos resultados.
Los balones de corte (BC) o incisión incorporan pequeñas cuchillas o bandas de nitinol en su superficie que permiten optimizar la predilatación de lesiones coronarias al realizar fracturas controladas en la placa de ateroma. Frente al ICP con balón convencional, su uso en la RIS se asocia a modificaciones estructurales de la neoíntima y mejoría aguda del área luminal12, aunque sin beneficio angiográfico ni clínico a medio plazo13,14.
La eficacia del BFA depende de la transferencia del fármaco desde la superficie del balón al tejido, donde deberá ejercer su efecto antiproliferativo15. Teóricamente, la transferencia será más efectiva cuanto mayor sea la desestructuración y menor sea el grosor del tejido, y en estudios preclínicos se ha sugerido un mayor efecto del BFA valorado como inhibición del crecimiento neointimal16. Estas mayores desestructuración y reducción de la neoíntima podrían conseguirse con el uso de BC previo al BFA.
Aunque esta hipótesis no se ha podido confirmar en modelos animales a corto plazo17, la estrategia ha demostrado a medio plazo (6-8 meses) mejores resultados angiográficos (reducción significativa de reestenosis binaria), aunque sin efecto en la RLT ni en los eventos clínicos a 1 año18. No existen resultados publicados de esta estrategia a largo plazo.
Nuestro objetivo fue valorar los resultados del uso de BC junto con BFA en el tratamiento de RIS a muy largo plazo.
MÉTODOS
Registro retrospectivo de cohortes formadas por pacientes de la vida real con al menos 1 RIS tratada con BFA en un solo centro de alto volumen de ICP (> 800/año) y seguimiento de al menos 5 años. Se definieron 2 cohortes en función del uso de BC previo al ICP con BFA (BFA_C) o de BFA estándar (BFA_S). La cohorte BFA_C se definió por el uso de al menos 1 balón de corte (Flextome Cutting Balloon, Boston Scientific, Estados Unidos) o de incisión (ScoreFlex, OrbusNeich, China). El uso de BC fue a discreción del operador. Se definió la RIS como una estenosis angiográfica > 50% en 2 proyecciones radiológicas ortogonales dentro del stent o < 5 mm de sus bordes, junto con síntomas de angina o demostración objetiva de isquemia miocárdica o de reserva de flujo coronario/reserva de flujo instantánea positivo. Las lesiones se trataron con 2 tipos de balones farmacoactivos, en función de la disponibilidad: SeQuent Please (B. Braun Surgical, Alemania) o Pantera Lux (Biotronik, Suiza). Los datos sobre la evolución a largo plazo de los pacientes con RIS tratados con BFA SeQuent Please en esta cohorte, independientemente del uso de BC, fueron comunicados previamente19.
Los criterios de exclusión fueron shock cardiogénico o parada cardiaca en el evento índice, presencia de ≥ 3 capas de metal en la lesión con RIS y contraindicación para doble antiagregación con ácido acetilsalicílico y un inhibidor de P2Y12 durante al menos 1 mes.
Las características clínicas y del procedimiento se obtuvieron de las bases de datos del centro y del laboratorio de cateterismo cardiaco. Se realizó un análisis coronario de las lesiones con el sistema Xcelera (Philips, Países Bajos) usando la proyección con mayor grado de estenosis. Se utilizó la clasificación de reestenosis de Mehran para categorizar las lesiones20. La estrategia del procedimiento, incluyendo el uso y el tipo de BC, fue libre a criterio del operador. La dilatación con BFA se realizó durante al menos 60 segundos, como mínimo a presión nominal. El ICP, el manejo y el tratamiento previo y posterior de los pacientes se realizaron según la práctica clínica habitual.
El estudio se llevó a cabo cumpliendo los criterios de la Declaración de Helsinki y las normas de buena práctica clínica (International Council on Harmonisation Good Clinical Practice), y fue autorizado por el comité ético y la dirección del Hospital Clínico Lozano Blesa, de Zaragoza. Dado el carácter retrospectivo del estudio, no se solicitó consentimiento informado. Se estableció un periodo de seguimiento de 5 años. Todos los seguimientos se realizaron mediante consulta de la base de datos electrónica del sistema sanitario regional, en la que se detallan de manera exhaustiva todos los eventos clínicos del paciente. Los datos se anonimizaron utilizando la identificación numérica interna del laboratorio de ICP.
Todos los eventos se definieron de forma estandarizada según el consenso ARC-221. El evento primario fue la necesidad de RLT con BFA clínicamente indicada a 5 años, y se calculó sobre el cómputo total de lesiones tratadas. Se definió una RLT clínicamente indicada como una nueva RIS de la lesión tratada > 70% o > 50% en presencia de síntomas de isquemia, test de inducción de isquemia positivo dependiente del vaso o reserva de flujo coronario ≤ 0,80 o reserva de flujo instantánea ≤ 0,89.
Los eventos secundarios fueron cualquier revascularización del vaso tratado o no, infarto agudo de miocardio del vaso tratado o no (según definición universal22), muerte por cualquier causa, muerte por causa cardiaca (infarto agudo de miocardio, arritmia grave, insuficiencia cardiaca, muerte no presenciada o por causa desconocida) o muerte por causa cardiovascular (cardiaca, ictus u otros procesos cardiovasculares), hemorragia ≥ 3 según el Bleeding Academic Research Consortium, ictus (nuevo déficit neurológico de > 24 h de duración) o los eventos combinados de fracaso de la lesión tratada (RLT + infarto agudo de miocardio del vaso tratado + muerte cardiovascular), fracaso del vaso tratado (revascularización del vaso tratado + infarto agudo de miocardio del vaso tratado + muerte cardiovascular) o evento compuesto orientado al paciente (cualquier revascularización + infarto agudo de miocardio + ictus + muerte total), y se calcularon sobre el cómputo total de pacientes. La trombosis de stent definitiva o probable también se definió según los criterios ARC-2, y se calculó sobre el cómputo total de lesiones.
Los datos se compilaron y analizaron con el programa SPSS 19.0 (IBM, Estados Unidos). Las variables cuantitativas se expresaron como media y desviación estándar. Las variables cualitativas se expresaron como porcentaje relativo. Se calculó la incidencia acumulada de los eventos a lo largo del seguimiento. Se compararon las variables y los eventos de los grupos de estudio mediante análisis bivariado con la prueba de χ² (o test exacto de Fisher si procedía) o con la prueba t de Student para las variables cuantitativas. Se realizó regresión de Cox para la estimación de predictores del evento primario (incluyendo variables asociadas con valor estadístico p < 0,1). Se realizó un análisis de la supervivencia con el método de Kaplan-Meier para construir la curva de incidencia acumulada en el tiempo del evento primario en función de la estrategia de tratamiento. La significación estadística se estableció en p < 0,05.
RESULTADOS
Entre enero de 2010 y diciembre de 2015 se trataron con BFA 107 RIS en 95 procedimientos realizados a 91 pacientes (en 4 pacientes se repitió el ICP con BFA durante el seguimiento, en 1 caso usando un BFA diferente sobre la misma lesión ya tratada). En 51 lesiones (42 pacientes) se realizó ICP con BC + BFA (BFA_C) y en 56 lesiones (49 pacientes) con BFA estándar (BFA_S). Cincuenta y tres lesiones fueron tratadas con SeQuent Please y 54 con Pantera Lux. El balón de corte y el balón de incisión se usaron en 36 y 15 lesiones, respectivamente.
Las cohortes del estudio eran similares en cuanto a las características clínicas (tabla 1) y de las lesiones, y al procedimiento (tabla 2). Como diferencias observadas, en el grupo BFA_C el acceso radial fue más frecuente y el tamaño del stent y el diámetro luminal mínimo fueron algo mayores, aunque con similares porcentajes de estenosis de la lesión tanto antes como después del ICP. Los pacientes presentaban una alta prevalencia de factores de riesgo cardiovascular, incluyendo diabetes en el 35% de casos. Durante el seguimiento se realizaron 47 nuevas coronariografías, y en 29 de ellas la lesión tratada presentaba un buen resultado. El porcentaje de nueva coronariografía fue similar en ambos grupos (44,6% frente a 41,2% en el grupo BFA_C; p = 0,71). Se produjeron 18 RLT a lo largo del seguimiento (16,8%), de las cuales 17 se trataron con ICP (16 stent-in-stent) y 1 con cirugía coronaria. La tasa de RLT fue menor en el grupo BFA_C a 1 año (3,9% frente a 7,1%; p = 0,68) y a 3 años (9,8% frente a 17,9%; p = 0,23). En comparación con el BFA_S, la estrategia de BFA_C consiguió una reducción, no significativa, en la tasa de RLT a 5 años (9,8% frente a 23,2%; odds ratio [OR] = 0,36; intervalo de confianza del 95% [IC95%], 0,19-1,09; p = 0,05). El análisis de Kaplan-Meier de la curva de incidencia acumulada mostró las diferencias observadas a los 5 años (log-rank, p = 0,05), con similar tasa de eventos a 1 año y separación de las curvas conforme avanzaba el tiempo de seguimiento (figura 1).
Tabla 1. Características basales de los pacientes
| BFA_S | BFA_C | p | |
|---|---|---|---|
| n = 49 pacientes/ 56 lesiones | n = 42 pacientes/ 51 lesiones | ||
| Edad | 68,9 ± 11,3 | 67,7 ± 10 | 0,58 |
| Varón | 85,7% (35) | 83,3% (35) | 0,75 |
| Hipertensión arterial | 26,8% (14) | 23,8% (10) | 0,6 |
| Dislipemia | 46,9% (23) | 28,6% (12) | 0,07 |
| Tabaquismo | 61,2% (30) | 57,1% (24) | 0,69 |
| Diabetes | 37,5% (21) | 35,3% (18) | 0,81 |
| FA en anticoagulantes orales | 22,4% (11) | 19% (8) | 0,38 |
| Infarto de miocardio previo | 55,1% (27) | 50% (21) | 0,62 |
| Cirugía coronaria previa | 6,1% (3) | 4,8% (2) | 1 |
| IRC (FG < 60 ml/min) | 32,7% (16) | 33,3% (14) | 0,94 |
| FEVI (%) | 54 ± 10 | 55 ± 9 | 0,51 |
FA: fibrilación auricular; FEVI: fracción de eyección del ventrículo izquierdo; FG: filtrado glomerular; IRC: insuficiencia renal crónica. | |||
Tabla 2. Características del procedimiento y de las lesiones
| BFA_S | BFA_C | p | BFA_S | BFA_C | p | ||||
|---|---|---|---|---|---|---|---|---|---|
| n = 49 pacientes/ 56 lesiones | n = 42 pacientes/ 51 lesiones | n = 49 pacientes/ 56 lesiones | n = 42 pacientes/ 51 lesiones | ||||||
| Presentación clínica | 0,87 | Localización RIS | 0.35 | ||||||
| Angina estable | 55,4% (31) | 56,9% (29) | DA | 53,6% (30) | 45,1% (23) | ||||
| Angina inestable/SCASEST | 41,1%(23) | 41,2% (21) | CX | 23,2%(13) | 15,7%(8) | ||||
| SCACEST | 3,6% (2) | 2% (1) | CD | 16,1%(9) | 31,4%(16) | ||||
| Acceso radial | 55,4% (31) | 78,4% (40) | 0,01 | TCI | 5,4%(3) | 3,9%(2) | |||
| BFA calibre (mm) | 3,03 ± 0,37 | 3,15 ± 0,42 | 0,13 | Injerto aortocoronario | 1,8% (1) | 3,9% (2) | |||
| BFA longitud (mm) | 20,2 ± 5,8 | 19,5 ± 4,7 | 0,53 | Patrón Mehran RIS | 0,42 | ||||
| BFA presión de inflado (atm) | 14 ± 3 | 14 ± 3 | 0,81 | IA | 1,8% (1) | 3,9% (2) | |||
| BC calibre (mm) | N/A | 2,93 ± 0,45 | IB | 3,6% (2) | 0% (0) | ||||
| BC longitud (mm) | N/A | 8 ± 3 | IC | 41,1% (23) | 49% (25) | ||||
| BC presión de inflado (atm) | N/A | 14 ± 3 | ID | 1,8% (1) | 3,9% (2) | ||||
| NC balón | 53,6% (30) | 70,6% (36) | 0,07 | II | 21,4% (12) | 27,5% (14) | |||
| NC balón calibre (mm) | 3,12 ± 0,42 | 3,28 ± 0,43 | 0,14 | III | 21,4% (12) | 11,8% (6) | |||
| NC balón longitud (mm) | 13,2 ± 3,1 | 12,6 ± 3,8 | 0,65 | IV | 8,9% (5) | 3,9% (2) | |||
| NC balón presión de inflado (atm) | 18 ± 4 | 18 ± 3 | 0,74 | Tipo stent RIS | 0,4 | ||||
| Imagen intracoronaria | 8,9% (5) | 5,9% (3) | 0,55 | SM | 53,6% (30) | 37,3% (19) | |||
| Enfermedad multivaso | 62,7% (32) | 47,7% (21) | 0,14 | SFA | 33,9% (19) | 45,1% (23) | |||
| Revascularización completa | 82,4% (42) | 93,2% (41) | 0,13 | SFA en SM | 8,9% (5) | 11,8% (6) | |||
| Inhibidor P2Y12 | 0,64 | SFA en SFA | 3,6% (2) | 5,9% (3) | |||||
| Clopidogrel | 88,2% (45) | 81,6% (36) | Tiempo desde el implante | 4,1 ± 4,8 | 3,8 ± 5 | 0,69 | |||
| Prasugrel | 3,9% (2) | 4,5% (2) | Bifurcación | 32,1% (18) | 23,5% (12) | 0,32 | |||
| Ticagrelor | 7,8% (4) | 13,6% (6) | Calibre stent (mm) | 2,96 ± 0,43 | 3,1 ± 0,56 | 0,02 | |||
| Duración doble antiagregación | 0,27 | Longitud del stent (mm) | 22,4 ± 6,5 | 22,8 ± 7,1 | 0,75 | ||||
| 1 mes | 3,9% (2) | 2,3% (1) | Diámetro de referencia (mm) | 2,98 ± 0,48 | 3,12 ± 0,53 | 0,16 | |||
| 3 meses | 21,6% (11) | 9,1% (4) | Diámetro luminal mínimo (mm) | 0,73 ± 0,51 | 0,68 ± 0,5 | 0,67 | |||
| 6 meses | 21,6% (11) | 34,1% (15) | Longitud (mm) | 13,2 ± 5,6 | 11,7 ± 5,3 | 0,18 | |||
| 12 meses | 52,9% (27) | 54,5% (24) | Estenosis (%) | 72 ± 18 | 75 ± 16 | 0,3 | |||
| Diámetro luminal mínimo tras ICP (mm) | 2,43 ± 0,46 | 2,77 ± 0,62 | 0,002 | ||||||
| Ganancia luminal aguda (mm) | 1,7 ± 0,64 | 2,08 ± 0,83 | 0,01 | ||||||
| Estenosis tras ICP (%) | 14 ± 5 | 14 ± 6 | 0,45 | ||||||
| Flujo final TIMI3 | 98,2% (55) | 100% (51) | 1 | ||||||
BC: balón de corte; BFA: balón farmacoactivo; CD: arteria coronaria derecha; Cx: arteria circunfleja; DA: arteria descendente anterior; ICP: intervencionismo coronario percutáneo; RIS: reestenosis en el interior del stent; SCACEST: síndrome coronario agudo con elevación del segmento ST; SCASEST: síndrome coronario agudo sin elevación del segmento ST; SFA: stent farmacoactivo; SM: stent metálico; TCI: tronco coronario izquierdo; TIMI: Thrombolysis In Myocardial Infarction. | |||||||||
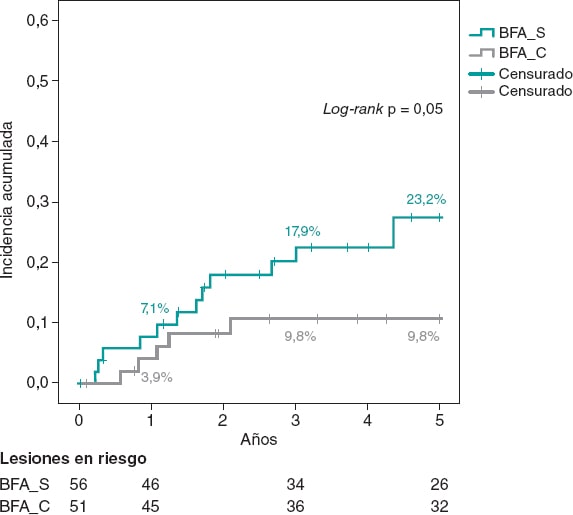
Figura 1. Análisis de Kaplan-Meier de la incidencia acumulada de revascularización de la lesión tratada a 5 años. BFA: balón farmacoactivo.
La incidencia acumulada de eventos secundarios a 5 años se muestra en la tabla 3. La tasa de eventos combinados dependientes del vaso tratado (fracaso en la lesión tratada y fracaso en el vaso tratado) fue menor en el grupo BFA_C, sin alcanzar la significación estadística. No se observaron diferencias en el resto de los eventos secundarios. La mortalidad global durante el seguimiento fue del 31,8% (n = 19), siendo la causa más frecuente las neoplasias (n = 7). Las tasas de ictus y de eventos compuestos orientados al paciente fueron elevadas (10,9% y 51,6%, respectivamente), como era de esperar en una cohorte de edad avanzada y alto riesgo cardiovascular. No hubo casos de trombosis del stent definitiva o probable durante el seguimiento.
Tabla 3. Tasa acumulada de evento primario y eventos secundarios a 5 años
| BFA_S | BFA_C | p | |
|---|---|---|---|
| n = 49 pacientes/ 56 lesiones | n = 42 pacientes/ 51 lesiones | ||
| Evento primario | |||
| RLT (clínicamente justificada) | 23,2% (13/56) | 9,8% (5/51) | 0,05 |
| Eventos secundarios | |||
| Revascularización vaso tratado | 28,6% (16/56) | 17,6% (9/51) | 0,18 |
| Cualquier revascularización | 28,6% (14/49) | 26,2% (11/42) | 0,8 |
| Infarto de miocardio vaso tratado | 7,1% (4/56) | 5,9% (3/51) | 0,79 |
| Infarto de miocardio | 18,3% (9/49) | 7,2% (3/42) | 0,19 |
| Mortalidad de causa cardiaca | 4,1% (2/49) | 4,8% (2/42) | 1 |
| Mortalidad de causa cardiovascular | 16,3% (8/49) | 11,9% (5/42) | 0,54 |
| Mortalidad total | 36,7% (18/49) | 26,2% (11/42) | 0,28 |
| Ictus | 10,2% (5/49) | 11,9% (5/42) | 0,55 |
| Hemorragia 3-5 BARC | 7,1% (4/49) | 3,9% (2/42) | 0,68 |
| Fracaso en lesión tratada | 37,5% (21/56) | 25,5% (13/51) | 0,18 |
| Fracaso en vaso tratado | 41,1% (23/56) | 25,5% (13/51) | 0,08 |
| ECOP | 53,1% (26/49) | 50% (21/42) | 0,77 |
BARC: Bleeding Academic Research Consortium; BFA: balón farmacoactivo; ECOP: evento compuesto orientado al paciente; RLT: revascularización de la lesión tratada. | |||
Un subanálisis de Kaplan-Meier en función de la RIS de SM o de SFA mostró que la estrategia BFA_C reducía a la mitad la RLT a 5 años de manera consistente en ambos tipos de stent, sin alcanzar la significación estadística (figura 2).
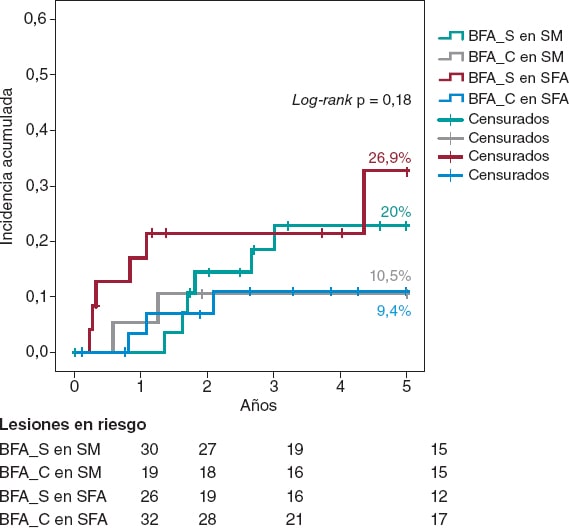
Figura 2. Análisis de Kaplan-Meier de la incidencia acumulada a 5 años de revascularización de la lesión tratada en función de si el stent es metálico o farmacoactivo. BFA: balón farmacoactivo; SFA: stent farmacoactivo; SM: stent metálico.
Además del BFA_C, no se encontró asociación entre ninguna variable y la RLT a 5 años, salvo la localización de la RIS, ya que fue del 100% en los casos localizados en stents de injertos aortocoronarios (3 casos) frente al 14,4% en el árbol coronario nativo (p = 0,003). La RLT a 5 años fue similar en los pacientes diabéticos (17,9% frente a 16,2%; p = 0,81), en la RIS de SFA (17,2% frente a 16,3%; p = 0,9) y en stents < 3 mm (12,9% frente a 18,4%; p = 0,58), y sin diferencias según el BFA (Sequent 20,4% frente a Pantera 13,2%; p = 0,32). En la regresión de Cox, el uso de BFA_C no fue un predictor independiente de RLT a 5 años, siendo la RIS en un injerto aortocoronario el único predictor independiente (OR = 5,4; IC95%, 1,5-19,8; p = 0,01).
DISCUSIÓN
En nuestro conocimiento, el estudio que presentamos es el primero que pone de manifiesto que:
– El uso de BC asociado a BFA en la RIS muestra una tendencia a reducir la tasa de RLT.
– El beneficio de esta estrategia se evidencia a largo plazo.
– El beneficio parece ser consistente en RIS de SM y SFA.
– La estrategia es segura, sin evidenciarse trombosis del stent tratado con BC.
Frente a la angioplastia convencional, el BC en el tratamiento de la RIS consigue una mayor área luminal gracias a la rotura de la continuidad elástica y fibrótica de la neoíntima, reduciendo su integridad y su resistencia12. Sin embargo, esta mejoría angiográfica aguda no se asocia a una reducción de la RLT, con tasas elevadas (18-29%) al año de seguimiento13,14. De manera concordante, el uso de BC en nuestra serie se asocia a un incremento significativo del diámetro luminal mínimo y una ganancia aguda al finalizar el procedimiento (tabla 2), pese a que los calibres de los balones no distensibles y del BFA fueron similares entre ambos grupos. Aunque el diámetro de los stents era ligeramente mayor en el grupo BFA_C, el porcentaje final de estenosis residual no difirió de forma significativa entre ambos grupos; este dato podría tener un peso importante en nuestros resultados, ya que el tamaño del vaso se ha descrito como predictor independiente de nueva reestenosis23.
El uso de BFA en el tratamiento de las RIS es frecuente tras la publicación de varios metanálisis que apuntaron que dicha estrategia, junto con la de implante de SFA con everolimus in-stent, eran las más efectivas para evitar nuevas revascularizaciones2-4. Posteriormente, Alfonso et al.8,9,24 demostraron, en los estudios RIBS IV (con SFA) y RIBS V (con SM), la superioridad a largo plazo del implante de SFA con everolimus in-stent. Sin embargo, la filosofía de no añadir una nueva capa de metal (o diferirla en el tiempo) y las cuestiones relacionadas con su seguridad a largo plazo10,11 hacen que el uso de BFA siga siendo frecuente en la RIS. Además de los estudios RIBS IV y V, otros estudios comunicaron datos sobre la efectividad del BFA a largo plazo (PEPCAD7 con SM y PEPCAD-DES6 e ISAR-DESIRE 310 con SFA). En total, en estos 5 trabajos se comunicaron 94 RLT en 524 RIS tratadas con BFA, lo que supondría una RLT a 3 años del 17,9%. Estos resultados se reproducen en nuestra cohorte BFA_S, y son unas tasas los suficientemente elevadas como para justificar la búsqueda de estrategias que mejoren la eficacia del BFA.
La eficacia del BFA se basa en la transferencia del fármaco a la neoíntima de la RIS, donde ejerce su efecto antiproliferativo. La adecuada preparación de la lesión, reduciendo el grosor de la neoíntima e incrementando la superficie de contacto con el balón, es clave para el éxito del BFA15. Los estudios preclínicos han sugerido que una mayor desestructuración de la neoíntima podría incrementar la liberación y la retención del fármaco en el tejido, y aumentar así su efecto16. Considerando la mayor ganancia luminal aguda y la desestructuración controlada que aporta el BC, su uso junto con un BFA podría mejorar los resultados. Esta hipótesis fue contrastada en un estudio preclínico, sin que se pudiera demostrar, ya que el uso de BC no se asoció con menor volumen neointimal o pérdida luminal tardía, si bien la evaluación se realizó de manera muy precoz (28 días)17.
El efecto sinérgico del BC con el BFA también fue valorado desde otro punto de vista por Scheller et al.25 en el estudio PATENT-C, en el cual se evaluó la adición de un fármaco antiproliferativo (paclitaxel) al balón de incisión, lo que redujo de forma drástica la RLT a 1 año (3% frente a 32%; p = 0,004). Este dato concuerda con la RLT a 1 año del 3,9% en nuestra cohorte BFA_C. De forma más novedosa, también con la filosofía de no dejar material a largo plazo tras el ICP, Alfonso et al.26 en el estudio RIBS VI Scoring analizaron el impacto del BC previo a un implante de armazón bioabsorbible en el tratamiento de la RIS, sin conseguir reducir la RLT al año de seguimiento (9,8% frente a 11,1%).
Dos ensayos clínicos aleatorizados han evaluado el efecto del BC previo al BFA en la RIS. Aoki et al.27 no encontraron diferencias angiográficas con seguimiento a 8 meses en el estudio ELEGANT, aunque este fue un estudio comparativo frente a balón no distensible. Kufner et al.18 evaluaron específicamente el efecto del BC en el estudio ISAR-DESIRE 4. El evento primario fue un resultado angiográfico en el que se evidencia que esta estrategia reducía significativamente la RIS binaria a los 6-8 meses de seguimiento. Sin embargo, no hubo diferencias en la evaluación de eventos clínicos o RLT a 1 año (16,2% frente a 21,8%; p = 0,26). Cualitativamente, estos resultados coinciden con lo apreciado en nuestra serie, pues aunque describimos un beneficio a largo plazo, a 1 año de seguimiento la tasa de RLT no difiere entre nuestros grupos. No existen datos a largo plazo con los que comparar nuestra cohorte para corroborar el beneficio que describimos. Cuantitativamente, sí se observan diferencias en las tasas de RLT a 1 año, mucho menores en nuestro trabajo (3,9% frente a 7,1%). Esto podría explicarse por 3 causas. Primero, por la evaluación angiográfica programada en el ISAR-DESIRE 4, ya que si observamos el análisis de Kaplan-Meier sobre la RLT en ese estudio apreciamos que existe un llamativo incremento de eventos a los 6-8 meses (momento de la evaluación angiográfica), poniendo de manifiesto una RLT guiada por criterios angiográficos (sugestivo de reflejo «oculodilatador») y no clínicamente justificada como en nuestra serie. Segundo, por el uso exclusivo de balón de incisión frente al uso predominante de BC en nuestra serie, pues el BC podría lograr una mayor desestructuración de la neoíntima y mayores diámetros luminales residuales, incrementando la eficacia del BFA. Tercero, por el tratamiento exclusivo de RIS en SFA frente a RIS en cualquier tipo de stent (SM o SFA) de nuestra serie, ya que diversos autores han sugerido una menor eficacia del BFA en la RIS de SFA11,28. A partir de este conocimiento previo realizamos un subanálisis de la estrategia BFA_C en función de tipo de stent (figura 2), y observamos una eficacia consistente tanto en SM como en SFA, con similar RLT a 5 años en ambos subgrupos (10,5% y 9,4% respectivamente).
El tratamiento de la RIS con BFA es una estrategia segura que se asocia a tasas muy bajas de trombosis del stent (en torno al 1%) en el seguimiento a largo plazo11. Se desconoce el papel de una mayor desestructuración tisular de la neoíntima por el BC en la aparición de fenómenos trombóticos sobre la lesión. Al igual que se describe en el estudio ISAR-DESIRE 4 a medio plazo, en nuestra serie la trombosis de la lesión tratada es nula a largo plazo, por lo que podemos asegurar que el uso de BFA_C es seguro.
Limitaciones
Nuestro estudio presenta diversas limitaciones. Se trata de un estudio retrospectivo, observacional y unicéntrico. Si bien el uso de BFA es de elección en el tratamiento de la RIS en nuestro centro, es posible que los pacientes con RIS más desfavorables hayan sido excluidos por tratarse con SFA. El uso de imagen intracoronaria fue limitado, y la caracterización de la RIS podría haber aportado datos relevantes respecto a la estrategia de tratamiento y su resultado a largo plazo. El tamaño muestral es limitado para obtener una evidencia potente. La ampliación del tamaño muestral y del seguimiento está garantizada.
CONCLUSIONES
En una cohorte de la vida real, la modificación neointimal de una RIS con BC junto con BFA frente al BFA estándar consigue una reducción, aunque no significativa, en la tasa de RLT a 5 años. El beneficio de esta estrategia se evidencia a largo plazo y es consistente entre RIS de SM y RIS de SFA.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
J.A. Linares Vicente: diseño del estudio, aportación y recolección de datos, análisis y redacción del manuscrito. J.R. Ruiz Arroyo: aportación de datos y revisión crítica del manuscrito. A. Lukic, B. Simó Sánchez y O. Jiménez Meló: aportación de datos. A. Riaño Ondiviela, P. Morlanes Gracia y P. Revilla Martí: recolección de datos.
CONFLICTO DE INTERESES
Ninguno.
¿QUÉ SE SABE DEL TEMA?
- El uso de BC en el tratamiento de la ISR con BFA se ha asociado a mejores resultados angiográficos, aunque sin impacto en los eventos clínicos a medio plazo. Los resultados clínicos de esta estrategia a largo plazo son desconocidos.
¿QUÉ APORTA DE NUEVO?
- El uso de BC junto con BFA en la ISR se asocia a una reducción en la tasa de RLT. El beneficio de la estrategia se produce a largo plazo. El beneficio parece ser consistente en RIS de SM y RIS de SFA.
BIBLIOGRAFÍA
1. Alfonso F, Byrne RA, Rivero F, Kastrati A. Current Treatment of In-Stent Restenosis. J Am Coll Cardiol. 2014;63:2659-2673.
2. Giacoppo D, Gargiulo G, Aruta P, Capranzano P, Tamburino C, Capodanno D. Treatment strategies for coronary in-stent restenosis:systematic review and hierarchical Bayesian network meta-analysis of 24 randomised trials and 4880 patients. BMJ. 2015;351:h5392.
3. Siontis GCM, Stefanini GG, Mavridis D, et al. Percutaneous coronary interventional strategies for treatment of in-stent restenosis:a network meta-analysis. Lancet. 2015;386:655-664.
4. Sethi A, Malhotra G, Singh S, Singh PP, Khosla S. Efficacy of Various Percutaneous Interventions for In-Stent Restenosis. Circ Cardiovasc Interv. 2015;8:e002778.
5. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019;40:87-165.
6. Rittger H, Waliszewski M, Brachmann J, et al. Long-Term Outcomes After Treatment With a Paclitaxel-Coated Balloon Versus Balloon Angioplasty. JACC Cardiovasc Interv. 2015;8:1695-700.
7. Unverdorben M, Vallbracht C, Cremers B, et al. Paclitaxel-coated balloon catheter versus paclitaxel-coated stent for the treatment of coronary in-stent restenosis:the three-year results of the PEPCAD II ISR study. EuroIntervention. 2015;11:926-934.
8. Alfonso F, Pérez-Vizcayno MJ, Cuesta J, et al. 3-Year Clinical Follow-Up of the RIBS IV Clinical Trial. JACC Cardiovasc Interv. 2018;11:981-991.
9. Alfonso F, Pérez-Vizcayno MJ, García del Blanco B, et al. Long-Term Results of Everolimus-Eluting Stents Versus Drug-Eluting Balloons in Patients With Bare-Metal In-Stent Restenosis. JACC Cardiovasc Interv. 2016;9;1246-1255.
10. Kufner S, Cassese S, Valeskini M, et al. Long-Term Efficacy and Safety of Paclitaxel-Eluting Balloon for the Treatment of Drug-Eluting Stent Restenosis. JACC Cardiovasc Interv. 2015;8:877-884.
11. Giacoppo D, Alfonso F, Xu B, et al. Drug-Coated Balloon Angioplasty Versus Drug-Eluting Stent Implantation in Patients With Coronary Stent Restenosis. J Am Coll Cardiol. 2020;75:2664-2678.
12. Ahmed JM, Mintz GS, Castagna M, et al. Intravascular ultrasound assessment of the mechanism of lumen enlargement during cutting balloon angioplasty treatment of in-stent restenosis. Am J Cardiol. 2001;88:1032-1034.
13. Albiero R, Silber S, di Mario C, et al. Cutting balloon versus conventional balloon angioplasty for the treatment of in-stent restenosis. J Am Coll Cardiol. 2004;43:943-949.
14. Park S-J, Kim K-H, Oh I-Y, et al. Comparison of Plain Balloon and Cutting Balloon Angioplasty for the Treatment of Restenosis With Drug-Eluting Stents vs Bare Metal Stents. Circ J. 2010;74:1837-1845.
15. Byrne RA, Joner M, Alfonso F, Kastrati A. Drug-coated balloon therapy in coronary and peripheral artery disease. Nat Rev Cardiol. 2014;11:13-23.
16. Radke P, Joner M, Joost A, et al. Vascular effects of paclitaxel following drug-eluting balloon angioplasty in a porcine coronary model:the importance of excipients. EuroIntervention. 2011;7:730-737.
17. Kong J, Hou J, Ma L, et al. Cutting balloon combined with paclitaxel-eluting balloon for treatment of in-stent restenosis. ArchCardiovasc Dis. 2013;106:79-85.
18. Kufner S, Joner M, Schneider S, et al. Neointimal Modification With Scoring Balloon and Efficacy of Drug-Coated Balloon Therapy in Patients With Restenosis in Drug-Eluting Coronary Stents. JACC Cardiovasc Interv. 2017;10:1332-1340.
19. Linares Vicente JA, Ruiz Arroyo JR, Lukic A, et al. 5 year-effectiveness of paclitaxel drug-eluting balloon for coronary in-stent restenosis in a real-world registry. REC Interv Cardiol. 2019;2:92-98.
20. Mehran R, Dangas G, Abizaid AS, et al. Angiographic Patterns of In-Stent Restenosis. Circulation. 1999;100:1872-1878.
21. Garcia-Garcia HM, McFadden EP, Farb A, et al. Standardized End Point Definitions for Coronary Intervention Trials:The Academic Research Consortium-2 Consensus Document. Circulation. 2018;137:2635-2650.
22. Thygesen K, Alpert JS, Jaffe AS, et al. Fourth Universal Definition of Myocardial Infarction (2018). Circulation. 2018;138:e618-e651.
23. Cassese S, Xu B, Habara S, et al. Incidence and predictors of reCurrent restenosis after drug-coated balloon Angioplasty for Restenosis of a drUg-eluting Stent:The ICARUS Cooperation. Rev Esp Cardiol. 2018;71:620-627.
24. Alfonso F, Pérez-Vizcayno MJ, García del Blanco B, et al. Comparison of the Efficacy of Everolimus-Eluting Stents Versus Drug-Eluting Balloons in Patients With In-Stent Restenosis (from the RIBS IV and V Randomized Clinical Trials). Am J Cardiol. 2016;117:546-554.
25. Scheller B, Fontaine T, Mangner N, et al. A novel drug-coated scoring balloon for the treatment of coronary in-stent restenosis:Results from the multi-center randomized controlled PATENT-C first in human trial. Catheter Cardiovasc Interv. 2016;88:51-59.
26. Alfonso F, Cuesta J, García del Blanco B, et al. Scoring balloon predilation before bioresorbable vascular scaffold implantation in patients with in-stent restenosis:the RIBS VI 'scoring'study. Coron Artery Dis. 2021;32:96-104.
27. Aoki J, Nakazawa G, Ando K, et al. Effect of combination of non-slip element balloon and drug-coating balloon for in-stent restenosis lesions (ELEGANT study). J Cardiol. 2019;74:436-442.
28. Habara S, Kadota K, Shimada T, et al. Late Restenosis After Paclitaxel-Coated Balloon Angioplasty Occurs in Patients With Drug-Eluting Stent Restenosis. J Am Coll Cardiol. 2015;66:14-22.
* Autor para correspondencia: Sección de Cardiología Intervencionista, Servicio de Cardiología, Hospital Clínico Universitario Lozano Blesa, Avda. San Juan Bosco 15, 5009 Zaragoza, España.
Correo electrónico: joselinares1979@hotmail.com (J.A. Linares Vicente).