Resumen
El uso de ácido acetilsalicílico en combinación con un inhibidor del receptor P2Y12, es decir, es decir, la doble terapia antiplaquetaria, representa la piedra angular del tratamiento para los pacientes en los que se implanta un stent coronario. El uso de inhibidores P2Y12 de nueva generación (prasugrel y ticagrelor), caracterizados por efectos antiplaquetarios más potentes y mejores resultados clínicos en comparación con clopidogrel, se recomienda en pacientes de alto riesgo, como aquellos con un síndrome coronario agudo. Sin embargo, este beneficio es a expensas de un aumento del riesgo de sangrado que se acumula con la duración del tratamiento. Dada la adversa repercusión pronóstica, incluido el aumento de la mortalidad, asociada al sangrado, han surgido una serie de estrategias destinadas a reducir el riesgo de este evento adverso a la vez que se preserva la eficacia. Entre estos, retirar el ácido acetilsalicílico representa una línea de investigación clínica. La justificación farmacológica de dicha estrategia se basa en el papel central de la v.a de inhibici.n de P2Y12 en la activación de plaquetas y su contribución a la amplificación de los procesos trombóticos. Por lo tanto, se ha planteado la hipótesis de que, en presencia de un potente bloqueo del receptor P2Y12, el ácido acetilsalicílico puede ofrecer una contribución mínima para la reducción de las complicaciones trombóticas, pero de hecho contribuye al aumento de las complicaciones hemorrágicas. Una serie de ensayos clínicos actualmente en curso cuestionan el dogma del ácido acetilsalicílico como una terapia de base obligatoria en pacientes tratados con stents coronarios.
Palabras clave: Ácido acetilsalicílico. Ticagrelor. Stent. Trombosis
Abstract
The use of aspirin in combination with a P2Y12 receptor inhibitor, also known as dual antiplatelet therapy, is at the cornerstone of treatment for patients undergoing coronary stenting. The use of newer generation P2Y12 inhibitors (ie, prasugrel and ticagrelor), characterized by more potent antiplatelet effects and better clinical outcomes compared to clopidogrel, are recommended in highrisk patients, such as those with an acute coronary syndrome. However, this occurs at the expense of increased bleeding that accumulates with the duration of treatment. Given the poor prognostic implication, including an increased mortality rate associated with bleeding, a number of strategies aimed at reducing the risk of this adverse event while preserving efficacy have emerged. Among these, withdrawing aspirin represents an ongoing line of clinical investigation. The pharmacological reason behind such strategy relies on the central role played by the metabolic pathway of P2Y12 receptor inhibitors on platelet activation and its contribution amplifying thrombotic processes. Thus, it has been hypothesized that in the presence of a powerful P2Y12 receptor blockade, aspirin may offer minimal contribution when it comes to reducing thrombotic complications, but rather contribute to increased bleeding complications. A number of ongoing clinical investigations are currently challenging the dogma of aspirin as a mandatory background therapy in patients undergoing coronary stenting.
Keywords: Aspirin. Ticagrelor. Stent. Thrombosis
Abreviaturas: AAS: ácido acetilsalicílico EC: enfermedad coronaria ICP: intervención coronaria percutánea SCA: síndrome coronario agudo TAPD: tratamiento antiagregante plaquetario doble
El ácido acetilsalicílico (AAS) es la piedra angular del tratamiento de pacientes con manifestaciones clínicas de enfermedad coronaria (EC)1. Sin embargo, el alto índice de episodios isquémicos recurrentes a pesar del tratamiento con AAS ha llevado, inevitablemente, a explorar los efectos asociados al uso de terapias antitrombóticas adyuvantes, sobre todo, en entornos de alto riesgo. Entre estas, el uso adyuvante de inhibidores orales del P2Y12 ha demostrado ser fundamental tanto en pacientes con síndrome coronario agudo (SCA) como en pacientes sometidos a intervenciones coronarias percutáneas (ICP) con implante de stent2. La combinación de AAS e inhibidor del P2Y12, también conocido como tratamiento antiagregante plaquetario doble (TAPD), ha sido el tratamiento estándar por excelencia de pacientes con SCA/ICP y forma parte, desde hace casi dos décadas, de las guías clínicas de uso diario3. Clopidogrel es el inhibidor del P2Y12 más usado. A pesar de su eficacia demostrada, varios estudios han revelado una amplia variabilidad en los perfiles individuales de respuesta al clopidogrel, y son muchos los pacientes que sufren efectos inhibitorios plaquetarios no buscados4. Cabe destacar que varios estudios han confirmado que estos sujetos corren, también mayor riesgo de sufrir episodios isquémicos, sobre todo, trombosis del stent5. Esto ha llevado a desarrollar inhibidores del P2Y12 tales como prasugrel y ticagrelor, que se caracterizan por tener un efecto antiagregante plaquetario más potente y fiable2. Comparados con el clopidogrel, ambos agentes han demostrado ser capaces de reducir, ostensiblemente, las re-currencias isquémicas de pacientes que sufren SCA, incluida trombosis del stent, a costa de un mayor riesgo de sangrado2. En ausencia de contraindicaciones, las guías de práctica clínica abogan por el uso de prasugrel o ticagrelor en detrimento de clopidogrel3.
Aunque se han llevado a cabo pocos estudios comparativos directos a gran escala entre prasugrel y ticagrelor, este último parece tener un perfil de seguridad algo más favorable que el prasugrel en lo que a la posibilidad de provocar hemorragias se refiere2. Estas observaciones pueden atribuirse a los distintos perfiles farmacológicos de estos agentes, ya que el ticagrelor es un inhibidor reversible del receptor P2Y12 y el prasugrel un agente irreversible1. Además, en pacientes con SCA, el ticagrelor se asocia a una menor mortalidad cardiovascular que el clopidogrel, un hallazgo que no se ha observado al comparar prasugrel y clopidogrel1. Estos hallazgos se han atribuido, aunque jamás se ha demostrado una relación causal, a efectos del ticagrelor en lugares distintos de su diana terapéutica (como en la inhibición del transportador de nucleósidos equilibrador tipo 1 [ENT-1], que acarrea niveles más altos de adenosina). En líneas generales, estas observaciones, al igual que otros muchos escenarios clínicos de SCA en los que el ticagrelor ha demostrado ser beneficioso, han fomentado el uso de ticagrelor en detrimento del prasugrel. En cualquier caso, sigue preocupando el riesgo hemorrágico asociado a cursos más largos de TAPD de AAS y ticagrelor7. Hemos de dejar constancia, no obstante, de que la ocurrencia de complicaciones hemorrágicas, incluso durante la fase de mantenimiento de TAPD, acarrea importantes implicaciones pronósticos incluida una mayor mortalidad8. Estas observaciones han generado una serie de investigaciones encaminadas a identificar estrategias asociadas a un menor riesgo hemorrágico sin un efecto negativo en la eficacia. Algunas de estas estrategias son acortar la duración del TAPD, ir reduciendo, paulatinamente, el tratamiento antiagregante plaquetario y retirar el AAS9-12. De hecho, la evolución del diseño de los stents nos ofrece ya plataformas (menos trombogénicas) que han posibilitado investigaciones en este campo10.
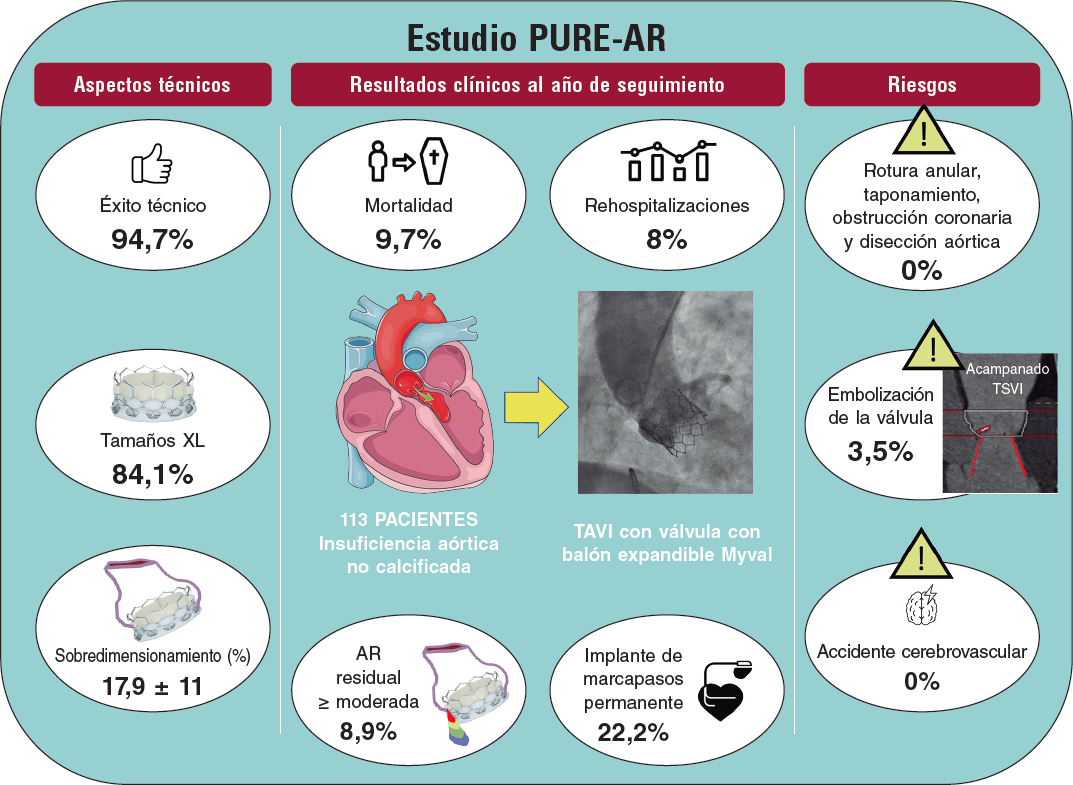
El uso de estrategias sin AAS post-ICP se ha puesto a prueba prospectivamente en ensayos aleatorizados de pacientes con fibrilación auricular sometidos a ICP y que precisan tratamiento anticoagulante13. Estos estudios han demostrado reiteradamente que retirar el AAS cuanto antes y promover un abordaje de tratamiento antitrombótico doble (principalmente clopidrogrel más un anticoagulante oral) reduce notablemente la tasa de hemorragias sin efecto negativo en la eficacia. En consecuencia, una estrategia de tratamiento antitrombótico doble es lo que se recomienda, hoy en día, tras realizar una ICP13,14. La razón de considerar una estrategia sin AAS en pacientes sometidos a ICP que no precisan tratamiento anticoagulante oral se debe, en buena medida, al muy efectivo grado de inhibición del P2Y12 que se alcanza con ticagrelor15. Cabe destacar que la vía de señalización del receptor P2Y12 juega un papel esencial tanto en la activación plaquetaria como en la amplificación de los procesos trombóticos (figura 1)16. Estudios in vitro también han venido a confirmar que el uso de AAS ofrece efectos farmacodinámicos limitados en presencia de un bloqueo efectivo del receptor P2Y12 (figura 2)17. A la luz de la bien establecida asociación que existe entre el AAS y las hemorragias, sobre todo las gastrointestinales, se ha planteado la hipótesis de que suspender el tratamiento con AAS tras la fase de mayor riesgo trombótico (1-3 meses post-ICP) podría reducir el riesgo de complicaciones hemorrágicas sin efecto negativo alguno sobre la eficacia9. También se ha sugerido que, a la luz del impacto nocivo que ejercen las hemorragias sobre los resultados clínicos, una estrategia sin AAS, mejoraría la eficacia18.
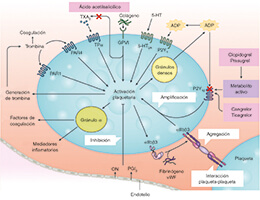
Figura 1. Mecanismos de activación plaquetaria. La activación plaquetaria se inicia mediante agonistas solubles como la trombina, el tromboxano A2 (TXA2), la 5-hidroxitriptamina 5-HT), el adenosín difosfato (ADP [mediante interacción con el receptor purinérgico P2Y12) y el adenosín trifosfato (ATP) y mediante ligandos de adhesión como el colágeno y el factor de von Villebrand (vWF). Como consecuencia, la densa secreción granular de los agonistas plaquetarios y la secreción de TXA2, resultante de la activación de la fosfolipasa A2, amplifican la activación plaquetaria y respuestas asociadas. El receptor purinérgico P2Y12 juega un papel fundamental en la amplificación de la activación plaquetaria, que también se ve apoyado por una señalización de fuera hacia adentro vía integrina αIIbβ3 (el receptor de la glucoproteína IIb/IIIa). De ahí que el bloqueo conjunto de P2Y12 e integrina αIIbβ3 tenga efectos sumativos tanto en la activación plaquetaria como en las respuestas plaquetarias asociadas. 5-HT2A: receptores 5-HT2A; GPVI: glucoproteína plaquetaria IV; ON: óxido nítrico; PAR: receptor activado por proteasas; PGI2: receptor de la prostaciclina; TPα: isoforma α del receptor TXA2. Adaptado de Capodanno et al9. con permiso de Springer Nature Ltd.
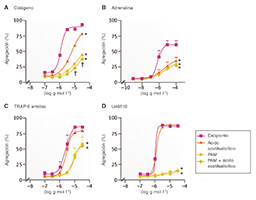
Figura 2. Ante un potente bloqueo del receptor P2Y12, el ácido acetilsalicílico ofrece poca inhibición adicional de la agregación plaqueta- ria. En estos estudios, la agregación plaquetaria se indujo a través de cuatro agonistas plaquetarios distintos: colágeno 0,1–30,0 μg/ml (parte A), adrenalina 0,001–100,0 μmol/l (parte B), antagonista sintético TRAP-6 amida (H-Ser–Phe–Leu–Leu–Arg–Asn–NH2) del receptor activado por la proteasa 1 (PAR1) 0,1–30,0 μmol/l (parte C) y tromboxano A2 miméticó U46619 0,1–30,0 μmol/l en presencia de ácido acetilsalicílico 30,0 μmol/l y/o del metabolito activo de prasugrel (PAM) 3,0 μmol/L (part d). Los datos se expresaron en medias ± desvia- ciones estándar de las respuestas medias calculadas mediante agregometría en microplaca de 96 pocillos en plasma rico en plaquetas obtenido mediante centrifugación de sangre citrada y preparado por cuatro técnicos distintos. *p 0,05 para la diferencia del vehículo mediante análisis de la varianza de dos factores (ANOVA) y prueba post hoc de Bonferroni. †p 0,05 para la diferencia entre PAM y PAM más ácido acetilsalicílico. Los símbolos que aparecen al final de las líneas expresan diferencias en conjuntos o grupos; los que aparecen en puntos determinados expresan diferencias particulares. Adaptado de Capodanno et al9. con permiso de Springer Nature Ltd.
El GLOBAL LEADERS fue un ensayo de superioridad que se llevó a cabo en 15.968 pacientes sometidos a ICP con stents liberadores de biolimus A9 y se diseñó para valorar si un régimen antitrombótico de un mes con AAS y 24 meses con ticagrelor mejoraba el objetivo compuesto de mortalidad por todas las causas o nuevo infarto de miocardio con onda Q frente a un curso convencional, de 12 meses de duración, de TAPD, seguido de monoterapia con AAS19. En cualquier caso, y a pesar de que se observó una cierta tendencia hacia un beneficio de la monoterapia con inhibidores del P2Y12, el ensayo no logró cumplir su objetivo primario (una estrategia experimental del 3,81% frente a una estrategia de referencia del 4,37%; razón de tasas de incidencia 0,87; IC95% 0,75-1,01; p = 0,073). Tampoco se observó diferencia alguna en el objetivo de seguridad de hemorragias tipo 3 o 5 según los criterios establecidos por el Bleeding Academic Research Consortium (BARC). Antes de interpretar el ensayo GLOBAL LEADERS, merece la pena hacer unas cuantas consideraciones. En primer lugar, se trata de uno de los estudios más extensos jamás llevado a cabo sobre ICP con una nueva plataforma de stent farmacoactivo y aunque no cumplió su objetivo primario, no hubo ninguna señal de alerta asociada a una retirada precoz (un mes después de la ICP) del AAS. Estas observaciones avalan otros estudios que se están llevando a cabo en la actualidad y que evalúan estrategias sin AAS post-ICP y apoyan los hallazgos de las investigaciones farmacodinámicas sobre la eficacia mantenida que ofrece la monoterapia con inhibidores del P2Y12. También vale la pena reseñar que a los 12 meses, se observó una diferencia relevante desde el punto de vista estadístico entre los grupos. Diferencia que no se mantuvo tras 2 años de seguimiento. Conviene destacar que, durante el primer año del ensayo, se llevó a cabo una comparativa entre 2 regímenes TAPD durante el primer mes, seguido de o bien monoterapia con ticagrelor o bien TAPD hasta completar el año. En cambio, entre los meses 12 y 24, una comparativa llevada a cabo entre ticagrelor y AAS no arrojó diferencia alguna y terminó por diluir el efecto global del tratamiento de la estrategia experimental. Se sugirió también como posible factor contribuyente una menor adhesión al tratamiento aleatorizado. De hecho, un estudio con una muestra más grande probablemente hubiese sido lo suficientemente relevante desde el punto de vista estadístico y se hubiese mostrado favorable a la monoterapia con inhibidores del P2Y12 a los 2 años. En segundo lugar, la inclusión de pacientes con EC estable (el 53% de la población total del estudio) quizá ha podido diluir el posible beneficio del estudio. De hecho, se observó una interacción significativa favorable a los pacientes con SCA, para las hemorragias tipo 3 o 5 según los criterios del BARC (p = 0,007). Es más, ampliar el estudio hasta los 24 meses e incluir pacientes con EC estable sin beneficios establecidos derivados del uso de ticagrelor podría explicar la falta de diferencias observada en el objetivo primario de seguridad de hemorragias. En tercer lugar, es discutible si el objetivo primario (mortalidad por todas las causas e infarto de miocardio con onda Q) elegido para este estudio fue, o no, demasiado ambicioso. Aunque la selección de estos objetivos se hizo específicamente para facilitar la evaluación de episodios, la inclusión de otros objetivos tradicionales habría facilitado, más si cabe, la detección de diferencias entre los distintos grupos de tratamiento. Si bien en este ensayo no se adjudicaron recurrencias isquémicas no mortales ni episodios hemorrágicos, el estudio GLASSY valorará la superioridad de la estrategia de tratamiento experimental sobre el tratamiento estándar en más de 7.000 pacientes en un objetivo compuesto de episodios isquémicos mortales y no mortales y episodios hemorrágicos20.
El TWILIGHT es un ensayo de superioridad a doble ciego que está llevando a cabo una comparativa del perfil de eficacia y seguridad del tratamiento antiagregante plaquetario con ticagrelor más placebo frente a un curso TAPD continuado con AAS y ticagrelor en 9.000 pacientes de alto riesgo en tratamiento con TAPD y sin eventos tres meses después de ser sometidos a una ICP y tratados con stents farmacoactivos disponibles en el mercado21. Hay diferencias esenciales entre el TWILIGHT y el GLOBAL LEADERS. El primer lugar, el diseño doble ciego (AAS frente a placebo), una de las fortalezas del estudio, pretendía eliminar la posibilidad de reportar sesgos. En segundo lugar, el objetivo primario se centra en la seguridad (hemorragias tipo 2, 3 o 5 según los criterios del BARC a los 12 meses), un objetivo más plausible de alcanzar tras retirar el tratamiento con AAS. La no inferioridad del TAPD para los episodios isquémicos también está siendo objeto de estudio. En tercer lugar, la población del estudio está enriquecida con factores de riesgo clínico y angiográfico que aumentan el episodio anticipado y, a su vez, la probabilidad de detectar el efecto del tratamiento. Este estudio ha terminado, recientemente, la fase de inscripción y los primeros resultados se esperan para el segundo trimestre de 2019. En la actualidad, se están llevando a cabo otros estudios que arrojarán más luz sobre el posible papel que juega la monoterapia con inhibidores del P2Y12 como alternativa a la inhibición plaquetaria a largo plazo en pacientes sometidos a ICP (tabla 1).
Tabla 1. Ensayos en curso de estrategias sin AAS en pacientes sometidos a intervenciones coronarias percutáneas
| Estudio | n | Población | Grupos de tratamiento | Indicador de resultado primario |
| TWILIGHT (NCT02270242) | 9.000 | ICP de alto riesgo en tratamiento con ticagrelor, sin episodios a los 3 meses | Placebo durante 12 meses frente a AAS durante 12 meses | Hemorragias a los 12 meses |
| TICO (NCT02494895) | 3.056 | SCA-ICP | TAPD durante 3 meses más ticagrelor durante 9 meses frente a TAPD durante 12 meses | MACCE a los 12 meses, hemorragias mayores a los 12 meses |
| SMART CHOICE (NCT02079194) | 3.000 | ICP | TAPD durante 3 meses seguido de clopidogrel durante 9 meses frente a TAPD durante 12 meses | Muerte, IM o ACV a los 12 meses, hemorragias mayores a los 12 meses |
| SHORT-DAPT 2 (NCT02619760) | 3.045 | ICP | TAPD durante 1 mes seguido de clopidogrel durante 59 meses frente a TAPD durante 12 meses seguido de AAS durante 48 meses | NACE a los 12 meses |
| ASET (NCT03469856) | 200 | ICP | Monoterapia con prasugrel | Muerta cardiaca, IM del vaso diana (espontáneo > 48 h) o trombosis definitiva del stent Hemorragias tipo 3 o 4 según criterios BARC |
| AUGUSTUS (NCT02415400) | 4.600 | Fibrilación auricular en tratamiento con anticoagulación oral con SCA o ICP | AAS durante 6 meses frente a placebo durante 6 meses | Hemorragias mayores o clínicamente relevantes a los 6 meses |
| ENTRUST-AF PCI (NCT02866175) | 1.500 | Fibrilación auricular en tratamiento con anticoagulación oral e ICP | Edoxaban y clopidogrel o ticagrelor durante 12 meses frente a un antagonista de la vitamina K durante 12 meses más TAPD durante 1-12 meses | Hemorragias mayores o clínicamente relevantes a los 12 meses |
AAS: ácido acetilsalicílico; ICP: intervención coronaria percutánea; IM: infarto de miocardio; MACCE: episodios cardiacos y cerebrovasculares adversos mayores; n: número de pacientes; NACE: episodios adversos clínicos netos; SCA: síndrome coronario agudo; TAPD: tratamiento antiagregante plaquetario doble; TAS: tratamiento antiagregante simple. | ||||
En resumen, los avances hechos en fármacoterapia intervencionista con la llegada de agentes antitrombóticos con efectos farmacodinámicos más efectivos ponen en jaque al abordaje estándar de tratamiento consistente en AAS como tratamiento de base. La cada vez mayor aceptación de lo importante que es reducir las complicaciones hemorrágicas ha puesto en duda si, en un arsenal terapéutico más moderno de tratamientos antitrombóticos, el AAS sigue siendo insustituible. El uso a largo plazo del AAS no es indispensable como ya ha quedado demostrado en ámbitos como pacientes en tratamiento con anticoagulantes orales, además las evidencias de que disponemos hoy en día revelan que, en presencia de un bloqueo efectivo de otras importantes vías de señalización plaquetaria, retirar el tratamiento con AAS es inocuo. De este modo, lo que hace no muchos años habría sido un mito, es decir, la posibilidad de prescindir del AAS a largo plazo tras el implante de un stent coronario, hoy en día ya no está tan alejado de la realidad. Si seremos, o no, capaces de abandonar el dogma del uso obligatorio a largo pazo del AAS dependerá de los hallazgos que hagan los estudios que se están llevando a cabo en la actualidad en este campo.
Conflicto de intereses
D. Caponanno declara haber recibido honorarios de Bayer y AstraZeneca. R. Mehran declara haber recibido honorarios por su labor como asesora para Abbott Vascular, Abiomed, Boston Scientific, BristolMyers Squibb, Cardiovascular Systems, Elixir, Medscape, Shanghai BraccoSine Pharmaceutical, The Medicines Company, y honorarios como miembro del comité ejecutivo de Janssen Pharmaceuticals y Osprey Medical. También declara que su centro recibe financiación de AstraZeneca, Bayer, Beth Israel Deaconess, Bristol-Myers Squibb, Cardiokinetix, Claret Medical, CSL Behring, Eli Lilly/DSI, Medtronic, Novartis Pharmaceuticals, OrbusNeich, Spectranetics y Watermark Research Partners. D.J. Angiolillo declara haber recibido: a) honorarios por su labor de asesor para Amgen, Aralez, AstraZeneca, Bayer, Biosensors, Boehringer Ingelheim, BristolMyers Squibb, Chiesi, Daiichi-Sankyo, Eli Lilly, Haemonetics, Janssen, Merck, PLx Pharma, Pfizer, Sanofi y The Medicines Company; b) honorarios por su labor como asesor y por su participación como revisor para CeloNova y St Jude Medical; también ha recibido subvenciones institucionales de Amgen, AstraZeneca, Bayer, Biosensors, CeloNova, CSL Behring, Daiichi-Sankyo, Eisai, Eli-Lilly, Gilead, Janssen, Matsutani Chemical Industry Co., Merck, Novartis, Osprey Medical y Renal Guard Solutions. Además, ha recibido financiación de la Fundación Scott R. MacKenzie y la concesión del Premio a las Ciencias Clínicas y Traslacionales de NIH/NCATS a la Universidad de Florida, UL1 TR000064 y NIH/NHGRI U01 HG007269, fuera del trabajo enviado.
Bibliografía
1. Angiolillo DJ. The Evolution of Antiplatelet Therapy in the Treatment of Acute Coronary Syndromes. Drugs. 2012;72:2087-2116.
2. Franchi F, Angiolillo DJ. Novel antiplatelet agents in acute coronary syndrome. Nat Rev Cardiol. 2015;12:30-47.
3. Capodanno D, Alfonso F, Levine GN, Valgimigli M., Angiolillo DJ. Dual Antiplatelet Therapy: Appraisal of the ACC/AHA and ESC Focused Updates. J Am Coll Cardiol. 2018;72:103-19.
4. Angiolillo DJ, Fernandez-Ortiz A, Bernardo E, et al. Variability in Individual Responsiveness to Clopidogrel. J Am Coll Cardiol. 2007;49: 1505-1516.
5. Tantry US, Bonello L, Aradi D, et al. Consensus and update on the definition of on-treatment platelet reactivity to adenosine diphosphate associated with ischemia and bleeding. J Am Coll Cardiol. 2013;62:2261-2273.
6. Cattaneo M, Schulz R, Nylander S. Adenosine-Mediated Effects of Ticagrelor J Am Coll Cardiol. 2014;63:2503-2509.
7. Becker RC, Bassand JP, Budaj A, et al. Bleeding complications with the P2Y12 receptor antagonists clopidogrel and ticagrelor in the PLATelet inhibition and patient Outcomes (PLATO) trial. Eur Heart J. 2011;32:2933-2944.
8. Généreux P, Giustino G, Witzenbichler B, et al. Incidence, Predictors, and Impact of Post-Discharge Bleeding After Percutaneous Coronary IIntervention. J Am Coll Cardiol. 2015;66:1036-1045.
9. Capodanno D, Mehran R, Valgimigli M, et al. Aspirin-free strategies in cardiovascular disease and cardioembolic stroke prevention. Nat Rev Cardiol. 2018;15:480-496.
10. Moon JY, Franchi F, Rollini F, Angiolillo DJ. The quest for safer antithrombotic treatment regimens in patients with coronary artery disease: new strategies and paradigm shifts. Expert Rev Hematol. 2018;11:5-12.
11. Angiolillo DJ, Rollini F, Storey RF, et al. International Expert Consensus on Switching Platelet P2Y12 Receptor-Inhibiting Therapies. Circulation. 2017; 136:1955-1975.
12. Moon JY, Franchi F, Rollini F, Angiolillo DJ. Evolution of Coronary Stent Technology and Implications for Duration of Dual Antiplatelet Therapy. Prog Cardiovasc Dis. 2018;60:478-490.
13. Angiolillo DJ, Goodman SG, Bhatt DL, et al. Antithrombotic Therapy in Patients with Atrial Fibrillation Treated with Oral Anticoagulation Undergoing Percutaneous Coronary Intervention: A North American Perspective 2018 Update. Circulation. 2018;138:527-536.
14. Lip GYH, Collet JP, Haude M, et al. 2018 Joint European consensus document on the management of antithrombotic therapy in atrial fibrillation patients presenting with acute coronary syndrome and/or undergoing percutaneous cardiovascular interventions: a joint consensus document of the European Heart Rhythm Association (EHRA), European Society of Cardiology Working Group on Thrombosis, European Association of Percutaneous Cardiovascular Interventions (EAPCI), and European Association of Acute Cardiac Care (ACCA) endorsed by the Heart Rhythm Society (HRS), Asia-Pacific Heart Rhythm Society (APHRS), Latin America Heart Rhythm Society (LAHRS), and Cardiac Arrhythmia Society of Southern Africa (CASSA). Europace. 2018. http://doi.org/10.1093/europace/euy174.
15. Rollini F, Franchi F, Cho JR, et al. A head-to-head pharmacodynamic comparison of prasugrel vs ticagrelor after switching from clopidogrel in patients with coronary artery disease: results of a prospective randomized study. Eur Heart J. 2016;37:2722-2730.
16. Storey RF. Biology and pharmacology of the platelet P2Y12 receptor. Curr Pharm Des. 2006;12:1255-1259.
17. Armstrong PCJ, Leadbeater PD, Chan MV, et al. In the presence of strong P2Y12 receptor blockade, aspirin provides little additional inhibition of platelet aggregation. J Thromb Haemost. 2011;9:552-561.
18. Vranckx P, Valgimigli M, Windecker S, et al. Long-term ticagrelor monotherapy versus standard dual antiplatelet therapy followed by aspirin monotherapy in patients undergoing biolimus-eluting stent implantation: rationale and design of the GLOBAL LEADERS trial. EuroIntervention. 2016; 12:1239-1245.
19. Vranckx P, Valgimigli M, Jüni P, et al. Ticagrelor plus aspirin for 1 month, followed by ticagrelor monotherapy for 23 months vs aspirin plus clopidogrel or ticagrelor for 12 months, followed by aspirin monotherapy for 12 months after implantation of a drug-eluting stent: a multicentre, open-label, randomised superiority trial. Lancet. 2018;392:940-949.
20. GLOBAL LEADERS Adjudication Sub-Study (GLASSY). https://clinicaltrials.gov/ct2/show/NCT03231059. Consultado 15 Nov 2018.
21. Baber U, Dangas G, Cohen DJ, et al. Ticagrelor with aspirin or alone in high-risk patients after coronary intervention: Rationale and design of the TWILIGHT study. Am Heart J. 2016;182:125-134.
Correo electrónico: dominick.angiolillo@jax.ufl.edu (D.J. Angiolillo).