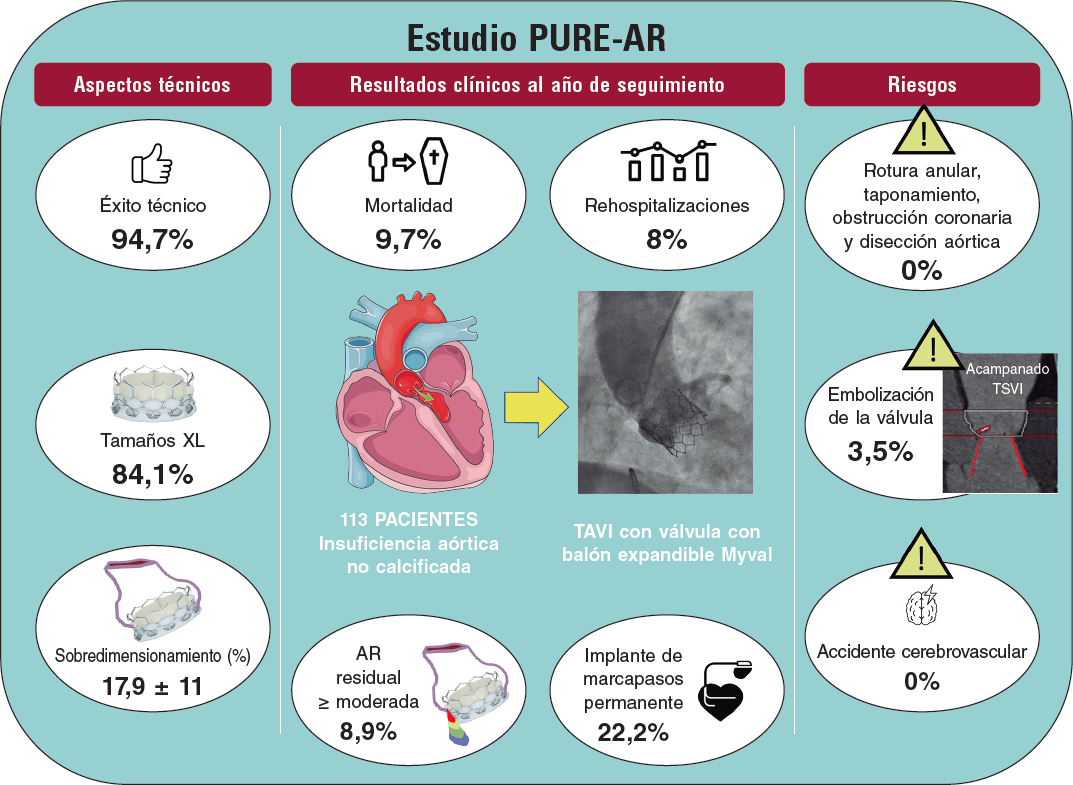
La introducción de la biopsia endomiocárdica (BEM) para el diagnóstico del rechazo en 19721 se considera uno de los principales avances en la historia del trasplante cardiaco (TxC). Desde ese momento, la BEM se viene aceptando como método de referencia (gold standard) para el diagnóstico del rechazo. Sin embargo, se trata de un procedimiento invasivo repetitivo, incómodo para los pacientes y no exento de complicaciones, a veces graves. En este contexto, en un reciente artículo publicado en REC: Interventional Cardiology,Tamargo et al.2 aportan la experiencia combinada de 2 grandes centros nacionales de TxC con el acceso a la BEM por vía venosa braquial, vía relativamente menos invasiva que la vía femoral o la más común por la vena yugular. Los autores demuestran que esta alternativa es factible en el 94% de los intentos. La vía braquial resulta más segura al eliminar alguna de las complicaciones mayores del acceso central (principalmente neumotórax y punción arterial). Sin embargo, el acceso braquial no afecta a la principal complicación de la BEM a medio-largo plazo: la insuficiencia tricuspídea traumática que puede aparecer tras repetidas biopsias, y que no rara vez es tan grave y sintomática que precisa corrección quirúrgica3. Aunque la vía braquial no consigue reducir el tiempo empleado en el procedimiento y además el tiempo de fluoroscopia es superior al de la vía yugular, parece evidente que esta ruta resulta más llevadera para los pacientes (aunque este dato se basa solo en el testimonio de 19 pacientes, tal como los autores reconocen en el apartado de limitaciones). Por tanto, el procedimiento descrito resulta en especial apropiado para los pacientes con TxC, que forman la mayor parte de su serie y en los que el uso repetido de BEM de seguimiento está universalmente aceptado para el despistaje de rechazo del injerto.
En cualquier caso, conviene señalar que aunque la BEM sigue manteniendo su aura como método de referencia en el diagnóstico del rechazo, resulta sorprendente la ausencia de una base científica que lo justifique. En plena era de la medicina basada en la evidencia, y pese a que llevamos más de 30 años utilizando esta técnica, no existe ninguna evidencia científica sólida que establezca su papel real en el tratamiento de los pacientes. En las guías de práctica clínica de la International Society for Heart and Lung Transplantation4, la BEM sistemática para la detección del rechazo obtiene una débil recomendación (nivel IIa) con el mínimo nivel de evidencia (clase C), y sin apoyo en ninguna referencia científica. Además, la interpretación histológica de una BEM es bastante subjetiva, los criterios diagnósticos se han modificado varias veces y existe una alarmante variabilidad entre distintos observadores5,6. En realidad, se desconocen por completo su sensibilidad y especificidad. Por otra parte, todos los grupos de TxC han experimentado la frustración de observar repetidos falsos positivos7 y falsos negativos8, hasta el punto de que habitualmente hay muy poca correlación entre el grado anatomopatológico del rechazo y la situación funcional del paciente y del injerto.
No sorprenden, por tanto, los numerosos intentos realizados con el fin de sustituir la BEM por otras técnicas no invasivas, principalmente ecocardiográficas. Los resultados han sido muy variables, y en la práctica clínica real nunca se han llegado a aplicar9. En los últimos tiempos se han introducido técnicas sofisticadas, como los perfiles de expresión genética. Sin embargo, solo se han aplicado a pacientes seleccionados (de bajo riesgo para rechazo) y relativamente tarde tras el TxC (> 2-6 meses), lo que excluye en la práctica la mayor parte de los episodios de rechazo con relevancia clínica10,11.
El principal problema de los intentos de sustituir la BEM por técnicas no invasivas es que estamos comparando estas nuevas aproximaciones diagnósticas con la BEM, asumiendo que esta constituye el método de referencia. Este planteamiento está viciado desde el principio, puesto que la supuesta referencia no lo es en realidad. Para considerar la BEM como un auténtico método de referencia se deberían aplicar los estándares actuales de la medicina basada en la evidencia, y demostrar de forma fehaciente que la práctica actual de seguimiento sistemático con BEM periódicas y tratamiento según la histología comporta realmente una mejoría de los resultados clínicos.
En este contexto, y ante las incertidumbres planteadas por los frecuentes falsos positivos y negativos de la BEM, a partir de los años 1990 desarrollamos en el Hospital Universitario Marqués de Valdecilla una estrategia de seguimiento periódico clínico-ecocardiográfico, sin la realización de BEM obligatorias12. Nuestra estrategia está basada en el siguiente concepto: a medida que pasa el tiempo tras el TxC, los episodios de rechazo son menos agresivos y más espaciados. Muchos de ellos remiten de manera espontánea, aunque algunos pueden progresar hasta llegar a comprometer la función del injerto, y serán detectados por la clínica o la ecocardiografía. Con esta estrategia, aunque se pierde sensibilidad diagnóstica se consigue una gran especificidad clínica, al identificar y tratar solo aquellos episodios de rechazo que no se resuelven espontáneamente, que la experiencia demuestra que son una minoría, y que en general responden bien al tratamiento (figura 1).
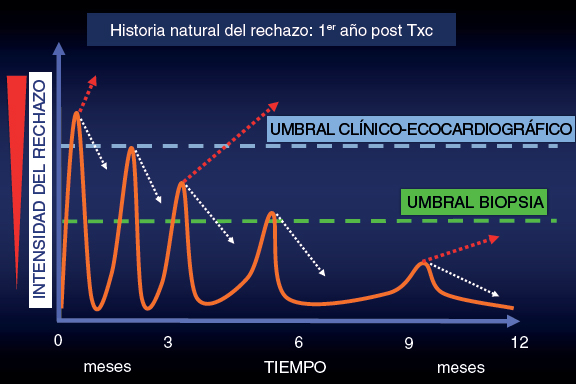
Figura 1. Representación gráfica de la evolución natural del rechazo durante el primer año tras el trasplante cardiaco. Los episodios de rechazo van disminuyendo en intensidad y frecuencia a lo largo del tiempo. Las flechas blancas discontinuas indican la resolución espontánea del rechazo por efecto de la inmunosupresión de base, y las flechas rojas discontinuas indican la progresión continuada del rechazo.
Por tanto, en las revisiones periódicas hacemos una valoración clínica y obtenemos ecocardiogramas evolutivos, pero sin BEM obligada, que únicamente se realiza en caso de dudas. Como se ha dicho, buscamos sobre todo especificidad, por lo que solo valoramos parámetros ecocardiográficos «duros» (cambios relevantes en el grosor de las paredes o disminución de la fracción de eyección) como indicativos de rechazo merecedor de tratamiento. De forma intencionada no nos apoyamos en otras técnicas, como el strain, que al ser mucho más sensibles nos harían perder especificidad.
Siguiendo esta estrategia y tras casi 30 años de experiencia con unos 600 TxC, la utilización de la BEM resulta hoy en día una técnica marginal en nuestro programa13. La media histórica es de 1,24 BEM por paciente, pero en los últimos 10 años ha bajado a tan solo 0,2. En nuestra práctica actual no se realiza ninguna BEM durante el primer año de seguimiento en la mayoría de los pacientes. Nuestra confianza en esta estrategia se apoya en los resultados clínicos, que se comparan de manera favorable con los del Registro Español de Trasplante Cardiaco14, tanto a medio como a largo plazo. Si excluimos la primera semana tras el TxC (periodo en el que prácticamente nunca se realizan BEM), la supervivencia actuarial del Hospital Universitario Marqués de Valdecilla es del 85% a 1 año, el 75% a 5 años y el 61% a 10 años, ligeramente superior a la del Registro Español de Trasplante Cardiaco14 (84% a 1 año, 73% a 5 años y 58% a 10 años).
En cualquier caso, el abordaje por la vena braquial propuesto por Tamargo et al.2 resulta una aportación sin duda bienvenida, sobre todo por parte de los pacientes. Siguiendo el protocolo clásico de Stanford15 se deberían realizar un mínimo de 14 BEM por paciente el primer año, por lo que una mejor tolerancia del procedimiento asociada a una reducción de las complicaciones agudas puede resultar muy relevante para los pacientes, dado el gran número de biopsias a las que se enfrentan a lo largo de su seguimiento.
Muchos aspectos de la práctica actual del TxC están basados en la opinión de expertos y en la inercia clínica más que en la evidencia científica. Destaca entre ellos el mito de la BEM como método de referencia, que no debería ser aceptado en ausencia de evidencia que lo sustente. Consideramos importante avanzar en este campo, pero para ello las alternativas no invasivas a la BEM deberían cambiar su enfoque actual. En lugar de seguir comparando su capacidad diagnóstica con respecto a la BEM (equívoco método de referencia), se deberían basar más bien en la comparación de los resultados clínicos, que en último término es lo más importante. Por tanto, consideramos que ha llegado el momento de diseñar estudios aleatorizados que comparen los resultados clínicos entre las estrategias de reducción de BEM basadas en métodos no invasivos y la pauta clásica vigente de realización de BEM obligatorias.
CONFLICTO DE INTERESES
No se declara ninguno.
BIBLIOGRAFÍA
1. Caves PK, Stinson EB, Billingham M, Shumway NE. Percutaneous transvenous endomyocardial biopsy in human heart recipients. Experience with a new technique. Ann Thorac Surg. 1973;16:325-336.
2. Tamargo M, Gutiérrez Ibañes E, Oteo Domínguez JF, et al. Endomyocardial biopsy using the brachial venous access route. Description of the technique and 12-year experience at 2 different centers. REC Interv Cardiol. 2020. https://doi.org/10.24875/RECICE.M20000110.
3. Alharethi R, Bader F, Kfoury AG, et al. Tricuspid valve replacement after cardiac transplantation. J Heart Lung Transplant. 2006;25:48.
4. The International Society of Heart and Lung Transplantation Guidelines for the care of heart transplant recipients. Task Force 2:Immunosuppression and Rejection. J Heart Lung Transplant. 2010;29:914-956.
5. Marboe CC, Billingham M, Eisen H, et al. Nodular endocardial infiltrates (Quilty lesions) cause significant variability in diagnosis of ISHLT Grade 2 and 3A rejection in cardiac allograft recipients. J Heart Lung Transplant. 2005;24:S219-S226.
6. Crespo-Leiro MG, Zuckermann A, Bara C, et al. Concordance among pathologists in the second Cardiac Allograft Rejection Gene Expression Observational Study (CARGO II). Transplantation. 2012;94:1172-1177.
7. Winters L, Loh E, Schoen F. Natural History of Focal Moderate Cardiac Allograft Rejection. Is Treatment Warranted?Circulation. 1995;91:1975-1980.
8. Fishbein MC, Kobashigawa J. Biopsy-negative cardiac transplant rejection:etiology, diagnosis and therapy. Curr Opin Cardiol. 2004;19:166-169.
9. Badano LP, Miglioranza MH, Edvardsen T, et al. European Association of Cardiovascular Imaging/Cardiovascular Imaging Department of the Brazilian Society of Cardiology recommendations for the use of cardiac imaging to assess and follow patients after heart transplantation. Eur Heart J Cardiovasc Imaging. 2015;16:919-948.
10. Pham MX, Teuteberg JJ, Kfoury AG, et al. Gene expression profiling for rejection surveillance after cardiac transplantation. N Engl J Med. 2010;362:1890-1900.
11. Crespo-Leiro M, Stypmann J, Schulz U, et al. Clinical usefulness of gene-expression profile to rule out acute rejection after heart transplantation. Eur Heart J. 2016;37:2591-2601.
12. Vázquez de Prada JA. Revisión crítica del papel de la biopsia endomiocárdica en el trasplante cardiáco. Rev Esp Cardiol. 1995;48(Supl 7):86-91.
13. Vázquez de Prada JA, Gonzalez Vilchez F, Rodriguez Entem F, et al. Heart Transplantation without Routine Endomyocardial Biopsies Is Feasible:Experience with a Clinical-Echocardiographic Strategy [abstract]. J Heart Lung Transplant. 2016;35(4S):S32-S33.
14. González-Vílchez F, Almenar-Bonet L, Crespo-Leiro MG, et al. Registro español de Trasplante Cardiaco. XXX Informe oficial de la Sección de Insuficiencia Cardiaca de la SEC (1984-2018). Rev Esp Cardiol. 2019;72:954-962.
15. Billingham ME. Diagnosis of cardiac rejection by endomyocardial biopsy. Heart Transplant.1981;1:25-30.
Autor para correspondencia: Servicio de Cardiología, Hospital Universitario Marqués de Valdecilla, Avda. Valdecilla s/n, 39008 Santander, Cantabria, España.
Correo electrónico: javdpt@gmail.com (J.A. Vázquez de Prada).