RESUMEN
Introducción y objetivos: La atresia pulmonar con septo íntegro (APSI) es una cardiopatía congénita cianosante infrecuente que por su gravedad requiere un tratamiento en época neonatal. En función de la anatomía del ventrículo derecho y de la circulación coronaria, se pueden plantear distintas estrategias. El objetivo fue describir los resultados de la perforación valvular pulmonar percutánea de los pacientes con diagnóstico de APSI en un centro terciario. Se comparó el abordaje transfemoral con el transyugular. Se revisó la necesidad de flujo adicional (fístula sistémico-pulmonar o stent ductal) en el seguimiento, procurando identificar posibles factores de riesgo asociados a esta reintervención.
Métodos: Se incluyeron todos los pacientes con APSI tratados con perforación percutánea de la válvula pulmonar como primera opción terapéutica desde febrero de 2004 hasta mayo de 2022. Se estudiaron los detalles técnicos del cateterismo, los tiempos de procedimiento y de escopia, y variables demográficas y ecocardiográficas.
Resultados: Se incluyeron 22 pacientes y el procedimiento fue exitoso en 20 (91%). Se presentaron complicaciones en 2 pacientes (9%). No hubo fallecimientos. Los abordajes transyugular y transfemoral mostraron una eficacia y una seguridad parecidas. Los tiempos medianos de procedimiento (n = 20) y de escopia (n = 16) fueron menores en los pacientes con acceso transyugular que en aquellos con acceso transfemoral (85 frente a 156 y 31 frente a 62 minutos, respectivamente), con significación estadística. En el seguimiento, 8 pacientes (40%) necesitaron flujo adicional (4 stent ductal y 4 fístula sistémico-pulmonar). No se encontró ningún factor asociado significativamente a esta reintervención.
Conclusiones: La perforación percutánea de la válvula pulmonar puede ser factible en manos expertas y en pacientes bien seleccionados, y representa una alternativa atractiva a la cirugía. En nuestra experiencia, el abordaje transyugular parece simplificar el procedimiento, reduciendo los tiempos de intervencionismo y de escopia.
Palabras clave: Cardiopatía congénita. Atresia pulmonar. Valvuloplastia con balón. Válvula pulmonar. Recién nacido.
ABSTRACT
Introduction and objectives: Pulmonary atresia with intact ventricular septum (PA/IVS) is a rare but serious cyanotic congenital heart disease. Depending on the patient’s anatomy, different therapeutic strategies—surgical or trancatheter—can be planned.
The objective of this study was to describe the results of transcatheter pulmonary valve perforation in patients with PA/IVS in a single tertiary center, and compare transjugular to transfemoral approach. The need for additional source of pulmonary flow (ductal stenting or systemic-to-pulmonary artery fistula) at follow-up was reviewed to identify possible risk factors associated with this reintervention.
Methods: patients with PA/IVS referred for transcatheter pulmonary valve perforation as first-line therapy from February 2004 through May 2022 were included. Technical procedural details, total procedural and fluoroscopy times, and demographic and echocardiographic data were studied.
Results: A total of 22 patients were included. Procedure was successful in 20 cases (91%). The rate of complications was 2/22 (9%). No deaths were reported. The transjugular and transfemoral approaches were equally safe and effective. The total median procedural (n = 20) and fluoroscopy times (n = 16), however, were shorter in the transjugular compared to the transfemoral approach (85 min vs 156 min, and 31 min vs 62 min, respectively), which reached statistical significance. At follow-up, 8/20 (40%) patients needed additional flow (4 ductal stenting, 4 systemic-to-pulmonary artery shunts). No significant risk factors regarding this reintervention were reported.
Conclusions: Transcatheter mechanical pulmonary valve perforation may be feasible in expert hands and properly selected patients being an attractive alternative to surgery. In our own experience, transjugular approach seems to simplify the procedure, and reduces procedural and fluoroscopy times.
Keywords: Congenital heart defect. Pulmonary atresia. Balloon valvuloplasty. Pulmonary valve. Newborn.
Abreviaturas
APSI: atresia pulmonar con septo íntegro. OTC: oclusión coronaria total crónica. VD: ventrículo derecho. VP: válvula pulmonar. VT: válvula tricúspide.
INTRODUCCIÓN
La atresia pulmonar con septo íntegro (APSI) es una cardiopatía congénita cianótica rara con una amplia constelación de signos clínicos1-8. Supone menos del 1% de todas las cardiopatías congénitas y su variabilidad anatómica implica un complejo proceso de toma de decisiones9. En ocasiones, es necesario realizar intervenciones durante el periodo neonatal para garantizar una fuente de flujo sanguíneo pulmonar3,10,11. Los pacientes con hipoplasia grave del ventrículo derecho (VD) o circulación coronaria dependiente del VD (algunas áreas ventriculares son perfundidas, en exclusiva, desde la cámara VD) serían candidatos a una fisiología cardiaca univentricular. En cambio, aquellos sin circulación coronaria dependiente del VD, hipoplasia VD leve o moderada y atresia pulmonar membranosa son candidatos a la perforación percutánea de la válvula pulmonar (VP) para lograr una circulación biventricular1,4,5,8,10-18. En líneas generales, durante las 2 últimas décadas se ha observad una transición de la descomprensión quirúrgica del VD al abordaje transcatéter, que se asocia a un menor índice de mortalidad7. No obstante, la selección de pacientes parece crucial para obtener buenos resultados17,19,20.
En la década de 1990, se describieron varias técnicas para perforar la VP atrésica tales como el láser, la radiofrecuencia o la punción empleando el extremo rígido de una guía2-4,10-12,14,15,17,21. En la actualidad, no obstante, el láser ha quedado obsoleto por su alto coste, abultado equipo y riesgo de daños en la retina12,22. Aunque la radiofrecuencia parece el método más empleado, la perforación mecánica con el extremo rígido de una guía coronaria o el uso de una guía para oclusión coronaria total crónica (OTC) es una alternativa prometedora cuando la primera no está disponible o es demasiado cara8,12,20.
Con independencia de le técnica empleada, las complicaciones eran algo habitual por aquel entonces. No obstante, la experiencia cada vez mayor y las continuas mejoras técnicas nos han permitido consolidar la perforación percutánea de la VP como una opción de primera línea en recién nacidos con APSI4,5,11,12,16-18. También se debe mencionar que el establecimiento precoz de un flujo pulmonar anterógrado a través de la válvula atrésica aumenta las probabilidades de crecimiento del VD1,3,8,17,23. Además, la intervención transcatéter descomprime el VD, lo que evita cirugías a corazón abierto durante el periodo neonatal.
El objetivo de este estudio es describir los resultados de la perforación percutánea de la VP con APSI en recién nacidos en un centro terciario y compararlos con el abordaje transyugular y transfemoral.
MÉTODOS
Este estudio ha sido aprobado por el comité de ética del Hospital Vall d’Hebron (Barcelona) de conformidad con la Declaración de Helsinki. Se obtuvo el consentimiento informado de los padres o tutores legales de los pacientes previo a la publicación de este artículo.
Se incluyó a pacientes con APSI tratados con perforación transcatéter entre febrero de 2004 y mayo de 2022. Se excluyó a aquellos con circulación coronaria dependiente del VD, VD unipartito, atresia pulmonar muscular, VD hipoplásico grave (índice z del anillo tricúspide < -5) o anomalía de Ebstein grave .
Las intervenciones se dividieron en 2 grupos según el abordaje venoso empleado, femoral o yugular. Las variables demográficas y las ecocardiográficas antes y después del procedimiento (VP y válvula tricúspide [VT] índice z, morfología del VD) y los datos de la misma se describieron y se compararon entre los 2 grupos. También se llevó a cabo una breve descripción de los detalles técnicos del procedimiento y de las complicaciones. Se intentó identificar los factores de riesgo asociados a la necesidad de una intervención adicional para proporcionar flujo sanguíneo pulmonar (fístula, implante del stent ductal). El estudio entero se dividió en 2 periodos, de 2004 a 2011 (1er periodo) y de 2012 a 2022 (2º periodo) por la existencia de un nuevo primer operador y porque se optó por el abordaje transyugular como primera opción.
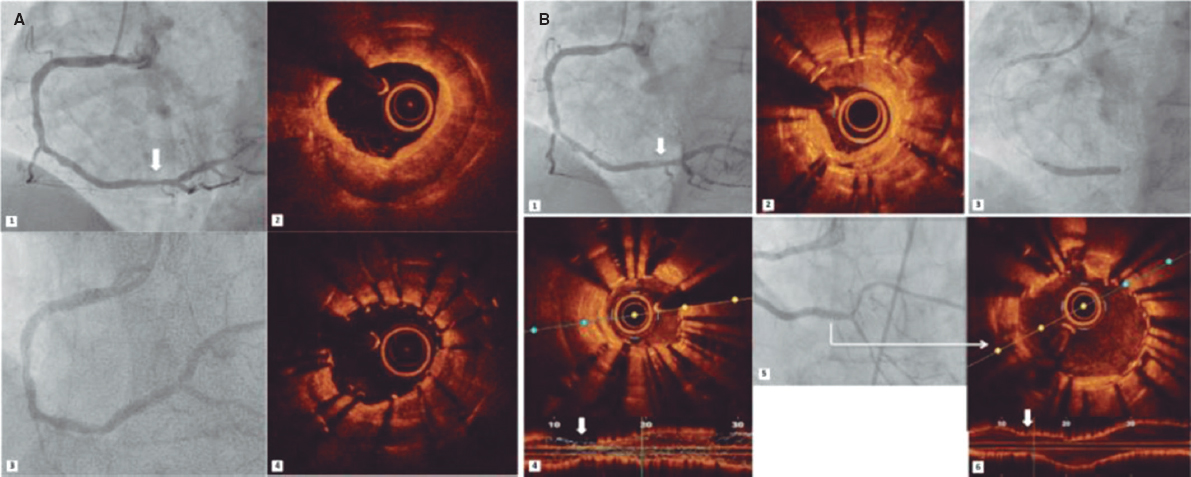
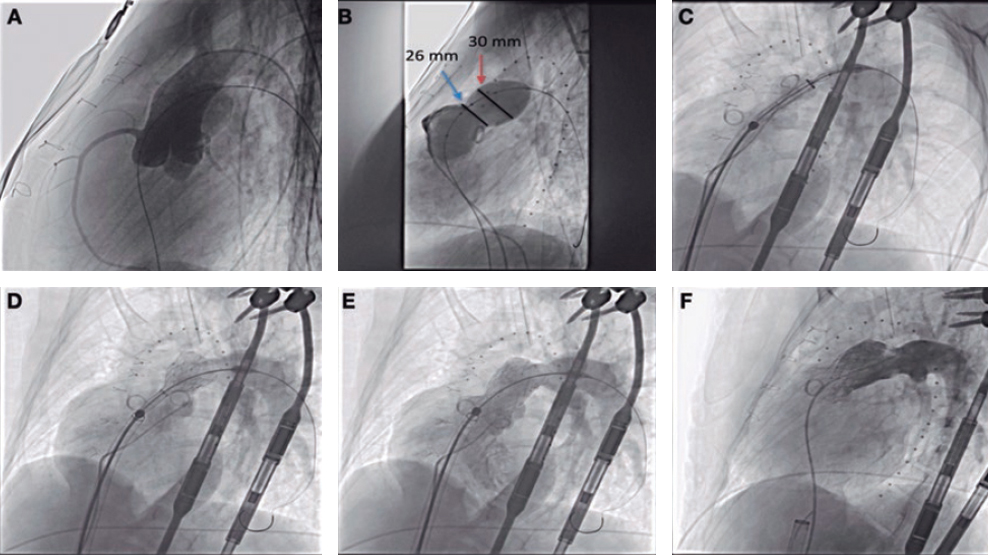
Todas las intervenciones se realizaron con anestesia general y ventilación mecánica. La ausencia de circulación coronaria dependiente del VD se valoró en todos los casos mediante ventriculografía derecha (figura 1A). Se empleó un catéter derecho Judkins de 4F (mediante abordaje femoral) o uno tipo Cobra (C1/C3) (mediante abordaje yugular) que se insertaron en el tracto de salida del ventrículo derecho por debajo de la VP atrésica. Después, empleándose diferentes guías para OTC de 0,014 pulgadas, la VP se perforó mecánicamente. Posteriormente, se avanzó un microcatéter de 0,014 pulgadas y se realizó una angiografía del árbol pulmonar para confirmar la posición adecuada (figura 1B). Desafortunadamente, la guía no siempre alcanza el tronco pulmonar al primer intento. Entonces, guía y microcatéter se retiran (sin consecuencias), y acto seguido se lleva a cabo otro intento hasta lograr alcanzar el tronco pulmonar. Una vez confirmada la correcta ubicación de la guía, ésta es recambiada por una guía BMW (Abbott Vascular, Estados Unidos) seguido de progresivas dilataciones de la VP con un balón para mejorar el flujo pulmonar (figura 1C). Finalmente, se realizó una ventriculografía derecha para descartar la presencia de complicaciones y la presencia de un flujo adecuado en la VP (figura 1D).
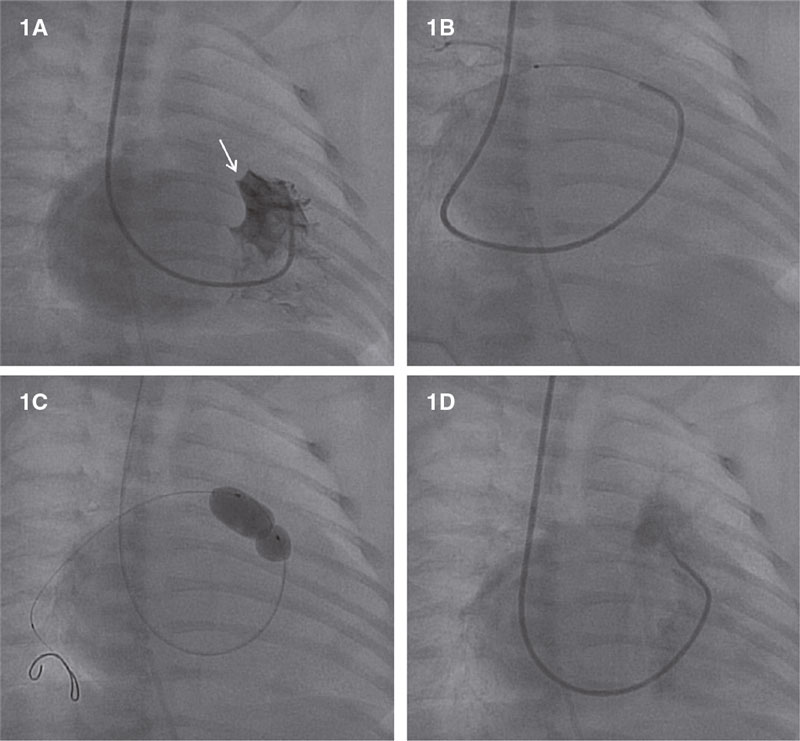
Figura 1. Perforación percutánea de válvula pulmonar atrésica. A: ventriculografía derecha con presencia de válvula pulmonar atrésica (flecha blanca) sin sinusoides coronarios. B: angiografía basada en microcatéter, que mostrando la posición correcta dentro de la arteria pulmonar derecha. C: valvuloplastia de válvula pulmonar. D: ventriculografía derecha mostrando el flujo en dirección a la arteria pulmonar sin complicaciones.
La indicación para una fuente adicional de flujo sanguíneo pulmonar (primero, fístula arterio-arterial sistémico-pulmonar, hasta 2011 y después implante de un stent ductal) fue la retirada fallida de prostaglandina E1 con cianosis excesiva (porcentaje de saturación de la hemoglobina < 70%) 1 o 2 semanas después del cateterismo.
Análisis estadístico
El análisis descriptivo de los datos se expresó como valores medianos y rango intercuartílico (RIQ) (percentil 25-75) para las variables cualitativas, dicotómicas o de alta dispersión y como valores medios con desviación estándar (DE) para las variables continuas cuantitativas (peso y semanas de gestación). Se empleó la prueba exacta de Fisher para analizar las posibles relaciones existentes entre las variables binarias. Valores p < 0,05 se consideraron significativos a nivel estadístico.
El análisis estadístico se realizó con el paquete de software estadístico para ciencias sociales SPSS versión 20.0 (Illinois, Estados Unidos).
RESULTADOS
Se incluyó a un total de 22 pacientes, 13 de los cuales eran mujeres (59%). El tiempo medio de gestación fue de 38,3 semanas (+/- 2,9) y el peso medio, 2,96 kg (+/– 0,62).
Previo al procedimiento, los índices z medianos tanto de la VP como de la VT para toda la muestra fueron –1,2 (n = 22; RIQ, –2,01 – –0,25) y –2,0 (n = 21; RIQ, –3 – –0,65), respectivamente. Excepto 2, los pacientes se clasificaron como pacientes con VD tripartito y 2 como pacientes con VD bipartito con la región trabecular hipoplásica.
En lo referente a la vía de acceso venoso transfemoral, inicialmente, los grupos transyugular y transfemoral incluyeron a 13 y 9 pacientes, respectivamente. No obstante, en 3 casos transfemorales, hubo que cambiar el abordaje por el transyugular por imposibilidad de perforar la válvula pulmonar o por falta de estabilidad del catéter. Finalmente, los grupos transyugular y transfemoral quedaron configurados con 16 y 6 pacientes, respectivamente. Todos los casos transfemorales (n = 6) y 4/16 transyugulares se realizaron en el primer periodo y los restantes 12 casos transyugulares en el segundo.
La mediana de edad de toda la muestra cuando se realizó el procedimiento fue de 1 día de vida (1-3). La ratio entre el diámetro máximo del balón y el anillo pulmonar fue de 0,8 a 1,45. No hubo ninguna muerte peri ni posoperatoria. El índice total de éxito operatorio fue del 91% (20/22) [15/16 (94%) y 5/6 (83%) para los grupos transyugular y transfemoral, respectivamente]. Los datos de todos los pacientes en quienes la intervención tuvo éxito (n = 20) y la comparativa entre el grupo transyugular y el transfemoral se muestran en la tabla 1.
Tabla 1. Comparativa entre el grupo transyugular y el transfemoral (casos exitosos)
| Abordaje | Global | Transyugular | Transfemoral | P | |||||
|---|---|---|---|---|---|---|---|---|---|
| Casos con éxito (n) | 20 | 15 | 5 | – | |||||
| Tiempo del procedimiento (min)a | 105 (63-143.8) | 85 (53-130) | 156 (120,5-220) | ||||||
| Duración < 140 min | 14 (70%) | 13 | 1 | 0,01 | |||||
| Duración ≥ 140 min | 6 (30%) | 2 | 4 | ||||||
| Tiempo de fluoroscopia (min); n = 16b | 35,6 (20,6-57,1) n = 16 | 31,2 (19-53,4) n = 11 | 62,5 (25,5-80) n = 5 | ||||||
| Tiempo de fluoroscopia < 60 min | 13/16 (81%) | 11 | 2 | 0,02 | |||||
| Tiempo de fluoroscopia ≥ 60 min | 3/16 (19%) | 0 | 3 | ||||||
| Ratio balón/válvula | 1,24 (1,11-1,33) | 1,2 (1,1-1,28) | 1,35 (1,26-1,4) | ||||||
| Gradiente residual invasivo ≤ 20 mmHg | 18 (90%) | 15 | 3 | 0,05 | |||||
| Gradiente residual invasivo > 20 mmHg | 2 (10%) | 0 | 2 | ||||||
| Complicaciones; n = 20 | 1 (5%) | 1/15 | 0/5 | 0,75 | |||||
| Valoración ecocardiográfica de la EP < 25 mmHg; n = 19c | 11/19 (58%) | 8/15 | 3/4 | 0,43 | |||||
| Valoración ecocardiográfica de la IP (moderada/grave); n = 19c | 15/19 (79%) | 11/15 | 4/4 | 0,35 | |||||
| Necesidad de FAF | 8 (40%) | 5/15 | 3/5 | 0,3 | |||||
| ISD | 4 | 4/5 | 0/3 | ||||||
| Fístula | 4 | 1/5 | 3/3 | ||||||
| Necesidad de nueva valvuloplastia | 4 (20%) | 3/15 | 1/5 | 0,72 | |||||
| Circulación biventricular | 18 (90%) | 14/15 | 4/5 | 0,45 | |||||
| Circulación 1 y 1/2 | 2 (10%) | 1/15 | 1/5 | ||||||
EP: estenosis pulmonar; FAF: fuente adicional de flujo; IP: insuficiencia pulmonar; ISD: implante del stent ductal; min: minutos. | |||||||||
Comparativa entre casos transfemorales y transyugulares exitosos
La duración del procedimiento de los 3 casos que pasaron del abordaje transfemoral al transyugular se tuvo en cuenta desde el mismo momento en el que se decidió el acceso transyugular (en detrimento del transfemoral). No se pudo calcular el tiempo de fluoroscopia de estos 3 casos al no haber forma de saber cuál era el tiempo exacto de fluoroscopia des del inicio del abordaje transyugular (solo se disponía del tiempo global). Además, faltaba la información sobre esta variable en un paciente (missing data) Así pues, la muestra total para el tiempo de fluoroscopia fue de 16 casos (20 casos exitosos, –3 casos con reconversión de acceso transfemoral a transyugular, –1 caso en el que faltaba éste información). Tal y como se muestra en la tabla 1, las variables duración del procedimiento y tiempo de fluoroscopia fueron menores en el grupo transyugular. En el grupo transyugular prevalecieron gradientes residuales ≤ 20 mmHg (n = 18) que se calcularon invasivamente puesto que 15 de estos 18 pacientes pertenecían a este grupo mientras que los pacientes con gradientes invasivos > 20 mmHg (n = 2) pertenecían al grupo transfemoral.
Complicaciones y casos fallidos
El procedimiento resultó fallido en 2/22 casos (9%). Un caso transfemoral por perforación del tracto de salida del ventrículo derecho con hematoma cardiaco significativo (hubo que realizar una valvulotomía quirúrgica de urgencia). En este paciente, un error de juicio en la posición de la guía para OTC, que en realidad estaba fuera del árbol pulmonar, seguido de una posterior dilatación del balón en una ubicación incorrecta, la cual terminó provocando un hemopericardio. El otro caso fallido fue un procedimiento transyugular, ante la imposibilidad de perforar la válvula por ser demasiado gruesa e hipoplásica, se derivó a valvulotomía quirúrgica y fístula sistémico-pulmonar (FSP) 6 días después.
No hubo ninguna muerte y el índice de complicaciones fue de 2/22 (9%). Al margen de la presencia de un hematoma cardiaco significativo (1er periodo), la otra complicación sobrevino con el abordaje transyugular [un flúter auricular que precisó cardioversión eléctrica (2º periodo)].
No se halló ningún factor (semana de gestación < 37, peso < 2,7kg, anillo de la VT o VP < –2,0, acceso venoso) asociado a las complicaciones
Seguimiento y reintervenciones en la cohorte exitosa
La figura 2 muestra un diagrama de los índices de tratamiento y reintervención de toda la cohorte.
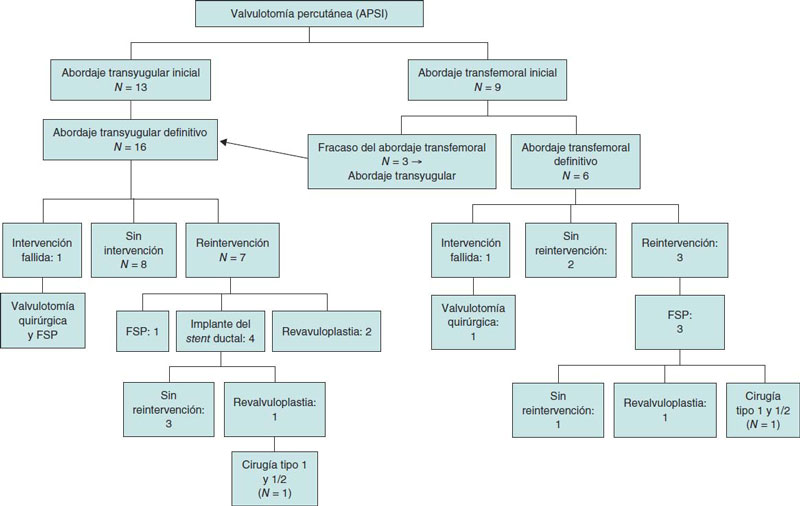
Figura 2. Tratamiento y reintervención de toda la muestra. APSI: atresia pulmonar con septo íntegro; FSP: fístula sistémico-pulmonar.
Se excluyó del seguimiento a los 2 casos fallidos enviados a cirugía.
La mediana de seguimiento fue de 9,39 años (3,97-11,94) [6,61 (3,67-10,29) y 13,9 (11,66-16,67) para los grupos transyugular y transfemoral, respectivamente]. Se debe mencionar que se hizo seguimiento de 10/20 pacientes (50%) durante más de 10 años. Durante dicho seguimiento, 10/20 pacientes (50%) necesitaron algún tipo de reintervención (4 implantes de stent ductal, 4 fístulas sistémico-pulmonares (SP) y 2 revalvuloplastias) a un tiempo mediano de 12 días (5,2-30). La mediana de tiempo para emplear una fuente adicional de flujo (4 fístulas SP, 4 implantes de stent ductal) fue de 7,5 días (desde el día de la intervención), 3,0 días para la fistula SP (0,87-13,75) y 13,5 días para el implante del stent ductal (6,25-18,5). Durante el periodo 2004-2011 todos los pacientes que precisaron una fuente adicional de flujo recibieron una fistula SP (n = 4) mientras que, de 2012 a 2022, los pacientes recibieron un implante del stent ductal (n = 4) siguiendo la nueva política del hospital.
La mediana de tiempo de la re-valvuloplastia como primera reintervención (n = 2) fue 4,4 meses. Otros 2 pacientes precisaron revalvuloplastia 3 y 9,5 meses después de la FSP e implante del stent ductal, respectivamente. Tres de los 10 pacientes que precisaron una nueva intervención eran del grupo transfemoral y 7 del transyugular. La tabla 2 compara a aquellos pacientes que no precisaron (n = 12) o sí (n = 8) una fuente adicional de flujo sanguíneo pulmonar. Se observó una correlación (p = 0,05) entre una ratio VD/presión sistémica < 150% previo al procedimiento (n = 7) y la necesidad de una fuente adicional de flujo pues 5/7 pacientes (71%) con ratios < 150% por solo 3/13 (23%) con ratios > 150% la necesitaron.
Tabla 2. Comparativa entre casos exitosos que precisaron, o no, una fuente adicional de flujo
| Fuente adicional de flujo (FAF) | Global | Sin necesidad de FAF | Con necesidad de FAF | p (prueba exacta de Fischer) | |||||
|---|---|---|---|---|---|---|---|---|---|
| Global (n) | 20 | 12 | 8 | – | |||||
| SG ≤ 37 | 5 (25%) | 4 | 1 | 0,31 | |||||
| Peso < 2,7 kg | 4 (20%) | 2 | 2 | 0,53 | |||||
| Índice z de la VP pre-flujo < -2,0 | 5 (25%) | 2 | 3 | 0,3 | |||||
| Índice z de la VT pre-flujo < -2,0 | 10 (50%) | 6 | 4 | 0,68 | |||||
| Ratio PVD/sistémica ≥ 150% | 13 (65%) | 10 | 3 | 0,05 | |||||
| Ratio PVD/sistémica < 150% | 7 (35%) | 2 | 5 | ||||||
| Gradiente ecocardiográfico residual al alta (≥ 25 mmHg); n = 19 | 8/19 (42%) | 5 | 3 | 0,66 | |||||
| IP al alta (mod/grave); n = 19 | 15/19 (79%) | 10 | 5 | 0,48 | |||||
| IP al alta (min-leve); n = 19 | 4/19 (21%) | 2 | 2 | ||||||
EP: estenosis pulmonar; FAF: fuente adicional de flujo; IP: insuficiencia pulmonar; kg, kilogramos; min: mínima; mod: moderada; PVD: presión del ventrículo derecho; SG: semana de gestación; VP: válvula pulmonar; VT: válvula tricúspide. | |||||||||
En líneas generales, en 18/20 (90%) pacientes se logró circulación biventricular y en 2/20 (10%) se practicó una reparación tipo ventrículo y medio (cirugía de anastomosis cavopulmonar superior bidireccional para posibilitar la descarga del ventrículo derecho) en una mediana de tiempo de 21,7 meses tras el procedimiento transcatéter inicial. Uno de estos 2 pacientes era del grupo transfemoral y el otro del transyugular. Ningún paciente siguió el camino de fisiología univentricular.
DISCUSIÓN
En pacientes con APSI y una anatomía adecuada, la descomprensión del VD mediante perforación precoz transcatéter de la VP puede fomentar el crecimiento y desarrollo funcional tanto del VD como de las arterias pulmonares, mejorando así las opciones de lograr una circulación biventricular1,3,17,19,21,24. En este contexto,
el abordaje más común descrito hasta la fecha ha sido el transfemoral4,5,8,13,15,19,20,23-25.
Aunque con una muestra muy modesta (n = 22), este estudio es, con diferencia, y hasta donde saben los autores, el primero que describe el uso del abordaje transyugular para perforar la VP en recién nacidos con APSI. Es, también, el primero en comparar los abordajes transyugular y transfemoral.
Comparado con otras series de casos que empleaban métodos mixtos para perforar la válvula1,2,4,11,25, el método de este estudio fue siempre la perforación mecánica mediante el uso de guías coronarias para OTC.
Los índices de éxito de las perforaciones mecánicas de la VP con guías coronarias para OTC o coronarias de otro tipo se sitúan entre el 73 y el 100%5,10,19. Considerando toda la muestra, el índice de éxito de nuestra cohorte fue del 91% (20/22). El caso transfemoral fallido sobrevino porque tanto la perforación como la dilatación se realizaron en un punto incorrecto del tracto de salida del ventrículo derecho. El caso transyugular fallido probablemente se debió a la incorrecta selección del caso puesto que la anatomía observada en la sala de hemodinámica resultó más desfavorable que la valorada por imágenes de ecocardiografía. Tanto el área anular como subvalvular eran más hipoplásicas y la membrana más gruesa a nivel de la VP. Estos hallazgos dificultaron enormemente las maniobras realizadas con los catéteres. Así pues, según lo visto en este caso y en otros estudios similares, la adecuada selección de casos es clave para el éxito del procedimiento1,2,14,15,19,20,24.
La perforación percutánea de la VP comporta importantes riesgos como la perforación del VD o del tronco pulmonar16. Algunos autores consideran que la perforación mecánica con una guía coronaria comporta un riesgo más alto comparada con las intervenciones por láser o radiofrecuencia10,12,19,20. No obstante, el menor diámetro de la guía para OTC y su microcatéter añadirían una ventaja adicional comparado con los diámetros más grandes de la guía de RF (0,016 pulgadas) y el microcatéter (0,024 pulgadas) provocando, por lo tanto, lesiones más pequeñas, a menudo, sin consecuencias significativas cuando la guía no está donde debe12. Además, las guía para OTC parecen proporcionar una mayor estabilidad al catéter y una mejor torqueabilidad y maniobrabilidad, lo que posibilita perforaciones más precisas y controladas12,19,20.
Hasta donde los autores conocen, la nuestra es la serie de recién nacidos con APSI más grande que existe en la que se empleó, solo, la perforación mecánica de la VP con guía coronaria para OTC. Teniendo en cuenta toda la muestra, se comunicaron 1/22 (4,5%) casos de perforación del tracto de salida del ventrículo derecho a consecuencia de la dilatación del balón. Cuando no se puede emplear la radiofrecuencia porque no está disponible o porque el procedimiento ha resultado fallido, la perforación mecánica de la VP con guías coronarias para OTC puede ser una opción atractiva a la vista de sus capacidades de penetración y menor coste, si bien puede suponer un desafío a nivel técnico8,12,19,20.
Comparativa entre los grupos transfemoral y transyugular
Hasta donde saben los autores, en ningún otro estudio publicado en la literatura médica existente se han realizado comparativas entre estos 2 abordajes. Así pues, según nuestras observaciones sobre el tiempo total de los procedimientos, los transyugulares se realizaron más rápidamente que los transfemorales (85 frente a 156 min) lo cual comportó, también, tiempos más cortos de fluoroscopia en el grupo transyugular (31 frente a 62 min). Según nuestra propia experiencia, el abordaje transyugular con el catéter Cobra parece aportar una buena estabilidad a la intervención, un mejor posicionamiento bajo las valvas de la VP y más soporte a la hora de perforar la válvula atrésica. Además de las razones expuestas, las diferencias temporales descritas entre los 2 grupos también se podrían deber a la curva de aprendizaje pues todos los casos transfemorales (n = 6) se realizaron durante el primer periodo mientras que 12/16 de los transyugulares se realizaron durante el segundo. El uso sistemático de la ecografía para canalizar el abordaje venoso central desde 2018 (n = 5) también pudo haber contribuido, en parte, a las diferencias temporales observadas.
Necesidad de una fuente adicional de flujo, re-valvuloplastia y seguimiento
El índice de reintervenciones descrito en diversas series de casos sigue siendo significativo (del 30 al 72%). Parece estar asociado, principalmente, a un mayor flujo sanguíneo pulmonar4,17,18,25. En nuestro estudio y de entre los procedimientos consideradas exitosos, 8 de cada 20 pacientes (40%) necesitaron intervenciones encaminadas a proporcionar una fuente adicional de flujo, un porcentaje algo menor que el descrito por Kim YH, Cho MJ o Hasan5,10,11. Se observó una cierta correlación, casi significativa a nivel estadístico (p = 0,05), entre ratios VD/presión sistémica < 150% previo al procedimiento (n = 7) y la necesidad de nuevas intervenciones encaminadas a proporcionar una fuente adicional de flujo puesto que 5/7 (71%) pacientes con ratios < 150% necesitaron una fuente adicional de flujo por solo 3/13 (23%) pacientes con ratios > 150%. Esta observación podría sugerir que estos ventrículos derechos, más disfuncionales e incapaces de generar presión, no llegarían a proporcionar un flujo pulmonar anterógrado adecuado tras la intervención. Ninguna otra variable se asoció a la necesidad de una intervención para proporcionar una fuente adicional de flujo. En cambio, otros estudios consideran que unos índices z de la TV más bajos son un factor de riesgo para estas intervenciones de fuente adicional de flujo11,13,15,18,23. Wang et al. también observaron que los diámetros de la VP más pequeños (mediana del índice z: –2,11) y los gradientes ecocardiográficos más altos 1 mes después del procedimiento podían ser factores de riesgo asociados a la realización de estas reintervenciones6.
Se debe mencionar que la mediana de seguimiento de nuestros pacientes fue de 9,39 años (39,7-11,94). Durante el seguimiento, 10/20 pacientes (50%) no precisaron una nueva intervención, un número mayor de pacientes que el descrito por Hasan (7/26, 27%), Schwartz (6/21, 29%) o Chen (7/36, 19%)11,13,25.
En lo referente al grupo de éxito (n = 20), salvo 2 pacientes, todos los demás lograron una circulación biventricular (90%), un índice similar al descrito en las series publicadas por Schwartz (18/19, 95%) o Chen (26/31 84%)13,25. Nuestros 2 casos con circulación no biventricular puntuaron –3 en el índice z de la VT, si bien la puntuación del índice z de la VP fue normal (–1,3 y +1,5, respectivamente). Chubb et al. indicaron que aquellos pacientes con índices z más bajos, tanto de la VT como de la VP, eran menos propensos a lograr una circulación biventricular4. Yoldas¸ indicó que índices z de la VP y VT de > –1,7 y > –1, respectivamente, eran buenos predictores de circulación biventricular en recién nacidos con APSI tratados con perforación de la VP por radiofrecuencia18.
Limitaciones
El pequeño tamaño de la muestra de pacientes con APSI de un único centro limita la potencial estadística del estudio hasta el punto de no poder extraer conclusiones definitivas. Además, dada su naturaleza retrospectiva, los 2 grupos finales (transyugular y transfemoral) no estuvieron equilibrados (16 frente a 6 pacientes) puesto que el abordaje transfemoral fue fallido en 3 de estos pacientes y hubo de cambiarse. Este desequilibrio limita la comparativa entre grupos y evita que podamos ser más concluyentes.
Además, todos los casos transfemorales se realizaron durante el primer periodo, lo cual implica un posible sesgo durante el “periodo de tiempo” también asociado a la curva de aprendizaje y al efecto de haber desarrollado mejoras en los materiales y técnicas de la intervención como la punción vascular ecoguiada (2018) o el cambio de primera opción para fuentes adicionales de flujo (implante del stent ductal en lugar de la fístula de Blalock Taussig) (2012 a 2022).
CONCLUSIONES
La perforación mecánica transcatéter de la VP en pacientes con APSI puede ser factible en manos expertas y una alternativa razonable a la cirugía cardiaca. La adecuada selección de casos parece ser clave en el éxito del procedimiento transcatéter. Según nuestra propia experiencia, comparado al abordaje transfemoral, el transyugular parece simplificar el procedimiento reduciendo los tiempos del mismo, así como los de fluoroscopia. No obstante, es necesario realizar nuevos y extensos estudios prospectivos que nos ayuden a corroborar estos hallazgos.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
M. Figueras Coll: idea y diseño del estudio, adquisición de datos e imágenes, análisis estadístico, redacción del artículo y aprobación de la versión final para su publicación. Asume toda responsabilidad sobre cualquier aspecto relacionado con el artículo. A. Fidalgo García: idea y diseño del estudio, análisis estadístico, colaboración en materia de redacción del artículo y aprobación de la versión final para su publicación. Asume toda responsabilidad sobre cualquier aspecto relacionado con el artículo. G. Martí Aguasca: diseño del estudio, provisión de la iconografía, colaboración en la redacción del artículo, revisión crítica de su contenido e interés intelectual y aprobación de la versión final para su publicación. Asume toda responsabilidad sobre cualquier aspecto relacionado con el artículo. P. Betrián Blasco: concepción y diseño del estudio, provisión de la iconografía, colaboración en la redacción del artículo, revisión crítica de su contenido e interés intelectual y aprobación de la versión final para su publicación. Asume toda responsabilidad sobre cualquier aspecto relacionado con el artículo.
CONFLICTOS DE INTERÉS
Ninguno.
¿QUÉ SE SABE DEL TEMA?
- La atresia pulmonar con septo íntegro (APSI) es una cardiopatía congénita cianótica rara pero grave. Durante las 2 últimas décadas, se ha observad un distanciamiento de la descompresión quirúrgica del ventrículo izquierdo y un acercamiento a un abordaje más transcatéter que ha reducido los índices de mortalidad. No obstante, no todos los casos de APSI son aptos para ser tratados mediante perforación transcatéter. Así, la adecuada selección de casos sigue siendo la pieza clave del éxito. En pacientes sin circulación coronaria dependiente del ventrículo derecho, hipoplasia VD leve o moderada y atresia pulmonar membranosa (no muscular), la perforación transcatéter de la VP puede ser una valiosa opción terapéutica para lograr una circulación biventricular.
¿QUÉ APORTA DE NUEVO?
- Hasta donde saben los autores, este es el primer estudio en describir el abordaje transyugular para perforación de la válvula pulmonar en recién nacidos con APSI y la anatomía adecuada. También es el primero en comparar los resultados obtenidos con el abordaje transfemoral o transyugular. Según nuestra propia experiencia, este último es seguro y eficaz, simplifica el procedimiento y reduce los tiempos tanto de intervencionismo como de fluoroscopia.
BIBLIOGRAFÍA
1. Humpl T, Söderberg B, McCrindle BW, et al. Percutaneuos balloon valvotomy in pulmonary atresia with intact ventricular septum: impact on patient care. Circulation. 2003;108:826-832.
2. Agnoletti G, Piechaud JF, Bonhoeffer P, et al. Perforation of the atretic pulmonary valve. Long-term follow-up. J Am Coll Cardiol. 2003;41:1399-1403.
3. Qureshi SA. Catheterization in neonates with pulmonary atresia with intact ventricular septum. Catheter Cardiovasc Interv. 2006;67:924-931.
4. Chubb H, Pesonen E, Sivasubramanian S, et al. Long-term outcome following catheter vavlotomy for pulmonary atresia with intact ventricular septum. J Am Coll Cardiol. 2012;59:1468-1476.
5. Kim YH. Pulmonary valvotomy with echocardiographic guidance in neonates with pulmonary atresia and intact ventricular septum. Catheter Cardiovasc Interv. 2015;85:E123-8.
6. Wang Q, Wu YR, Zhang LN, et al. Evaluating the risk factors of reintervention of neonates with PA/IVS and CP/IVS after PBPV as initial intervention method. J Cardiol. 2016;68:190-195.
7. Wright LK, Knight JH, Thomas AS, Oster ME, St Louis JD, Kochilas LK. Long-term outcomes after intervention for pulmonary atresia with intact ventricular septum. Heart. 2019;105:1007-1013.
8. Kamalı H, Tanıdır ጐC, Erdem A, Sarıtas¸ T, Güzeltas¸ A. The Use of Chronic Total Occlusion (CTO) Wires for Perforation of Atretic Pulmonary Valve; Two Centers Experience. Pediatr Cardiol. 2021;42:1041-1048.
9. Li QZ, Cao H, Chen Q, Zhang GC, Chen LW, Chen DZ. Balloon valvuloplasty through the right ventricle: another treatment of pulmonary atresia with intact ventricular septum. Ann Thorac Surg. 2013;95:1670-1674.
10. Cho MJ, Ban KH, Kim MJ, Park JA, Lee HD. Catheter – based treatment in patients with critical pulmonary stenosis or pulmonary atresia with intact ventricular septum: a single institute experience with comparison between patients with and without additional procedure for pulmonary flow. Congenit Heart Dis. 2013;8:440-449.
11. Hasan BS, Bautista-Hernandez V, Mc Elhinney DB, et al. Outcomes of transcatheter approach for initial treatment of pulmonary atresia with intact ventricular septum. Catheter Cardiovasc Interv. 2013; 81:111-118.
12. Alwi M, Budi RR, Mood MC, Leong MC, Samion H. Pulmonary atresia with intact septum: the use of Conquest Pro coronary guidewire for perforation of atretic valve and subsequent interventions. Cardiol Young. 2013;23:197-202.
13. Schwartz MC, Glatz AC, Dori Y, Rome JJ, Gillespie MJ. Outcomes and predictors of reintervention in paitents with pulmonary atresia and intact ventricular septum treated with radiofrequency perforation and ballon pulmonary valvuloplasty. Pediatr Cardiol. 2014;35:22-29.
14. El Shedoudy S, El-Doklah E. Transcatheter perforation of atretic pulmonary valve by the stiff end of a coronary wire in neonates with pulmonary atresia with intact ventricular septum: A solution in developing countries. J Saudi Heart Assoc. 2018;30:222-232.
15. Hascoët S, Borrhomée S, Tahhan N, et al. Transcatheter pulmonary valvulplasty in neoantes with pulmonary atresia and intact ventricular septum. Arch Cardiovasc Dis. 2019;112:323-333.
16. Asnes JD, Fahey JT. Novel catheter positioning technique for atretic pulmonary valve perforation. Catheter Cardiovasc Interv. 2008;71:850-852
17. Morgan GJ, Narayan SA, Goreczny S, et al. A low threshold for neonatal intervention yields a high rate of biventricular outcomes in pulmonary atresia with intact ventricular septum. Cardiol Young. 2020;30:649-655.
18. Yoldas¸ T, Örün UA, Dog˘an V, et al. Transcatheter radiofrequency pulmonary valve perforation in newborns with pulmonary atresia/intact ventricular septum: Echocardiographic predictors of biventricular circulation. Echocardiography. 2020;37:1258-1264.
19. Haddad RN, Saliba Z. Optimal management of pulmonary atresia with intact ventricular septum in a developing country: the art of pulmonary valve mechanical perforation in the era of CTO hardware. Am J Cardiovasc Dis. 2021;11:21-28.
20. Bakhru S, Marathe S, Saxena M, et al. Transcatheter pulmonary valve perforation using chronic total occlusion wire in pulmonary atresia with intact ventricular septum. Ann Pediatr Cardiol. 2017;10:5-10.
21. Haddad RN, Hanna N, Charbel R, Daou L, Chehab G, Saliba Z. Ductal stenting to improve pulmonary blood flow in pulmonary atresia with intact ventricular septum and critical pulmonary stenosis after balloon valvuloplasty. Cardiol Young. 2019;29:492-498.
22. Rosenthal E, Qureshi SA, Chan KC, et al. Radiofrequency-assisted balloon dilatation in patients with pulmonary valve atresia and an intact ventricular septum. Br Heart J. 1993;69:347-351.
23. Marasini M, Gorrieri PF, Tuo G, et al. Long-term results of cathter-based treatment of pulmonary atresia and intact ventricular septum. Heart. 2009;
95:1520-1524.
24. Rathgeber S, Auld B, Duncombe S, Hosking MC, Harris KC. Outcomes of radiofrequency perforation for pulmonary atresia and intact ventricular septum: A single-centre experience. Pediatr Cardiol. 2017;38:170-175.
25. Chen RHS, K T Chau A, Chow PC, Yung TC, Cheung YF, Lun KS. Achieving biventricular circulation in patients with moderate hypoplastic right ventricle in pulmonary atresia intact ventricular septum after transcatheter pulmonary valve perforation. Congenit Heart Dis. 2018;13:884-891.
* Autor para correspondencia.
Correo electrónico: mfiguerascoll@gmail.com (M. Figueras Coll).