RESUMEN
La coronariografía es el método de elección para el estudio de la anatomía coronaria en la práctica clínica diaria. Las diferentes modalidades de imagen intracoronaria permiten valorar en tiempo real la anatomía de la pared arterial coronaria. Sobre esta base, la tomografía de coherencia óptica y la ecografía intravascular tienen un impacto positivo en el diagnóstico y en el intervencionismo percutáneo. La presente revisión proporciona un resumen de las técnicas de imagen intracoronaria basadas en la evidencia actual disponible.
Palabras clave: Ecografía intravascular. Tomografía de coherencia óptica. Coronariografía.
ABSTRACT
Invasive coronary angiography is the standard approach in the routine clinical practice. Intracoronary imaging modalities provide real-time images of intracoronary anatomy. On this basis, optical coherence tomography and intravascular ultrasound have a positive impact on diagnosis and percutaneous coronary intervention. This summary pro e imaging modalities for the interventional and clinical cardiologist with the currently available evidence.
Keywords: Intravascular ultrasound. Optical coherence tomography. Invasive coronary angiography.
Abreviaturas ETCI: enfermedad de tronco común izquierdo. ICP: intervención coronaria percutánea. IIC: imágenes intracoronarias. IVUS: ecocardiografía intravascular. MACE: eventos adversos cardiovasculares mayores. OCT: tomografía de coherencia óptica. OTC: oclusión coronaria total crónica.
INTRODUCCIÓN
La enfermedad coronaria sigue siendo la principal causa de muerte en todo el mundo y tiene un amplio abanico de presentación dada su naturaleza dinámica1. La coronariografía es el patrón oro que se emplea para evaluar la presencia y gravedad de la enfermedad coronaria. Se ve, no obstante, limitada por la valoración cualitativa, si bien se han hecho avances en este sentido como, por ejemplo, la coronariografía cuantitativa2. Durante las últimas décadas se han desarrollado nuevas técnicas de imágenes de evaluación coronaria para mejorar los resultados clínicos de los pacientes3.
Las imágenes intracoronarias (IIC) no solo proporcionan información detallada sobre aquellos aspectos que contribuyen a la patogénesis de la enfermedad coronaria, sino que también ayudan a guiar el proceso de toma de decisiones. Tanto la ecocardiografía intravascular (IVUS) como la tomografía de coherencia óptica (OCT) generan imágenes transversales de las coronarias a tiempo real. Datos de estudios clínicos sugieren mejores resultados cuando las intervenciones coronarias percutáneas (ICP) complejas se realizan guiadas por IIC4,5. Las guías de práctica clínica europeas y norteamericanas sobre la revascularización miocárdica le asignan una recomendación clase II (American College of Cardiology/American Heart Association: clase IIa6 y Sociedad Europea de Cardiología: clase IIa) a la ICP guiada por IVUS7, siendo la ICP guiada por OCT una alternativa salvo en casos de enfermedad de tronco común izquierdo ostial6,7. Su uso, no obstante, no se ha extendido por igual en todo el mundo.
La presente revisión pretende resumir la evidencia actualmente disponible mediante una descripción de todas las posibles ventajas y desventajas de ambas técnicas de imágenes basadas en catéter en la práctica clínica habitual.
TÉCNICAS DE IMÁGENES
IVUS
Los catéteres IVUS son de intercambio rápido y constan de un cristal piezoeléctrico que genera ondas de sonido a través de transductores cuando se excita eléctricamente. Las ondas de sonido se propagan por los diferentes tejidos y se reflejan en las superficies en función de las propiedades acústicas del tejido en cuestión. Las ondas de choche que retornan se formatean en imágenes a escala de grises con resolución mediante contraste dinámico. Esta técnica de imágenes permite al cardiólogo intervencionista evaluar la integridad de la pared vascular, caracterizar la composición de los tejidos y abordar cualquier problema que pudiera presentarse durante la ICP (como por ejemplo la mala aposición e infraexpansión del stent)8.
La calidad de las imágenes depende de la onda de sonido y del transductor, así como de las propiedades de los tejidos. La resolución de las imágenes resultantes es mayor a distancias más cortas (campo cercano), aunque no es tan clara en campos profundos (campo lejano) por la dispersión de los rayos. Las propiedades del flujo también hacen que sea más difícil distinguir la luz de los tejidos. Tanto los catéteres mecánicos como los rotacionales tra-bajan a frecuencias de entre 40 y 60 MHz, a diferencia de los electrónicos, que trabajan a 20 MHz y tienen más resolución axial y lateral. En líneas generales, las mejores imágenes se obtienen cuando el catéter es coaxial al vaso, el rayo es perpendicular a la lesión y las luces son más nítidas8,9.
La adquisición de imágenes IVUS se debe llevar a cabo de forma rutinaria con anticoagulación IV y nitratos intracoronarios para evitar complicaciones asociadas al dispositivo5. La interrogación de los vasos se puede realizar mediante pullbacks manuales o automáticos empezando, como mínimo, a 10 mm en sentido distal a la lesión diana hasta que pueda verse la aorta o el catéter guía. En el caso de lesiones aortoostiales, el catéter guía se debe retirar para desenmascarar lesiones ostiales. Los pullbacks automáticos tienen la ventaja de proporcionar mediciones de la longitud de la lesiones, que se calcula a partir del tiempo medio y de la velocidad del pullback. Se consideran lesiones múltiples aquellas en las que la distancia es > 5 mm dentro del mismo segmento coronario. No obstante, la orientación espacial es una limitación muy importante8,9. Las características principales se muestran en la tabla 1 y tabla 2.
Tabla 1. Características generales de las técnicas de imágenes intracoronarias
| Técnica de imágenes intracoronarias | Fuente de las imágenes | Frecuencia (Mhz) | Longitud de onda (µm) | Catéter guía mínimo (Fr) | Resolución axial (µm) | Resolución lateral (µm) | Penetración en los tejidos (mm) | Longitud del pullback (mm) | Velocidad del pullback (mm/seg) |
|---|---|---|---|---|---|---|---|---|---|
| IVUSa | Ecografía | 20-60 | 40-50 | 5 | 20-170 | 50-260 | 3-8 | 100 | 0,5-10 |
| OCTb | Luz infrarroja | NA | 1,3 | 5 | 15-20 | 20-40 | 1-3 | 75 | 10-40 |
| Híbrido (OCT/IVUS)c | Ecografía y luz infrarroja | 40 | 1,3 | 5 | 200/15 | 200/30 | 3-8 | 100-150 | 0,5-40 |
IVUS: ecocardiografía intravascular; OCT: tomografía de coherencia óptica; NA: no aplicable. a Incluye OptiCross (Boston Scientific, Estados Unidos), Volcano (Philips, Estados Unidos), Infraredx (Burlington, Estados Unidos), ACIST Cvi (ACIST, Estados Unidos) y Fastview (Terumo, Japón). b Incluye OPTIS (Abbott Vascular, Estados Unidos) y Lunawave (Terumo, Japón). c Incluye Novasight Hybrid (Conavi Medical, Canadá) y Dual Sensor (Terumo, Japón). | |||||||||
Tabla 2. Principales ventajas y desventajas de las técnicas de imágenes intracoronarias
| Ecocardiografía intravascular | Ecocardiografía intravascular |
|---|---|
| • Más capacidad de penetración y de valoración del volumen de placa y placas más profundas | • Mayor resolución, menos artefactos y facilita la identificación de detalles sutiles |
| • Menor resolución | • Menor capacidad de penetración; no apta para la evaluación de lesiones ostiales |
OTC: oclusiones coronarias totales crónicas; ETCI: enfermedad de tronco común izquierdo. | |
Durante los últimos años, se han descrito los esfuerzos que se han ido haciendo por explorar los posibles beneficios de IVUS sobre coronariografía con resultados prometedores. En un reciente metanálisis de 27.610 pacientes que comparó ICP guiadas por IVUS o por coronariografía, la IVUS se asoció a menos mortalidad cardiovascular (cociente de tasas de incidencia [RR], 0,63; intervalo de confianza del 95% [IC95%], 0,54–0,73) y complicaciones asociadas a la ICP. El riesgo de infarto de miocardio (RR = 0,71; IC95%, 0,58–0,86), revascularización de la lesión diana (RR = 0,81; IC95%, 0,70–0,94) y trombosis intratent (RR = 0,57; IC95%, 0,41–0,79), también fue menor en las ICP guiadas por IVUS10.
Tomografía de coherencia óptica
La OCT genera imágenes mediante luz infrarroja (longitud de onda, 1,3 μm). Comparada con la IVUS, esta técnica de imágenes ofrece mayor resolución axial (10-20 frente a 50-150 μm) pero con una penetración limitada en los tejidos blandos (1-2 frente a 5-6 mm salvo para la evaluación del calcio)3,4,11.
Los dispositivos actuales son compatibles con 5 Fr a través de un sistema de intercambio rápido que, también, permite pullbacks automáticos con corregistro de imágenes de angiografía y mediciones automáticas de la luz y detección del calcio. La calidad de las imágenes depende de la interacción de la luz con los tejidos circundantes (demora en el tiempo de eco). Como tal, la reflexión, refracción y atenuación de la luz (absorción) determinan la resolución final de las imágenes. Tanto los dispositivos metálicos como las placas fibróticas se consideran potentes reflectores en contraposición al calcio y a los núcleos necróticos que se consideran malos reflectores (ricos en lípidos). Los glóbulos rojos provocan la dispersión de la luz que requiere el lavado del contraste, lo cual provoca la aparición de una imagen de «seudotrombo» con mal aclaramiento sanguíneo.
Las imágenes de OCT también se suelen obtener mediante la administración de anticoagulación IV y nitratos intracoronarios para evitar complicaciones. El estudio de los vasos se inicia a 10 mm en sentido distal a la lesión diana, se purga el catéter con contraste y, después se hace un pullback automático con corregistro (si está disponible). La velocidad media del pullback de 10-40 mm/s normalmente permite administrar 1 único bolo de contraste para conseguir un entorno libre de sangre12. Las características generales de la OCT se muestran en la tabla 1 y tabla 2.
Comparada con la ICP guiada por coronariografía, estudios observacionales han sugerido un posible beneficio de la ICP guiada por OCT, con incidencias más bajas de eventos cardiovasculares adversos mayores (MACE) y complicaciones asociadas al stent13. Además, la OCT proporciona imágenes más fiables y reproducibles, con menor variabilidad interobservador que la IVUS. En este sentido, la OCT sería superior a la hora de valorar el stent y los diámetros de la luz14,15.
ESCENARIOS ESPECÍFICOS
Síndromes coronarios agudos
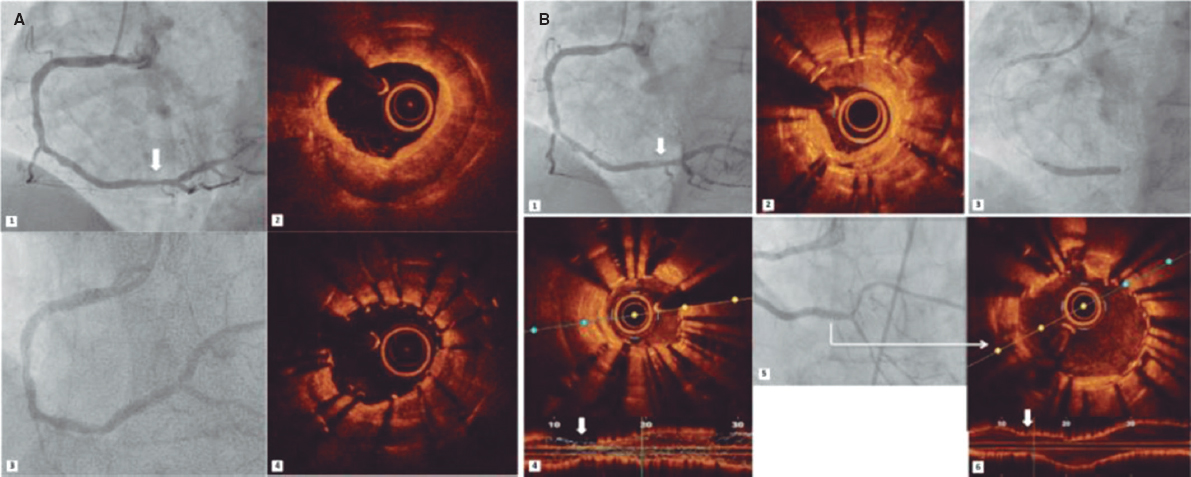
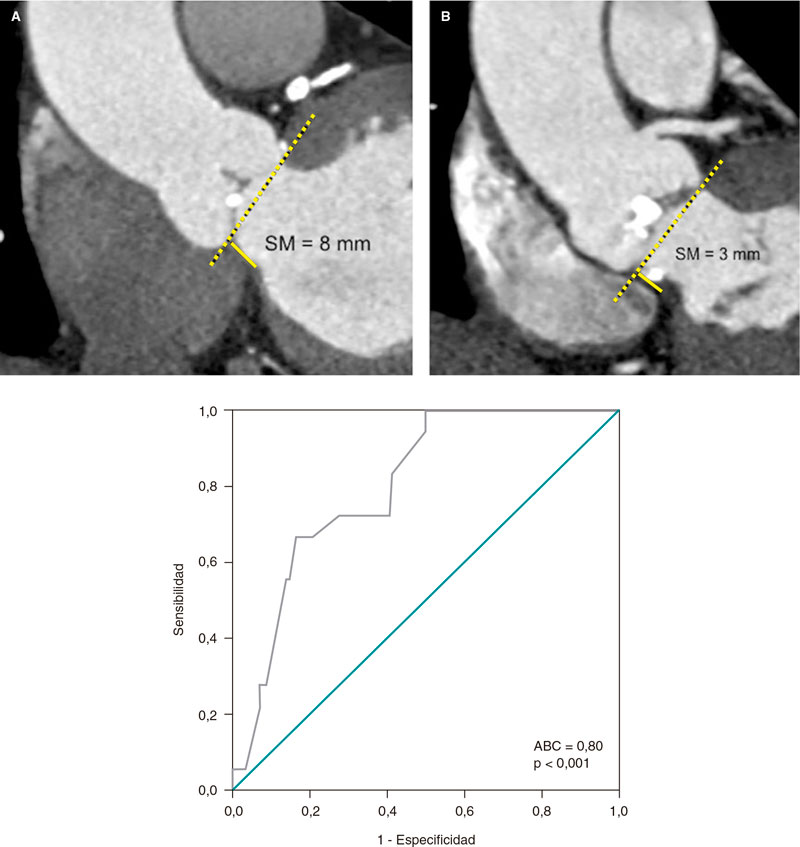
Los síndromes coronarios agudos se suelen deber a trombosis coronarias provocadas por la rotura o erosión de la placa o la presencia de un nódulo calcificado eruptivo16. Hacer un diagnóstico preciso puede llegar a tener implicaciones pronósticas. La rotura de la placa se asocia a una incidencia más alta de ausencia de flujo miocárdico y embolización distal. La erosión de la placa se puede tratar de modo conservador ante la presencia de estenosis no críticas. Los nódulos calcificados se asocian a una incidencia más alta de reestenosis y trombosis intrastent17 (figura 1).
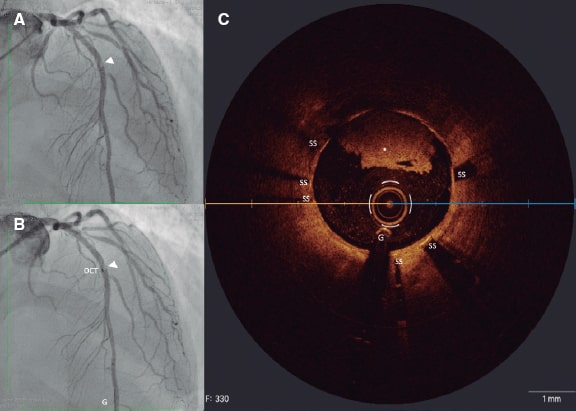
Figura 1. Trombosis intrastent. A: defecto de llenado (cabeza de flecha) en el segmento medio de la descendente anterior en el plano oblícuo anterior derecho. B: co-registro de tomografía de coherencia óptica y angiografía. C: imagen transversal mediante OCT de una trombosis intrastent no oclusiva (asterisco blanco). G: guía; OCT: tomografía de coherencia óptica; SS: struts del stent.
La OCT se suele usar para la identificación perioperatoria de le-siones culpables tras una meticulosa evaluación de las características morfológicas del casquete fibroso18. El algoritmo de clasificación de placas mediante OCT las clasifica según el estado de los casquetes fibrosos: intacto en presencia de erosión de la placa y alterado en presencia de placas rotas o nódulos calcificados. La OCT también se usa para determinar la carga trombótica sin tener que establecer cuál es la lesión culpable. No obstante, una reciente publicación que comparó la espectroscopia de infarrojo cercano con IVUS y OCT en 276 pacientes confirmó que la primera es capaz de caracterizar de forma precisa las lesiones culpables tras haber hecho lo propio con el calcio, la cavidad de la placa y el índice máximo de carga del núcleo lipídico, con una sensibilidad y especificidad del 93 y 100%, respectivamente19.
Además, los datos avalan la preferencia de la ICP guiada por IIC para mejorar los resultados en el tratamiento del síndrome coronario agudo. Un metanálisis de 26.610 pacientes comunicó un beneficio neto derivado del uso de IVUS con independencia de la presencia de síndrome coronario agudo y una incidencia más baja de MACE (RR = 0,57; IC95%, 0,41-0,79) frente a la ICP guiada por coronariografía10. Asimismo, un registro observacional coreano de 11.731 pacientes en tratamiento con ICP primaria comunicó una menor incidencia de mortalidad cardiovascular, reinfarto del vaso diana y revascularización de la lesión diana con la intervención guiada tanto por IVUS como por OCT20.
Lesiones coronarias en bifurcación
Las lesiones coronarias en bifurcación se dan entre el 15 y el 20% de todos los pacientes tratados con ICP21. El principal reto en el tratamiento de lesiones coronarias en bifurcación es seleccionar la estrategia ICP adecuada para evitar el fracaso de la lesión diana o la oclusión de ramas laterales. La importancia de realizar una evaluación exhaustiva resulta evidente con la enfermedad de tronco común izquierdo (ETCI) distal. El European Bifurcation Club recomienda el uso de imágenes intracoronarias para tratar lesiones bifurcadas22.
El riesgo de compromiso de las ramas laterales puede minimizarse tanto con la IVUS como con la OCT con solo seleccionar el stent adecuado (tipo y tamaño), la zona de anclaje y evaluar los resultados post-ICP (expansión y aposición del stent; disección distal). Las imágenes intracoronarias pueden identificar carinas «puntiagudas» en casos de ETCI distal, lo cual se asocia a reestenosis secundarias al desplazamiento de la carina. También se han descrito otros predictores del compromiso de ramas laterales con IVUS (área luminal mínima de las ramas laterales y carga de placa)19 y OCT (ángulos < 50º y longitudes punto en rama hasta punta de carina < 1,70 mm)23.
Además, las 2 técnicas de imágenes se pueden emplear para estimar el tamaño del stent en lesiones bifurcadas; no obstante, se recomienda evitar que las zonas de anclaje sean áreas con alta carga de placa o placas lipídicas en las que ambas técnicas son útiles. En líneas generales, las IIC también resultan útiles para tratar bifurcaciones con ICP porque ayudan a comprobar la entrada de la guía en ramas laterales, la calcificación, la longitud de la lesión y las complicaciones posimplante de stent que podrían interferir en los resultados clínicos22. En la actualidad, hay 2 estudios en curso que están analizando el papel de la OCT en pacientes con lesiones en bifurcación (NCT03171311; NCT03507777).
Calcificación coronaria
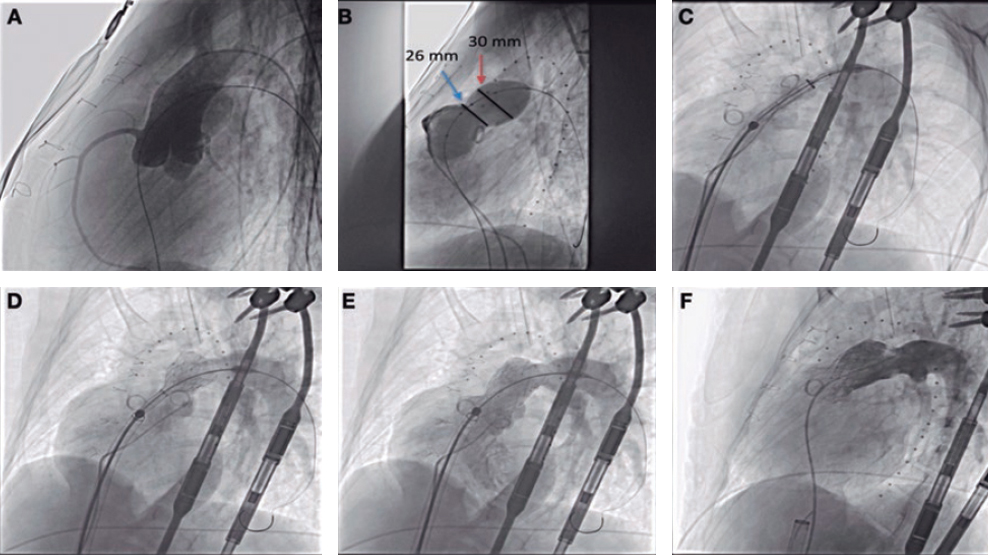
La calcificación coronaria aumenta la complejidad de la ICP dificultando el despliegue, expansión y aposición del stent, lo cual a su vez aumenta el riesgo de trombosis y reestenosis del stent.24 La coronariografía es capaz de detectar, con una sensibilidad entre baja y moderada, la presencia de calcificación coronaria siendo visibles los casos graves sin movimiento cardiaco ni inyección de contraste25.
Las placas calcificadas se muestran como estructuras hiperecoicas con una sombra acústica característica en la IVUS (figura 2)8. Con la IVUS se puede hacer una evaluación cuantitativa (ángulo y longitud), semicuantitativa (ausente o distribuida en cuadrantes) y cualitativa (profundidad de la sombra acústica según el grosor de la placa y la íntima media) de la calcificación coronaria25. Un estudio que comparó IVUS y coronariografía en 67 lesiones de oclusiones coronarias totales crónicas (OTC) descubrió que la IVUS fue superior en la identificación de los depósitos de calcio (96 frente al 61%)26. Aunque la IVUS no puede evaluar las microcalcificaciones (> 5 μm) sí puede calcular la profundidad o el grosor de los depósitos de calcio25.
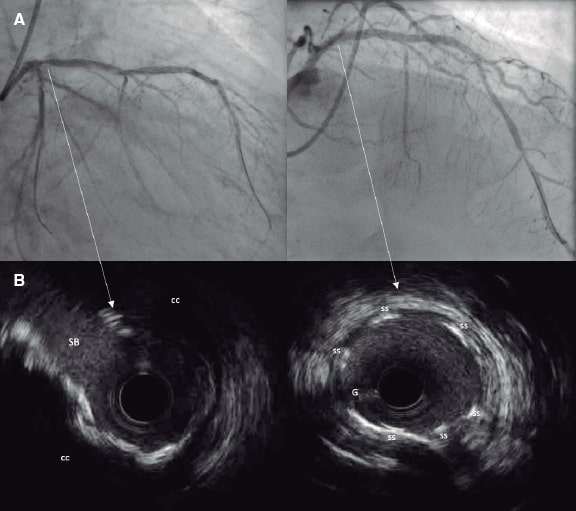
Figura 2. Imágenes mediante coronariografía (A) y ecocardiografía intravascular (B) de descendente anterior ostial con presencia de calcificación coronaria concéntrica grave. Los paneles C y D muestran los resultados inmediatos tras el implante definitivo del stent. CC: calcificación concéntrica; G: guía; SS: struts del stent.
En la OCT, la calcificación aparece como una estructura heterogénea con bordes bien definidos, algo que podría usarse para compensar alguna de las limitaciones de la IVUS. Aunque la OCT penetra menos en los tejidos25, la evaluación que hace del grosor, área y volumen del calcio es más precisa y fiable27.
El análisis de las IIC de las características del calcio resulta ilustrativo para poder hacer una planificación eficiente y evitar la infraexpansión o mala aposición del stent28,29. Por tanto, circunferencias de calcio > 180º, grosores > 0,5 mm o longitudes > 5 mm en las IIC deben recibir tratamientos adyuvantes de modificación de la placa30. El análisis OCT de 31 pacientes del estudio Disrupt CAD reveló que las características del calcio fueron el principal mecanismo de acción de la litotripsia coronaria observándose una tendencia hacia una expansión más adecuada del stent31. Se observaron resultados parecidos con la aterectomía rotacional en un estudio que analizó 88 lesiones calcificadas con ambas técnicas de IIC y que confirmó que la aterectomía rotacional guiada por OCT tuvo menores expansiones del stent (83 frente a 72%; p = 0,0004) con índices similares de supervivencia al año de seguimiento32. No obstante, la IVUS podría ser de ayuda durante una ICP en el tratamiento de la enfermedad del tronco común izquierdo33, donde una primera valoración ayuda a identificar cuál debería ser la técnica óptima de modificación de la placa que debería emplearse34.
Lesiones de oclusión coronaria total crónica
La prevalencia de las OTC es del 20% en pacientes con enfermedad coronaria. Realizar una ICP en una OTC puede mejorar los síntomas, la capacidad de hacer ejercicio y la calidad de vida de los pacientes35. El índice de éxito de intervenciones realizadas en OTC está entre el 70 y 90%. No obstante, cuanto mejor sea la planificación, mejores resultados podrán alcanzarse36,37.
La IVUS proporciona una forma adecuada y más eficaz de evaluar las características de la OTC (ambigüedad del casquete, longitud de la lesión y calcificación) lo cual permite reentradas óptimas a la luz verdadera mediante abordaje anterógrado y retrógrado38. Los estudios que han comparado IVUS frente a coronariografía en ICP realizadas en OTC ofrecen resultados contradictorios en lo que a la incidencia de MACE se refiere (tabla 3)39-41. Además, la IVUS ha demostrado ser capaz de predecir la reestenosis en ICP realizadas en OTC en las que diámetros luminales mínimos tras la intervención de ≤ 2,4 mm e índices de expansión del stent del ≤ 70% fueron predictores independientes de reestenosis post-ICP en el seguimiento a medio plazo, sobre todo, en OTC complejas42. Una de las principales limitaciones de las ICP guiadas por IVUS y realizadas en OTC son los artefactos que provoca la renderización del calcio que complican la interpretación de las imágenes38.
Tabla 3. Coronariografía invasiva frente a imágenes intracoronarias para realizar intervenciones coronarias percutáneas en oclusiones coronarias totales crónicas
| Referencia | Tipo de estudio | IVUS frente a C (n) | Objetivo primario | Objetivos secundarios |
|---|---|---|---|---|
| Tian et al.39 | ECA prospectivo | 130 frente a 130 | Pérdida luminal tardía intrastent | • Incidencia de la reestenosis intrastent (3,9 frente al 13,7%; p = 0,021) |
| Hong et al.40 | Retrospectivo | 206 frente a 328 | Trombosis intrastent | • Incidencia similar de MACE en la cohorte emparejada |
| Kim et al.41 | ECA | 201 frente a 201 | Mortalidad cardiovascular | • Menos MACE (HR = 0,35; IC95%, 0,13–0,97) y trombosis intrastent (0 frente al 1,5%; p = 0,11) en ICP guiadas por IVUS |
C: coronariografía; ECA: ensayo controlado aleatorizado; ICP: intervención coronaria percutánea; IVUS: ecocardiografía intravascular; MACE: eventos cardiovasculares adversos mayores. | ||||
El principal obstáculo de las OCT empleadas para guiar la ICP que se realizan en OTC es la necesidad de lavado de contraste y la propagación de las disecciones debido a la necesidad de aclaramiento sanguíneo, razón por la cual se ha considerado una técnica de imágenes poco apropiada. No obstante, esta técnica de imágenes sí podría emplearse en la optimización de la ICP de OTC y monitorizaciones durante el seguimiento. Un estudio retrospectivo confirmó un índice más alto de mala aposición del stent y struts no cubiertos a los 6 meses tras estudios OCT realizados en pacientes con ICP exitosas realizadas en OTC43. El registro ALSTER-OCT-OTC obtuvo resultados similares tras analizar 111 lesiones mediante OCT confirmando un mayor índice de struts del stent mal apuestos y sin cubrir en OTC que aquellas sin OTC tras 12 meses de seguimiento44.
Aneurismas coronarios
Los aneurismas coronarios suelen ser silentes, a nivel clínico, y se suelen identificar en el 5% de todos los pacientes sometidos a coronariografía. Las causas más frecuentes son la aterosclerosis en adultos y la enfermedad de Kawasaki en niños. El aneurisma coronario se define como una dilatación focal de, al menos, > 1,5 veces la coronaria normal adyacente. Por otro lado, la dilatación difusa se considera ectasia coronaria. A nivel morfológico, si se analizan desde su diámetro máximo, pueden observarse aneurismas saculares y fusiformes teniendo los primeros un diámetro más transversal que longitudinal45.
Decir cuál es la técnica de IIC óptima sigue siendo un asunto controvertido. No obstante, tradicionalmente, la IVUS es el abordaje preferido para el análisis y seguimiento del aneurisma coronario en la enfermedad de Kawasaki. La mayor capacidad de penetración de la IVUS permite evaluar el diámetro del vaso. También distingue, de forma precisa, los falsos de los verdaderos aneurismas al identificar el abombamiento de 1 sola capa. Se recomienda llevar a cabo una planificación preoperatoria guiada por IVUS puesto que la coronariografía suele infradimensionar los aneurismas45.
Dionne et al. realizaron un análisis de aneurismas coronarios empleando la OCT en una población pediátrica con historia clínica de enfermedad de Kawasaki. La OCT demostró ser segura, ofreciendo hallazgos similares (hiperplasia intimal, fibrosis y disrupción de la lámina media) en lesiones aneurismáticas comparada con anteriores estudios histopatológicos. No obstante, estos hallazgos también se observaron en segmentos coronarios no aneurismáticos, lo cual explicaría el mayor riesgo de isquemia de pacientes con historia clínica de enfermedad de Kawasaki46.
Enfermedad de tronco común izquierdo
La prevalencia de la ETCI es del 4%. Tradicionalmente, la cirugía de revascularización coronaria ha sido el tratamiento estándar, pero cada vez hay más evidencias que avalan a la ICP47. Elegir la técnica de imágenes adecuada es importante para saber, de forma precisa, qué grado de importancia clínica tiene la ETCI. La coronariografía sigue siendo la técnica de evaluación por excelencia, si bien está sujeta a una variabilidad inter e intraobservador alta en lo que a la detección de lesiones intermedias se refiere (entre el 30 y el 70%)48. En consecuencia, las imágenes intracoronarias mejoran tanto la valoración de la ETCI como los resultados a largo plazo.
La importancia que tiene la IVUS en la evaluación de la anatomía de la ETCI es evidente por su mayor capacidad de penetración en los tejidos, lo cual permite evaluar mejor la placa. Estudios publicados (tabla 4) confirmaron la presencia de ETCI significativa con áreas luminales mínimas entre 6 y 9 mm2 calculadas mediante IVUS33,49 con valores < 6 mm2 mostrando una buena correlación con valores de la reserva fraccional de flujo < 0,7550. No obstante, se han descrito áreas más pequeñas en la población asiática51. Un estudio prospectivo y multicéntrico que evaluó la ETCI mediante IVUS confirmó una incidencia similar de eventos cardiovasculares a los 2 años en pacientes revascularizados con áreas luminales mínimas (ALM) < 6 mm2 (5,5%) y con ALM ≥ 6 mm2 (2,3%) con diferimiento de la revascularización33. Así pues, ETCI angiográficamente ambiguas con ALM > 6 mm2 según la IVUS pueden considerarse no isquémicas y aquellas con ALM ≤ 4,5 mm2, generadoras de isquemia. No obstante, en aquellas ETCI con ALM entre 4,5 y 6 mm2, se necesitan herramientas de evaluación invasivas o no invasivas para descartar la presencia de isquemia en curso52.
Tabla 4. Resumen de los estudios que evaluaron imágenes coronarias invasivas para valorar la enfermedad del tronco común izquierdo
| Referencia | Tipo de estudio | Uso de IIC | Tiempo de seguimiento | Resultados |
|---|---|---|---|---|
| De la Torre Hernandez et al.33 | Multicéntrico y prospectivo | IVUS | 2 años | Diferir ICP con ALM > 6 mm2 es seguro |
| Fassa et al.49 | Prospectivo | IVUS | 3 años | Diferir ICP con ALM ≥ 7,5 mm2 es seguro |
| Jasti et al.50 | Prospectivo | IVUS | 3 años | ALM < 5,9 mm2 está bien correlacionado con valores de FFR < 0,75 |
| Park et al.51 | Prospectivo | IVUS | NA | Valores de FFR < 0,8 mantuvieron una buena correlación con ALM |
ALM: área luminal mínima; ICP: intervención coronaria percutánea; IIC: imágenes intracoronarias; IVUS: ecocardiografía intravascular. | ||||
Estudios publicados han demostrado que cargas de placa > 60% fuera del contexto de la ETCI son un predictor de MACE reconocible durante la valoración del riesgo de eventos futuros tras ICP4. Mediante análisis IVUS, se pudo observar que a mayor carga de placa en la ETCI, mayor carga de placa a nivel general en el árbol coronario53. No obstante, según el estudio PROSPECT, una mayor carga de placa no se asoció a una mayor incidencia de MACE a diferencia de la carga de placa generalizada (HR = 1,06; IC95%, 1,01–1,11; p = 0,02)54. Así pues, la evaluación de la carga de placa de la ETCI mediante IVUS es capaz de identificar a pacientes de alto riesgo con enfermedad aterosclerótica sin ETCI asociada.
El papel que juega la IVUS en la ETCI no se limita únicamente al diagnóstico (tabla 5)55-59. Un metanálisis que comparó ICP guiadas por IVUS o por coronariografía en la ETCI confirmó que las primeras se asociaron a menos mortalidad cardiovascular (RR = 0,47; IC95%, 0,33–0,66; p < 0,001), nueva revascularización de la lesión diana (RR = 0,43; IC95%, 0,25–0,73; p = 0,002) y trombosis del stent (RR = 0,28; IC95%, 0,12–0,67; p = 0,004)60. De la Torre Hernández et al. también se dieron cuenta de que las ICP guiadas por IVUS fueron especialmente útiles en lesiones distales con una menor incidencia de eventos que las ICP no guiadas por IVUS (HR = 0,54; IC95%, 0,34–0,90)56. Otros estudios han propuesto un papel para la IVUS en la optimización de la ETCI tras el despliegue del stent donde las áreas luminales mínimas se asociaron a la infraexpansión del stent, lo cual podría ser predictivo de reestenosis del stent con diferentes umbrales según el segmento evaluado (8 mm2 para el tronco común izquierdo proximal, 6 mm2 para el ostium coronario de la descendente anterior y 5 mm2 para el ostium coronario de la circunfleja izquierda)61.
Tabla 5. Resumen de los estudios que compararon intervenciones coronarias percutáneas guiadas por IVUS o coronariografía en el tratamiento de la enfermedad del tronco común izquierdo
| Referencia | Objetivos | Resultados |
|---|---|---|
| Park et al.55 | • El objetivo primario fue la mortalidad por cualquier causa | • La ICP guiada por IVUS se asoció a una menor incidencia de mortalidad global (HR = 0,31; IC95%, 0,19–0,51) e IM (HR = 0,470; IC95%, 0,33-0,67). |
| De la Torre Hernandez et al.56 | • El objetivo primario fue MACE (muerte cardiovascular, IM, RLD) | • Menor incidencia de mortalidad por cualquier causa a los 3 años con la ICP guiada por IVUS (4,7 frente al 16%; p = 0,048) |
| Gao et al.57 | • El objetivo primario fue la incidencia de MACE al cabo de 1 año (mortalidad cardiovascular, IM, RVD) | • Menor incidencia a 1 año de MACE del grupo guiado por IVUS (14,8 frente al 27,7%) |
| Tan et al.58 | • Incidencia de MACE a los 2 años (muerte, IM o RLD) | • Se observó una incidencia similar de eventos asociados a la RS (3,28% frente a 8,15%; |
| Andell et al.59 | • El objetivo primario fue un compuesto de mortalidad por cualquier causa, RS y TS) | • El grupo IVUS se asoció a menos objetivos compuesto (HR = 0,65; IC95%, 0,50–0,84) y a una menor incidencia de la mortalidad por cualquier causa (HR = 0,62; IC95%, 0,47–0,82) |
95%IC: intervalo de confianza del 95%; ETCI: enfermedad de tronco común izquierdo; HR: hazard ratio; ICP: intervención coronaria percutánea; IM: infarto de miocardio; IVUS: ecocardiografía intravascular; MACE: eventos cardiovasculares adversos mayores; OR: odds ratio; RLD: revascularización de la lesión diana; RS: reestenosis del stent; RVD: revascularización del vaso diana; TS: trombosis del stent. | ||
Por el contrario, la utilidad de la OCT valorando la ETCI es limitada dado su diámetro medio (de 3 a 5 mm) e incapacidad para evaluar lesiones aortoostiales en las que los campos libres de sangre son difíciles de alcanzar48. Recientemente, un estudio retrospectivo y multicéntrico (ROCK cohort II) ha confirmado una incidencia de fracaso de la lesión diana en ICP distales guiadas por imágenes intravasculares o angiográficas para tratar el TC (12,7 frente al 21,2%; p = 0,039) con resultados parecidos entre la OCT y la IVUS (p = 0,26)62. No obstante, se esperan futuros datos prospectivos que avalen las ICP guiadas por OCT y que definan mejor cuál ha de ser el tratamiento clínico óptimo de pacientes con ETCI (NCT04248777, NCT04391413, NCT03474432, NCT03820492 y NCT04531007).
Disecciones coronarias espontáneas
La disección coronaria espontánea es una patología amenazante para la vida infradiagnosticada que se puede dar en sujetos, en principio, sanos. El flujo coronario se ve comprometido tras el despliegue de una luz falsa mediante un mecanismo «de dentro a fuera» o «de fuera a dentro». La clasificación de Yip-Saw ha puesto de manifiesto las limitaciones de la coronariografía. El diagnóstico resulta especialmente complicado con disecciones coronarias espontáneas tipos 2 (estenosis lisa y difusa) y 3 (que imita a una estenosis ateroesclerótica)63,64.
Los beneficios de implementar IIC (tabla 6) en el diagnóstico o para guiar las intervenciones coronarias en el tratamiento de disecciones coronarias espontáneas son que ofrecen una mayor resolución65,66. La IVUS tiene mayor capacidad de penetración para visualizar la pared vascular y los hematomas intramurales y se recomienda para disecciones proximales8. También distingue entre luces verdaderas y falsas si se fusiona con interpolación cromática. Sin embargo, la OCT es más sensible a la hora de identificar señales sutiles tales como roturas intimales (roturas en la puerta de entrada a la luz falsa). De hecho, Ribero et al. la emplearon para establecer el mecanismo subyacente de la disección coronaria67.
Tabla 6. Beneficios de las técnicas de imágenes intravasculares para el abordaje de las disecciones coronarias espontáneas
| IVUS | OCT |
|---|---|
| Hematoma intramural (visualización completa de la pared vascular) | Caracterización detallada del flap intimal (disrupción de la íntima y de la media) |
| Luz verdadera y falsa (con IVUS y ChromaFlo*) | Conexión entre luz verdadera-falsa (rotura en puerta de entrada) |
| Trombosis de la luz falsa | Compromiso de ramas laterales y/o trombo |
| Posición de la guía | Posición de la guía |
IVUS: ecocardiografía intravascular; OCT: tomografía de coherencia óptica. * Chromaflo Volcano (Phillips, Estados Unidos). | |
Si durante el tratamiento de una disección coronaria espontánea se considera necesario realizar IIC, es importante reconocer que existe un riesgo de complicaciones operatorias (tales como disecciones con inyección de contraste durante la OCT, sobre todo en disecciones espontáneas tipo I o que acarrean oclusiones vasculares). Un estudio de 28 pacientes con disecciones coronarias espontáneas descubrió que realizar valoraciones mediante imágenes intracoronarias se asoció a disecciones iatrogénicas por la guía (3,5%) y del catéter guía (3,5%), así como a propagación por reposicionamiento de las guías (10,7%) o por el avance del catéter OCT (3,5%)68. Por lo tanto, el beneficio podría ser mayor en casos de incertidumbre diagnóstica o con disecciones complejas que precisan ICP.
Vasculopatía del injerto cardiaco
La presentación clínica de la vasculopatía del injerto cardiaco (VIC) suele ser silente. Aún así, se caracteriza por una displasia fibromuscular difusa concéntrica y agresiva. La International Society for Heart and Lung Transplantation clasifica la vasculopatía del injerto en 4 categorías según la función del injerto y los hallazgos angiográficos teniendo la VIC2 y VIC3 el peor pronóstico de todos69. La VIC Se considera la técnica patrón oro para un despistaje rutinario y diagnóstico definitivo.
Los pacientes trasplantados de corazón pueden presentar engrosamiento intimal identificable, solo, a través de una IVUS. Estudios publicados han informado que un engrosamiento intimal > 0,5 mm con respecto a los valores basales se asoció a una mayor incidencia de eventos adversos durante el primer año tras el trasplante car-
diaco70,71. De acuerdo con estos hallazgos, estudios volumétricos con IVUS han revelado que la combinación de engrosamiento intimal más el remodelado negativo de la descendente anterior proximal se asociaron a rechazos agudos y eventos adversos mayores al cabo de 1 año72. No obstante, con la OCT se pueden identificar las primeras fases del engrosamiento intimal en forma de hiperplasia intimal (grosor > 100 μm) y mejorar los resultados clínicos73.
Hallazgos tras el implante de stent
Ambas técnicas de imágenes se han empleado para identificar la infraexpansión, aposición incompleta y disección de los bordes del stent como posibles mecanismos causales del fracaso del stent.
A este respecto, el área mínima del stent (AMS) se asocia a la reestenosis y a la trombosis del stent. Estudios IVUS confirmaron AMS entre 5,3 y 5,7 mm2 con áreas más pequeñas identificadas en pacientes con reestenosis definitiva del stent a corto plazo tras el implante74,75. Asimismo, 2 estudios revelaron que AMS < 5 mm2 según la OCT se asociaron a una mayor incidencia de revascularización de la lesión diana y trombosis del stent con stents farmacoactivos76,77. Por el contrario, la permeabilidad del stent evaluada mediante OCT sugirió que valores > 4,5 mm2 se asociaban a una menor incidencia de MACE76 si bien la evaluación mediante IVUS sugirió valores de corte más altos para la ETCI proximal (> 8 mm2) y distal (> 7 mm2). De ahí que las guías de práctica clínica recomienden un AMS/luz media de referencia post-ICP > 80%.
Una serie de registros OCT observaron que el mecanismo principal habitual responsable de la formación de trombos precoz (de 1 a 30 días), tardía (de 1 a < 12 meses) y muy tardía (> 1 año) es la mala aposición (distancia axial > 0,4 mm con una extensión longitudinal > 1 mm) de los segmentos implantados de stent78-80. En consonancia con esto, la disección de los bordes del stent también se asoció a eventos adversos tal y como confirmó el estudio CLI-OICP II en el que las disecciones de los bordes distales del stent > 200 µm se asociaron a una mayor incidencia de MACE76.
SEGURIDAD
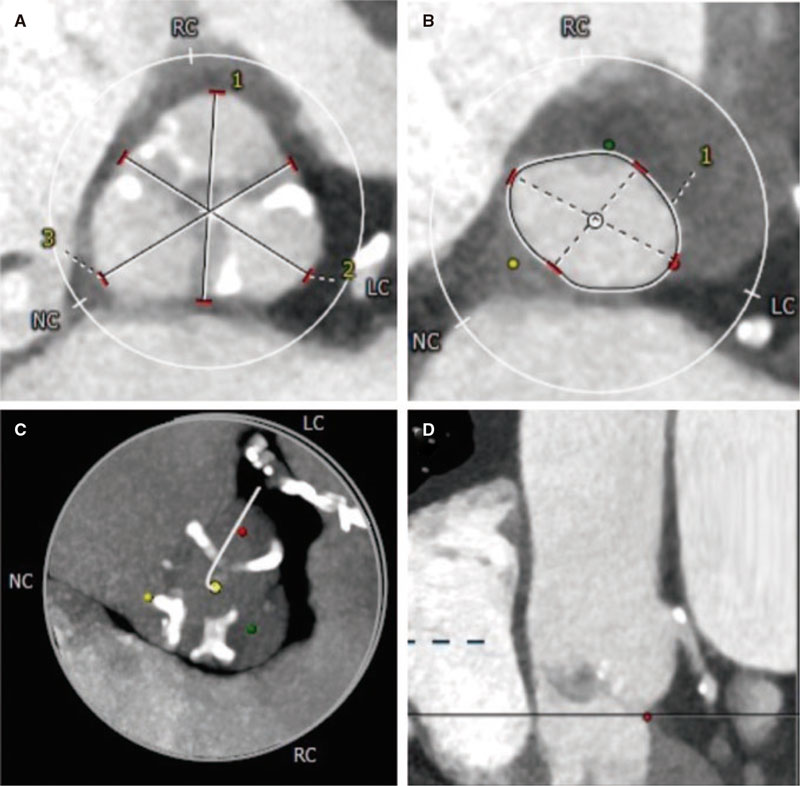
El desarrollo de técnicas de IIC ha traído consigo importantes mejoras a nivel clínico que, sin embargo, no están exentas de complicaciones operatorias (figura 3).
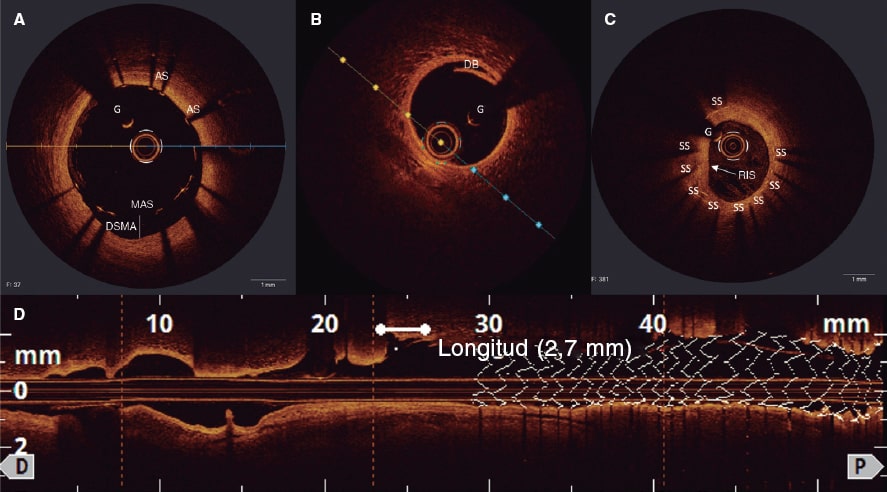
Figura 3. Hallazgos tras el implante de stent mediante tomografía de coherencia óptica: A: mala aposición del stent desde la posición de las 16 a las 19 en punto; B y D: disección de los bordes con flap (asterisco blanco) a nivel distal al stent farmacoactivo implantado; C: reestenosis intrastent (flecha blanca) secundaria a proliferación neointimal concéntrica; los struts del stent son visibles bajo una capa homogénea y brillante. AS: aposición de los struts; DB: disección de los bordes; DSMA: distancia del stent mal apuesto; G: guía; MAS: mala aposición de los struts; RIS: reestenosis intrastent; SS: struts del stent.
Los estudios de seguridad sobre IVUS hablan de una tasa estimada de complicaciones entre 1-3%, en su mayoría asociados al tamaño del catéter. El inconveniente de la coronariografía es que emplea materiales de contraste para mejorar la calidad de las imágenes con el consiguiente riesgo de nefropatía inducida por contraste81. A este respecto, un pequeño estudio retrospectivo de 37 pacientes con enfermedad renal avanzada que evaluó el perfil de seguridad de una ICP guiada por IVUS sin contraste no halló una mayor incidencia de terapia de reemplazo renal o MACE82. Se han hecho hallazgos similares en un estudio prospectivo y multicéntrico83, así como en un ensayo clínico aleatorizado controlado84. También se ha valorado el perfil de seguridad y la viabilidad de la OCT sin hallarse una mayor incidencia de MACE85, complicaciones operatorias ni daño renal agudo86. Además, los datos de 2 estudios prospectivos sugieren que la OCT con menos contraste sería una técnica de imagen viable87,88.
En estudios publicados que compararon diferentes técnicas de IIC (tabla 7), se han descrito incidencias similares de complicaciones89-91. Van der Sijde et al. llevaron a cabo un estudio prospectivo para comparar las complicaciones operatorias de ambas IIC y no hallaron una mayor incidencia de eventos durante la adquisición de imágenes. Tampoco identificaron ningún factor de riesgo potencial en lo referente a los eventos adversos mayores, lo cual sugiere que la seguridad y viabilidad de las IIC son mayores de lo esperado y no guardan relación con la experiencia del operador92.
Tabla 7. Resumen de los estudios que compararon IVUS con OCT y coronariografía para el guiado de ICP
| Referencia | Tipo de estudio | Técnica de IIC | Resultados |
|---|---|---|---|
| Ali et al.89 | ECA multicéntrico | OCT frente a IVUS frente a C | No se observaron diferencias en los MACEa operatorios descritos entre OCT (3%) e IVUS (1%; p = 0,37) y C (1%; p = 0,37) |
| Habara et al.90 | ECA prospectivo | OCT frente a IVUS | Índice similar de tiempo operatorio (40 ± 16,4 min frente a 47 ± 17,6 min; p = 0,09) y de fluoroscopia (20,4 ± 8,4 min frente a 24,8 ± 10,4 min; p = 0,05) |
| Kubo et al.91 | ECA multicéntrico y prospectivo | OCT frente a IVUS | Incidencia similar de mortalidad cardiovascular (0 frente al 0,2%; p = 0,99) y MACEb (2,9 frente al 3,5%; p = 0,81) |
| Van der Sijde et al.92 | Prospectivo de un único centro | OCT frente a IVUS | Incidencia similar de eventos cardiovasculares operatorios (< 1%) |
C: coronariografía; ECA: ensayo controlado aleatorizado; IIC: imágenes intracoronarias; IVUS: ecocardiografía intravascular; MACE: eventos cardiovasculares adversos mayores; OCT: tomografía de coherencia óptica. a Definidos como complicaciones operatorias (disección angiográfica, perforación, trombo o cierre agudo) e intervenciones activas (inflados del balón, implante de stent adicionales o pericardiocentesis). b Definidos como un compuesto de muerte, infarto de miocardio o revascularización de la lesión diana motivada por la isquemia. | |||
CONCLUSIONES
Más allá de las limitaciones de la coronariografía, las evaluaciones coronarias siguen siendo difíciles de realizar por los diferentes signos de presentación. Por lo tanto, la técnica de imágenes ideal debería ser fácil de usar e interpretar además de segura. El guiado mediante imágenes intracoronarias está ya ampliamente reconocido a título diagnóstico, aunque también para planificar la ICP y guiar el tratamiento post-ICP. No obstante, sigue habiendo margen de mejora y los estudios que se realicen en el futuro contribuirán a que estas técnicas de imágenes se adopten más ampliamente en todas las salas de hemodinámica.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
Á. Aparisi ha elaborado el manuscrito original. Á. Aparisi, H. Cubero-Gallego y H. Tizón-Marcos llevaron a cabo el proceso de revisión crítica del manuscrito en lo referente a su contenido intelectual más importante para, finalmente, redactar su versión definitiva. Todos los autores leyeron y dieron su consentimiento a la publicación de la presente versión del manuscrito.
CONFLICTO DE INTERESES
Ninguno.
BIBLIOGRAFÍA
1. Malakar AK, Choudhury D, Halder B, Paul P, Uddin A, Chakraborty S. A review on coronary artery disease, its risk factors, and therapeutics. J Cell Physiol. 2019;234:16812-16823.
2. Collet C, Grundeken MJ, Asano T, Onuma Y, Wijns W, Serruys PW. State of the art:coronary angiography. EuroIntervention. 2017;13:634-643.
3. Mintz GS, Guagliumi G. Intravascular imaging in coronary artery disease [published correction in Lancet. 2017;390:1026]. Lancet. 2017;390:793-809.
4. Räber L, Mintz GS, Koskinas KC, et al. Clinical use of intracoronary imaging. Part 1:guidance and optimization of coronary interventions. An expert consensus document of the European Association of Percutaneous Cardiovascular Interventions [published correction in Eur Heart J. 2019;40:308]. Eur Heart J. 2018;39:3281-3300.
5. Garcia-Garcia HM, Fernández-Peregrina E, and KOK, Diletti R. Ongoing large randomized clinical trials on complex percutaneous coronary interventions:intravascular imaging-guided trials. REC Interv Cardiol. 2021;3:297-303.
6. Lawton JS, Tamis-Holland JE, Bangalore S, et al. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization:A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. J Am Coll Cardiol. 2021;79:e21-e129.
7. Neumann FJ, Sousa-Uva M, Ahlsson A, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization [published correction in Eur Heart J. 2019;40:3096]. Eur Heart J. 2019;40:87-165.
8. Mintz GS, Nissen SE, Anderson WD, et al. American College of Cardiology Clinical Expert Consensus Document on Standards for Acquisition, Measurement and Reporting of Intravascular Ultrasound Studies (IVUS). A report of the American College of Cardiology Task Force on Clinical Expert Consensus Documents. J Am Coll Cardiol. 2001;37:1478-1492.
9. Xu J, Lo S. Fundamentals and role of intravascular ultrasound in percutaneous coronary intervention. Cardiovasc Diagn Ther. 2020;10:1358-1370.
10. Darmoch F, Alraies MC, Al-Khadra Y, Moussa Pacha H, Pinto DS, Osborn EA. Intravascular Ultrasound Imaging-Guided Vs Coronary Angiography-Guided Percutaneous Coronary Intervention:A Systematic Review and Meta-Analysis. J Am Heart Assoc. 2020;9:e013678.
11. Ali ZA, Karimi Galougahi K, Maehara A, et al. Intracoronary Optical Coherence Tomography 2018:Current Status and Future Directions. JACC Cardiovasc Interv. 2017;10:2473-2487.
12. Tearney GJ, Regar E, Akasaka T, et al. Consensus standards for acquisition, measurement, and reporting of intravascular optical coherence tomography studies:a report from the International Working Group for Intravascular Optical Coherence Tomography Standardization and Validation. J Am Coll Cardiol. 2012;59:1058-1072.
13. Prati F, Di Vito L, Biondi-Zoccai G, et al. Angiography alone vs angiography plus optical coherence tomography to guide decision-making during percutaneous coronary intervention:the Centro per la Lotta contro l'Infarto-Optimisation of Percutaneous Coronary Intervention (CLI-OPCI) study. EuroIntervention. 2012;8:823-829.
14. Magnus PC, Jayne JE, Garcia-Garcia HM, et al. Optical coherence tomography vs intravascular ultrasound in the evaluation of observer variability and reliability in the assessment of stent deployment:the OCTIVUS study. Catheter Cardiovasc Interv. 2015;86:229-235.
15. Abnousi F, Waseda K, Kume T, et al. Variability in quantitative and qualitative analysis of intravascular ultrasound and frequency domain optical coherence tomography. Catheter Cardiovasc Interv. 2013;82:E192-E199.
16. Collet C, Conte E, Mushtaq S, et al. Reviewing imaging modalities for the assessment of plaque erosion. Atherosclerosis. 2021;318:52-59.
17. Khalifa AKM, Kubo T, Ino Y, et al. Optical Coherence Tomography Comparison of Percutaneous Coronary Intervention Among Plaque Rupture, Erosion, and Calcified Nodule in Acute Myocardial Infarction. Circ J. 2020;84:911-916.
18. Jia H, Abtahian F, Aguirre AD, et al. In vivo diagnosis of plaque erosion and calcified nodule in patients with acute coronary syndrome by intravascular optical coherence tomography. J Am Coll Cardiol. 2013;62:1748-1758.
19. Terada K, Kubo T, Kameyama T, et al. NIRS-IVUS for Differentiating Coronary Plaque Rupture, Erosion, and Calcified Nodule in Acute Myocardial Infarction. JACC Cardiovasc Imaging. 2021;14:1440-1450.
20. Kim N, Lee JH, Jang SY, et al. Intravascular modality-guided vs angiography-guided percutaneous coronary intervention in acute myocardial infarction. Catheter Cardiovasc Interv. 2020;95:696-703.
21. Sawaya FJ, Lefèvre T, Chevalier B, et al. Contemporary Approach to Coronary Bifurcation Lesion Treatment. JACC Cardiovasc Interv. 2016;9:1861-1878.
22. Burzotta F, Lassen JF, Lefèvre T, et al. Percutaneous coronary intervention for bifurcation coronary lesions:the 15th consensus document from the European Bifurcation Club. EuroIntervention. 2021;16:1307-1317.
23. Watanabe M, Uemura S, Sugawara Y, et al. Side branch complication after a single-stent crossover technique:prediction with frequency domain optical coherence tomography. Coron Artery Dis. 2014;25:321-329.
24. Mori H, Torii S, Kutyna M, Sakamoto A, Finn AV, Virmani R. Coronary Artery Calcification and its Progression:What Does it Really Mean?. JACC Cardiovasc Imaging. 2018;11:127-142.
25. Mintz GS. Intravascular imaging of coronary calcification and its clinical implications. JACC Cardiovasc Imaging. 2015;8:461-471.
26. Fujii K, Ochiai M, Mintz GS, et al. Procedural implications of intravascular ultrasound morphologic features of chronic total coronary occlusions. Am J Cardiol. 2006;97:1455-1462.
27. Mehanna E, Bezerra HG, Prabhu D, et al. Volumetric characterization of human coronary calcification by frequency-domain optical coherence tomography. Circ J. 2013;77:2334-2340.
28. Wang X, Matsumura M, Mintz GS, et al. In Vivo Calcium Detection by Comparing Optical Coherence Tomography, Intravascular Ultrasound, and Angiography. JACC Cardiovasc Imaging. 2017;10:869-879.
29. Kobayashi Y, Okura H, Kume T, et al. Impact of target lesion coronary calcification on stent expansion. Circ J. 2014;78:2209-2214.
30. Fujino A, Mintz GS, Matsumura M, et al. A new optical coherence tomography-based calcium scoring system to predict stent underexpansion. EuroIntervention. 2018;13:e2182-e2189.
31. Ali ZA, Brinton TJ, Hill JM, et al. Optical Coherence Tomography Characterization of Coronary Lithoplasty for Treatment of Calcified Lesions:First Description. JACC Cardiovasc Imaging. 2017;10:897-906.
32. Teng W, Li Q, Ma Y, et al. Comparison of optical coherence tomography-guided and intravascular ultrasound-guided rotational atherectomy for calcified coronary lesions. BMC Cardiovasc Disord. 2021;21:290.
33. de la Torre Hernandez JM, Hernández Hernandez F, Alfonso F, et al. Prospective application of pre-defined intravascular ultrasound criteria for assessment of intermediate left main coronary artery lesions results from the multicenter LITRO study. J Am Coll Cardiol. 2011;58:351-358.
34. Sakakura K, Yamamoto K, Taniguchi Y, Tsurumaki Y, Momomura SI, Fujita H. Intravascular ultrasound enhances the safety of rotational atherectomy. Cardiovasc Revasc Med. 2018;19(3 Pt A):286-291.
35. Khan AA, Khalid MF, Ayub MT, et al. Outcomes of Percutaneous Coronary Intervention Vs Optimal Medical Treatment for Chronic Total Occlusion:A Comprehensive Meta-analysis. Curr Probl Cardiol. 2021;46:100695.
36. Wang N, Fulcher J, Abeysuriya N, Adams M, Lal S. Predictors of successful chronic total occlusion percutaneous coronary interventions:a systematic review and meta-analysis. Heart. 2018;104:517-524.
37. Ellis SG, Burke MN, Murad MB, et al. Predictors of Successful Hybrid-Approach Chronic Total Coronary Artery Occlusion Stenting:An Improved Model With Novel Correlates. JACC Cardiovasc Interv. 2017;10:1089-1098.
38. Galassi AR, Sumitsuji S, Boukhris M, et al. Utility of Intravascular Ultrasound in Percutaneous Revascularization of Chronic Total Occlusions:An Overview. JACC Cardiovasc Interv. 2016;9:1979-1991.
39. Tian NL, Gami SK, Ye F, et al. Angiographic and clinical comparisons of intravascular ultrasound- vs angiography-guided drug-eluting stent implantation for patients with chronic total occlusion lesions:two-year results from a randomised AIR-CTO study. EuroIntervention. 2015;10:1409-1417.
40. Hong SJ, Kim BK, Shin DH, et al. Usefulness of intravascular ultrasound guidance in percutaneous coronary intervention with second-generation drug-eluting stents for chronic total occlusions (from the Multicenter Korean-Chronic Total Occlusion Registry) [published correction in Am J Cardiol. 2014;114:1937]. Am J Cardiol. 2014;114:534-540.
41. Kim BK, Shin DH, Hong MK, et al. Clinical Impact of Intravascular Ultrasound-Guided Chronic Total Occlusion Intervention With Zotarolimus-Eluting Vs Biolimus-Eluting Stent Implantation:Randomized Study. Circ Cardiovasc Interv. 2015;8:e002592.
42. Kang J, Cho YS, Kim SW, et al. Intravascular Ultrasound and Angiographic Predictors of In-Stent Restenosis of Chronic Total Occlusion Lesions. PLoS One. 2015;10:e0140421.
43. Jia H, Hu S, Liu H, et al. Chronic total occlusion is associated with a higher incidence of malapposition and uncovered stent struts:OCT findings at 6 months following DES implantation. Catheter Cardiovasc Interv. 2017;89:582-591.
44. Heeger CH, Busjahn A, Hildebrand L, et al. Delayed coverage of drug-eluting stents after interventional revascularisation of chronic total occlusions assessed by optical coherence tomography:the ALSTER-OCT-CTO registry. EuroIntervention. 2016;11:1004-1012.
45. Kawsara A, Núñez Gil IJ, Alqahtani F, Moreland J, Rihal CS, Alkhouli M. Management of Coronary Artery Aneurysms. JACC Cardiovasc Interv. 2018;11:1211-1223.
46. Dionne A, Ibrahim R, Gebhard C, et al. Coronary Wall Structural Changes in Patients With Kawasaki Disease:New Insights From Optical Coherence Tomography (OCT). J Am Heart Assoc. 2015;4:e001939.
47. Sabatine MS, Bergmark BA, Murphy SA, et al. Percutaneous coronary intervention with drug-eluting stents vs coronary artery bypass grafting in left main coronary artery disease:an individual patient data meta-analysis. Lancet. 2021;398:2247-2257.
48. Collet C, Capodanno D, Onuma Y, et al. Left main coronary artery disease:pathophysiology, diagnosis, and treatment. Nat Rev Cardiol. 2018;15:321-331.
49. Park SJ, Ahn JM, Kang SJ, Yoon SH, Koo BK, Lee JY, Kim WJ, Park DW, Lee SW, Kim YH, Lee CW, Park SW. Intravascular ultrasound-derived minimal lumen area criteria for functionally significant left main coronary artery stenosis. JACC Cardiovasc Interv. 2014;7:868-874.
50. Jasti V, Ivan E, Yalamanchili V, Wongpraparut N, Leesar MA. Correlations between fractional flow reserve and intravascular ultrasound in patients with an ambiguous left main coronary artery stenosis. Circulation. 2004;110:2831-2836.
51. Park SJ, Ahn JM, Kang SJ, Yoon SH, Koo BK, Lee JY, Kim WJ, Park DW, Lee SW, Kim YH, Lee CW, Park SW. Intravascular ultrasound-derived minimal lumen area criteria for functionally significant left main coronary artery stenosis. JACC Cardiovasc Interv. 2014;7:868-874.
52. Johnson TW, Räber L, di Mario C, et al. Clinical use of intracoronary imaging. Part 2:acute coronary syndromes, ambiguous coronary angiography findings, and guiding interventional decision-making:an expert consensus document of the European Association of Percutaneous Cardiovascular Interventions. Eur Heart J. 2019;40:2566-2584.
53. Uchida Y, Ichimiya S, Ishii H, et al. Impact of plaque burden in the left main coronary artery determined by intravascular ultrasound on cardiovascular events in a Japanese population undergoing percutaneous coronary intervention. Am J Cardiol. 2012;109:352-358.
54. Shimizu T, Mintz GS, De Bruyne B, et al. Relationship between left main coronary artery plaque burden and nonleft main coronary atherosclerosis:results from the PROSPECT study. Coron Artery Dis. 2018;29:397-402.
55. Park SJ, Kim YH, Park DW, et al. Impact of intravascular ultrasound guidance on long-term mortality in stenting for unprotected left main coronary artery stenosis. Circ Cardiovasc Interv. 2009;2:167-177.
56. de la Torre Hernandez JM, Baz Alonso JA, Gómez Hospital JA, et al. Clinical impact of intravascular ultrasound guidance in drug-eluting stent implantation for unprotected left main coronary disease:pooled analysis at the patient-level of 4 registries. JACC Cardiovasc Interv. 2014;7:244-254.
57. Gao XF, Kan J, Zhang YJ, et al. Comparison of one-year clinical outcomes between intravascular ultrasound-guided vs angiography-guided implantation of drug-eluting stents for left main lesions:a single-center analysis of a 1,016-patient cohort. Patient Prefer Adherence. 2014;8:1299-1309.
58. Tan Q, Wang Q, Liu D, Zhang S, Zhang Y, Li Y. Intravascular ultrasound-guided unprotected left main coronary artery stenting in the elderly. Saudi Med J. 2015;36:549-553.
59. Andell P, Karlsson S, Mohammad MA, et al. Intravascular Ultrasound Guidance Is Associated With Better Outcome in Patients Undergoing Unprotected Left Main Coronary Artery Stenting Compared With Angiography Guidance Alone. Circ Cardiovasc Interv. 2017;10:e004813.
60. Ye Y, Yang M, Zhang S, Zeng Y. Percutaneous coronary intervention in left main coronary artery disease with or without intravascular ultrasound:A meta-analysis. PLoS One. 2017;12:e0179756.
61. Kang SJ, Ahn JM, Song H, et al. Comprehensive intravascular ultrasound assessment of stent area and its impact on restenosis and adverse cardiac events in 403 patients with unprotected left main disease. Circ Cardiovasc Interv. 2011;4:562-569.
62. Cortese B, de la Torre Hernandez JM, Lanocha M, et al. Optical coherence tomography, intravascular ultrasound or angiography guidance for distal left main coronary stenting. The ROCK cohort II study. Catheter Cardiovasc Interv. 2021;99:664– 673.
63. Adlam D, Alfonso F, Maas A, Vrints C;Writing Committee. European Society of Cardiology, acute cardiovascular care association, SCAD study group:a position paper on spontaneous coronary artery dissection. Eur Heart J. 2018;39:3353-3368.
64. Hayes SN, Tweet MS, Adlam D, et al. Spontaneous Coronary Artery Dissection:JACC State-of-the-Art Review. J Am Coll Cardiol. 2020;76:961-984.
65. Cerrato E, Giacobbe F, Rolfo C, et al. Role of Invasive and Non-invasive Imaging Tools in the Diagnosis and Optimal Treatment of Patients with Spontaneous Coronary Artery Dissection. Curr Cardiol Rep. 2019;21:122.
66. Alfonso F, Bastante T, Cuesta J, Rodríguez D, Benedicto A, Rivero F. Spontaneous coronary artery dissection:novel insights on diagnosis and management. Cardiovasc Diagn Ther. 2015;5:133-140.
67. Alfonso F, Paulo M, Gonzalo N, et al. Diagnosis of spontaneous coronary artery dissection by optical coherence tomography. J Am Coll Cardiol. 2012;59:1073-1079.
68. Macaya F, Salazar CH, Pérez-Vizcayno MJ, et al. Feasibility and Safety of Intracoronary Imaging for Diagnosing Spontaneous Coronary Artery Dissection. JACC Cardiovasc Imaging. 2019;12:763-764.
69. Lee MS, Tadwalkar RV, Fearon WF, et al. Cardiac allograft vasculopathy:A review. Catheter Cardiovasc Interv. 2018;92:E527-E536.
70. Olymbios M, Kwiecinski J, Berman DS, Kobashigawa JA. Imaging in Heart Transplant Patients. JACC Cardiovasc Imaging. 2018;11:1514-1530.
71. Javaheri A, Saha N, Lilly SM. How to Approach the Assessment of Cardiac Allograft Vasculopathy in the Modern Era:Review of Invasive Imaging Modalities. Curr Heart Fail Rep. 2016;13:86-91.
72. Okada K, Kitahara H, Yang HM, et al. Paradoxical Vessel Remodeling of the Proximal Segment of the Left Anterior Descending Artery Predicts Long-Term Mortality After Heart Transplantation. JACC Heart Fail. 2015;3:942-952.
73. Ichibori Y, Ohtani T, Nakatani D, et al. Optical coherence tomography and intravascular ultrasound evaluation of cardiac allograft vasculopathy with and without intimal neovascularization. Eur Heart J Cardiovasc Imaging. 2016;17:51-58.
74. Hong MK, Mintz GS, Lee CW, et al. Intravascular ultrasound predictors of angiographic restenosis after sirolimus-eluting stent implantation. Eur Heart J. 2006;27:1305-1310.
75. Doi H, Maehara A, Mintz GS, et al. Impact of Post-Intervention Minimal Stent Area on 9-Month Follow-Up Patency of Paclitaxel-Eluting Stents An Integrated Intravascular Ultrasound Analysis From the TAXUS IV, V, and VI and TAXUS ATLAS Workhorse, Long Lesion, and Direct Stent Trials. JACC Cardiovasc Interventions. 2009;2:1269-1275.
76. Prati F, Romagnoli E, Burzotta F, et al. Clinical Impact of OCT Findings During PCI The CLI-OPCI II Study. JACC Cardiovasc Imaging. 2015;8:1297-1305.
77. Meneveau N, Souteyrand G, Motreff P, et al. Optical Coherence Tomography to Optimize Results of Percutaneous Coronary Intervention in Patients with Non–ST-Elevation Acute Coronary Syndrome. Circulation. 2016;134:906-917
78. Adriaenssens T, Joner M, Godschalk TC, et al. Optical Coherence Tomography Findings in Patients With Coronary Stent Thrombosis. Circulation. 2017;136:1007-1021.
79. Souteyrand G, Amabile N, Mangin L, et al. Mechanisms of stent thrombosis analysed by optical coherence tomography:insights from the national PESTO French registry. Eur Heart J. 2016;37:1208-1216.
80. Taniwaki M, Radu MD, Zaugg S, et al. Mechanisms of Very Late Drug-Eluting Stent Thrombosis Assessed by Optical Coherence Tomography. Circulation. 2016;133:650-660.
81. Batkoff BW, Linker DT. Safety of intracoronary ultrasound:Data from a multicenter European registry. Catheter Cardio Diag. 1996;38:238-241.
82. Ali ZA, Galougahi KK, Nazif T, et al. Imaging- and physiology-guided percutaneous coronary intervention without contrast administration in advanced renal failure:a feasibility, safety, and outcome study. Eur Heart J. 2016;37:3090-3095.
83. Sakai K, Ikari Y, Nanasato M, et al. Impact of intravascular ultrasound-guided minimum-contrast coronary intervention on 1-year clinical outcomes in patients with stage 4 or 5 advanced chronic kidney disease. Cardiovasc Intervention Ther. 2019;34:234-241.
84. Mariani J, Guedes C, Soares P, et al. Intravascular Ultrasound Guidance to Minimize the Use of Iodine Contrast in Percutaneous Coronary Intervention The MOZART (Minimizing cOntrast utiliZation With IVUS Guidance in coRonary angioplasTy) Randomized Controlled Trial. JACC Cardiovasc Interventions. 2014;7:1287-1293.
85. Lehtinen T, Nammas W, Airaksinen JKE, Karjalainen PP. Feasibility and safety of frequency-domain optical coherence tomography for coronary artery evaluation:a single-center study. Int J Cardiovasc Imaging. 2013;29:997-1005.
86. Khurwolah MR, Meng H-Y, Wang Y-S, Wang L-S, Kong X-Q. Safety and efficacy of frequency-domain optical coherence tomography in evaluating and treating intermediate coronary lesions. World J Cardiol. 2018;10:222-233.
87. Gupta A, Chhikara S, Vijayvergiya R, et al. Saline as an alternative to radio-contrast for optical coherence tomography guided percutaneous coronary intervention:A prospective comparison. Cardiovasc Revasc Med. 2022;34:86-91.
88. Gore AK, Shlofmitz E, Galougahi KK, et al. Prospective Comparison Between Saline and Radiocontrast for Intracoronary Imaging With Optical Coherence Tomography. JACC Cardiovasc Imaging. 2020;13:2060-2062.
89. Ali ZA, Maehara A, Généreux P, et al. Optical coherence tomography compared with intravascular ultrasound and with angiography to guide coronary stent implantation (ILUMIEN III:OPTIMIZE PCI):a randomised controlled trial. Lancet. 2016;388:2618-2628.
90. Habara M, Nasu K, Terashima M, et al. Impact of Frequency-Domain Optical Coherence Tomography Guidance for Optimal Coronary Stent Implantation in Comparison With Intravascular Ultrasound Guidance. Circ Cardiovasc Interv. 2012;5:193-201.
91. Kubo T, Shinke T, Okamura T, et al. Optical frequency domain imaging vs intravascular ultrasound in percutaneous coronary intervention (OPINION trial):one-year angiographic and clinical results. Eur Heart J. 2017;38:3139-3147.
92. Sijde JN van der, Karanasos A, Ditzhuijzen NS van, et al. Safety of optical coherence tomography in daily practice:a comparison with intravascular ultrasound. Eur Heart J Cardiovasc Imaging. 2017;18:467-474.
* Autor para correspondencia:
Correo electrónico: htizon@psmar.cat (H. Tizón-Marcos).