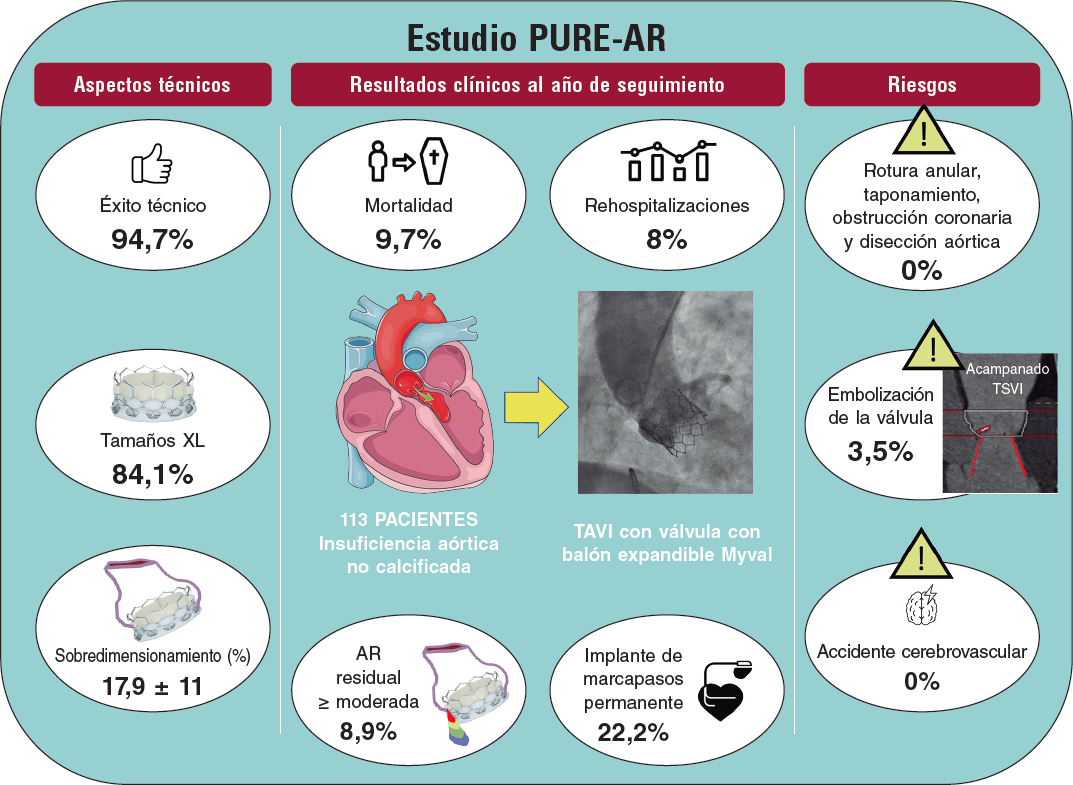
Sr. Editor:
El coronavirus tipo 2 causante del síndrome respiratorio agudo grave (SARS-CoV-2) es el agente causante de la enfermedad por coronavirus 2029 (COVID-19) y responsable del brote pandémico que estamos sufriendo en todo el mundo. Aunque la COVID-19 provoca, principalmente, neumonía vírica, han saltado todas las alarmas por la posible afectación del sistema cardiovascular con el daño miocárdico como uno de los factores de riesgo de mortalidad. Son varias las posibles causas del daño miocárdico asociado a la COVID-19 como por ejemplo los infartos de miocardio tipo I y II1.
Este es el caso clínico de una disección coronaria aparentemente espontánea (DCE) en un paciente con COVID-19 (consentimiento informado obtenido) seguido de una revisión sistemática de la literatura médica disponible sobre esta cuestión.
Presentamos el caso de un varón de 40 años sin historia clínica conocida ni factores de riesgo cardiovascular ingresado en nuestro hospital terciario con un cuadro de fiebre y tos. El paciente dio positivo en la prueba de reacción en cadena de la polimerasa de transcripción inversa a infección por SARS-CoV-2 y la radiografía torácica realizada reveló la presencia de opacidades bilaterales (figura 1A). El paciente fue hospitalizado en la unidad de cuidados intensivos debido al rápido deterioro de su situación clínica durante las primeras 72 horas a pesar del tratamiento de soporte inicial con intubación. El análisis del laboratorio reveló linfopenia grave (0,5 × 103/l), niveles de troponina T de 42 ng/dl, niveles del dímero D > 10.000 ng/ml, niveles de CRP > 300 mg/dl y niveles de ferritina > 3.000 ng/ml. Aunque se administraron corticosteroides y remdesivir, el estado hemodinámico del paciente fue deteriorándose con signos de síndrome de distrés respiratorio agudo y shock cardiogénico (SC). Se inició soporte inotrópico y vasopresor concomitante y se realizó una ecocardiografía transtorácica que reveló la presencia de disfunción biventricular grave con trombo intraventricular sin anomalías segmentarias en el movimiento de la pared. Tras consultar con el equipo multidisciplinar, se optó por implantar oxigenación con membrana extracorpórea con configuración veno-arteriovenosa (ECMO V-AV). Durante la primera semana después de la implantación de la ECMO V-AV, el nuevo electrocardiograma que se realizó reveló la presencia de inversión difusa de ondas T en las derivaciones precordiales (
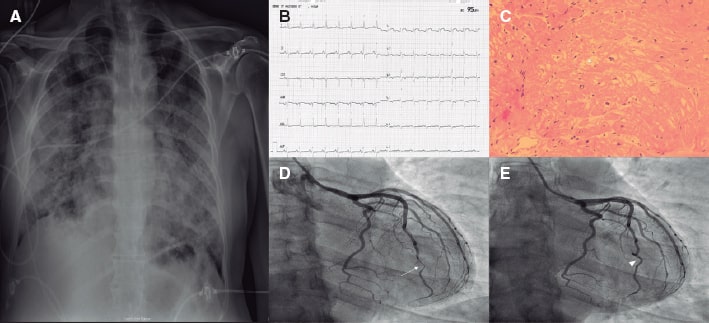
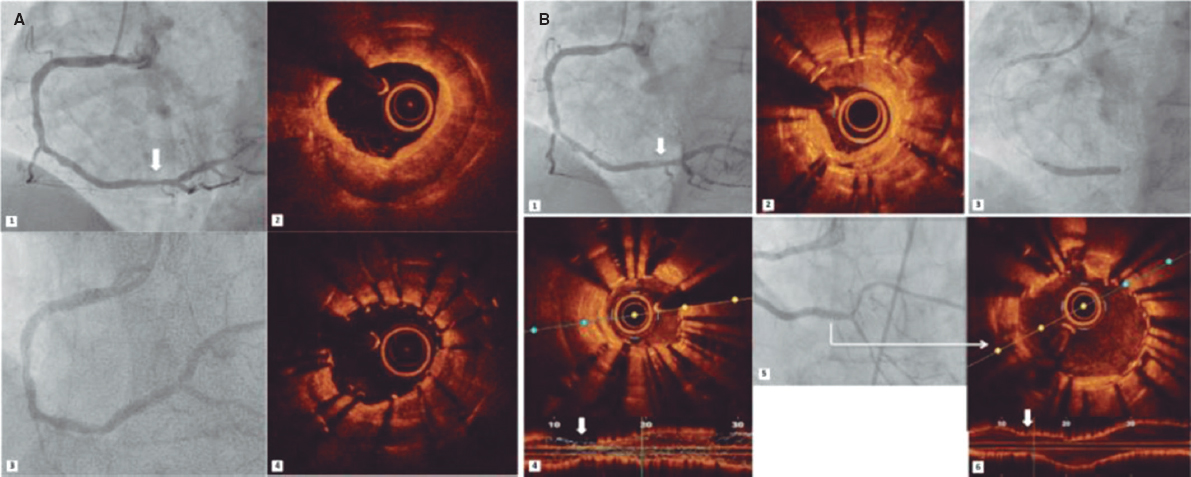
Figure 1. A: chest x-ray showing bilateral patchy infiltrates. B: electrocardiogram with diffuse T-wave inversion. C: endomyocardial biopsy without leukocyte infiltrate suggestive of myocarditis. Some freezing artifacts can be seen (asterisk). D: coronary angiogram, the arrow indicates the presence of significant stenosis of the distal portion of the LAD, which is compatible with a type II SCAD. E: follow-up with invasive coronary imaging showing the SCAD complete resolution (arrowhead).
Dos meses después del evento índice, se realizó una resonancia magnética cardiovascular que descartó cualquier signo de inflamación o fibrosis, confirmó una fracción de eyección del ventrículo izquierdo del 35% y la resolución del trombo intraventricular. La biopsia endomiocárdica realizada dio negativo para miocarditis (figura 1C). La coronariografía realizada (figura 1D-E; vídeo 1 del material adicional) para descartar enfermedad coronaria concomitante reveló la presencia de una lesión aislada del segmento distal en una descendente anterior (DA) tortuosa compatible con una DCE tipo II. Se descartaron las imágenes intravasculares tras valorar el riesgo-beneficio y se optó por un tratamiento conservador. El paciente fue dado de alta y tras realizar una coronariografía de seguimiento sin eventos a los 3 meses se confirmó la resolución completa del caso.
El daño miocárdico es un hallazgo habitual en pacientes con COVID-19 que está asociado a la presencia de eventos adversos1. Una infección previa por coronavirus o gripe podría llegar a desencadenar o agravar diferentes eventos cardiovasculares mayores, aunque los mecanismos responsables todavía no se han descubierto. La DCE es un evento coronario, probablemente infrarreportado, cuya prevalencia está en torno al 4%. Son muchos los posibles desencadenantes, pero los más comunes son los estresores emocionales y físicos.
Se ha descrito un caso de disección bilateral de arteria carótida en un paciente infectado de SARS-CoV-2. Diferentes estudios de cohortes y de casos-control han descrito la posible relación que existe entre las infecciones del tracto respiratorio superior y las disecciones de la arteria carótida2; no obstante, todavía no se ha publicado ningún estudio concluyente a este respecto que confirme que las infecciones predisponen a sufrir una DCE. Cabe destacar que se han descrito 3 casos de DCE e infección por SARS-CoV-2 en la literatura médica3-5 con diferente curso clínico y gravedad (tabla 1). Todavía no se entienden del todo cuáles son los posibles mecanismos responsables de las DCE en pacientes con COVID-19, pero probablemente no tengan que ver con un único factor ya que la causalidad es un proceso altamente complejo.
Tabla 1. Revisión sistemática de la literatura médica sobre disecciones coronarias espontáneas en pacientes con COVID-19
| Autores | Revista/año | Edad/sexo | FEVI en el ingreso | Factores predisponentes* | Síntomas/signos en el ingreso | Gravedad de la COVID-19 | Tratamiento hospitalario | Angiografía coronaria | Tratamiento de la DCE |
|---|---|---|---|---|---|---|---|---|---|
| Courand P-Y et al.3 | JACC Cardiovasc Interv 2020 | 55/varón | Conservada | Enfermedad arterial periférica | Fiebre, disnea y tos | Leve | No informado | Disección CD media (confirmada por la OCT) | Conservador Ácido acetilsalicílico, estatinas y bloqueadores beta |
| Gasso LF et al.4 | Eur Heart J 2020 | 39/varón | Del 50 al 55% | Ninguno | Fiebre, disnea, tos, dolor torácico y mialgia | Grave | Hidroxicloroquina, azitromicina,lopinavir/ritonavir, tocilizumab | Disección multivaso (sin imágenes intracoronarias) | Conservador Tratamiento antiagregante plaquetario doble |
| Kumar K et al.5 | Catheter Cardio Int2020 | 48/mujer | Del 45 al 55% | Migraña Dislipemia | Dolor torácico | Leve | No informado | Disección DA media a distal (confirmada por tomografía computarizada) | Conservador Tratamiento antiagregrante plaquetario doble LifeVest, bloqueadores beta y amiodarona tras TVP sostenida |
| Paciente descrito | 2020 | 40/varón | Grave(< 30%) | Ninguno | Fiebre y disnea | Grave (con shock) | Hidroxicloroquina, azitromicina,lopinavir/ritonavir, corticosteroides, remdisivir, agentes inotrópicos y vasopresores, ECMO V-AV | Dissección AD distal (sin imágenes intracoronarias) | Conservador Ácido acetilsalicílico y tratamiento médico basado en la guía de práctica clínica para el tratamiento de la IC La CA de seguimiento confirmó la resolución completa |
AC: angiografía coronaria; CD: coronaria derecha; COVID-19: enfermedad por coronavirus 2029; DA: descendente anterior; FEVI: fracción de eyección del ventrículo izquierdo; IC: insuficiencia cardiaca; OCT: tomografía de coherencia óptica; TVP: taquicardia ventricular polimórfica. *Antes del ingreso. | |||||||||
La DCE está asociada a enfermedades autoinmunes e inflamatorias, lo cual podría ser el resultado de infiltrado eosinofílico con secreción de enzimas líticas6. La clave de la COVID-19 es una intensa carga inflamatoria y disfunción endotelial1. No obstante, la DCE podría deberse a otros factores contribuyentes que suelen verse en pacientes críticos. Por ejemplo, una sobreactivación del sistema simpático podría llegar a provocar disecciones de la íntima. La DCE podría ser, también, el resultado de dosis altas de corticosteriodes que suelen recetarse contra la COVID-19, debido a la rotura espontánea de una pared arterial debilitada6. Por último, tampoco puede descartarse daño endotelial directo secundario a SARS-CoV-2.
Aunque las DCE suelen ser más habituales en mujeres, 3 de los 4 casos descritos son varones, lo que explicaría la incidencia más alta de COVID-19 descrita en varones. El dolor torácico es el síntoma más habitual de una DCE y estuvo presente en 2 de los casos descritos; no obstante, ni el caso descrito por Courand PY et al. ni el nuestro revelaron síntomas específicos de síndrome coronario agudo3. Si, en nuestro caso, la DCE fue la causante del CS y de la disfunción ventricular grave sigue siendo objeto de debate. Una miocardiopatía o disfunción ventricular transitoria previas desconocidas podrían haber sido las causas ya que la DCE se halló en una pequeña porción distal de la DA. En cualquier caso, con independencia de la gravedad de la COVID-19, el tratamiento conservador es una estrategia segura. La morbilidad es alta, no en vano Kumar K et al. refirieron taquicardia ventricular polimórfica5 y nuestro paciente sufrió un SC. Se optó por tratamiento con un único antiagregante plaquetario con ácido acetilsalicílico y por tratamiento médico basado en las guías de práctica clínica para el manejo de la insuficiencia cardiaca igual hicieron que Courand PY et al.3, pero a diferencia de los otros 2 casos descritos que optaron por tratamiento antiagregante plaquetario doble4,5. En cualquier caso, hay dudas de si la anticoagulación es una estrategia segura ya que la COVID-19 se asocia a un estado protrombótico.
En conclusión, la DCE es una posible causa del infarto de miocardio tipo II en pacientes con COVID-19, aunque se necesitan más estudios a este respecto antes de poder establecer la causalidad. Las DCE asociadas a infección pueden sobrevenir en cualquier momento durante la ocurrencia de eventos índices y son difíciles de diagnosticar. El tratamiento conservador parece la estrategia más segura, aunque pueden darse SC y arritmias ventriculares.
FINANCIACIÓN
Ninguna.
CONTRIBUCIÓN DE LOS AUTORES
Á. Aparisi, C. Ybarra-Falcón, P.E. García-Granja, redacción del artículo y revisión crítica del contenido científico. Todos los autores contribuyeron sustancialmente a la concepción y diseño del artículo, así como a la interpretación de los datos y aprobaron la versión final del artículo para publicar.
CONFLICTO DE INTERESES
No se declara ninguno.
MATERIAL ADICIONAL
Vídeo 1. Aparisi A. DOI: 10.24875/RECIC.M20000181
BIBLIOGRAFÍA
1. Sandoval Y, Januzzi JL, Jaffe AS. Cardiac Troponin for the Diagnosis and Risk-Stratification of Myocardial Injury in COVID-19:JACC Review Topic of the Week. J Am Coll Cardiol. 2020;76:1244-1258.
2. Morassi M, Bigni B, Cobelli M, Giudice L, BnàC, Vogrig A. Bilateral carotid artery dissection in a SARS-CoV-2 infected patient:causality or coincidence? J Neurol. 2020. http://dx.doi.org/10.1007/s00415-020-09984-0.
3. Courand P-Y, Harbaoui B, Bonnet M, Lantelme P. Spontaneous Coronary Artery Dissection in a Patient with COVID-19. Jacc Cardiovasc Interventions. 2020;13:e107-e108.
4. Gasso LF, Melon NMM, Cebada FS, Solis J, Tejada JG. Multivessel spontaneous coronary artery dissection presenting in a patient with severe acute SARS-CoV-2 respiratory infection. Eur Heart J. 2020;41:3100-3101.
5. Kumar K, Vogt JC, Divanji PH, Cigarroa JE. Spontaneous coronary artery dissection of the left anterior descending artery in a patient with COVID?19 infection. Catheter Cardio Inte. 2021;87:E249-E252.
6. Krittanawong C, Kumar A, Johnson KW, et al. Conditions and Factors Associated with Spontaneous Coronary Artery Dissection (From a National Population-Based Cohort Study). Am J Cardiol. 2018;123:249-253.
Autor para correspondencia: Instituto de Ciencias del Corazón (ICICOR), Hospital Clínico Universitario de Valladolid, Ramón y Cajal 3, 47005 Valladolid, España.
Correo electrónico: alvaro_aparisi@hotmail.com (Á. Aparisi Sanz).