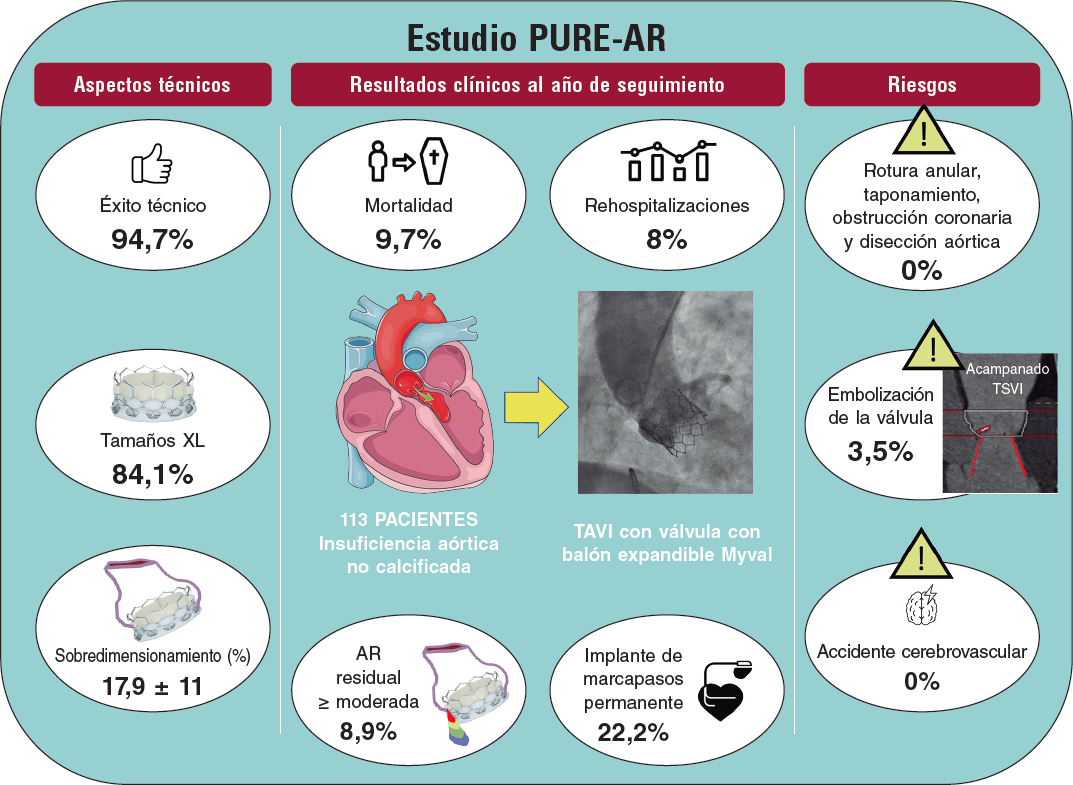
RESUMEN
Introducción y objetivos: La cardiopatía isquémica y la enfermedad mental coexisten a menudo. Los inhibidores selectivos de la recaptación de serotonina (ISRS) se utilizan con frecuencia en este contexto, pero se han asociado con un incremento en el riesgo hemorrágico. Los estudios previos han evaluado este fenómeno en pacientes tratados con clopidogrel, con resultados contradictorios. No hay datos sobre el uso de ISRS e inhibidores del P2Y12 potentes o triple terapia antitrombótica. El objetivo de este estudio fue examinar el impacto de los ISRS en los eventos hemorrágicos en pacientes tratados con doble (incluyendo clopidogrel, prasugrel o ticagrelor) o triple terapia antitrombótica tras una intervención coronaria percutánea (ICP).
Métodos: Estudio retrospectivo en el que se incluyeron todos los pacientes tratados con ICP en un centro de alto volumen durante 2018. Los pacientes en tratamiento con ISRS fueron emparejados mediante puntaje de propensión con pacientes sin ISRS. El objetivo primario fue el sangrado mayor al año de seguimiento (BARC 3 o 5). Los objetivos secundarios fueron un combinado de sangrado mayor o menor clínicamente relevante (BARC 2, 3 o 5) y un combinado de eventos cardiovasculares adversos mayores.
Resultados: De los 1.063 pacientes tratados con ICP durante el periodo del estudio, 1.002 cumplieron los criterios de selección y 139 (13,9%) recibían ISRS. Los pacientes con ISRS tenían un mayor riesgo de sangrado antes del emparejamiento (PRECISE-DAPT: 16 [10-24] frente a 13 [9-21]; p = 0,040). No hubo diferencias en el objetivo primario (2,9% frente a 2,9%; p = 0,991) ni en los objetivos secundarios de sangrado mayor o menor clínicamente relevante (2,9 frente a 7,2%; p = 0,120) y eventos cardiovasculares adversos mayores (7,9 frente a 7,9%; p = 0,979).
Conclusiones: El uso de ISRS fue frecuente en los pacientes tratados con ICP, y aunque fue un marcador de riesgo hemorrágico basal, no se asoció con un mayor riesgo de sangrado en el seguimiento.
Palabras clave: Sangrado. Enfermedad coronaria. Intervencionismo coronario percutáneo. Inhibidores selectivos de la recaptación de serotonina. Terapia antitrombótica.
ABSTRACT
Introduction and objectives: Coronary artery disease and mental health disorders are often coexistent. Selective serotonin reuptake inhibitors (SSRIs) are often used in this context but have been associated with an increased risk of bleeding due to platelet dysfunction. Previous studies have assessed this risk in patients treated with clopidogrel-based dual antiplatelet therapy (DAPT) with contradictory results. However, there is no data regarding the use of SSRIs and potent P2Y12 inhibitors or triple antithrombotic therapy after percutaneous coronary intervention (PCI). The purpose of this study was to assess the impact of SSRIs on bleeding outcomes after PCI in patients treated with clopidogrel, prasugrel or ticagrelor-based DAPT or triple antithrombotic therapy.
Methods: Retrospective study including all patients undergoing PCI at a high-volume center during 2018. Patients on SSRIs were propensity-score-matched on a 1:1 ratio with patients naive to SSRIs adjusting for the baseline differences. The primary endpoint was major bleeding (BARC type 3 or 5 bleeding) at the 1-year follow-up. Secondary endpoints were a composite of major/non-major clinically relevant bleeding (BARC type 2, 3 or 5 bleeding), and a composite of major adverse cardiovascular events.
Results: Out of a total of 1063 patients treated with PCI during the study period, 1002 met the selection criteria, and 139 (13.9%) were on SSRIs. The latter had a higher bleeding risk before matching [PRECISE-DAPT, 16 [10-24] vs 13 [9-21]; P = .040]. No differences were reported in major bleeding (2.9% vs 2.9%, P = .991), major/non-major clinically relevant bleeding (2.9% vs 7.2%, P = .120) or in major adverse cardiovascular events (7.9% vs 7.9%, P = .979) in patients treated with SSRIs.
Conclusions: The use of SSRIs was frequent in patients treated with PCI, and although it was a marker of a higher bleeding risk at baseline, this was not associated with an additional bleeding liability.
Keywords: Bleeding. Coronary artery disease. Percutaneous coronary intervention. Selective serotonin reuptake inhibitors. Antithrombotic therapy.
Abreviaturas ICP: intervencionismo coronario percutáneo. ISRS: inhibidores selectivos de la recaptación de serotonina. TAPD: tratamiento antiagregante plaquetario doble.
INTRODUCCIÓN
La enfermedad coronaria (EC) y los trastornos mentales suelen ir de la mano y guardan, de hecho, una relación bidireccional1,2. Los pacientes que padecen trastornos mentales tienen un riesgo más alto de desarrollar enfermedad coronaria y, a la inversa, no es raro que estos pacientes cursen con síntomas de depresión o ansiedad tras sufrir un evento cardiaco3. De hecho, la depresión en pacientes con EC se asocia a una mala adherencia al tratamiento, a hábitos de vida poco saludables y confiere un peor pronóstico4-8.
Los inhibidores selectivos de la recaptación de serotonina (ISRS) suelen recetarse como agentes de primera línea para tratar la depresión y la ansiedad,9,10 pero se han asociado a un mayor riesgo hemorrágico debido al efecto inhibidor que tienen sobre el transportador de serotonina (5-HTT) plaquetario11. La inhibición del 5-HTT plaquetario se asocia a una menor activación y agregación plaquetarias y a un alargamiento de los tiempos de coagulación13. Por otro lado, algunos estudios vinculan el riesgo hemorrágico asociado a los ISRS a la edad avanzada, las comorbilidades o a la polifarmacia14,15.
El riesgo hemorrágico secundario al tratamiento antitrombótico es algo que preocupa enormemente tras una intervención coronaria percutánea (ICP) ya que los eventos hemorrágicos ensombrecen el pronóstico tanto o más que los eventos isquémicos recurrentes17. Aunque el riesgo hemorrágico depende de múltiples características clínicas y de laboratorio18,19, identificar factores modificables es clave para tratar de optimizar el equilibrio entre riesgo isquémico y hemorrágico20. Algunos estudios publicados hasta la fecha han valorado el riesgo hemorrágico de pacientes en tratamiento concomitante con ISRS y tratamiento antiagregante plaquetario doble (TAPD) basado en ácido acetilsalicílico y clopidogrel con resultados contradictorios21-23. No obstante, el efecto de la asociación de ISRS con inhibidores más potentes del receptor P2Y12 (por ejemplo, ticagrelor o prasugrel) o tratamiento antitrombótico triple con TAPD y anticoagulación oral (ACO) nunca se ha explorado. En este estudio se comparararon eventos hemorrágicos mayores al año de seguimiento en pacientes tratados con ICP y tratamiento antitrombótico acorde a las guías de práctica clínica (incluyendo TAPD basado en clopidogrel, ticagrelor o prasugrel o tratamiento antitrombótico triple) añadido, o no, a tratamiento con ISRS.
MÉTODOS
Diseño del estudio y contexto
Estudio retrospectivo con todos los pacientes consecutivos dados de alta tras ICP en un único centro durante el año 2018. Los pacientes tratados con ISRS fueron emparejados por puntuación de propensión (EPP) con un grupo de control para comparar eventos hemorrágicos al año de seguimiento. El tratamiento antitrombótico lo decidió un cardiólogo clínico de acuerdo a las actuales guías de práctica clínica24. Este estudio se realizó de conformidad con la Declaración de Helsinki y fue aprobado por el comité de ética de la investigación del centro. Todos los pacientes dieron su consentimiento informado antes de la ICP.
Población
Se consideraron elegibles aquellos pacientes dados de alta tras la ICP realizada durante el periodo de estudio. Se excluyó a los pacientes con tratamiento antiagregante plaquetario simple y TAPD sin ácido acetilsalílico, así como aquellos que, por alguna razón, recibieron al alta tratamiento anticoagulante con heparinas de bajo peso molecular También se excluyó a aquellos pacientes con pérdida de información en el seguimiento. Los datos clínicos y de la intervención, el tratamiento al alta y los resultados clínicos durante el primer año fueron obtenidos de la historia clínica electrónica. Se incluyó en el grupo de ISRS a aquellos pacientes en los que la lista de fármacos recetados al alta incluía a alguno de los siguientes: citalopram, escitalopram, fluoxetina, fluvoxamina, paroxetina o sertralina.
Objetivos
El objetivo primario de seguridad fueron las hemorragias mayores al año de seguimiento. Los objetivos secundarios fueron un compuesto de hemorragia mayor o no mayor clínicamente relevante y un compuesto de eventos cardiovasculares adversos mayores (MACE). Las hemorragias mayores se definieron como todo evento hemorrágico tipo 3 o 5 según los criterios del Bleeding Academic Research Consortium (BARC). Las hemorragias mayores/no mayores clínicamente relevantes se definieron como eventos hemorrágicos tipo 2, 3 o 5 según el BARC25. Los MACE se definieron como un compuesto de muerte cardiovascular, infarto de miocardio no fatal o revascularización no programada. Dos cardiólogos desconocedores del grupo de tratamiento con ISRS adjudicaron los eventos de manera independiente.
Análisis estadístico
Las variables categóricas se expresaron como recuentos (porcentajes) y las continuas como media ± desviación estándar o mediana [rango intercuartil] según su distribución, que fue evaluada mediante la prueba de Shapiro-Wilk. Los valores de significación se obtuvieron empleando X2 o U de Mann-Whitney, según procediera. El EPP se llevó a cabo para reducir el sesgo debido a variables de confusión 26. Se empleó la regresión logística para determinar la probabilidad de ser tratado con ISRS y se incluyeron las siguientes covariables asociadas, potencialmente, tanto al tratamiento con ISRS como al objetivo primario27: edad, sexo, antecedente de hemorragias relevantes, hipertensión, cáncer, historia clínica de enfermedad hematológica o anemia, enfermedad hepática, aclaramiento de creatinina, tratamiento con inhibidores potentes del receptor plaquetario P2Y12 o con ACO concomitante. Para el EPP en proporción 1:1 se empleó la técnica del vecino más cercano, sin reemplazo y con un calibrador de 0,1. Se emplearon histogramas de la puntuación de propensión y diferencias de medias estandarizadas antes y después del EPP para valorar el balance de los grupos con respecto a las covariables28. Los análisis de tiempo hasta el evento se realizaron empleando curvas de Kaplan-Meier y modelos de riesgos proporcionales de Cox. Para determinar los predictores de hemorragias mayores en la cohorte no emparejada, se realizó un análisis multivariado de regresión de Cox que empleó un modelo de selección intencionada priorizando la parsimonia. En el análisis univariado se incluyeron las variables de importancia clínica y aquellas con valores p < 0,2. Los análisis estadísticos se realizaron empleando los paquetes de software SPSS (versión 24; IBM Corp., Estados Unidos) y R (versión 4.0.3; R Foundation for Statistical Computing, Austria). El emparejamiento se realizó empleando el paquete estadístico MatchIt R (Ho, Imai, King, & Stuart, 2011) y el balance de las covariables se valoró mediante el paquete de software estadístico Cobalt R (Greifer, 2021).
RESULTADOS
Características clínicas basales
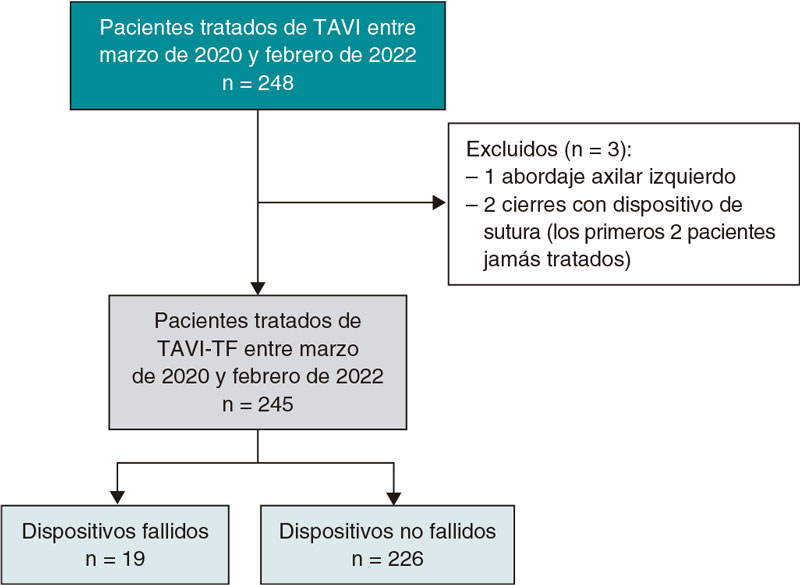
Un total de 1.063 pacientes fueron tratados mediante ICP durante el periodo del estudio, de los cuales, 1.002 cumplieron los criterios de selección y fueron incluidos en el análisis. Un total de 139 pacientes (13,9%) fueron tratados con ISRS al alta (figura 1). La mediana de edad se situó en torno a los 66 años (58-75) y 745 pacientes (74,4%) eran varones. La puntuación en la escala PRECISE-DAPT fue de 13 [9-22]. En lo referente al tratamiento antitrombótico, 684 pacientes (68,3%) fueron tratados con inhibidores potentes del P2Y12 y 102 (10,2%) con tratamiento concomitante con ACO. Tanto las características clínicas basales de toda la población como de los grupos no emparejados se muestran en la tabla 1. En el grupo de ISRS había un mayor porcentaje de mujeres y presentaban un mayor porcentaje de hipertensión, diabetes mellitus, cáncer, antecedente de hemorragias relevantes y enfermedad hematológica o anemia. Las escalas de riesgo hemorrágico HAS-BLED y PRECISE-DAPT fueron más altas en el grupo en tratamiento con ISRS.

Figura 1. Diagrama de flujo. ICP: intervención coronaria percutánea; ISRS: inhibidores selectivos de la recaptación de serotonina.
Tabla 1. Características clínicas basales de la población total y del los pacientes en tratamiento con y sin ISRS antes del emparejamiento
| Variable | Población general (n = 1.002) | Con ISRS (n = 139) | Sin ISRS (m = 863) | p |
|---|---|---|---|---|
| Edad, Años | 66 [58-75] | 67 [60-76] | 66 [57-75] | 0,530 |
| Sexo, varón | 745 (74,4) | 76 (54,7) | 669 (77,5) | 0,001* |
| IMC | 28,7 [25,9-31,8] | 30,0 [25,8-32,0] | 28,6 [25,9-31,7] | 0,067 |
| Hipertensión | 688 (68,7) | 112 (80,6) | 576 (66,7) | 0,001* |
| Diabetes mellitus | 370 (36,9) | 64 (46,0) | 306 (35,5) | 0,017* |
| Hiperlipemia | 525 (52,4) | 83 (59,7) | 442 (51,2) | 0,059 |
| Hábito tabáquico (activo o pasado) | 260 (25,9) | 34 (24,5) | 226 (26,2) | 0,709 |
| Revascularización previa | 248 (24,8) | 41 (29,5) | 207 (24,0) | 0,174 |
| EPOC | 67 (6,7) | 10 (7,2) | 57 (6,6) | 0,740 |
| Insuficiencia renal crónica | 115 (11,5) | 17 (12,2) | 98 (11,4) | 0,774 |
| Cáncer | 98 (9,8) | 20 (14,4) | 78 (9,0) | 0,044* |
| Enfermedad hepática | 37 (3,7) | 8 (5,8) | 29 (3,4) | 0,166 |
| Enfermedad hematológica o anemia | 99 (9,9) | 25 (18) | 74 (8,6) | 0,001* |
| Hemorragia relevante previa por motivos clínicos | 31 (3,1) | 9 (6,5) | 22 (2,5) | 0,010* |
| Fibrilación auricular | 87 (8,7) | 11 (7,9) | 76 (8,8) | 0,871 |
| Anticoagulante oral | 102 (10,2) | 9 (6,5) | 93 (10,8) | 0,119 |
| Inhibidores potentes del receptor plaquetario P2Y12 | 684 (68,3) | 90 (64,7) | 594 (68,8) | 0,323 |
| Ticagrelor, n (%) | 660 (65,9) | 86 (61,8) | 574 (66,5) | 0,543 |
| Prasugrel | 24 (2,4) | 4 (2,9) | 20 (2,3) | 0,543 |
| Duración del TAPD (meses) | 8 [6-12] | 6 [6-12] | 8 [6-12] | 0,440 |
| PRECISE-DAPT | 13 [9-22] | 16 [10-24] | 13 [9-21] | 0,040* |
| PRECISE-DAPT ≥ 25 | 195 [19,5] | 34 [24,5] | 161 [18,7] | 0,109 |
| HAS-BLED | 2 (2-3) | 3 (2-3) | 2 (2-3) | 0,034* |
| Aclaramiento de creatinina, ml/min/1,73 m2 | 100 [82,3-124,1] | 94,8 [72,9-125,2] | 100 [82,7-124,1] | 0,154 |
| Presentación clínica | ||||
| SCC | 441 (44,0) | 66 (47,5) | 375 (43,5) | 0,375 |
| SCA | 561 (56,0) | 73 (52,5) | 488 (56,5) | |
SCA: síndrome coronario agudo; SCC: síndrome coronario crónico; EPOC: enfermedad pulmonar obstructiva crónica; TAPD: tratamiento antiagregante plaquetario doble; ISRS: inhibidores selectivos de la recaptación de serotonina; IMC: índice de masa corporal (kg/m2). Los datos expresan n (%), media ± desviación estándar o mediana [rango intercuartílico]. * Indica una diferencia estadísticamente significativa con valores p < 0,05. | ||||
Estudio no emparejado
En la cohorte general se observaron un total de 19 eventos hemorrágicos mayores al año de seguimiento: 4 (2,9%) en el grupo tratado con ISRS y 15 (1,7%) en el grupo sin ISRS (p = 0,350). Cuatro de estos eventos (21,1%) fueron mortales, 10 (52,6%) hemorragias gastrointestinales, 4 (21,1%) hemorragias intracraneales y los restantes ocurrieron en otras localizaciones.
Se empleó el modelo multivariable de Cox para identificar los siguientes predictores independientes para el objetivo primario de hemorragias mayores: puntuación ≥ 25 en la escala PRECISE-TAPD y anticoagulación concomitante. La tabla 2 muestra los predictores univariables y multivariables de Cox para el objetivo primario.
Tabla 2. Predictores univariables y multivariables de Cox para las hemorragias mayores
| Variable | Análisis univariable | Análisis multivariable | ||
|---|---|---|---|---|
| HR (IC95%) | p | HR (IC95%) | p | |
| Edad, años | 1,06 (1,02-1,11) | 0,008 | ||
| Sexo, varón | 0,47 (0,19-1,18) | 0,107 | ||
| IMC | 0,98 (0,89-1,09) | 0,756 | ||
| Hipertensión | 0,99 (0,38-2,61) | 0,989 | ||
| Diabetes mellitus | 1,91 (0,78-4,79) | 0,160 | ||
| Hiperlipemia | 0,82 (0,33-2,01) | 0,664 | ||
| Insuficiencia renal crónica | 3,67 (1,39-9,66) | 0,008 | ||
| Cáncer | 2,47 (0,82-7,46) | 0,107 | ||
| Enfermedad hepática | 1,48 (0,19-11,05) | 0,705 | ||
| Enfermedad hematológica o anemia | 2,47 (0,82-7,46) | 0,107 | ||
| Hemorragia relevante previa por motivos clínicos | 3,91 (0,90-16,91) | 0,068 | ||
| Fibrilación auricular | 5,45 (2,05-14,53) | 0,001 | ||
| Anticoagulante oral | 8,22 (3,34-20,23) | 0,001 | 6,99 (2,78-17,64) | 0,001 |
| Inhibidores potentes del receptor plaquetario P2Y12 | 0,16 (0,06-0,45) | 0,001 | ||
| PRECISE-DAPT ≥ 25 | 4,77 (1,94-11,75) | 0,001 | 3,59 (1,44-8,98) | 0,006 |
| HAS-BLED | 1,69 (1,17-2,43) | 0,005 | ||
| Aclaramiento de reatinina | 0,98 (0,97-0,99) | 0,024 | ||
| ISRS | 1,68 (0,56-5,07) | 0,356 | 1,95 (0,64-5,93) | 0,241 |
IC95%: intervalo de confianza del 95%; HR: hazard ratio; ISRS: inhibidores selectivos de la recaptación de serotonina; IMC: índice de masa corporal (kg/m2). | ||||
El objetivo de hemorragias mayores/no mayores clínicamente relevantes ocurrió en 4 pacientes (2,9%) del grupo de ISRS y en 43 pacientes (4,9%) del grupo sin ISRS (p = 0,290). La incidencia de MACE fue similar en los 2 grupos: 11 eventos (7,9%) en el grupo de ISRS y 50 (5,8%) en el grupo sin ISRS.
Tanto las curvas de Kaplan-Meier como las tablas de riesgo asociados para cada objetivo de las cohortes no emparejadas se muestran en la figura 2.
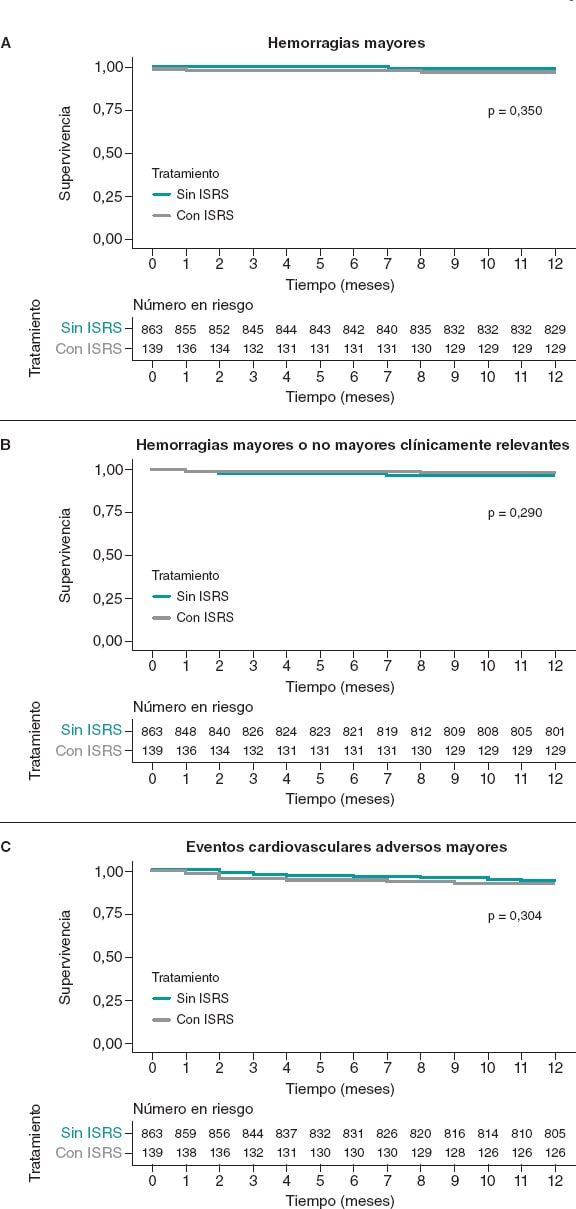
Figura 2. Curvas de Kaplan-Meier para el objetivo primario hemorrágico (A), el objetivo secundario compuesto hemorrágico (B) y los eventos isquémicos (C). Cohorte no emparejada. ISRS: inhibidores selectivos de la recaptación de serotonina.
Estudio con puntuación de propensión
Las variables empleadas en el EPP, las diferencias de medias estandarizadas y las distribuciones de la puntuación de la propensión de las muestras emparejadas y no emparejadas se muestran en la figura 3. El EPP confirmó el excelente balance de las covariables con diferencias de medias estandarizadas ≤ 10% en todas las variables incluidas en la puntuación de la propensión. También se observó un balance adecuado en el resto de características basales y en las escalas de riesgo, salvo para diabetes mellitus e hiperlipemia, que fueron más prevalentes en el grupo de tratamiento con ISRS (tabla 3).

Figura 3. Variables utilizadas en el puntaje de propensión y sus diferencias estandarizadas antes y después del emparejamiento (A). Distribuciones de la puntuación de propensión de las cohortes emparejadas y no emparejadas (B). ACO: anticoagulante oral.
Tabla 3. Características clínicas basales de pacientes en tratamiento con y sin ISRS después del emparejamiento
| Variable | Con ISRS (n = 139) | Sin ISRS (n = 139) | p |
|---|---|---|---|
| Edad, Años | 68 [60-76] | 67 [58-75] | 0,757 |
| Sexo, varón | 76 (54,7) | 73 (52,5) | 0,810 |
| IMC | 30,0 [25,8-32,0] | 28,4 [25,3-32,4] | 0,143 |
| Hipertensión | 112 (80,6) | 109 (78,4) | 0,656 |
| Diabetes mellitus | 64 (46,0) | 48 (34,5) | 0,050 |
| Hiperlipemia | 83 (59,7) | 67 (48,2) | 0,045 |
| Hábito tabáquico (activo o pasado) | 34 (24,5) | 28 (20,1) | 0,330 |
| Revascularización previa | 41 (29,5) | 30 (21,6) | 0,153 |
| EPOC | 10 (7,2) | 9 (6,5) | 0,816 |
| Insuficiencia renal crónica | 17 (12,2) | 19 (13,7) | 0,721 |
| Cáncer | 20 (14,4) | 18 (12,9) | 0,727 |
| Enfermedad hepática | 8 (5,8) | 10 (7,2) | 0,626 |
| Enfermedad hematológica o anemia | 25 (18) | 21 (15,1) | 0,519 |
| Hemorragia relevante previa por motivos clínicos | 9 (6,5) | 10 (7,2) | 0,812 |
| Fibrilación auricular | 11 (7,9) | 11 (7,9) | 1,000 |
| Anticoagulante oral | 9 (6,5) | 9 (6,5) | 1,000 |
| Inhibidores potentes del receptor plaquetario P2Y12 | 90 (64,7) | 97 (69,8) | 0,371 |
| Ticagrelor, n (%) | 86 (61,8) | 91 (65,5) | 0,749 |
| Prasugrel | 4 (2,9) | 6 (4,3) | 0,749 |
| Duración del TAPD (meses) | 6 [6-12] | 6 [6-12] | 0,810 |
| PRECISE-TAPD | 16 [10-24] | 15 [10-24] | 0,863 |
| PRECISE-TAPD ≥ 25 | 34 (24,5) | 32 (23,0) | 0,778 |
| HAS-BLED | 3 [2-3] | 3 [2-3] | 0,560 |
| Aclaramiento de creatinina, ml/min/1,73 m2 | 94,8 [72,9-125,2] | 100 [82,7-114,0] | 0,747 |
| Presentación clínica | |||
| SCC | 66 (47,5) | 63 (45,3) | 0,718 |
| SCA | 73 (52,5) | 76 (54,7) | |
SCA: síndrome coronario agudo; SCC: síndrome coronario crónico; EPOC: enfermedad pulmonar obstructiva crónica; TAPD: tratamiento antiagregante plaquetario doble; ISRS: inhibidores selectivos de la recaptación de serotonina; IMC: índice de masa corporal (kg/m2). Los datos expresan n (%), media ± desviación estándar o mediana [rango intercuartil]. | |||
La incidencia de hemorragias mayores al año de seguimiento se situó en torno al 2,9% tanto en los pacientes tratados con ISRS como en los pacientes sin ISRS emparejados (HR = 1.01; IC95%, 0.25-4.03; p = 0,991). No se observaron hemorragias no mayores clínicamente relevantes en el grupo de ISRS pero sí 6 (4,3%) en el grupo sin ISRS (HR = 0.39; IC95%, 0.16-1.27; p = 0,120). No se observaron diferencias en los MACE entre los grupos (HR = 1.01; IC95%, 0.44-2.33; p = 0,979) (figura 4).
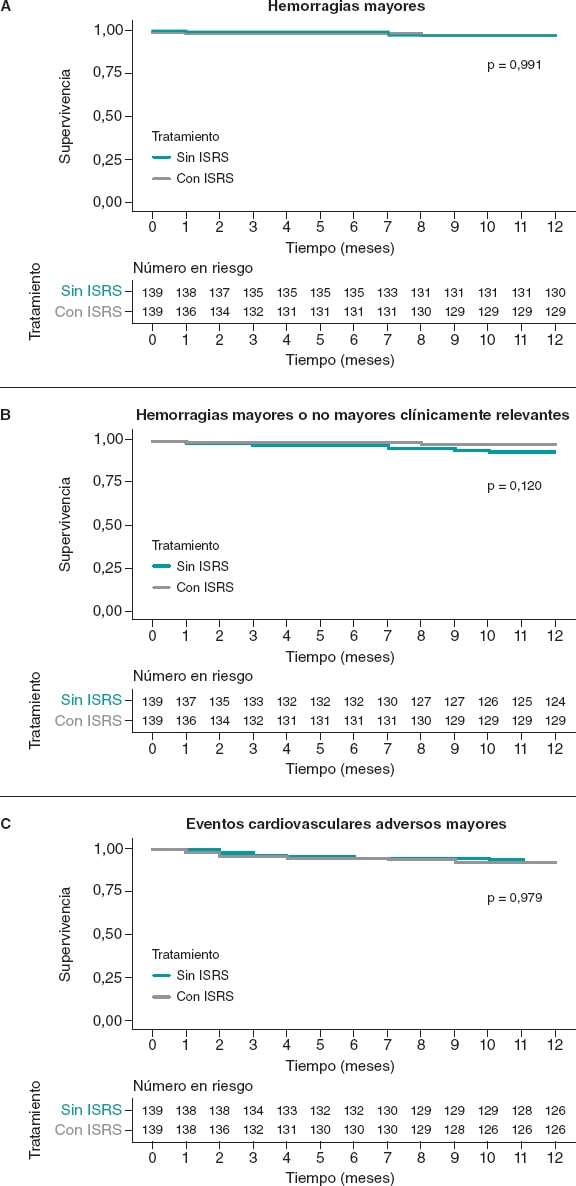
Figura 4. Curvas de Kaplan-Meier para el objetivo primario hemorrágico (A), el objetivo secundario compuesto hemorrágico (B) y los eventos isquémicos (C). Cohorte emparejadas. ISRS: inhibidores selectivos de la recaptación de serotonina.
DISCUSIÓN
Los principales hallazgos de este estudio son: a) el uso de ISRS fue habitual en pacientes dados de alta tras ICP; b) los pacientes tratados con ISRS tenían un riesgo hemorrágico basal más alto; c) a pesar de las diferencias en las características basales, tras el emparejamiento, el tratamiento con ISRS no se asoció a un exceso significativo de hemorragias mayores al año de seguimiento.
Existe una asociación bidireccional entre la enfermedad coronaria y los trastornos mentales. En nuestro estudio recibían tratamiento con ISRS el 13,9% de los pacientes dados de alta tras ICP. Se trata de un grupo con más comorbilidades y factores de riesgo hemorrágico, lo cual puede llegar a complicar el proceso de toma de decisiones clínicas a la hora de optar por un tratamiento antitrombótico u otro. Si los ISRS determinan o no un mayor riesgo hemorrágico por el efecto biológico que ejercen sobre los receptores 5-HTT plaquetarios o son un marcador de mayor riesgo hemorrágico por las comorbilidades concomitantes es algo que ya ha sido objeto de debate en anteriores estudios.
Labos et al.21 observaron un incremento del riesgo hemorrágico en pacientes tratados con ISRS y ácido acetilsalicílico o TAPD con clopidogrel tras un infarto de miocardio. Por el contrario, Lasella et al.22 evaluaron el impacto del tratamiento con ISRS en pacientes con TAPD tras ICP sin hallar un dicho incremento. No obstante, objetivaron un menor riesgo de MACE en pacientes tratados con ISRS frente a aquellos en tratamiento con mirtazapina, pero un mayor riesgo que en pacientes en tratamiento con ninguno de los 2 antidepresivos. Esto podría ser debido a que el efecto protector de los ISRS frente a los MACE29 sería sobrepasado por el efecto desfavorable que tienen los trastornos mentales sobre los eventos cardiovasculares30. Otra interpretación podría estar en la farmacocinética del clopidogrel ya que se trata de un profármaco que precisa de metabolización a través del citocromo P450 (CYP)31. Bykov et al.23 describieron un mayor riesgo de eventos isquémicos en pacientes tratados con clopidogrel y un ISRS inhibidor del CYP2C19 que en aquellos tratados con ISRS no inhibidores. No se observaron diferencias en lo referente a las hemorragias mayores. Este estudio no incluyó a un grupo de pacientes sin ISRS.
Se debe mencionar que ninguno de los estudios citados incluyó a pacientes en tratamiento con inhibidores potentes del receptor P2Y12 que son, en la actualidad, el tratamiento estándar en pacientes con SCA. Que sepamos, este es el primer estudio en valorar el impacto de los ISRS en pacientes tratados con inhibidores potentes del receptor P2Y12, prasugrel o ticagrelor. En nuestra población, dos terceras partes de los pacientes recibieron tratamiento con inhibidores potentes del P2Y12, lo cual está más en consonancia con las estrategias antiagregantes plaquetarias recomendadas por las actuales guías de práctica clínica32,33. En este contexto clínico, y a pesar del desequilibrio respecto al mayor riesgo hemorrágico basal en el análisis no emparejado, no hallamos diferencias en los eventos hemorrágicos mayores o no mayores clínicamente relevantes entre pacientes tratados con ISRS y el grupo emparejado sin ISRS. Así pues, aunque la prescripción de ISRS pueda ser un marcador de una población de mayor riesgo hemorrágico con más comorbilidades y factores de riesgo, quizás esto no se traduzca en un predictor independiente de eventos hemorrágicos tras tener en cuenta los posibles factores de confusión. Esto coincide con la literatura médica previamente publicada al respecto. En el estudio realizado por Labos et al.21 los pacientes en tratamiento con ISRS presentaban un mayor porcentaje de hipertensión, insuficiencia renal, anemia o cualquier otra enfermedad hematológica, así como hemorragias no gastrointestinales. Lasella et al.22 describieron que los pacientes en tratamiento con ISRS eran más propensos a tener diabetes, hipertensión, dislipemia, EPOC e insuficiencia renal crónica.
Nuestros hallazgos son relevantes a nivel clínico por varias razones. Aunque los ISRS se han vinculado a un potencial mayor riesgo hemorrágico, todavía no se ha podido confirmar que esto se traduzca en un exceso de eventos adversos. Nuestros datos sugieren un relativo perfil de seguridad de la asociación entre tratamientos antiplaquetarios potentes e ISRS en vida real al constatar que el riesgo hemorrágico no aumentó significativamente durante el primer año tras la ICP, que es cuando la decisión del tratamiento se basa en una evaluación concienzuda del balance entre el riesgo hemorrágico e isquémico.
Nuestro estudio también incluyó a una proporción de pacientes en tratamiento concomitante con antiagregantes plaquetarios y ACO (~10%), lo cual coincide con la práctica clínica habitual34. El impacto que ejercen los ISRS sobre los eventos hemorrágicos de pacientes con FA en tratamiento con ACO también ha sido objeto de estudio con anterioridad. Son varios los autores que han descrito un mayor riesgo hemorrágico en pacientes en tratamiento concomitante con ISRS y warfarina35,36. Al contrario, Quinn et al.37 no hallaron un riesgo hemorrágico mucho mayor entre los pacientes del estudio ROCKET AF aleatorizados a warfarina o rivaroxabán, y que también estaban en tratamiento ISRS. No obstante, sí se observó un modesto mayor riesgo de hemorragias mayores, que, sin embargo, no fue significativo a nivel estadístico, en el grupo de tratamiento con warfarina. Como los ISRS inhiben el CYP2C9, un aumento de las concentraciones plasmáticas de warfarina podría explicar estos hallazgos38. Esto confirma la importancia de los anticoagulantes orales directos para reducir el riesgo hemorrágico también en esta población, dada la necesidad de administrar múltiples agentes antitrombóticos tras la ICP y el mayor riesgo hemorrágico basal descrito39.
Limitaciones
Este estudio tiene varias limitaciones. En primer lugar, su diseño retrospectivo y observacional. También un tamaño muestral relativamente pequeño que limita la generalización de conclusiones al existir la posibilidad residual de error tipo 2. En segundo lugar, a pesar de que el EPP resultó en un buen balance entre los potenciales factores de confusión seleccionados y las demás características basales, la presencia de confusión residual no puede descartarse del todo. Por ejemplo, algunas variables asociadas a hemorragias tales como la presencia de diabetes mellitus o de enfermedad arterial periférica no fueron incluidas en el modelo de la puntuación de propensión. Aun así, se observaron hallazgos similares en los análisis ajustados y no ajustados. En tercer lugar, la clasificación de pacientes tratados con ISRS se basó en la lista de tratamiento al alta, con independencia de la adherencia a este o la interrupción del mismo en el seguimiento.
CONCLUSIONES
En este estudio de vida real, la combinación de ISRS y tratamientos antitrombóticos fue frecuente tras intervencionismo coronario percutáneo. Aunque el tratamiento con ISRS se asoció a un riesgo hemorrágico basal más alto en el análisis no ajustado, no se observó un exceso de hemorragias mayores o no mayores clínicamente relevantes en el seguimiento.
FINANCIACIÓN
Ninguna
CONTRIBUCIÓN DE LOS AUTORES
R. González-Manzanares y S. Ojeda idearon y diseñaron el estudio. R. González-Manzanares, M. Ruiz-Moreno, C. Fernández-Avilés, L. Carmona-Artime, G. Flores-Vergara y F. Costa recopilaron y analizaron los datos e interpretaron los resultados obtenidos. R. González-Manzanares, M. Ruiz-Moreno, S. Ojeda y F. Hidalgo redactaron el manuscrito y completaron las revisiones críticas del mismo. S. Ojeda, F. Hidalgo, G. Flores-Vergara, F. Costa, J. Suárez de Lezo y M. Pan llevaron a cabo el proceso de revisión del manuscrito y aprobaron la versión definitiva antes de enviarlo. Todos los autores dieron su aprobación final a la versión publicada.
CONFLICTO DE INTERESES
S. Ojeda es editora asociada de REC: Interventional Cardiology. Se ha seguido el procedimiento editorial establecido en la revista para garantizar la gestión imparcial del manuscrito. S. Ojeda y M. Pan declararon haber recibido honorarios como conferenciantes de Abbott, Boston, World Medical y Terumo. J Suárez de Lezo también declaró haber recibido honorarios como conferenciante de Abbott. Los demás autores no han declarado ningún conflicto de intereses.
¿QUÉ SE SABE DEL TEMA?
- La enfermedad coronaria y los trastornos mentales coexisten con frecuencia. El tratamiento concomitante con ISRS y tratamientos antitrombóticos es frecuente.
- Los eventos hemorrágicos tras una ICP empeoran el pronóstico de forma similar a los eventos isquémicos recurrentes.
- Los ISRS se han asociado a un potencial mayor riesgo hemorrágico. Los datos existentes respecto al uso concomitante de ISRS y tratamientos antitrombóticos potentes son escasos y poco concluyentes.
¿QUÉ APORTA DE NUEVO?
- Se trata del primer estudio en valorar el impacto de los ISRS en los eventos hemorrágicos en pacientes de la práctica clínica habitual tratados mediante intervencionismo coronaria percutáneo e inhibidores potentes del receptor P2Y12 o tratamiento antitrombótico triple.
- El perfil de riesgo hemorrágico de los pacientes tratados con ISRS es más alto.
- El uso de ISRS no se asoció a un mayor riesgo de hemorragias mayores tras ajustar por los potenciales factores de confusión.
BIBLIOGRAFÍA
1. De Hert M, Detraux J, Vancampfort D. The intriguing relationship between coronary heart disease and mental disorders. Dialogues Clin Neurosci. 2018;20:31-40.
2. Jha MK, Qamar A, Vaduganathan M, Charney DS, Murrough JW. Screening and Management of Depression in Patients With Cardiovascular Disease:JACC State-of-the-Art Review. J Am Coll Cardiol. 2019;73:1827-1845.
3. Lane D, Carroll D, Ring C, Beevers DG, Lip GY. The prevalence and persistence of depression and anxiety following myocardial infarction. Br J Health Psychol. 2002;7:11-21.
4. Gehi A, Haas D, Pipkin S, Whooley MA. Depression and medication adherence in outpatients with coronary heart disease:findings from the Heart and Soul Study. Arch Intern Med. 2005;165:2508-2513.
5. Sin NL, Kumar AD, Gehi AK, Whooley MA. Direction of Association Between Depressive Symptoms and Lifestyle Behaviors in Patients with Coronary Heart Disease:the Heart and Soul Study. Ann Behav Med. 2016;50:523-532.
6. Meijer A, Conradi HJ, Bos EH, et al. Prognostic association of depression following myocardial infarction with mortality and cardiovascular events:a meta-analysis of 25 years of research. Gen Hosp Psychiatry. 2011;33:203-216.
7. Carney RM, Blumenthal JA, Freedland KE, et al. Depression and late mortality after myocardial infarction in the Enhancing Recovery in Coronary Heart Disease (ENRICHD) study. Psychosom Med. 2004;66:466-474.
8. Valgimigli M, Garcia-Garcia HM, Vrijens B, et al. Standardized classification and framework for reporting, interpreting, and analysing medication non-adherence in cardiovascular clinical trials:a consensus report from the Non-adherence Academic Research Consortium (NARC) [published correction appears in Eur Heart J. 2019;40:2774]. Eur Heart J. 2019;40:2070-2085.
9. Ghaffari Darab M, Hedayati A, Khorasani E, Bayati M, Keshavarz K. Selective serotonin reuptake inhibitors in major depression disorder treatment:an umbrella review on systematic reviews. Int J Psychiatry Clin Pract. 2020;24:357-370.
10. Bandelow B. Current and Novel Psychopharmacological Drugs for Anxiety Disorders. Adv Exp Med Biol. 2020;1191:347-365.
11. Berger M, Gray JA, Roth BL. The expanded biology of serotonin. Annu Rev Med. 2009;60:355-366.
12. Abdelmalik N, RuhéHG, Barwari K, et al. Effect of the selective serotonin reuptake inhibitor paroxetine on platelet function is modified by a SLC6A4 serotonin transporter polymorphism. J Thromb Haemost. 2008;6:2168-2174.
13. De Abajo FJ. Effects of selective serotonin reuptake inhibitors on platelet function:mechanisms, clinical outcomes and implications for use in elderly patients. Drugs Aging. 2011;28:345-367.
14. Hougardy DM, Egberts TC, van der Graaf F, Brenninkmeijer VJ, Derijks LJ. Serotonin transporter polymorphism and bleeding time during SSRI therapy. Br J Clin Pharmacol. 2008;65:761-766.
15. Yuan Y, Tsoi K, Hunt RH. Selective serotonin reuptake inhibitors and risk of upper GI bleeding:confusion or confounding?Am J Med. 2006;119:719-727.
16. Valgimigli M, Costa F, Lokhnygina et al. Trade-off of myocardial infarction vs. bleeding types on mortality after acute coronary syndrome:lessons from the Thrombin Receptor Antagonist for Clinical Event Reduction in Acute Coronary Syndrome (TRACER) randomized trial. Eur. Heart J. 2017;38:804-810.
17. Mehran R, Pocock SJ, Stone GW, et al. Associations of major bleeding and myocardial infarction with the incidence and timing of mortality in patients presenting with non-ST-elevation acute coronary syndromes:a risk model from the ACUITY trial. Eur Heart J. 2009;30:1457-1466.
18. Mehran R, Pocock SJ, Nikolsky E, et al. A risk score to predict bleeding in patients with acute coronary syndromes. J Am Coll Cardiol. 2010;55:2556-2566.
19. Costa F, van Klaveren D, James S, et al. Derivation and validation of the predicting bleeding complications in patients undergoing stent implantation and subsequent dual antiplatelet therapy (PRECISE-DAPT) score:a pooled analysis of individual-patient datasets from clinical trials. Lancet. 2017;389:1025-1034.
20. Kang DO, An H, Park GU, et al. Cardiovascular and Bleeding Risks Associated With Nonsteroidal Anti-Inflammatory Drugs After Myocardial Infarction. J Am Coll Cardiol. 2020;76:518-529.
21. Labos C, Dasgupta K, Nedjar H, Turecki G, Rahme E. Risk of bleeding associated with combined use of selective serotonin reuptake inhibitors and antiplatelet therapy following acute myocardial infarction. CMAJ. 2011;183:1835-1843.
22. Iasella CJ, Kreider MS, Huang L, Coons JC, Stevenson JM. Effect of Selective Serotonin Reuptake Inhibitors on Cardiovascular Outcomes After Percutaneous Coronary Intervention:A Retrospective Cohort Study. Clin Drug Investig. 2019;39:543-551.
23. Bykov K, Schneeweiss S, Donneyong MM, Dong YH, Choudhry NK, Gagne JJ. Impact of an Interaction Between Clopidogrel and Selective Serotonin Reuptake Inhibitors. Am J Cardiol. 2017;119:651-657.
24. Valgimigli M, Bueno H, Byrne RA, et al. 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS:The Task Force for dual antiplatelet therapy in coronary artery disease of the European Society of Cardiology (ESC) and of the European Association for Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2018;39:213-260.
25. Mehran R, Rao SV, Bhatt DL, et al. Standardized bleeding definitions for cardiovascular clinical trials:a consensus report from the Bleeding Academic Research Consortium. Circulation. 2011;123:2736-2747.
26. Austin PC. An Introduction to Propensity Score Methods for Reducing the Effects of Confounding in Observational Studies. Multivariate Behav Res. 2011;46:399-424.
27. Brookhart MA, Schneeweiss S, Rothman KJ, Glynn RJ, Avorn J, Stürmer T. Variable selection for propensity score models. Am J Epidemiol. 2006;163:1149-1156.
28. Austin PC. Balance diagnostics for comparing the distribution of baseline covariates between treatment groups in propensity-score matched samples. Stat Med. 2009;28:3083-3107.
29. Fernandes N, Prada L, Rosa MM, et al. The impact of SSRIs on mortality and cardiovascular events in patients with coronary artery disease and depression:systematic review and meta-analysis. Clin Res Cardiol. 2021;110:183-193.
30. Zhang WY, Nan N, Song XT, Tian JF, Yang XY. Impact of depression on clinical outcomes following percutaneous coronary intervention:a systematic review and meta-analysis. BMJ Open. 2019;9:e026445.
31. Price MJ, Tantry US, Gurbel PA. The influence of CYP2C19 polymorphisms on the pharmacokinetics, pharmacodynamics, and clinical effectiveness of P2Y(12) inhibitors. Rev Cardiovasc Med. 2011;12:1-12.
32. Patel A, Goodman SG, Tan M, et al. Contemporary use of guideline-based higher potency P2Y12 receptor inhibitor therapy in patients with moderate-to-high risk non-ST-segment elevation myocardial infarction:Results from the Canadian ACS reflective II cross-sectional study. Clin Cardiol. 2021;44:839-847.
33. De Luca L, Zeymer U, Claeys MJ, et al. Comparison of P2Y12 receptor inhibitors in patients with ST-elevation myocardial infarction in clinical practice:a propensity score analysis of five contemporary European registries. Eur Heart J Cardiovasc Pharmacother. 2021;7:94-103.
34. Costa F, Garcia-Ruiz V, Licordari R, Fimiani L. The High Bleeding Risk Patient with Coronary Artery Disease. Cardiol Clin. 2020;38:481-490.
35. Quinn GR, Singer DE, Chang Y, et al. Effect of selective serotonin reuptake inhibitors on bleeding risk in patients with atrial fibrillation taking warfarin. Am J Cardiol. 2014;114:583-586.
36. Schelleman H, Brensinger CM, Bilker WB, Hennessy S. Antidepressant-warfarin interaction and associated gastrointestinal bleeding risk in a case-control study [published correction appears in PLoS One. 2015;10:e0121926]. PLoS One. 2011;6:e21447.
37. Quinn GR, Hellkamp AS, Hankey GJ, et al. Selective Serotonin Reuptake Inhibitors and Bleeding Risk in Anticoagulated Patients With Atrial Fibrillation:An Analysis From the ROCKET AF Trial. J Am Heart Assoc. 2018;7(15):e00∳.
38. Sansone RA, Sansone LA. Warfarin and Antidepressants:Happiness without Hemorrhaging. Psychiatry (Edgmont). 2009;6:24-29.
39. Costa F, Valgimigli M, Steg PG, et al. Antithrombotic therapy according to baseline bleeding risk in patients with atrial fibrillation undergoing percutaneous coronary intervention:applying the PRECISE-DAPT score in RE-DUAL PCI [published online ahead of print, 2020 Dec 1]. Eur Heart J Cardiovasc Pharmacother. 2020;pvaa135.
* Autor para correspondencia: Servicio de Cardiología, Hospital Universitario Reina Sofía, Av. Menéndez Pidal s/n, 14004 Córdoba, España.
Correo electrónico: soledad.ojeda18@gmail.com (S. Ojeda).